大豆细胞质雄性不育恢复基因的SSR标记定位
雷梦林,连世超
(1.山西省农业科学院农作物品种资源研究所,农业部黄土高原作物基因资源与种质创制重点实验室,杂粮种质资源发掘与遗传改良山西省重点实验室,山西太原030031;2.山西大学生物工程学院,山西太原030006)
大豆细胞质雄性不育恢复基因的SSR标记定位
雷梦林1,连世超2
(1.山西省农业科学院农作物品种资源研究所,农业部黄土高原作物基因资源与种质创制重点实验室,杂粮种质资源发掘与遗传改良山西省重点实验室,山西太原030031;2.山西大学生物工程学院,山西太原030006)
利用组合不育系SXJLCMS1A×恢复系Z-119-99构建F2育性分离群体,进行育性的遗传模式分析和恢复基因定位。结果表明,F1群体全为可育株,F2群体的可育株与半不育株经卡方测验符合1∶1的分离比例,说明该大豆细胞质雄性不育符合单基因配子体不育的遗传模式;利用F2分离群体,采用445对大豆SSR引物对其恢复基因进行分子标记和定位,结果发现,该恢复基因与J连锁群的2个标记Satt674和Satt249连锁,距2个标记的遗传距离分别为8.7,9.6 cM。
大豆;基因定位;细胞质雄性不育
细胞质雄性不育是作物杂种优势利用的基础[1]。有关大豆细胞质雄性不育的研究是DAVIS[2]首次在美国的专利中报道。孙寰等[3]育成了我国第1个细胞质雄性不育系,并实现栽培大豆三系配套。目前,我国已育成适应于不同生态区种植、农艺性状良好、不育度高、育性稳定的优良不育系10多个[4-10],并审定了多个大豆杂交品种[11-14]。虽然我国在大豆细胞质雄性不育的应用方面已经取得了长足的进展,但对其机制研究仍然相对滞后。因此,研究大豆细胞质雄性不育的形成原因及育性恢复的机制,对了解大豆细胞质雄性不育的机制具有重要的理论价值与实际意义[15]。
利用SSR(Simple Sequence Repeats,SSR)标记定位基因是研究大豆细胞质雄性不育育性恢复机制的主要手段之一。赵丽梅等[16]、许占友等[17]、WANG等[18]、董建生等[19]、汤复跃等[20]、李曙光等[21]、连世超等[22]、杨守萍等[23]、DONG等[24]以及YANG等[25]都利用分子标记手段对大豆不同细胞质雄性不育恢复基因进行了研究,已将不同的大豆恢复基因定位在不同的连锁群上,可见,大豆细胞质遗传基础是比较复杂的。
本研究利用大豆细胞质雄性不育系SXJLCMS1A和恢复系Z-119-99构建分离群体,对恢复基因进行遗传定位分析,以期获得与恢复基因连锁的SSR标记,为进一步精细定位并克隆该恢复基因打下基础。
1 材料和方法
1.1 大豆细胞质雄性不育的遗传分析
大豆细胞质雄性不育系SXJLCMS1A和恢复系Z-119-99试验材料由山西省农业科学院农作物品种资源研究所卫保国研究员提供。以SXJLCMS1A为母本、Z-119-99为父本构建F1群体和F2群体。参试材料于2012—2014年在山西省农业科学院农作物品种资源研究所榆次东阳大豆试验基地网室内种植。
大豆盛花期,采摘每株植株中上部当天即将开放的花蕾3朵,用1%I2-KI染色法观察父母本及F1,F2的花粉育性,随机选取3个视野,分别统计不育和可育花粉粒的数目,计算花粉败育率。
成熟期,大豆植株育性鉴定标准为:不育株表现为整株呈浓绿色,叶片肥厚不脱落,茎秆粗壮,结有大量未受精的幼嫩肉荚;可育植株表现正常,植株叶片呈黄色并脱落,有大量结实荚。
通过盛花期和成熟期的育性表现,F2群体的植株分为可育和半不育2类,并采用检测方法对育性分离结果进行遗传分析。
1.2 SSR标记分析
在大豆三节期,从母本、父本、F1和F2群体植株上分单株摘取叶片,于-80℃超低温冰箱中保存备用。通过CTAB[26]法提取叶片DNA。
利用混合分析法[27](bulked segregate analysis,BSA),在不育系群体中随机选取10株不育系单株的等量DNA混合构成不育基因池。在F2群体中随机选取10株可育单株的等量DNA混合构成可育基因池;随机选取10株半不育单株的等量DNA混合构成半不育基因池。
从SoyBase网站(http://soybase.org/)上均匀挑选分布在大豆20个连锁群上的SSR引物445对,由生工生物工程(上海)股份有限公司合成所有引物。PCR反应体系(10 μL):0.5 μL dNTP(2.5 mmol/L),2 μLPrimer(10 μmol/L),5 μL模板DNA(10 ng/μL),1μL10×PCRbuffer,0.1μLReal Taq DNAPolymerase(5 U/μL),1.4 μL dd H2O。PCR反应在BIO-RAD C1000 Thermal Cycler扩增仪中进行。PCR反应程序:94℃预变性5 min;94℃变性1 min,退火温度下退火30 s,72℃延伸30 s,共进行34个循环;72℃延伸10 min;4℃保存。扩增产物经8%非变性聚丙烯酰胺凝胶电泳、银染,用数码相机记录试验结果。
根据PCR扩增产物电泳显示的带型,与可育基因池带型一致记录为“A”,与半不育带型一致记录为“B”,与不育系带型一致记为“C”,将统计结果用Join Map 4.0作图软件分析标记与恢复基因之间的连锁关系,构建分子遗传图谱,并计算遗传距离[28]。
2 结果与分析
2.1 细胞质雄性不育SXJLCMS1A的遗传模式分析
通过对不育系SXJLCMS1A全部植株花粉进行镜检,结果表现为花粉全不育(图1-A),而恢复系Z-119-99表现为全可育(图1-C)。SXCMS1A和Z-119-99的F1群体在花期进行镜检,结果显示全为半不育(图1-B),统计计算F1花粉败育率为55.52%,接近50%,成熟期全部表现为可育株。SXCMS1A和Z-119-99的F2群体共317株,花粉镜检表现为可育和半不育2种类型。花粉育性参考孙寰等[29]提出的大豆花粉育性判定标准,可育株、半不育株的数量分别为151,166,经卡方检测符合1∶1(χ2=0.33,P=0.56>0.05)的分离比例(表1),F2群体成熟期的育性表现支持该分离结果。因此,推测该大豆细胞质雄性不育符合单基因配子体不育遗传特点。


表1 F2群体植株育性分离的适合性测验
2.2 大豆细胞质雄性不育恢复基因定位
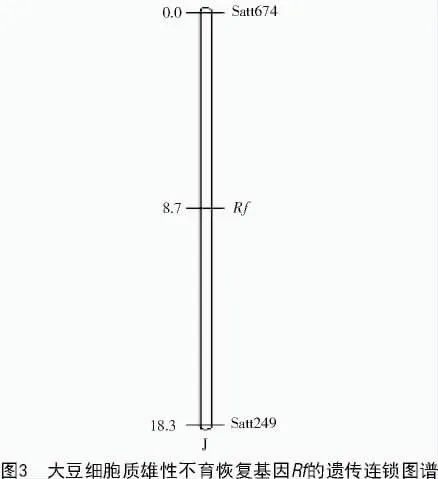
通过遗传分析研究,已经确认大豆细胞质雄性不育属于单基因配子体不育。利用445对SSR引物对构建的可育基因池、不育基因池、半不育基因池和父母本进行多态性筛选,结果发现,位于J连锁群上的标记Satt674,Satt249扩增产物表现出特异的多态性。利用标记Satt674,Satt249对F2群体进行扩增(图2-A,B),统计群体的多态性结果,并结合表型鉴定结果,用Join Map 4.0遗传作图软件进行作图,结果发现,与恢复基因连锁的SSR引物Satt674,Satt249的遗传距离分别为8.7,9.6 cM(图3)。

3 讨论
花粉育性划分标准是对细胞质雄性不育及其恢复性遗传研究的前提条件,本研究参考孙寰等[29]提出的大豆败育率划分标准,将试验中的大豆花粉分为不育、半不育和可育3类,其中,不育花粉的败育率为90.1%~100%、半不育花粉的败育率为10.1%~90%、可育花粉的败育率为0~10%。通过界定,将F2群体的花粉育性区分开来,以期获得更可靠的试验数据。此外,试验鉴定花粉育性还运用目测法观察花药的散粉情况,不育株上的花药瘦小、干瘪,花药不开裂或开裂不散粉;而可育株上的花药开裂,有大量的花粉且形态饱满,花粉为淡黄色。在大豆成熟期,通过对植株的形态特征再一次鉴定植株的育性,大大降低了只用一种方法的局限性和误差。因此,在育性鉴定方法上的研究是可行的。
采用分子标记定位基因是作物研究杂种优势利用的前提。试验采用445对SSR引物对大豆细胞质雄性不育的恢复基因进行分子标记定位,结果发现了与恢复基因连锁的标记Satt674和Satt249,但遗传距离为8.7 cM还是很大的距离,这不利于后续的精细定位和克隆基因等。出现以上不足可能的原因是:一群体数量不够大;二标记类型单一;三标记数量不多。这需要在后续试验加以改进,为获得更紧密的分子标记,并为克隆相关恢复基因和分子标记辅助育种奠定基础。
[1]汤复跃,周立人,程潇,等.大豆M型细胞质雄性不育恢复基因SSR标记初步定位[J].大豆科学,2008,27(3):383-386.
[2]DAVIS W H.Route to hybrid soybean production[J].United States Patent,1985,4:545-546.
[3]孙寰,赵丽梅,黄梅.大豆质核互作不育系研究[J].科学通报,1993,38(16):1535-1536.
[4]赵丽梅,孙寰,黄梅.大豆细胞质雄性不育系ZA的选育和初步研究[J].大豆科学,1998,17(3):268-270.
[5]孙寰,赵丽梅,王曙明,等.大豆杂种优势利用研究进展[J].中国油料作物学报,2003,25(1):92-96.
[6]李磊,杨庆势,胡亚敏,等.栽培大豆双亲基因互作型不育材料的发现及其遗传推断[J].安徽农业科学,1995,23(4):304-306.
[7]GAI J Y,CUI Z L,JI D F.A Report on the nuclear cytoplasmic male sterility from a cross between two soybean cultivars[J].Soybean Genetics Newsletter,1995,22:55-58.
[8]张磊,戴欧和.大豆质核互作不育系W931A的选育研究[J].中国农业科学,1997,30(6):90-91.
[9]盖钧镒,丁德荣,崔章藜,等.大豆质核互作雄性不育株NJCMS1A的选育及其特性[J].中国农业科学,1999,32(5):23-27.
[10]张磊,戴欧和,张丽亚.大豆质核互作雄性不育系W945A,W948A的选育[J].大豆科学,1999,18(4):327-330.
[11]赵丽梅,孙寰,王曙明,等.大豆杂交种杂交豆1号选育报告[J].中国油料作物学报,2004,26(3):15-17.
[12]彭宝,赵丽梅,王曙明,等.杂交豆2号选育及高产制种技术研究[J].吉林农业科学,2008,33(2):3-4.
[13]张磊,戴瓯和,黄志平,等.杂交大豆杂优豆1号选育[J].大豆通报,2007(2):14-16.
[14]卫保国,卫一超,白志元,等.杂交大豆新品种晋豆48号的选育及制种技术[J].中国种业,2015(9):65-66.
[15]董德坤,高莎,刘乐承,等.大豆质核互作雄性不育研究进展[J].中国农学通报,2012,28(15):5-9.
[16]赵丽梅,王玉民,孙寰,等.大豆细胞质雄性不育恢复基因的SSR标记[J].大豆科学,2007,26(6):835-939.
[17]许占友,李磊,邱丽娟,等.大豆三系的选育及恢复基因的SSR初步定位研究[J].中国农业科学,1999,32(2):32-38.
[18]WANG Y,ZHAO L,WANG X,SUN H.Molecular mapping of a fertility restorer gene for cytoplasmic male sterility in soybean[J]. Plant Breed,2010,129:9-12.
[19]董建生,杨守萍,喻德跃,等.大豆质核互作雄性不育系NJCMS2A的育性恢复性遗传和育性恢复基因的SSR标记[J].大豆科学,2008,27(2):181-185.
[20]汤复跃,张磊,陈培,等.大豆M型细胞质雄性不育恢复基因标记定位[J].大豆科学,2009,28(4):578-582.
[21]李曙光,赵团结,盖钧镒.大豆质核互作雄性不育系NJCMS3A双亲雄性育性基因的SSR标记[J].作物学报,2010,36(7):1061-1066.
[22]连世超,雷梦林,张瑞军,等.大豆细胞质雄性不育恢复基因的标记定位[J].山西农业科学,2016,44(5):579-582.
[23]杨守萍,曾维英,段美萍,等.大豆雄性不育突变体NJ89-1核不育基因的SSR标记和定位[J].大豆科学,2006,25(4):344-347.
[24]DONGDK,LI Z,YUANF J,et al.Inheritance and fine mapping of a restorer-of-fertility(Rf)gene for the cytoplasmic male sterility in soybean[J].Plant Science,2012,118/189:36-40.
[25]YANG S P,DUAN M P,MENG Q C,et al.Inheritance and gene tagging of male fertility of cytoplasmic-nuclear male-sterile line NJCMS1Ain soybean[J].Plant Breed,2007,126:302-305.
[26]Keim P,Olson T C,Shoemaker R C.A rapid protocol for isolating soybean DNA[J].Soybean Genetics Newslett,1988,15:150-152.
[27]MICHELMORE R W,PARAN I,KESSELI R V.Identification of markers linked to disease-resistance genes by bulked segregate analysis:a rapid method to detect markers in specific genomic regions by using segregating populations[J].Proc Natl Acad Sci USA,1991,88:9828-9832.
[28]STAMP.Construction of integrated genetic linkage maps by means ofa new computer package:Join Map[J].The Plant Journal,1993,3(5):739-744.
[29]孙寰,赵丽梅,王曙明,等.大豆花粉育性分类标准的研究[J].大豆科学,2006,25(4):339-343.
M apping for Fertility Restoring Genes of Cytop lasm ic M ale Sterility in Soybean by SSR Marker
LEI Menglin1,LIANShichao2
(1.Institute ofCrop Germplasm Resources,Shanxi Academy ofAgricultural Sciences,Key Laboratory ofCrop Gene Resources and Germplasm Enhancement on Loess Plateau,Ministry ofAgriculture,Shanxi Key Laboratory ofGenetic Resources and Genetic Improvement ofMinor Crops,Taiyuan 030031,China;2.College ofBiological Engineering,Shanxi University,Taiyuan 030006,China)
Utilization of the cytoplasmic male sterile(CMS)line SXJLCMS1A×Z-119-99 constructed F2segregation population, cytoplasmic male sterility restorer gene was located using SSR markers in soybean.The results showed that the F1pollen were fertile.The separation ratio of fertile plants and semi-sterility plants of F2was 1∶1,which was under χ2test.The results of this study showed that cytoplasmic male sterile lines was controlled by single gene gametophyte sterility.The mapping results on F2showed that out of 445 random ly selected SSR markers Satt674 and Satt249 on linkage group J were linked to the male fertility gene Rf with their genetic distances of8.7,9.6 cM.
soybean;gene mapping;cytoplasmic male sterility
S565.1
:A
:1002-2481(2017)07-1053-04
10.3969/j.issn.1002-2481.2017.07.01
2017-04-13
山西省青年科技研究基金项目(2014021029-1)
雷梦林(1984-),女,四川巴中人,助理研究员,主要从事大豆杂种优势利用研究工作。

