自然水体生物膜胞外聚合物的提取及优化
慕亚南, 成小英
(江南大学 环境与土木工程学院,江苏 无锡214122)
自然水体生物膜胞外聚合物的提取及优化
慕亚南, 成小英*
(江南大学 环境与土木工程学院,江苏 无锡214122)
以自然水体生物膜为研究对象,蛋白质和多糖的提取量作为生物膜胞外聚合物(EPS)提取总量的衡量指标,核酸含量用于表征细胞破裂程度,本文作者以高速离心法为对照,分别研究了加热法、EDTA法、NaOH+NaCl法和超声+CER法对自然水体生物膜胞外聚合物的提取效果,从而确定自然水体生物膜最适提取方法并对实验条件进行优化。研究结果表明,NaOH+NaCl法因提取胞外聚合物总量高,核酸含量较少为最适提取方法。在NaOH浓度为2mol/L,NaCl质量分数为0.85%,萃取2.5 h,分离转速为7 000 g条件下,EPS提取量为157.57mg/L。
自然水体生物膜;胞外聚合物;提取
近年来,我国河流污染严重,导致河流生态系统退化和水质恶化,其中重金属污染占据了较大比重[1]。自然水体生物膜是河流中相对稳定存在的微生物群落结构[2],对水体重金属、有机物和营养物质等的富集和迁移发挥着巨大作用[3]。大量研究表明,胞外聚合物 (EPS)对重金属离子具有很强吸附能力,例如Liu等[4]研究EPS对Zn2+、Cu2+和Cr3+的去除效果,其去除率都达到95%以上;杜伟等[5]研究了EPS对Cu2+、Cr3+和Ni2+的吸附效果,结果表明EPS对3种重金属离子的最大吸附容量分别为0.81、0.62、0.50mg/g EPS。国内外对EPS吸附重金属离子的吸附研究较多,但重金属离子对EPS的组分、形态结构等的影响有待进一步研究,高效提取EPS是进一步研究EPS作用和性质的前提。
目前的EPS提取中,多以活性污泥为研究对象,阳离子交换树脂法(CER)因其具有提取效率高、化学污染小、细胞破损量小以及操作方便的优点得到普遍认同[6-8]。自然水体生物膜是一种稳定的、复杂的微生物系统,微生物种类繁多,与活性污泥相比,其生长环境中营养程度较低,促使微生物分泌更多的EPS[9],故提取EPS的方法不能完全参照活性污泥来进行。曹勇等[10]对自然水体生物膜胞外聚合物提取方法进行对比,结果表明NaOH法提取效果优于清水法、超声波法、K2HPO4法和EDTA法,但DNA含量占提取物总量的22.27%,细胞破裂程度较大。自然水体生物膜EPS的提取方法尚未统一,不同的提取方法和操作条件对EPS的提取效果有很大的影响[11-13],为了最大程度提取EPS并尽可能减少细胞破裂和溶解,本研究选取高速离心法、加热法、EDTA法、NaOH+NaCl法和超声+CER法提取自然水体生物膜EPS并对提取效果进行比较,进而选取自然水体生物膜EPS最适提取方法并优化其提取条件,以期提供一种有效的、全面的EPS提取方法,为EPS的进一步研究提供理论参考。
1 材料与方法
1.1 材料
本实验选取生物膜由江南大学校内小蠡湖中培养所得。培养期间水质情况如表1所示(n=10):
表1 生物膜生长期间河水水质特征(±s)Table 1 W ater quality during the grow th of biofilm s

表1 生物膜生长期间河水水质特征(±s)Table 1 W ater quality during the grow th of biofilm s
水温/℃D O / ( m g / L ) p H C O DMn/ ( m g / L ) T N / ( m g / L ) T P / ( m g / L ) 1 9 . 4 2 ± 1 . 5 2叶绿素/ ( m g / m3) 6 . 5 6 ± 0 . 8 7 6 . 8 5 ± 0 . 5 6 8 . 1 3 ± 0 . 9 1 1 . 7 4 ± 0 . 7 9 0 . 0 5 ± 0 . 0 4 1 2 . 1 4 ± 2 . 7 5
1.2 实验方法
1.2.1 生物膜的培养 采用载玻片 (25.4mm×76.2 mm×1mm)[14-16]作为自然水体中微生物挂膜的载体,改进后的玻载生物膜培养装置为实验装置,如图1。载玻片用李鱼等[17]的方法进行预处理,之后将干净的载玻片固定于玻载生物膜装置上,垂直置于水面表层30 cm处进行生物膜培养。取附着有成熟生物膜的载玻片,将生物膜刮入研钵中,加少量去离子水研磨,定容后将生物膜样品放入磁力搅拌器中混匀,待用。
1.2.2 自然水体生物膜EPS提取方法筛选 以高速离心法[18]为对照,分别采用加热法[19]、EDTA法[20]、 NaOH+NaCl法[21]和超声+CER法[15]来提取自然水体生物膜胞外聚合物,其中包括了物理法、化学法和物理-化学法3大类提取方法。具体操作步骤如表2所示。

图1 生物膜培养装置Fig.1 Culturing device of biofilm s
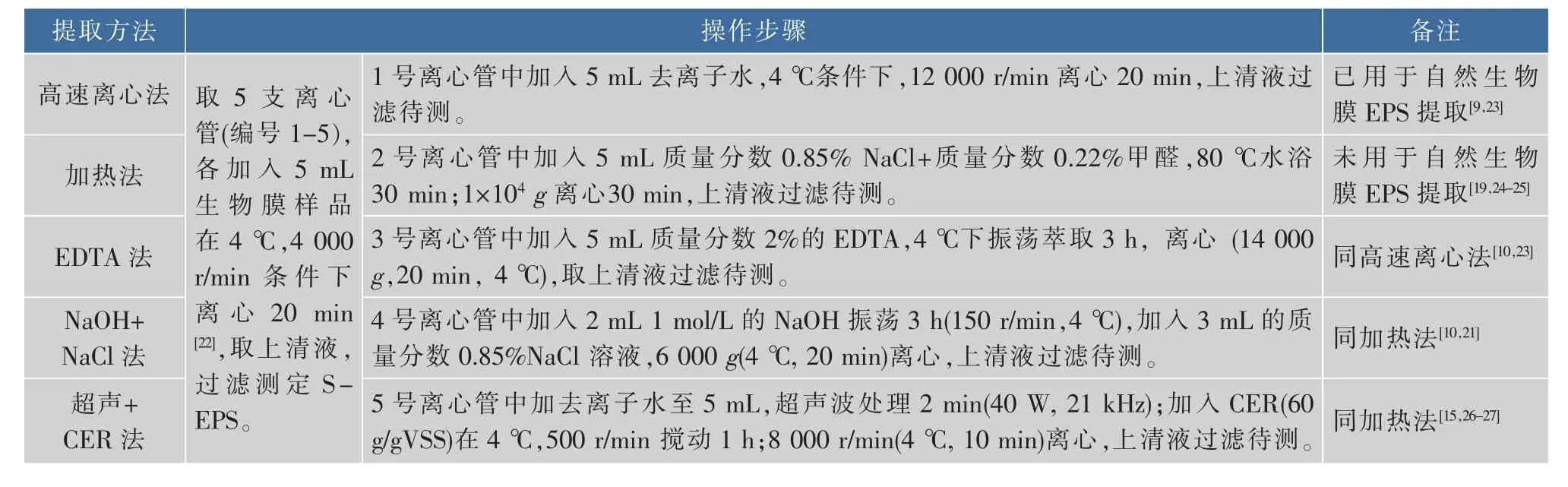
表2 5种EPS提取方法的操作步骤Table 2 Procedures for five EPS extraction methods
1.3 分析方法
EPS的提取量用多糖与蛋白质总和来表征,提取过程中细胞破坏程度用DNA含量来表征。其中多糖采用蒽酮法测定[28],蛋白质采用考马斯亮兰G-250法测定[29],DNA含量采用二苯胺法[25]测定。
将冷冻干燥的EPS样品与KBr按质量比1∶100混合,压制成薄片,采用傅里叶红外光谱分析仪(Thermo IS10)进行扫描测试其主要官能团,扫描范围为4 000~400 cm-1。
2 结果与讨论
2.1 5种提取方法的结果比较和分析
多糖和蛋白质是EPS的主要成分,以多糖和蛋白质含量总和来反应胞外聚合物提取方法的有效性,通过测定DNA的含量来比较各种提取方法对细胞的破裂程度,实验结果为3次测定结果的平均值(见表3)。
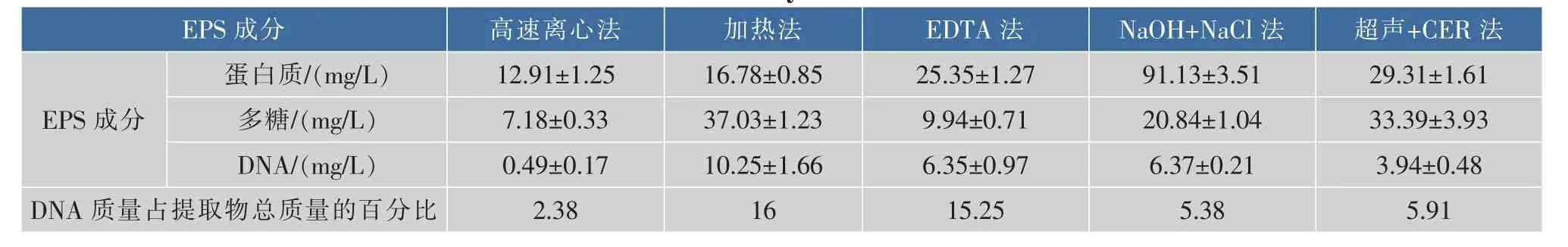
表3 5种不同方法的EPS提取效果Table 3 Contents of EPS by five extraction methods
由表3可知,5种方法对EPS总量的提取效果:NaOH+NaCl法>超声+CER法>加热法>EDTA法>高速离心法;DNA质量浓度:加热法>EDTA法>超声+ CER法>NaOH+NaCl法>高速离心法。不同的提取方法对EPS的提取效果有很大影响,高速离心法提取步骤温和,无大量细胞自溶现象产生,结果能较好的反应生物膜中EPS的相对组成,可作为对照用以评价各种提取方法对细胞的破裂程度[18]。相比于高速离心法,其他4种方法对EPS的提取效果都有一定程度的提高,说明自然生物膜EPS与细胞结合较为紧密,仅通过高速离心法不能有效地提取EPS,需要进一步借助化学或物理-化学法来提高自然生物膜 EPS的溶解性。高速离心法、EDTA法和NaOH+NaCl法中蛋白质质量分数皆超过50%,说明该生物膜EPS中蛋白质为主要成分,这与已有报道中的研究结果一致[23]。
比较不同提取方法的提取效果及对生物膜细胞的破裂程度,NaOH+NaCl法和超声+CER法提取效果较好且DNA质量分数都<6%。但两种提取方法中蛋白质/多糖差异明显,分别为4.37和0.88。一方面可能由于CER法提取EPS时,蛋白质是最难被提取的物质,因提取时间过短,致使蛋白质未被提取完全[30-31];另一方面表明NaOH的加入对于提取EPS中的蛋白质有较好的效果。
与其他提取方法相比,加热法和EDTA法提取的EPS中DNA质量分数较高(>15%),说明加热法和EDTA法对细胞的破裂程度较大,导致胞内物质释放,另外提取过程中甲醛和EDTA的存在对DNA质量浓度的测定值有一定影响[32]。与其他方法提取效果相比,加热法提取的EPS中蛋白质质量浓度偏低,可能是由于糖类物质及核酸热稳定性相对较强,而蛋白质在热处理过程中则随着作用时间的增加会部分凝固变性,质量浓度降低[33]。EDTA法提取效率较低,仅高于对照组,这可能是由于EDTA在使EPS游离进入液相的同时,与EPS的部分大分子相结合,使测量值偏低[34]。
综上所述,NaOH+NaCl法提取EPS质量浓度最高,且DNA质量分数在10%以内,表明该方法没有引起严重的细胞裂解[35]。为获取大量的EPS,选取NaOH+NaCl法作为自然水体生物膜胞外聚合物的提取方法。
2.2 NaOH+NaCl法提取胞外聚合物条件的优化
操作条件的不同对EPS的提取效果有很大影响。以1 mo1/L NaOH,萃取3 h,加入质量分数0.85%NaCl,6 000 g 4℃条件下离心20 min为参考,探究不同的萃取剂浓度、萃取时间及离心力对NaOH+NaCl法提取自然水体生物膜EPS效果的影响,从而选出最适宜的萃取条件。
2.2.1 NaOH溶液浓度对EPS提取效果的影响 分别选取0.5、1.0、2.0、3.0、4.0、5.0 mol/L的NaOH溶液作为萃取剂,萃取3 h,加入质量分数0.85% NaCl,6 000 g、4℃条件下离心20min提取EPS。测定不同浓度的萃取剂对EPS提取效果的影响(见图2)。

图2 NaOH溶液浓度对EPS提取效果的影响Fig.2 Effect of NaOH concentration on the extraction of EPS
由图2可知,NaOH浓度极大的影响着EPS组分。随着NaOH浓度增大,蛋白质、多糖、DNA的质量浓度均随之增大,其中蛋白质含量增幅最明显。当NaOH浓度大于2 mol/L后,DNA质量浓度大幅增加,表明过高的NaOH浓度对生物膜的细胞破坏较为严重。因此,为降低细胞的破碎程度,选择NaOH溶液摩尔浓度为2mol/L。
2.2.2 NaCl质量分数对EPS提取效果的影响 以2 mol/L NaOH为萃取剂,萃取3 h,分别加入质量分数为0.55%、0.65%、0.75%、0.85%、0.95%、1.05%的NaCl溶液,6 000 g、4℃条件下离心20 min提取EPS,测定NaCl质量分数对EPS提取效果的影响(见图3)。
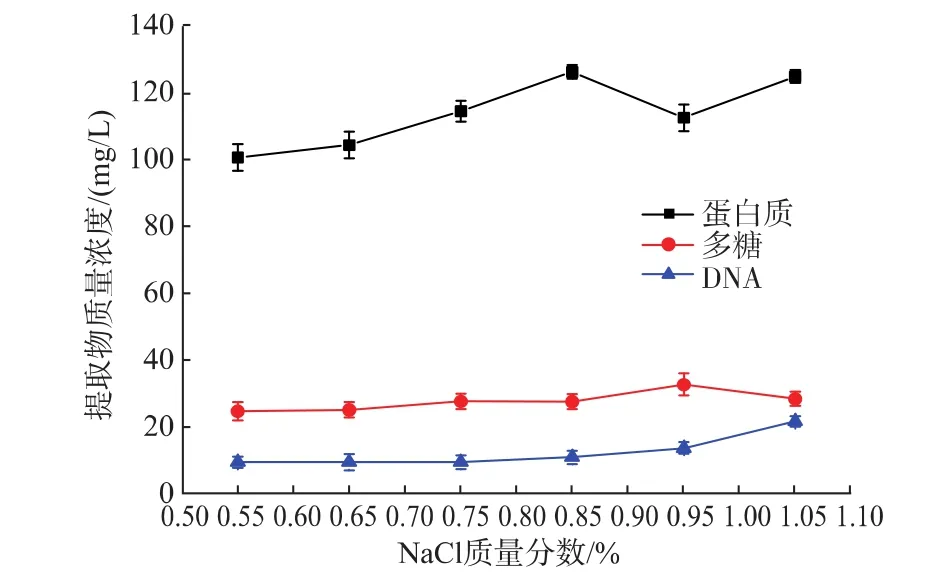
图3 NaCl质量分数对EPS提取效果的影响Fig.3 Effect of NaCl mass fraction on the extraction of EPS
由图3可知,NaCl质量分数对EPS的提取影响不大。NaCl质量分数为0.55%~0.95%时,DNA质量浓度增加幅度不明显,而大于0.95%时,DNA质量浓度明显增加。在NaCl质量分数0.85%时,EPS总量达到最大,故最适NaCl质量分数选取0.85%。
2.2.3 萃取时间对EPS提取效果的影响 选取2mol/LNaOH,分别萃取2.0、2.5、3.0、3.5、4.0、4.5 h,加入质量分数0.85%NaCl,6 000 g、4℃条件下离心20min提取EPS,测定不同萃取时间对EPS提取效果的影响(见图4)。
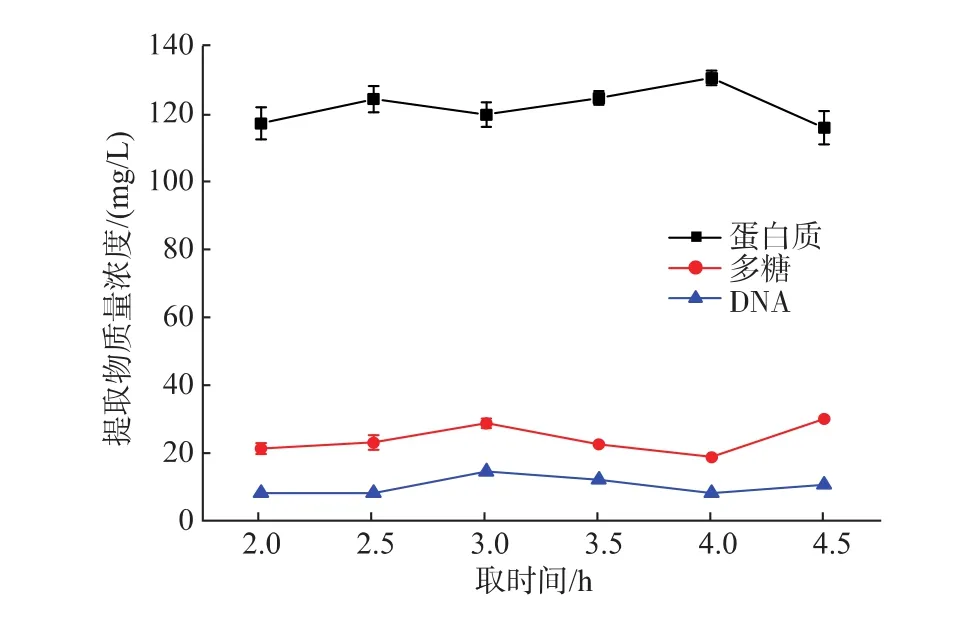
图4 萃取时间对EPS提取效果的影响Fig.4 Effect of extraction time on the content of EPS
由图4可知,在萃取时间≤2.5 h时,蛋白质和多糖质量浓度随着时间的延长增大,DNA质量浓度无明显增加,当萃取时间>2.5 h时,DNA质量浓度增幅明显。因此,确定2.5 h为最佳适萃取时间。
2.2.4 离心力对EPS提取效果的影响 选取2mol/L NaOH,萃取3 h,加入质量分数0.85%NaCl,分别设定离心力为 4 000、5 000、6 000、7 000、8 000、10 000 g,4℃条件下离心20 min提取EPS,测定不同离心力对EPS提取效果的影响(见图5)。
由图5可知,随着离心力的增加,蛋白质与多糖质量浓度成缓慢上升趋势,当离心力达到7 000 g时,随着转速的继续增大,蛋白质和多糖增加趋于平缓,离心力的增加不再分离出更多的蛋白质和多糖,但DNA质量浓度与之前相比增加显著。从细胞破碎小方面考虑,7 000 g为最适萃取离心力。
在 NaOH浓度为 2 mol/L,NaCl质量分数为0.85%,萃取2.5 h,分离转速为7 000 g条件下,NaOH+NaCl法提取效果最佳,EPS提取量为157.57mg/L。与文献中提取条件不同的原因可能是生物膜生长环境(如微生物种类、营养水平和水温等)的不同,致使EPS成分有所差异,提取操作条件也有所不同。与人工配水相比,自然水体中微生物种类繁多,主要有细菌、原生动物、真菌和藻类,分泌的EPS更为丰富;因自然水体中的营养物质含量较低,当微生物生长需求的不能被满足时,微生物将优先利用EPS中的多糖将作为能源物质用以维持自身正常的生命活动,致使蛋白质/多糖比值增大。与多糖相比,EPS中蛋白质较难被提取,提高NaOH浓度有利于蛋白质的提取,提高EPS的提取量。随着NaOH浓度的增加,在较短的时间内可使大部分EPS与微生物分离,萃取时间>2.5 h时,DNA含量大幅增加,可能是NaOH直接作用于细胞壁所导致。经过NaOH的萃取后,高速离心用以将胞外聚合物与细胞剥离来进行EPS的提取,再不增大细胞裂解的前提下,离心力的增加有助于细胞的完全分离。
2.3 NaOH+NaCl法中NaCl作用探究
NaOH法对EPS提取具有效率高的特点,但对细胞破坏程度较大。目前,与NaOH法相组合的方法研究较多,如甲醛+NaOH法[25]、甲酰胺+NaOH法[36]等,甲醛、甲酰胺的加入用以固定细胞,降低NaOH对细胞的破坏。为探究NaOH+NaCl法中NaCl的作用,分别以NaOH和去离子水替代NaCl,即NaOH+ NaOH、NaOH+NaCl、NaOH+去离子水法来提取EPS。
由图6可知,蛋白质、多糖提取效果都符合NaOH+NaOH法>NaOH+NaCl法>NaOH+去离子水法;DNA质量浓度则是NaOH+NaOH法>NaOH+去离子水法>NaOH+NaCl法。以NaOH代替NaCl时,蛋白质质量浓度和DNA质量浓度明显增大,应该是细胞发生溶解,胞内物质外流所导致[37]。与加入NaOH相比,NaCl溶液和去离子水的加入对细胞破裂程度都有所缓解,加入NaCl溶液条件下细胞破裂程度最小。唐金花等[38]以去离子水、低浓度NaCl和缓冲溶液作为提取液进行对比,结果表明低浓度NaCl溶液为提取液时细胞破裂程度最小;Fang等[39]在提取胞外有机物质时,也加入NaCl用以维持渗透平衡和减少细胞自溶。综上,NaOH法中加入的NaCl对细胞起到了一定的保护作用。
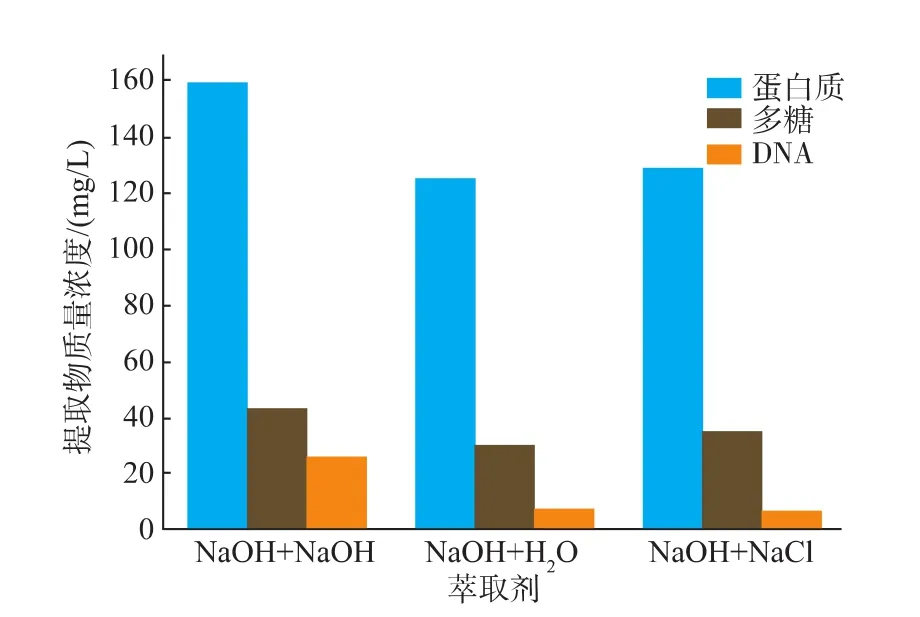
图6 不同萃取剂的提取效果比较Fig.6 Effect of different extraction agents
2.4 胞外聚合物红外光谱分析
对提取的溶解性胞外聚合物(S-EPS)和结合态胞外聚合物(B-EPS)样品进行红外光谱图分析(见图7),表4列出了其主要官能团。由红外光谱图可知,S-EPS和B-EPS中含有多种官能团,其中多糖和蛋白质是提取的EPS中两大主要成分。S-EPS图谱中多糖的特征峰较蛋白质强且宽,这说明多糖与细胞结合较松散或处于细胞较外层,比蛋白质更容易被提取[35],要更完全的提取蛋白质,还需借助化学法或物理-化学法;B-EPS图谱中,蛋白质峰明显增强,表明NaOH的加入,有效的提取了生物膜中的蛋白质。
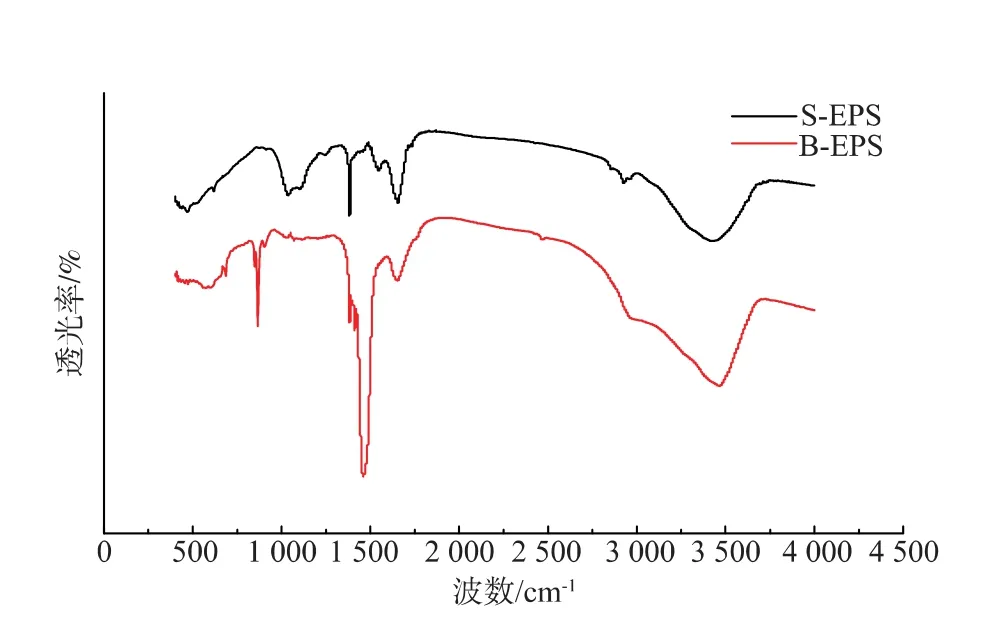
图7 红外光谱图Fig.7 FTIR spectra of EPS
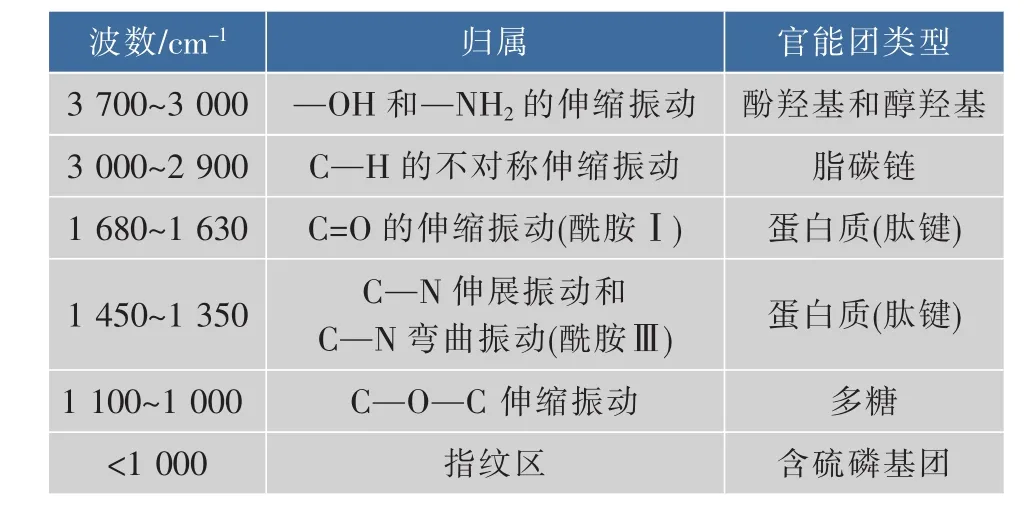
表4 EPS的红外光谱图的主要官能Table 4 M ain functional groups observed in the FTIR spectra of EPS
3 结语
自然水体生物膜广泛存在于各类水体中,本文作者通过改进的装置培养自然水体生物膜,对比不同提取方法对自然水体生物膜EPS的提取效果。结果表明,NaOH+NaCl法>超声+CER法>加热法>EDTA法>高速离心法。NaOH+NaCl法提取的EPS总量分别是超声+CER法、加热法、EDTA法、高速离心法的1.77倍、1.85倍、2.84倍和5.75倍,同时细胞的破裂程度较小,是理想的EPS提取方法。通过对NaOH+NaCl法提取EPS进行条件优化并探究NaCl的作用,表明在NaOH浓度为2mol/L,NaCl质量分数为0.85%,萃取2.5 h,分离转速为7 000 g(4℃)条件下,EPS提取效果最佳,加入NaCl对细胞起到了一定的保护作用。NaOH+NaCl法提取的EPS红外光谱分析可知,EPS中含有多种官能团,其中蛋白质和多糖官能团出峰明显,蛋白质是自然水体生物膜的主要成分,多糖次之。
[1]CHEN Longsheng,CHEN Shijin,Xu Shuwen,et al.Environment significance and polluti on status of heavy metals in lake sediments of the m iddle and lower reaches of yangtze river[J].Journal of Anhui Agricultural Sciences,2013,41(16):7290-7293.(in Chinese)
[2]秦松岩.德国奥德河水中生物膜形态及其生物多样性的研究[D].哈尔滨:哈尔滨工业大学,2008.
[3]LAWRENCE JR,DYNES JJ,KORBERD R,etal.Monitoring the fate of copper nanoparticles in river biofilms using scanning transm ission X-raym icroscopy(STXM)[J].Chem ical Geology,2012,329:18-25.
[4]LIU Y,LAM M C,FANG H H P.Adsorption of heavymetals by EPS of activated sludge[J].W ater Science and Technology,2001,43(6):59-66.
[5]DUWei,SUN Baosheng,LV Ying.Study on adsorption of Cu2+,Cr3+and Ni2+by EPS[J].China W ater&Wastewater,2007,23(13):98-101.(in Chinese)
[6]DOM INGUEZ L,RODRIGUEZM,PRATSD.Effectof differentextractionmethods on bound EPS from MBR sludges.Part I:Influence of extractionmethods over three-dimensional EEM fluorescence spectroscopy fingerprint[J].Desalination,2010,261(1):19-26.
[7]LONG Tengrui,LUO Taizhong,LONG Xiangyu,et al.Research on extraction of extracellular polymeric substances from activated sludgeby ultrasonic and cation resin[J].W ater&W astewater Engineering,2008,34(5):34-39.(in Chinese)
[8]WANG Yi,ZHENG Shujian,PENG Dangcong.A review on extracellular polymeric substance in environmentalengineering[J]. Journal of Xi'an University of Architecture&Technology,2011,43(6):854-858.(in Chinese)
[9]YAN Nengjie,XU Yanbin,DUAN Xiaojun,et al.A review on the extraction and propety analysis of extracellular polymeric substance[J].Science&Technology Review,2009,27(0920):106-110.(in Chinese)
[10]CAO Yong,WANG Bingling,ZHANG Yimeng,et al.Extraction of extracellular polymeric substances from biofilm and adsorptionmechanism ofheavymetals[J].Shang Hai Environmental Sciences,2013,32(4):139-142.(in Chinese)
[11]D’ABZAC P,BORDAS F,VAN Hullebusch E,et al.Extraction of extracellular polymeric substances(EPS)from anaerobic granular sludges:comparison of chem ical and physical extraction protocols[J].App lied M icrobiology and Biotechnology,2010,85(5):1589-1599.
[12]LIU H,FANG H H P.Extraction of extracellular polymeric substances(EPS)of sludges[J].Journal of Biotechnology,2002,95(3):249-256.
[13]CHO J,HERMANOWICZ S W,HUR J.Effects of experimental conditions on extraction yield of extracellular polymericsubstancesby cation exchange resin[J].The Scientific World Journal,2012.
[14]ZHANG Daoyong,ZHAO Yongsheng,PAN Xiangliang.The role of EPS in removing cadmium in sewage by A lgae-Bacteria biofilm[J].Research of Environmental Sciences,2004,17(5):52-55.(in Chinese)
[15]WANG C,M IAO L,HOU J,et al.The effect of flow velocity on the distribution and composition of extracellular polymeric substances in biofilmsand the detachmentmechanism ofbiofilms[J].W ater Science&Technology,2014,69(4):825-832.
[16]STEWARTT J,TRABER J,KROLLA,etal.Characterization ofextracellular polymeric substances(EPS)from periphyton using liquid chromatography-organic carbon detection-organic nitrogen detection(LC-OCD-OND)[J].Environmental Science and Pollution Research,2013,20(5):3214-3223.
[17]LIYu,ZHENG Na,DONG Dem ing,etal.Accumulation of Cd in the naturalsurface coatingsduring the development[J].Chinese Journal of Applied Chem istry,2004,21(1):28-31.(in Chinese)
[18]LIJihong,SHAN Shiliang,LI liang,et al.Extraction of extracelluar polymeric substances from activated sludge in membrane bioreactor[J].Environmental Engineering,2013,31(3):10-14.(in Chinese)
[19]FANG H H P,XU L C,CHAN K Y.Effects of toxicmetals and chem icals on biofilm and biocorrosion[J].W ater Research,2002,36(19):4709-4716.
[20]BROWNM J,LESTER JN.Comparison of bacterialextracellularpolymerextractionmethods[J].App lied and Environmental M icrobiology,1980,40(2):179-185.
[21]HU Xuewei,LIShu,RONG Ye,et al.Effect of Cu2+on biofilm and extracellular polymeric substance[J].CIESC Jorunal,2014,65(3):1062-1067.(in Chinese)
[22]ZHU P,LONG G,NIJR,et al.Deposition kinetics of extracellular polymeric substances(EPS)on silica in monovalent and divalentsalts[J].Environmental Science&Technology,2009,43(15):5699-5704.
[23]KANG Chunli,DONG Dem ing,LIZhonghua,etal.Extraction ofextracellular polymers from biofilms in naturalwater by EDTA solution[J].Journal of Northeast Normal University(Natural Science Edition),2003,35(2):120-122.(in Chinese)
[24]SUN M,LIW W,MU Z X,etal.Selection of effectivemethods for extracting extracellular polymeric substances(EPSs)from Bacillusmegaterium TF10[J].Separation and Purification Technology,2012,95:216-221.
[25]SUN M,LIW W,YU H Q,etal.A novel integrated approach to quantitatively evaluate the efficiency of extracellular polymeric substances(EPS)extraction process[J].Applied M icrobiology and Biotechnology,2012,96(6):1577-1585.
[26]HAN Wei,YUAN Linjiang,CAI Lu.Extracellular polymer ability of phosphorus accumulation and the relationship w ith the biologicalphosphorus removal[J].Journal of Safety and Environment,2012,12(5):23-28.(in Chinese)
[27]LIU Xiang,HUANG Yingen,LIU Yan,et al.The comparison of effectiveness of differentmethods in extracting extracellular polymeric substances(EPS)from biofilm and activated sludge[J].Journal of Fudan University(Natural Science),2011,50(5):556-562.(in Chinese)
[28]张治安,陈展宇.植物生理学试验技术[M].长春:吉林大学出版社,2008.
[29]CEYHAN N,OZDEM IR G.Extracellular polysaccharides produced by cooling water tower biofilm bacteria and their possible degradation[J].Biofouling,2008,24(2):129-135.
[30]FROLUND B,PALMGREN R,KEIDING K,et al.Extraction of extracellular polymers from activated sludge using a cation exchange resin[J].W ater Research,1996,30(8):1749-1758.
[31]GE Liyun,DENG Huanhuan,GAO Hongwei,et al.Study on extraction of extracellular polymeric substances from activated sludge[J].Environmental Science and M anagement,2010,35(9):47-50.(in Chinese)
[32]GAO Jingfeng,GUO Jianqiu,CHEN Ranni,etal.Comparison of the efficiency of five extracellular polymeric substances(EPS)extraction methods using three dimensional excitation and em ission matrix (EEM)fluorescence spectroscopy together w ith chemicalanalysis[J].Environmental Chem istry,2008,27(5):662-668.(in Chinese)
[33]WANG Xuan,JIM in,WANG Jingfeng,et al.Study on the extraction of extracellular polymer from aerobic granular sludge[J]. China Water&Wastewater,2005,21(8):91-93.(in Chinese)
[34]SUN M,LIW W,YU H Q,etal.A novel integrated approach to quantitatively evaluate the efficiency of extracellular polymeric substances(EPS)extraction process[J].Applied M icrobiology and Biotechnology,2012,96(6):1577-1585.
[35]YAN Jieneng,XU Yanbin,XU Da,etal.On the optim ization of extracted progress for theextracellular polymeric substance of aCr(Ⅵ)-removalpredominated strain(Brevibacillussp.)[J].Journal of Safety and Environment,2012(2):13.(in Chinese)
[36]ADAV S S,LEE D J,TAY J H.Extracellular polymeric substances and structural stability of aerobic granule[J].W ater Research,2008,42(6):1644-1650.
[37]WU Zhuoying,GUO Feng,YEChengsong,etal.Comparison of extractionmethods forextracellular polymeric substances from a drinkingwaterbiofilm-form ing bacteria[J].Environmental Chem istry,2012,31(4):539-543.(in Chinese)
[38]TANG Jinhua,XU Guoren,XIAO Jing,et al.Optim ization of extraction condition of extracellular polymeric substances from activated sludge[J].Journal of Anhui Agricultural Sciences,2012,40(6):3505-3507.(in Chinese)
[39]QU F,LIANG H,HE J,etal.Characterization of dissolved extracellularorganicmatter(dEOM)and bound extracellularorganic matter(bEOM)of M icrocystis aeruginosa and their impacts on UFmembrane fouling[J].W ater Research,2012,46(9):2881-2890.
Extraction of Extracellular Polymers from Natural Biofilm s
MU Yanan, CHENG Xiaoying*
(School of Environment and Civil Engineering,Jiangnan University,Wuxi214122,China)
Using the contentof protein and polysaccharide and the contentof nucleic acid separately as indicators of total extracellular polymeric substances(EPS)and cell autolysis,five different extraction methods,including thermal,EDTA,NaOH+NaCl,ultrasonic+CER and high speed centrifugation(control)treatments,for EPS from naturalbiofilmswere studied.Resultsshowed that NaOH+NaCl treatment was the most effective for EPS extraction w ith less nucleic acid contam ination.The optimal extraction conditionswere 2mol/L NaOH,0.85%NaCl,extraction time 2.5 h and centrifugal force 7 000 g.W ith these parameters,the extraction content of EPS was 157.57mg/L.
naturalbiofilms,extracellularpolymeric substances,extraction
X 172
A
1673—1689(2017)05—0499—08
2015-06-08
国家“十二五”科技支撑计划重大项目(2012ZX07101-013-04)。
*通信作者:成小英(1977—),女,江苏无锡人,理学博士,副教授,硕士研究生导师,主要从事湖泊生态工程研究。
E-mail:chengxiaoysytu@163.com
慕亚南,成小英.自然水体生物膜胞外聚合物的提取及优化[J].食品与生物技术学报,2017,36(05):499-506.

