日本血吸虫凋亡相关基因SjBAK的初步研究
窦雪峰,王 涛,吕 超,韩 倩,曹晓丹,沈元曦,张祖航,洪 炀,傅志强,林矫矫
(1.上海师范大学 生命与环境科学学院,上海 200234;2.中国农业科学院上海兽医研究所,上海 200241)
·研究论文·
日本血吸虫凋亡相关基因SjBAK的初步研究
窦雪峰1,2,王 涛2,吕 超1,2,韩 倩2,曹晓丹2,沈元曦1,2,张祖航2,洪 炀2,傅志强2,林矫矫1,2
(1.上海师范大学 生命与环境科学学院,上海 200234;2.中国农业科学院上海兽医研究所,上海 200241)
利用PCR技术扩增日本吸血虫凋亡相关基因BAK(Bcl-2 homologous antagonist/killer),并构建重组质粒。应用Realtime PCR技术分析在日本血吸虫非易感宿主大鼠和易感宿主小鼠来源、不同发育阶段虫体中BAK基因的表达状况。结果显示,克隆获得日本血吸虫(Schistosoma japonicum,Sj)BAK编码基因SjBAK,其ORF含2142bp,编码713个氨基酸,理论分子量为79.3 kDa,理论等电点为4.9。结构域分析表明该基因编码蛋白具有至少3个BH结构域,属于Bcl家族成员。Real-time PCR结果显示该基因在大、小鼠来源4个不同发育阶段虫体均有表达,其中大鼠来源虫体SjBAK的表达水平都高于小鼠来源虫体,在感染后32 d和42 d表达差异具有显著统计学意义(P<0.05)。由此可推测日本血吸虫凋亡相关基因SjBAK在血吸虫生长发育中可能发挥重要的作用。
日本血吸虫;BAK;细胞凋亡
血吸虫病严重危害人类的身体健康,给疫区社会经济发展带来巨大的损失。截止2014年,全国仍有血吸虫病病人115 614人,发现钉螺面积324.42 hm2,其中新发现钉螺面积531.13 hm2[1],我国血吸虫病防治仍是一项复杂、艰巨的任务。
目前我国血吸虫病防控采用的主要策略是控制传染源,吡喹酮是目前唯一大规模使用的血吸虫病治疗药物,但长期大规模单一用药可能导致抗药性的产生,研究人员已在小鼠动物模型中诱导出耐药性虫株[2]。近年来,血吸虫基因组、转录组和蛋白质组等研究的广泛开展[3-5],为血吸虫的防治工作奠定了更好的基础。
细胞凋亡是程序性细胞死亡的一种表现形式,在多细胞生物体内重塑组织活性和细胞增殖中发挥着重要作用,对于维持多细胞生物个体发育和内环境稳态[6],以及正常的生理过程,如机体的发育、免疫稳定、抵御病毒入侵和防止细胞癌变等方面都有着重要的作用。本实验室前期鉴定了14个日本血吸虫(Schistosoma japonicum,Sj)凋亡相关基因,包括SjAIF、SjAPAF1、SjATM、SjBcl-2、Sjtnfr、Sjbak、SjIAP、Sjbax、Sjcaspase3、Sjcaspase7、Sjcaspase9、SjCIAP、SjCYT-C、SjP53。收集易感宿主小鼠和非易感宿主大鼠的日本血吸虫虫体,对上述14个基因的表达状况进行了比较分析,初步结果表明,一些凋亡相关基因在大、小鼠来源日本血吸虫虫体的差异表达可能是影响血吸虫生长发育的重要原因之一[7]。本研究对在大鼠来源虫体呈高表达的凋亡相关基因SjBAK(Bcl-2 homologous antagonist/killer)进行了克隆,对大、小鼠来源不同发育阶段虫体中该基因的表达状况进行了比较分析,构建了SjBAK基因的重组表达质粒,为深入探讨SjBAK基因在血吸虫生长发育中的作用提供了基础。
1 材料与方法
1.1 材料
1.1.1 主要试剂和酶 Trizol、SuperscriptTMIII反转录酶购自Invitrogen公司;Ex Taq DNA聚合酶、T4 DNA连接酶、pMD19-T载体、pET-28a质粒、限制性内切酶、PrimeScriptTMRT-PCR Kit、SYBR® Premix Ex TaqTMⅡ、EASY Dilutio均购自TaKaRa生物工程(大连)有限公司;DNA纯化回收试剂盒、小型质粒回收试剂盒购自Axygen公司;大型质粒纯化回收试剂盒购自QIAGEN公司。
1.1.2 生物材料 DH5a和BL21(DE3)感受态细胞购自北京全式金生物有限公司;日本血吸虫虫体和阳性钉螺由中国农业科学院上海兽医研究所血吸虫病实验室保存提供。
1.2 方法
1.2.1 RNA提取与反转录 用日本血吸虫尾蚴感染BALB/c小鼠和Wistar大鼠,分别于感染后d 14、23 、32、42解剖动物,通过灌注法收集虫体并保存于液氮待用。分别取感染后不同时期的虫体约150 mg,按照Trizol试剂盒说明书提取虫体总RNA,利用SuperscriptTMIII反转录酶将总RNA反转录成cDNA。
1.2.2 SjBAK基因的克隆 根据日本血吸虫SjBAK基因(GenBank登录号:FN318787.1)序列设计特异引物F1(与ORF的1-26位核苷酸一致)和R1(与ORF的2119-2142位核苷酸反向互补),引物由上海桑尼生物科技有限公司合成,序列见表1。PCR反应条件:94℃预变性 3 min;94℃变性 30 s,56℃退火20 s,72℃延伸 2.5 min,共35个循环;72℃继续延伸1 min,4℃终止反应并保存。
1.2.3 重组质粒pMD19-T-SjBAK的构建 按照DNA纯化试剂盒的操作步骤纯化扩增到的目的片段,将其连接至pMD19-T 载体,连接产物转化到DH5α感受态细胞中。挑单个菌落接种到LB培养液培养,按照试剂盒操作提取质粒,然后进行双酶切鉴定,将阳性质粒送测序公司测序。
1.2.4 生物信息学分析 利用ORF FINDER(http:// www.ncbi.nlm.nih.gov/gorf/gorf.htmL)在线分析寻找开放阅读框(open reading frame,ORF);将序列进行BLASTX(http://blast.ncbi.nlm.nih.gov/Blast.cgi/)比对寻找同源基因;利用Primer Premier 5软件进行酶切位点分析和理论编码蛋白质序列分析;利用NCBI和SMART(http://smart.embl-heidelberg.de/)在线分析寻找结构域;利用MEGA6软件进行多序列比对并构建系统发育树;利用ProtParam tloo(http:// web.expasy.org/protparam/)在线分析氨基酸残基组成、数目,蛋白质理论分子质量和理论等电点等基本理化性质。
1.2.5 荧光定量PCR分析SjBAK在不同期别虫体中的表达情况 分别提取日本血吸虫尾蚴感染后14、23、32、42 d虫体的总RNA,按照TaKaRa PrimeScriptTMRT-PCR Kit试剂盒说明书反转录日本血吸虫各时期虫体的cDNA。以日本血吸虫SjNADH基因为内参,各时期日本血吸虫cDNA为模板,并利用SYBR® Premix Ex TaqTMⅡ酶进行荧光定量PCR分析,设3次独立重复。SjBAK荧光定量PCR引物(F2和R2)序列和日本血吸虫SjNADH内参引物(F3和R3)序列见表1。引物由上海桑尼生物科技有限公司合成。
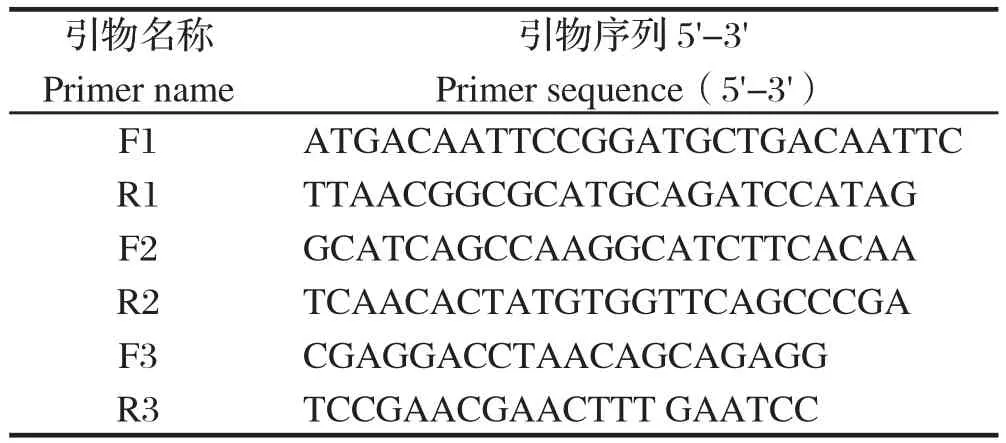
表1 PCR和RT-PCR引物Table 1 Primers used for PCR and RT-PCR
1.2.6 重组质粒pET-28a(+)-SjBAK的构建 取100 μL经测序鉴定正确的pMD19-T-SjBAK/ DH5α菌液,接到5 mL加有氨苄抗生素的LB中,37℃、250 r/min过夜培养。收集菌液并抽提质粒。用BamHⅠ和Hind III酶对重组质粒pMD19-T-SjBAK与空载体pET-28a(+)进行双酶切,回收纯化酶切产物,16℃连接过夜。取10 μL连接产物转入宿主菌BL21并涂板,37℃培养箱中培养12~16 h后,挑取单个克隆,进行PCR和双酶切鉴定(方法步骤同前)。将电泳结果鉴定为阳性的质粒送公司测序。用Clustalx软件分析测序结果。
2 结果
2.1 日本血吸虫促凋亡基因SjBAK的克隆及生物信息学分析
2.1.1 日本血吸虫SjBAK基因的克隆 以日本血吸虫42 d虫体cDNA为模板进行PCR扩增,将PCR扩增产物进行凝胶电泳,在2000 bp和3000 bp之间得到1条DNA片段,接近预期大小2142 bp(图1)。
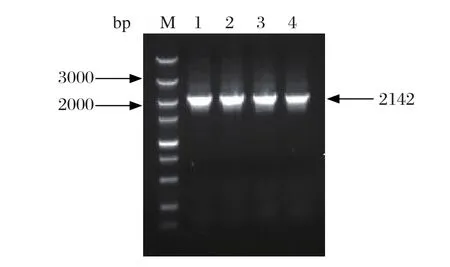
图1 SjBAK基因的PCR扩增结果Fig.1 Amplif cation of SjBAK of S. japonicum by PCRM: DNA 分子量标准 (DL 5000); 1~4: SjBAKM: DNA Marker (DL 5000); 1-4: SjBAK
2.1.2 日本血吸虫促凋亡基因SjBAK基因的生物信息学分析 利用ORFFINDER分析表明其开放阅读框为2142 bp,编码713个氨基酸,推测该蛋白分子量为79.3 kDa,理论等电点为4.9。利用SignalP(www. cbs.dtu/ services/ Singnalp)在线软件预测,SjBAKA蛋白1-22个氨基酸是信号肽(图2)。利用TMHMM ServerV2.0在线软件预测SjBAKA基因长度为2142 bp,无跨膜区(图3)。结构域分析该基因编码蛋白具有至少3个BH结构域,BH结构域与Bcl-2属于同源结构域,因此属于Bcl家族成员,如图4所示。
2.2 Real-time PCR检测SjSjBAK在不同时期日本血吸虫虫体内的转录水平 Real-time PCR结果分析表明,SjBAK基因在大、小鼠来源4个不同发育时期的日本血吸虫虫体中均有表达,在14 d虫体中表达量最高,42 d虫体中表达量最低。在4个测试的不同发育阶段虫体中,大鼠来源虫体SjBAK的表达水平都高于小鼠来源虫体,其中32 d和42 d虫体表达差异具有显著统计学意义(P<0.05)。大鼠来源的14 d、23 d和32 d虫体中基因表达水平差异不具有统计学意义,但都显著高于大鼠42 d虫体的表达水平。小鼠来源SjBAK相对表达量随着虫体的生长发育逐渐降低,其中14 d和42 d表达水平差异具有极显著统计学意义(P<0.01),14 d和23 d虫体的SjBAK表达差异不具有统计学意义,而从32 d开始,表达量开始明显下降(图5)。
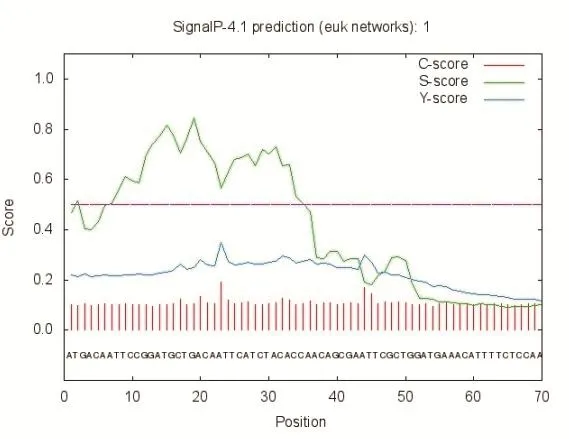
图2 SjBAK蛋白信号肽的预测Fig.2 Prediction of signal peptide of SjBAK protein
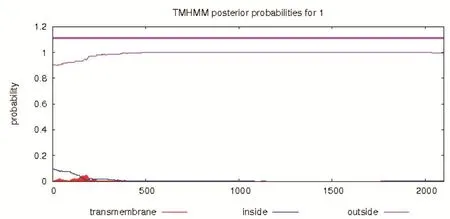
图3 SjBAK蛋白跨膜区的预测Fig.3 Prediction of transmembrane region of SjBAK protein

图4 SjBAK结构域的预测Fig 4 Prediction of the functional domain of SjBAK protein
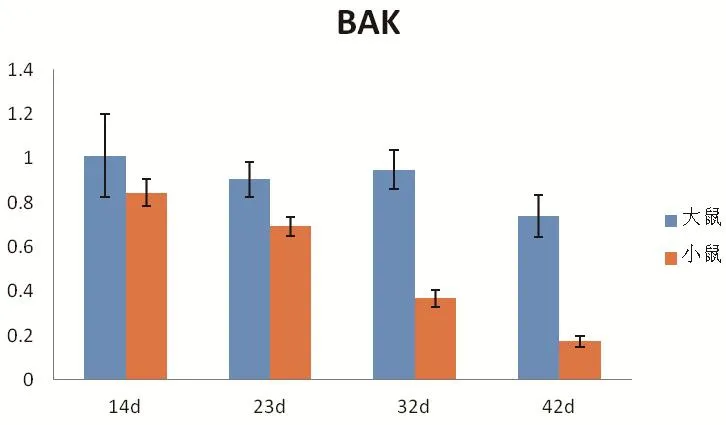
图5 SjBAK在虫体不同发育时期的表达分析Fig. 5 Analysis of SjBAK expressions in different development stages of S. japonicum by Real-time RT-PCR
3 讨论
日本血吸虫病是一种严重危害公共卫生的人畜共患寄生虫病,目前尚无有效的疫苗[8]。本实验室前期在探讨东方田鼠抗日本血吸虫感染机制时发现,细胞凋亡可能是东方田鼠清除日本血吸虫的机制之一[9]。
日本血吸虫可感染40余种哺乳动物,但不同动物对血吸虫感染的易感性呈现较大的差别,如小鼠属血吸虫的易感宿主,血吸虫感染小鼠后虫体发育率在50%~60%之间,虫体大,发育完全,雌虫产卵量大。而相对小鼠,大鼠属血吸虫非易感宿主,血吸虫感染大鼠后虫体发育率只有10%左右,虫体小,发育不如小鼠来源虫体完全,雌虫产卵量少。前期研究表明在血吸虫的生长发育中一些凋亡相关分子起着重要的作用[9-11]。彭金彪等[11]研究发现在血吸虫适宜性宿主小鼠、非适宜宿主大鼠和抗性宿主东方田鼠来源的10 d童虫中,一些凋亡相关基因呈现明显的差异表达,可能是影响日本血吸虫生长发育的重要因素之一。本文对收集自非易感宿主大鼠和易感宿主小鼠日本血吸虫虫体促凋亡相关基因SjBAk的表达进行了分析,结果表明大鼠来源4个不同发育时期虫体SjBAk基因的表达水平都明显高于小鼠来源虫体,提示SjBAk的表达差异可能是影响日本血吸虫在大鼠和小鼠体内生长发育差异的因素之一。日本血吸虫感染后22~24 d卵壳形成并开始排卵,胚胎期虫卵于感染后28~29 d出现,感染后34 d达到高峰。成熟期虫卵于感染后36 d出现,感染45~50 d达到高峰。小鼠来源的血吸虫雌虫产卵量要明显高于大鼠来源雌虫。本研究结果也显示,大、小鼠来源血吸虫虫体SjBAk的表达差异在发育后期的32 d和42 d比早期的14 d和23 d明显,提示SjBAk可能在血吸虫卵胚发育、卵成熟等方面对虫体产生更显著的影响。
在哺乳动物细胞中,Bcl-2蛋白家族成员是细胞发生凋亡的重要调控因子。根据结构域的差异,Bcl-2蛋白家族成员被分为多结构域蛋白(BH1、BH2、BH3、BH4)和仅有BH3结构域的蛋白,其中多结构域蛋白又依据不同功能分为促凋亡蛋白和凋亡抑制蛋白两类,而仅含有BH3蛋白的具有促凋亡功能。多结构域凋亡抑制蛋白主要有Bcl-2、BclxL、Bcl-w、Mcl-1和Bfl-1,多结构域促凋亡蛋白主要是Bax和Bak。促凋亡蛋白是细胞凋亡程序中不可或缺的组分。凋亡抑制蛋白(Bcl-2)通过疏水性裂缝结合到促凋亡蛋白质双亲性α螺旋结构域BH3能够使促凋亡蛋白丧失生理功能[12]。很多仅有BH3结构域的蛋白能够应答细胞受到的刺激,通过激活Bak 和Bax直接诱导凋亡,或通过阻断促凋亡蛋白和凋亡抑制蛋白之间相互结合间接诱导细胞凋亡。在细胞受到死亡信号刺激时,仅有BH3结构域的蛋白会被激活,进而引发细胞凋亡级联反应。凋亡信号通路一旦激活,Bax/Bak寡聚物就会在线粒体外膜表面形成多孔结构(膜通道孔)使线粒体的通透性增加,线粒体释放凋亡因子如细胞色素C,并与胞质中的APAF-1结合形成凋亡复合物(apoptosome),凋亡复合体能够诱导蛋白酶(caspase)分解细胞。SjBAK是一多结构域促凋亡蛋白,可能参与血吸虫凋亡的过程,在血吸虫生长发育中发挥重要作用。
Lee等[13]分析发现血吸虫存在Bcl-2家族相关基因,这些基因涉及多结构域成员和单结构域(BH3)成员,其中多结构域成员SjA具有类BAK/ BAX功能,推测日本血吸虫也存在Bcl-2凋亡调节通路。结果分析表明BH3类似物可与Bcl-2蛋白相互作用,从而抑制BCL-2蛋白的抑凋亡作用。
至今,有关血吸虫BAK的生物学功能尚不完全清楚,本文克隆了日本血吸虫SjBAK基因,构建了SjBAk的重组表达质粒,验证了SjBAK在大、小鼠来源的不同发育阶段的日本血吸虫虫体中均有表达,且该基因在不同发育阶段虫体和不同宿主来源虫体呈差异表达,可能与血吸虫的生长发育相关。这些将为深入探讨该基因在血吸虫生长发育中的作用,评估SjBAk作为血吸虫治疗药物靶标或疫苗候选分子的潜力提供基础。
[1] 雷正龙, 张丽娟, 徐志敏, 等. 2014年全国血吸虫病疫情通报[J]. 中国血吸虫病防治杂志, 2015, 27(6): 563-569.
[2] Fallon P G, Doenhoff M J. Drug-resistant schistosomiasis: resistance to praziquantel and oxamniquine induced in Schistosoma mansoni in mice is drug specific[J]. Am J Trop Med Hyg, 1994, 51(1): 83-88.
[3] Berriman M, Haas B J, LoVerde P T, et al. The genome of the blood fluke Schistosoma mansoni[J]. Nature, 2009, 460(7253): 352-358.
[4] Zhou Y, Zheng H, Chen Y, et al. The Schistosoma japonicum genome reveals features of host-parasite interplay[J]. Nature, 2009, 460(7253): 345-351.
[5] Young N D, Jex A R, Li B, et al. Whole-genome sequence of Schistosoma haematobium[J]. Nat Genet, 2012, 44(2): 221-225.
[6] Bruchhaus I, Roeder T, Rennenberg A, et al. Protozoan parasites: programmed cell death as a mechanism of parasitism[J]. Trends Parasitol , 2007, 23(8): 376-383.
[7] Wang T, Guo X, Hong Y, et al. Comparison of apoptosis between adult worms of Schistosoma japonicum from susceptible (BALB/c mice) and less-susceptible (Wistar rats) hosts[J], Gene, 2016, 592 (1): 71-77.
[8] Beaumier C M, Gillespie P M, Hotez P J, et al. New vaccines for neglected parasitic diseases and dengue[J]. Transl Res, 2013, 162(3): 144-155.
[9] Peng J, Gobert G N, Hong Y, et al. Apoptosis governs the elimination of Schistosoma japonicum from the nonpermissive host Microtus fortis[J]. PLoS ONE, 2011, 6(6): e21109.
[10] Chen L, Rao K V, He Y X, et al. Skin-stage schistosomula of Schistosoma mansoni produce an apoptosis inducing factor that can cause apoptosis of T cells[J]. J Biol Chem, 2002, 277(37): 34329-34335.
[11] 彭金彪. 不同宿主来源日本血吸虫童虫差异表达基因的研究[D]. 北京: 中国农业科学院, 2010.
[12] Lee E F, Young N D, Lim N T, et al. Apoptosis in schistosomes: toward novel targets for the treatment of schistosomiasis[J]. Trends Parasitol, 2014, 30(2): 75-84.
[13] Lee E F, Clarke O B, Evangelista M, et al. Discovery and molecular characterization of a Bcl-2-regulated cell death pathway in schistosomes[J]. Proc Natl Acad Sci U S A, 2011, 108(17): 6999-7003.
A PRELIMINARY STUDY ON APOPTOSIS ASSOCIATE GENES SJBAK OF SCHISTOSOMA JAPONICUM
DOU Xue-feng1,2, WANG Tao2, LV Chao1,2, HAN Qian2, CAO Xiao-dan2, SHEN Yuan-xi1,2, ZHANG Zu-hang2, HONG Yang2, FU Zhi-qiang2, LIN Jiao-jiao1,2
(1. College of Life and Environmental Sciences, Shanghai Normal University, Shanghai 200234 China 2. Shanghai Veterinary Research Institute, CAAS, Shanghai, 200241 China)
The objectives of the present study were to clone the apoptosis related gene of Schistosoma japonicum SjBAK(Bcl-2 homologous antagonist/killer), analyze its expression in schistosome worms and possible role in the development of schistosome. The full-length sequence of SjBAK was cloned in PCR and the recombinant plasmid containing SjBAK was constructed. The expression of SjBAK in S. japonicum at different development stages from non-susceptible host rats and susceptible host mice were analyzed using Real-time PCR. The ORF of the SjBAK gene contained 2142 bp encoding 713 amino acids with the theoretical molecular weight of 79.3 kDa and theoretical isoelectric point at 4.9. Analysis also revealed that the molecule possessed at least three BH domains and belonged to the member of Bcl family. Real-time PCR analysis showed that the gene expressed in all worms at four development stages and the expression level in worms from rats was higher than those from mice. Signif cant difference in SjBAK expression was observed in worms from two different hosts at 32 d and 42 d post-infection(P<0.05). In conclusion, the apoptosis-related gene SjBAK of S japonicum may play an important role in the development of Schistosome.
Schistosoma japonicum; BAK ; apoptosis
S852.735
A
1674-6422(2017)03-0068-05
2016-11-14
国家自然科学基金(81271871)
窦雪峰,女,硕士研究生,动物学专业
林矫矫,E-mail:jjlin@shvri.ac.cn

