新型(Z)-2-[(苯氧基)(芳基)]次甲基-2-丁烯酸酯类化合物的合成
金秀秀, 潘诚敏, 杨健国, 高建荣
(1. 浙江工业大学 化学工程学院,浙江 杭州 310014; 2. 台州学院 医药化工学院,浙江 台州 317000)
·研究论文·
新型(Z)-2-[(苯氧基)(芳基)]次甲基-2-丁烯酸酯类化合物的合成
金秀秀1,2, 潘诚敏1,2, 杨健国2*, 高建荣1
(1. 浙江工业大学 化学工程学院,浙江 杭州 310014; 2. 台州学院 医药化工学院,浙江 台州 317000)
以三苯基膦为催化剂,氮气保护下在苯中实现了取代苯酚与α-取代-2,3-丁二烯酸酯的β′-极化加成反应,合成了16个新型(Z)-2-[(苯氧基)(芳基) ]次甲基-2-丁烯酸酯类化合物,其结构经1H NMR,13C NMR和MS(ESI)表征。
三苯基膦; 苯酚; 2,3-丁二烯酸酯; 联烯酸酯; 催化; 极化加成反应; 合成
有机膦催化是现代有机化学合成中构建新型碳环和杂环骨架的有效方法,能够催化缺电子联烯与亲核试剂发生加成反应[1-3]。联烯酸酯作为一类缺电子的联烯[4],近年来受到研究人员的广泛关注。早在1995年,陆熙炎等[5-6]在叔膦催化下完成了以2,3-丁二烯酸酯和缺电子烯烃为原料的环加成反应,高效合成了环戊烯类化合物,点亮了联烯酸酯领域的指明灯,引起了研究员的广泛关注和兴趣。2005年,Kwon等[7-8]以γ-位取代的2,3-丁二烯酸乙酯和亚胺为原料,在三丁基膦催化下,高效合成了一系列多取代的吡咯啉衍生物。同年, Kwon等[9-10]又以2,3-丁二烯酸酯和醛类化合物为原料,在三甲基膦催化下,于室温反应以较高收率合成了一系列氧杂环化合物。2010年,叶松等[11-12]以2,3-丁二烯酸酯和三氟甲基芳基酮为原料,在三苯基膦催化下,高效合成

Scheme 1
了一系列二氢呋喃衍生物。由于联烯酸酯能够与缺电子烯烃、亚胺、醛、酮等多种化合物发生反应,因此在一些天然产物及药物的合成中也起到了关键的作用[14]。本课题组在参考Guan[3]和Tioga[13]的研究基础上优化反应条件,并在优化条件下合成一系列新化合物,进一步丰富了该类化合物的种类,也将其应用于串联反应的研究。
本文系统研究了苯酚与2-苄基-2,3-丁二烯酸酯的亲核加成反应。以取代苯酚(1a~1i)和2-苄基-2,3-丁二烯酸酯(2a, 2j~2p)为原料,三苯基膦为催化剂,苯为溶剂,于80 ℃反应合成了一系列新型(Z)-2-[(苯氧基)(芳基)]次甲基-2-丁烯酸酯类化合物(3a~3p, Scheme 1),其结构经1H NMR,13C NMR和MS(ESI)表征。
1 实验部分
1.1 仪器与试剂
Bruker ARX-400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标);Bruker Vector 22型红外光谱仪(KBr压片)。
2-苄基-2,3-丁二烯酸乙酯(2a)及其衍生物(2j~2p)按文献[15]方法合成;PPh3, 1a~1i,上海达瑞精细化学品有限公司;柱层析用硅胶H,安徽良臣硅胶有限公司。
1.2 合成
(1) 3a~3p的合成(以3a为例)
氮气保护下,在25 mL史莱克管中依次加入苯酚(1a)94.1 mg(1 mmol), PPh352.6 mg(0.2 mmol)和苯2 mL,油浴升温至80 ℃,缓慢滴加2a 242.8 mg(1.2 mmol)的苯(2 mL)溶液,滴毕(3 h),保温反应8 h。反应液浓缩后经硅胶柱层析[洗脱剂:V(石油醚) ∶V(乙酸乙酯)=100 ∶1]纯化得3a。
用类似方法合成3b~3p。
3a: 无色油状液体,收率96%;1H NMRδ: 7.41~7.17(m, 7H), 6.92~6.87(m, 3H), 6.24~6.19(m, 1H), 6.11(s, 1H), 4.19(q,J=7.2 Hz, 2H), 2.00(dd,J=7.2 Hz, 1.2 Hz, 3H), 1.20(t,J=7.2 Hz, 3H);13C NMRδ: 166.7, 158.0, 139.5, 138.4, 133.2, 129.4, 128.5, 127.9, 127.4, 121.1, 116.0, 79.1, 60.5, 15.6, 14.2; MS(ESI)m/z: 296{[M+H]+}。
3b: 无色油状液体,收率61%;1H NMRδ: 7.40~7.23 (m, 5H), 7.01(d,J=12.0 Hz, 2H), 6.81(d,J=8.0 Hz, 2H), 6.24~6.19(m, 1H), 6.06(s, 1H), 4.20(q,J=8.0 Hz, 2H), 2.24(s, 3H), 2.01(d,J=8.0 Hz, 3H), 1.22(t,J=8.0 Hz, 3H);13C NMRδ: 166.7, 155.9, 139.6,138.3, 133.3, 130.3, 129.8, 128.4, 127.9, 127.4, 115.9, 79.2, 60.4, 20.5, 15.5,14.2; MS(ESI)m/z: 310{[M+H]+}。
3c: 无色油状液体,收率85%;1H NMRδ: 7.40~7.22(m, 5H), 7.03(d,J=8.0 Hz, 2H), 6.83(d,J=8.0 Hz, 2H), 6.24~6.19(m, 1H), 6.07(s, 1H), 4.20(q,J=8.0 Hz, 2H), 2.54(q,J=8.0 Hz, 2H), 2.01(d,J=8.0 Hz, 3H), 1.15(m, 6H);13C NMRδ: 166.7, 156.1, 139.6,138.3, 136.8, 133.3, 128.6, 128.5, 127.9, 127.4, 115.9, 79.2, 60.5, 27.9, 15.8, 15.6,14.2; MS(ESI)m/z: 324{[M+H]+}。
3d: 无色油状液体,收率91%;1H NMRδ: 1.22(t,J=8.0 Hz, 3H), 1.26(s, 9H), 2.01(d,J=4.0 Hz, 3H), 4.20(q,J=8.0 Hz, 2H), 6.08(s, 1H), 6.19~6.25(m, 1H), 6.85(d,J=8.0 Hz, 2H), 7.22~7.41(m, 7H);13C NMRδ: 166.7, 155.8, 143.7,139.7, 138.3, 133.3, 128.5, 127.9,127.4, 126.1, 115.3, 79.1, 60.5, 34.1, 31.5, 15.6, 14.2; MS(ESI)m/z: 352{[M+H]+}。
3e: 无色油状液体,收率92%;1H NMRδ: 7.95~7.92(m, 2H), 7.40~7.27(m, 5H), 6.95~6.91(m, 2H), 6.22~6.17(m, 2H), 4.30(q,J=8.0 Hz, 2H), 4.20(q,J=8.0 Hz, 2H), 2.02(d,J=8.0 Hz, 3H), 1.35(t,J=8.0 Hz, 3H), 1.22(t,J=8.0 Hz, 3H);13C NMRδ: 166.4, 166.3, 161.5, 139.1, 138.7, 132.7, 131.4, 128.6, 128.2,127.3, 123.3, 115.4, 79.0, 60.6,15.6,14.4, 14.2; MS(ESI)m/z: 368{[M+H]+}。
3f: 无色油状液体,收率95%;1H NMRδ: 7.40~7.25(m, 5H), 7.06(d,J=8.0 Hz, 2H), 6.84(d,J=8.0 Hz, 2H), 6.24~6.18(m, 1H), 6.07(s, 1H), 4.20(q,J=8.0 Hz, 2H), 3.53(t,J=8.0 Hz, 2H), 3.33(s, 3H), 2.79(t,J=8.0 Hz, 2H), 2.01(d,J=8.0 Hz, 3H), 1.22(t,J=8.0 Hz, 3H);13C NMRδ: 166.7, 156.5, 139.5, 138.4, 133.2, 131.4, 129.6, 128.5, 127.9, 127.4, 115.9, 79.1, 73.8, 60.5, 58.6, 35.3, 15.6, 14.2; MS(ESI)m/z: 354{[M+H]+}。
3g: 无色油状液体,收率95%;1H NMRδ: 7.38~7.22(m, 7H), 6.79(d,J=8.0 Hz, 2H), 6.20~6.14(m, 1H), 6.07(s, 1H), 4.20(q,J=8.0 Hz, 2H), 2.01(q,J=8.0 Hz, 3H), 1.21(t,J=8.0 Hz, 3H);13C NMRδ: 166.5, 157.1,138.9,138.8, 132.9, 132.2, 128.6, 128.2,127.4, 117.8, 113.4, 79.4, 60.6, 15.6, 14.2; MS(ESI)m/z: 374{[M+H]+}。
3h: 无色油状液体,收率90%;1H NMRδ: 7.39~7.14(m, 7H), 6.83(d,J=8.0 Hz, 2H), 6.20~6.14(m, 1H), 6.06(s, 1H), 4.21(q,J=8.0 Hz, 2H), 2.01(d,J=4.0 Hz, 3H), 1.22(t,J=8.0 Hz, 3H);13C NMRδ: 166.6, 156.5,138.9,138.8, 132.9, 129.3, 128.6, 128.1, 127.3, 126.0, 117.3, 79.5, 60.6, 15.6, 14.2; MS(ESI)m/z: 330{[M+H]+}。
3i: 无色油状液体,收率52%;1H NMRδ: 7.49~7.21(m, 7H), 6.98(d,J=8.0 Hz, 2H), 6.20~6.15(m, 2H), 4.22(q,J=8.0 Hz, 2H), 2.03(d,J=8.0 Hz, 3H), 1.23(t,J=8.0 Hz, 3H);13C NMRδ: 166.5, 160.3, 139.2, 138.5, 132.6, 128.7, 128.3, 127.3, 126.9, 126.8, 126.7, 115.8, 79.2, 60.7, 15.6, 14.2; MS(ESI)m/z: 364{[M+H]+}。
3j: 无色油状液体,收率95%;1H NMRδ: 7.41~7.19(m, 7H), 6.92~6.89(m, 3H), 6.26(q,J=8.0 Hz, 1H), 6.11(s, 1H), 3.74(s, 3H), 2.01(d,J=4.0 Hz, 3H);13C NMRδ: 121.1, 167.1, 157.9, 139.4, 138.8, 132.9, 129.4, 128.5, 127.9, 127.3, 116.0, 78.9, 51.4, 15.6; MS(ESI)m/z: 282{[M+H]+}。
3k: 无色油状液体,收率64%;1H NMRδ: 7.48~7.18(m, 12H), 6.99~6.91(m, 3H), 6.41(q,J=4.0 Hz, 1H), 6.25(s, 1H), 2.12(d,J=4.0 Hz, 3H);13C NMRδ: 164.9, 157.9, 150.5, 140.8, 139.2, 132.6, 129.5, 129.4, 128.7, 128.2, 127.5, 126.3, 125.9, 121.6, 116.1, 79.1, 15.8; MS(ESI)m/z: 344{[M+H]+}。
3l: 无色油状液体,收率53%;1H NMRδ: 7.47~7.28(m, 12H), 7.17~6.96(m, 3H), 6.94(q,J=8.0 Hz, 1H), 6.53(s, 1H), 5.22(s, 2H), 1.91(d,J=4.0 Hz, 3H);13C NMRδ: 166.6, 157.7, 143.8, 139.9, 136.0, 132.3, 129.5, 128.6, 128.4, 128.2, 128.1, 127.5,126.3, 121.1,115.5, 75.2, 66.7, 15.1; MS(ESI)m/z: 358{[M+H]+}。
3m: 无色油状液体,收率85%;1H NMRδ: 7.29~7.12(m, 6H), 6.92~6.86(m, 3H), 6.20(q,J=8.0 Hz, 1H), 6.08(s, 1H), 4.19(q,J=8.0 Hz, 2H), 2.31(s, 3H), 2.00(d,J=4.0 Hz, 3H), 1.20(t,J=4.0 Hz, 3H);13C NMRδ: 166.7, 158.1, 138.1, 137.7, 136.4, 133.3, 129.4, 129.2, 127.4, 121.0, 116.0, 78.9, 60.5, 21.2, 15.5, 14.2; MS(ESI)m/z: 310{[M+H]+}。
3n: 无色油状液体,收率55%;1H NMRδ: 7.42~7.19(m, 6H), 6.93~6.88(m, 3H), 6.31~6.24(m, 1H), 6.08(s, 1H), 4.23~4.18(m, 2H), 2.03(d,J=4.0 Hz, 3H), 1.22(t,J=8.0 Hz, 3H);13C NMRδ: 166.3, 157.7, 141.8, 139.1, 134.4, 132.6, 129.7, 129.5, 129.4, 128.8, 128.7, 128.1, 127.5, 125.5, 121.4, 116.0, 78.4, 60.6, 15.6, 14.2; MS(ESI)m/z: 330{[M+H]+}。
3o: 无色油状液体,收率54%;1H NMRδ: 7.48~7.45(m, 2H), 7.30~7.20(m, 4H), 6.94~6.88(m, 3H), 6.28~6.23(m, 1H), 6.06(s, 1H), 4.20(q,J=8.0 Hz, 2H), 2.02(d,J=8.0 Hz, 3H), 1.23(t,J=8.0 Hz, 3H);13C NMRδ: 138.8, 166.4, 161.5, 157.7, 143.4, 131.7, 131.5, 129.6, 129.5, 129.1, 128.1, 121.4, 116.0, 78.4, 60.6, 15.6, 14.2; MS(ESI)m/z: 375{[M+H]+}。
3p: 无色油状液体,收率48%;1H NMRδ: 7.46~7.43(m, 2H), 7.29~7.25(m, 1H), 7.15~6.94(m, 6H), 6.65~6.59(m, 1H), 6.47(s, 1H), 4.24(q,J=8.0 Hz, 2H), 1.91(d,J=4.0 Hz, 3H), 1.29(t,J=8.0 Hz, 3H);13C NMRδ: 166.7, 157.5,143.2, 129.5, 128.1, 128.0, 121.2, 115.4, 115.3, 115.1, 74.7, 61.0, 14.9, 14.2; MS(ESI)m/z: 314{[M+H]+}。
2 结果与讨论
2.1 反应条件优化
以3a的合成为模板反应,考察溶剂、催化剂、反应物投料比[r=n(2a)∶n(1a)]及反应温度对3a收率的影响,对反应条件进行优化。
(1) 溶剂
1a 1 mmol,反应8 h,其余反应条件同1.2(1),考察溶剂对3a收率的影响,结果见表1。由表1可见,当使用DMF作溶剂时,3a收率为62%;当使用乙腈为溶剂时,收率78%;当使用甲苯为溶剂时,收率85%;当使用苯为溶剂时,3a收率提高至96%。因此,本实验选择苯为溶剂。

表1 溶剂对3a收率的影响
(2) 催化剂
1a 1 mmol,反应8 h,其余反应条件同1.2(1),考察催化剂对3a收率的影响,结果见表2。当使用(n-Bu)3P为催化剂时,3a收率83%;当使用(CH3)3P为催化剂时,3a收率90%;当使用PPh3为催化剂时,3a收率96%。因此以三苯基膦为催化剂较佳。
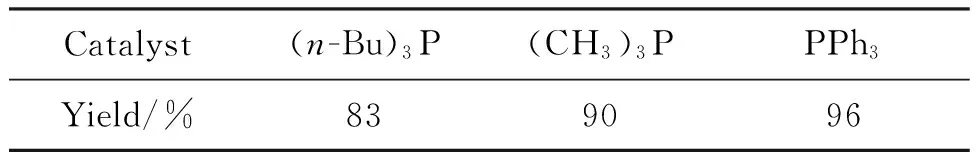
表2 催化剂对3a收率的影响
(3)r
1a 1 mmol,反应8 h,其余反应条件同1.2(1),考察r对3a收率的影响,结果见表3。由表3可见,当r=1时,3a收率为87%;当r=1.1时,3a收率为90%;当r=1.2时,3a收率为96%;当r=1.3时,3a收率有所降低,为91%。因此,确定r为1.2较佳。

表3 反应物的投料比对3a收率的影响
(4) 反应温度
1a 1 mmol,反应8 h,其余反应条件同1.2(1),探究反应温度对3a收率的影响,结果见表4。由表4可见,当反应温度为60 ℃时,3a收率72%;当反应温度升高至70 ℃时,3a收率升高至87%;当反应温度升高至80 ℃时,3a收率最高(96%);继续升高反应温度至90 ℃, 3a收率反而降低至85%。因此,最佳反应温度为80 ℃。

表4 温度对3a收率的影响
综上所述,合成3a的最佳反应条件为:苯为溶剂,PPh3为催化剂,反应物的投料比为1.2,氮气保护下于80 ℃反应。
2.2 底物拓展
氮气保护下,以PPh3为催化剂,苯为溶剂,反应物的投料比为1.2,反应温度为80 ℃进行底物拓展,结果见Scheme 1。实验结果显示,当苯酚上连有推电子基团或吸电子基团时(3c~3h),反应收率均较高(85%~95%);当2-苄基-2,3-丁二烯酸酯上连有吸电子基团时(3n~3p),反应收率较低(55%~48%)。
Scheme 2
2.3 反应机理
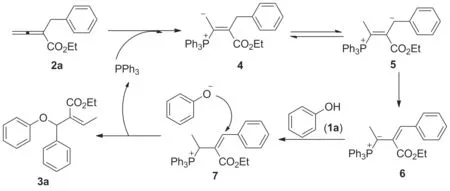
推测1a和2a反应合成3a的反应机理见Scheme 2所示:首先三苯基膦亲核加成至2a上形成具有两性离子的季膦盐4,然后通过质子转移形成烯丙基型的膦叶立德5;再通过共振作用形成相对稳定的膦叶立德6;而苯酚1a在化合物6的作用下去质子后,进攻化合物7的β′-位,最后消去三苯基膦得β′-位的加成产物3a。
通过有机膦催化苯酚与联烯酸酯的亲核加成反应,合成了一系列的新型(Z)-2-[(苯氧基)(芳基)]次甲基-2-丁烯酸酯类化合物,进一步丰富了膦催化的亲核加成产物的种类。由于该类化合物同时具有醚键、双键官能团,有发生消除反应生成共轭烯烃的可能[16],是构建苯并杂环化合物的潜在原料,因此其具有重要的科研价值和潜在的应用价值。
[1] Ye I W, Zhou J, Tang Y. Phosphine-triggered synthesis of functionalized cyclic compounds[J].Chem Soc Rev,2008,37:1140-1152.
[2] Wilson J E, Fu G C. For representative examples on phosphine-catalyzed asymmetric[3+2] variants[J].Angew Chem Int Ed,2006,45:1426-1429.
[3] Guan X Y, Wei Y, Shi M. Phosphane-catalyzed umpolung addition reaction of nucleophiles to ethyl 2-methyl-2,3-butadienoate[J].Eur J Org Chem,2011,2673-2677.
[4] Ma S. Recent advances in the chemistry of allenes[J].Aldrichimica Acta,2007,40(4):91-102.
[5] Zhang C, Lu X. Phosphine-catalyzed cycloaddition of 2,3-butadienoates or 2-butynoates withelectron-deficient olefins.A novel [3+2] annulation approach to cyclopentenes[J].Org Chem,1995,60(9):2906-2908.
[6] Xu Z, Lu X. Phosphine-catalyzed [3+2] cycloaddition reaction of methyl 2,3-butadienoates andN-tosylimines. A novel approach to nitrogen heterocycles[J].Tetrahedron Lett,1997,38(19):3461-3464.
[7] Zhu X F, Henry C E, Kwon O. A highly diastereoselective synthesis of 3-carbethoxy-2,5-disubstituted-3-pyrrolines by phosphine catalysis[J].Tetrahedron,2005,61(26):6276-6282.
[8] Zhu X F, Lan J, Kwon O. An expedient phosphine-catalyzed [4+2] annulation:Synthesis of highly functionalized tetrahydropyridines[J].J Am Chem Soc,2003,125(16):4716-4717.
[9] Zhu X F, Henry C E, Wang J,etal. Phosphine-catalyzed synthesis of 1,3-dioxan-4-ylidenes[J].Org Lett,2005,7(7):1387-1390.
[10] Creech G S, Kwon O. Alcohol-assisted phosphine catalysis:One-step syntheses of dihydropyrones from aldehydes and allenoates[J].Org Lett,2008,10(3):429-432.
[11] 徐四龙,贺峥杰. 叔膦参与下联烯酸酯与醛的反应[J].中国科学:化学,2010,40(7):856-868.
[12] Wang T, Ye S. Phosphine-catalyzed [3+2] cycloaddition of allenoates with trifluoromethylketones:Synthesis of dihydrofurans and tetrahydrofurans[J].Org Biomol Chem,2011,9(14):5260-5265.
[13] Tioga J, Martin V G, Vakhshori Y S,etal. Phosphine-catalyzedβ′-umpolung addition of nucleophiles to activatedα-alkyl allenes[J].Org Lett,2011,13(10):2586-2589.
[14] Andrews I P, Kwon O. Enantioselective total synthesis of (+)-ibophyllidineviaan asymmetric phosphine-catalyzed [3+2] annulation[J].Chem Sci,2012,3(8):2510-2514.
[15] Rout L, Hamed A M. Allene carboxylates as dipolarophiles in Rh-catalyzed carbonyl ylide cycloadditions[J].Chemistry,2009,15(47):12926-12928.
[16] Bruce H, Lipshutz, Subir Ghorai,etal. Tandem olefin metathesis-elimination reactions.A new route to doubly unsaturated carbonyl derivatives[J].Tetrahedron,2008,64:6949-6954.
Synthesis of Novel (Z)-ethyl 2-(phenoxy(phenyl)methyl) but-2-enoate Compounds
JIN Xiu-xiu1,2, PAN Cheng-min1,2, YANG Jian-guo2*, GAO Jian-rong1
(1. College of Chemical Engineering, Zhejiang University of Technology, Hangzhou 310014, China;2. College of Medicine and Chemical, Taizhou University, Taizhou 317000, China)
A series of novel (Z)-ethyl 2-(phenoxy(phenyl)methyl)but-2-enoate compounds were synthesized by polarization addition reaction of ethylα-substituted-2,3-dienoates with substituted phenols using PPh3as catalyst and benzene as solvent in N2atmosphere. The structures were characterized by1H NMR,13C NMR and MS(ESI).
triphenylphosphine; phenol; 2,3-dienoate; allene; catalysis; polarization addition reaction; synthesis
2016-12-30;
2017-05-24
国家自然科学基金资助项目(21272169)
金秀秀(1990-),女,汉族,浙江上虞人,硕士研究生,主要从事有机化学合成方法学的研究。 E-mail: 740072786@qq.com
杨健国,教授,硕士生导师, E-mail: yjg@tzc.edu.cn
O626.13; O623.6
A
10.15952/j.cnki.cjsc.1005-1511.2017.07.16334

