DEHP对大鼠肝组织及肝细胞色素P450酶系的影响
刘瑞菁,贺永健,刘 焕,郑冬冬,范嘉盛,柳春红,2*(.华南农业大学食品学院,广东 广州 50642;2.广东省食品质量安全重点实验室,广东 广州 50642)
DEHP对大鼠肝组织及肝细胞色素P450酶系的影响
刘瑞菁1,贺永健1,刘 焕1,郑冬冬1,范嘉盛1,柳春红1,2*(1.华南农业大学食品学院,广东 广州 510642;2.广东省食品质量安全重点实验室,广东 广州 510642)
为探讨邻苯二甲酸二(2-乙基己基)酯(DEHP)染毒对雄性大鼠肝组织及肝细胞色素P450(CYP450)酶系的影响,将32只SPF级SD雄性大鼠随机分为4组:(对照组, DEHP低,中,高剂量组),每组8只,分别以0, 300, 1000, 3000mg/kg DEHP的剂量连续灌胃染毒28d.观察肝组织病理学变化;ELISA法测定肝脏CYP450、亚型CYP2E1和CYP3A1、以及孕烷X受体(PXR)水平.结果显示,HE染色可见低,中,高剂量DEHP暴露组肝脏组织分别出现炎性细胞浸润、充血、空泡和脂肪变性等不同程度的损伤; DEHP中,高剂量组大鼠CYP450酶含量分别为(203.61±34.44),(263.73±63.78)pmol/gprot, CYP2E1酶含量分别为(14.57±3.03),(20.06±2.90)U/gprot,均显著高于对照组(141.12±20.24)pmol/gprot, (10.76±2.24)U/gprot(P<0.01);低,中,高3个剂量组CYP3A1含量及PXR含量均同样显著高于对照组(P<0.05或P<0.01). DEHP暴露对大鼠肝组织有损伤作用,对肝脏CYP450、CYP2E1、CYP3A1以及上游调节因子PXR具有诱导效应.
邻苯二甲酸二(2-乙基己基)酯;肝损伤;CYP450;孕烷X受体
邻苯二甲酸酯(PAEs)是目前环境中较为丰富且普遍存在的污染物,食品包装、医疗设备(比如血袋和透析设备)以及化妆品等都含有该物质,在世界范围内,每年要消耗约180亿t邻苯二甲酸酯类[1],随着时间的推移,PAEs能从塑料制品中溶出和挥发,进而导致人群明显暴露于 PAEs的污染中[2].邻苯二甲酸二(2-乙基己基)酯(DEHP)是我国工业生产中使用最广泛的 PAEs类物质,是聚氯乙烯(PVC)塑料制品中常用的一种增塑剂[3-4],也是在环境污染物中含量较高的一种[5],可经口、呼吸道以及皮肤等多种途径进入人体内[6],美国毒性物质与疾病登记署(ATSDR)估算一般人群每日暴露于 DEHP的最大剂量可达2mg/d[7].已有的毒性研究表明,DEHP具有肝毒性、免疫毒性、生殖毒性等,其中以生殖毒性最为明显,并具有引起甲状腺素代谢改变的类雌激素活性[8-10].
细胞色素P450(CYP450)是一类主要存在于肝脏中的多功能氧化酶系[11],在生物体内既可参与前致癌物、药物及前毒物等外源化合物的生物转化,又可催化氧化和还原代谢类固醇激素、脂肪酸及胆汁酸等内源性物质[12].CYP450在毒理学上的意义是可作为污染物潜在影响的早期预警信号系统对环境污染物进行监测和预报[13]. CYP2E1占肝脏CYP450总量的7%,主要参与丙酮、乙醇、氯仿等小分子化合物代谢,有研究表明,长期酗酒可使肝细胞中CYP2E1的活性大大提高[14];CYP3A基因在肝脏中高度表达,约占肝脏中CYP450的30%,它们在许多原致癌物、内源性化合物以及 50%药物的氧化和过氧化、还原代谢中充当重要的角色[15],CYP3A1又称类固醇诱导性同工酶,是大鼠肝脏中 CYP3A的主要亚型[16].核受体超家族是介导CYP450酶系的关键调控因子,孕烷 X受体(PXR)是其中一类由配体调节的孤儿核受体,主要在肝脏中表达[17],可以被利福平、胆汁酸等多种物质激活[18],外源性化合物对 CYP450的诱导作用也主要是通过由配体介导的转录调节因子 PXR的调控实现的.关于DEHP是否能激活PXR进而对CYP450酶等产生影响,目前并不明确,本研究通过不同剂量的 DEHP暴露探讨其对大鼠肝组织及细胞色素P450酶的影响.
1 材料与方法
1.1 主要试剂与仪器
DEHP纯度≥99.5% (美国Sigma-Aldrich公司);金龙鱼玉米油 (市售);考马斯亮蓝试剂盒(南京建成生物工程研究所);苏木素伊红染色试剂盒(碧云天生物技术研究所);大鼠 CYP450酶试剂盒、CYP2E1试剂盒、CYP3A1试剂盒、孕烷 X受体(PXR)试剂盒均购于上海江莱生物科技有限公司;三羟甲基氨基甲烷(Tris) (国药集团化学试剂有限公司);其他试剂均为国产分析纯;Enspire Xenon Light Module多功能酶标仪(美国PE公司);Thermo Fisher Lynx 4000高速冷冻离心机;冷冻研磨仪 (上海净信实业技术有限公司);YD-202A轮转式石蜡切片机 (河北润联科技开发有限公司);BX51T-PHD-J11显微镜(日本奥林巴斯).
1.2 实验方法
1.2.1 实验动物与分组 SPF级 SD雄性大鼠32只,4~5周,体重90~110g,一批次购于广东省医学动物实验中心,实验动物合格证号:SCXK (粤)2013-0002.单笼饲养,适应性饲养一周后按体重采用随机区组设计分组法[19]分为4组:对照组(C组)和低(L组)、中(M组)、高(H组)剂量组,每组 8只.低、中、高剂量组以 300、1000、3000mg/kg的DEHP玉米油溶液灌胃,灌胃体积1mL,对照组灌以同体积的玉米油.每天上午9:00灌胃,连续染毒28d,期间大鼠自由摄食、饮水,动物室温度22~24℃,相对湿度45%~55%,于末次染毒24h后,断颈处死并迅速取出肝脏,称量并计算脏器系数:
脏器系数(%)=脏器湿重/体质量×100%及时切取一定体积的肝脏组织块用 10%福尔马林固定,用于制备组织切片.
1.2.2 大鼠肝微粒体的制备 取新鲜肝脏,用预冷的PBS缓冲液(0.01mol/L)冲洗后,用滤纸吸干,剪取1.5g,按质量体积比1:4的比例加入TMS缓冲液(Tris 3.025g, MgCl20.3045g,蔗糖34.20g,加蒸馏水至250mL溶解,用盐酸调节pH值至7.40,蒸馏水定容至 500mL),用冷冻研磨仪制备成肝匀浆,4℃高速离心机12000g离心20min,小心吸取上清,并按每毫升上清液加 0.1mL 88mmol/L CaCl2溶液,轻轻搅拌数次,置冰浴中5min,再将混合液于4℃高速离心机27000g离心15min,弃去上清液,按每克肝组织所得微粒体沉淀重悬于5mL 0.10mol/L Tris溶液中(pH=7.40),用移液枪轻轻吹打,洗涤,以除去杂蛋白和过量的 CaCl2,在4℃高速离心机27000g离心15min所得沉淀即为肝微粒体,CYP450、CYP2E1、CYP3A1酶含量以及PXR含量的检测采用ELISA试剂盒,微粒体蛋白浓度采用考马斯亮蓝法测定.
1.2.3 组织切片制备及HE染色 大鼠断颈后,迅速分离取出肝脏,取下组织块(一般厚度不超过0.5cm),放入预先配好的固定液中(10%福尔马林),固定24h以上,使组织、细胞的蛋白质变性凝固,以防止细胞死后的自溶或细菌的分解,从而保持细胞本来的形态结构,将组织脱水透明、浸蜡包埋、切片贴片和脱蜡染色,光镜下观察.
1.2.4 统计学分析 采用SPSS23.0软件进行统计学分析,实验数据用±s 表示.多组间比较采用单因素方差分析,进一步进行组间两两比较,若方差齐,采用LSD检验;若方差不齐,采用Tamhane’s检验,差异显著水平为 P<0.05,极显著水平为P<0.01.
2 结果与分析
2.1 体质量变化
DEHP暴露前后大鼠体质量及其增量见表1.各组大鼠体质量在染毒结束后均有增长,对照组大鼠体质量增量较各染毒组高;随染毒剂量增加,大鼠体质量增量减少,DEHP暴露高剂量组大鼠的体质量增量极显著低于对照组(P<0.01).
表1 DEHP对大鼠体质量的影响(±s, n=8)Table 1 Effect of DEHP on weight of rats (±s, n=8)
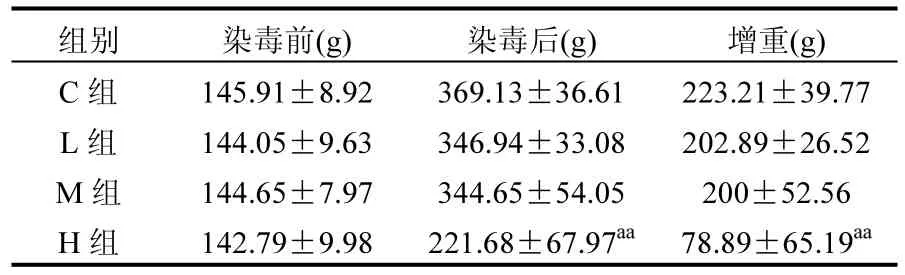
表1 DEHP对大鼠体质量的影响(±s, n=8)Table 1 Effect of DEHP on weight of rats (±s, n=8)
注:与对照组比较,a:P<0.05;aa:P<0.01(下同).
组别 染毒前(g) 染毒后(g) 增重(g) C组 145.91±8.92 369.13±36.61 223.21±39.77 L组 144.05±9.63 346.94±33.08 202.89±26.52 M组 144.65±7.97 344.65±54.05 200±52.56 H组 142.79±9.98 221.68±67.97aa 78.89±65.19aa
2.2 DEHP对大鼠肝脏重量及脏器系数影响
各组大鼠肝脏重量及脏器系数见表 2.与对照组比较,DEHP染毒组大鼠的肝脏质量、肝脏系数均明显升高,具有统计学意义(P<0.05, P<0.01),且呈现出剂量-效应关系.
表2 DEHP对大鼠肝脏重量及脏器系数的影响(±s, n=8)Table 2 Effect of DEHP on weight and coefficient of liver(±s, n=8)

表2 DEHP对大鼠肝脏重量及脏器系数的影响(±s, n=8)Table 2 Effect of DEHP on weight and coefficient of liver(±s, n=8)
组别 肝重量(g) 脏器系数(%) C组 12.54±1.37 3.40±0.21 L组 14.96±1.74a 4.32±0.32aaM组 16.74±1.27aa 4.83±0.21aaH组 16.80±2.71aa 7.49±0.96aa
2.3 DEHP对大鼠肝脏组织形态学的影响
在光镜下观察各组大鼠肝脏组织切片结果见图 1.对照组细胞形态正常,未见炎性细胞浸润及水肿变性;L组,细胞形态不规则,可见少量炎性细胞浸润;M 组,肝细胞部分变性并伴有轻度水肿,嗜酸性变伴肝索散在淋巴细胞浸润,炎性细胞浸润增多,有充血现象;H组,组织严重损伤,细胞形态严重改变,肝细胞明显广泛浊肿,在淤血周围个别细胞出现空泡,产生脂肪变性.

图1 大鼠肝组织病理切片Fig.1Histology of livers from DEHP-treated rats
2.4 DEHP对大鼠肝微粒体CYP450酶及亚型含量的影响
各组大鼠肝微粒体 CYP450、CYP2E1及CYP3A1的含量见图2-4.随着染毒剂量增大,3个剂量组的CYP450、CYP2E1、CYP3A1含量均呈现逐渐升高的趋势;与对照组比较,中、高剂量染毒组的CYP450、CYP2E1含量升高都具有统计学意义(P<0.01),3个剂量组的CYP3A1含量的升高亦具有统计学意义(P<0.01).
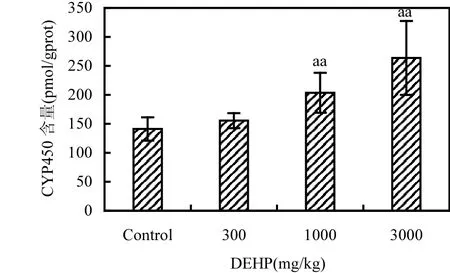
图2 大鼠肝微粒体中CYP450含量(n=8)Fig.2 CYP450 in rat liver induced by DEHP (n=8)

图3 大鼠肝微粒体CYP2E1含量(n=8)Fig.3 CYP2E1 in rat liver induced by DEHP (n=8)

图4 大鼠肝微粒体CYP3A1含量(n=8)Fig.4 CYP3A1 in rat liver induced by DEHP (n=8)
2.5 DEHP暴露后对大鼠肝脏PXR含量的影响
各组大鼠肝脏中PXR的含量见图5.随着染毒剂量的增大,PXR含量也呈升高趋势;与对照组比较,低剂量组PXR含量的上升具有显著性意义(P<0.05),而中、高剂量组的升高则具有极显著性意义(P<0.01).
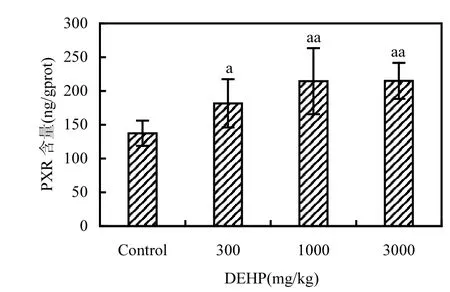
图5 大鼠肝脏中PXR含量(n=8)Fig.5 PXR in rat liver induced by DEHP (n=8)
3 讨论
肝脏是毒物代谢和转运的主要器官,也是CYP450酶高表达的场所,体内参与药物及外源化学物代谢的主要为肝 CYP450酶系,许多药物及环境内分泌干扰物对CYP450酶系具有诱导或抑制作用,已有的研究表明,利福平与异烟肼对大鼠肝组织CYP2E1具有诱导作用[20];烟草烟气中的多环芳烃类物质(PAHs)对人肺癌细胞中的CYP1A1也同样具有诱导表达作用[21];丹参酮ⅡA能显著诱导CYP1A2及CYP2E1的活性以及基因蛋白的表达,且呈现出剂量-效应关系;安妥明与16α-碳腈孕烷醇酮(PCN)联合应用时可增强PXR和CYP3A1的表达,且诱导作用随安妥明浓度的增加而增加[22].DEHP是目前工业生产中大量使用的 PAEs类物质,研究表明,DEHP可通过干扰林蛙精巢中CYP17和CYP19等基因的表达,进一步影响其相应关键酶的表达,从而干扰类固醇激素的合成,导致雌激素效应的产生[23];田雨等[24]研究表明,DEHP对大鼠肝脏CYP2E1和CYP3A均具有诱导作用.本研究结果显示,DEHP暴露会导致大鼠肝脏明显肿大,脏器系数明显增加,通过光镜下观察 HE染色肝脏组织切片发现:肝脏中出现肿胀以及空泡和脂肪变性等,说明 DEHP暴露对大鼠肝脏具有损伤作用,随着暴露剂量的增加,肝细胞损伤程度加重,与Kim等[25]对SD大鼠进行的 DEHP经口染毒实验结果较为相符;通过对肝微粒体CYP450、亚型CYP2E1、CYP3A1以及上游调节因子 PXR的测定结果分析发现, DEHP对CYP450及其两种亚型均具有明显的诱导作用,对PXR的作用亦是如此.
PXR是一种重要的核受体,调控的药物代谢酶包括细胞色素酶如:CYP3A4、CYP7A1、CYP2B6、CYP2C9、CYP2C18和CYP2C19等,II相代谢酶如:UDP-葡糖醛酸转移酶、谷胱甘肽-S-转移酶等[26].由于 PXR 能够调控多种CYP450的转录,因而它必须能够被大量外源物所激活,已有文献报道,许多外源化学物如:处方药、中草药、农药以及环境污染物等均可激活PXR[27],黄芩素在 LS174T细胞系中可以通过诱导PXR介导CYP3A4的转录表达,并且呈现剂量-效应关系等[28].本实验研究发现,DEHP染毒对大鼠肝脏CYP450及其亚型CYP2E1、CYP3A1均具有明显的诱导作用,PXR水平也显著升高,这可以视为大鼠机体早期自身对抗外源性化学污染物的一种应激代偿机制,推测其作用机制是:DEHP进入到体内后,通过激活 PXR进而对CYP450酶及其亚型产生影响,当DEHP进入肝细胞后,与细胞核内 PXR的配体结合区域结合,结合有配体的 PXR与另外一重要核受体RXR(维甲酸X受体)组成异二聚体,并与CYP3A基因反应元件结合,从而促进 CYP3A基因的转录表达;当与细胞内的载体蛋白结合时,可进一步诱导CYP2E1mRNA的转录,表达强度增强,其含量和也增加, 进而促进毒物的代谢,也说明了DEHP对PXR受体及CYP450等的诱导作用,是机体自身为了加快其在体内的代谢速度的早期应激反应.
肝脏微粒体中CYP450及其亚型CYP2E1、CYP3A1 以及PXR 含量可作为污染生物标志物来评价DEHP 的早期污染毒理效应. 肝细胞色素P450 酶系的诱导也已被提出作为评价环境污染状况的最灵敏的生物学反应之一.由于PXR的配体种类繁多,因此研究DEHP对PXR的调节作用将有助于我们更好地探讨环境污染物的作用机制,为以后环境监测等工作奠定基础.本实验通过大鼠染毒模型证明了环境污染物DEHP 早期的短期重复暴露可通过激活PXR 对CYP450 总酶及亚型CYP2E1、CYP3A1 含量产生影响,但DEHP 的长期慢性接触以及是否能通过PXR 通路对CYP450 酶的其他亚型产生诱导还是抑制效应还有待进一步的研究.
4 结论
4.1 DEHP短期重复染毒会导致大鼠肝组织出现不同程度的损伤,随着剂量的增加,肝组织炎性细胞浸润从少到多,肝细胞从部分变性、轻度水肿到广泛浊肿,并出现充血、空泡、脂肪变性等病理变化.
4.2 DEHP短期重复染毒使肝微粒体CYP450、CYP2E1及CYP3A1酶含量以及肝脏PXR含量同时上升,提示DEHP暴露可能通过激活上游调节因子PXR对CYP450总酶及亚型CYP2E1、CYP3A1水平产生影响.D E H P暴露所致肝脏毒性及今后如何尽可能降低这一暴露危害值得进一步研究探讨.
[1] Lovekamp-Swan T, Davis B J. Mechanisms of phthalate ester toxicity in the female reproductive system [J]. Environmental Health Perspectives, 2003,111(2):139-145.
[2] Svechnikova I, Svechnikov K, Söder O. The influence of di-(2-ethylhexyl) phthalate on steroidogenesis by the ovarian granulosa cells of immature female rats [J]. Journal of Endocrinology, 2007,194(3):603-609.
[3] 杨艳玲,徐晓虹.增塑剂 D E H P的神经和行为发育毒性 [ J ].心理科学进展, 2013 , 21 ( 6 ) : 1007 -1013 .
[4] 王夫美,陈 丽,焦 姣,等.住宅室内降尘中邻苯二甲酸酯污染特征及暴露评价 [ J ].中国环境科学, 2012 , 32 ( 5 ) : 780 -786 .
[5] 耿梦娇,昌 盛,刘 琰,等.滹沱河冲洪积扇深层孔隙水中多环芳烃和酞酸酯的污染水平与饮水健康风险评估 [ J ].中国环境科学, 2016 , 36 ( 12 ) : 3824 -3830 .
[6] Mckee R H, Butala J H, David R M, et al. NTP center for the evaluation of risks to human reproduction reports on phthalates:addressing the data gaps [J]. Reproductive Toxicology, 2004,18(1):1-22.
[7] Koch H M, Drexler H, Angerer J. An estimation of the daily intake of di (2-ethylhexyl) phthalate (DEHP) and other phthalatesin the general population [J]. International Journal of Hygiene andEnvironmental Health, 2003,206(2):77-83.
[8] Guyton K Z, Chiu W A, Bateson T F, et al. A Reexamination of the PPAR-α Activation Mode of Action as a Basis for Assessing Human Cancer Risks of Environmental Contaminants [J]. Environmental Health Perspectives, 2009,117(11):1664-1672.
[9] Swan S H. Environmental phthalate exposure in relation to reproductive outcomes and other health endpoints in humans [J]. Environmental Research, 2008,108(2):177-184.
[10] Koch H M, Preuss R, Angerer J D. Di (2-ethylhexyl) phthalate (DEHP): Human metabolism and internal exposure-an update and latest results1 [J]. International Journal of Andrology, 2006, 29(1):155-165.
[11] 李晓宇,刘皋林.CYP450酶特性及其应用研究进展 [J]. 中国临床药理学与治疗学, 2008,13(8):942-946.
[12] Rocejanasaroj A, Tencomnao T, Sangkitikomol W. Thunbergia laurifolia extract minimizes the adverse effects of toxicants by regulating P-glycoprotein activity, CYP450, and lipid metabolism gene expression in HepG2cells [J]. Genetics & Molecular Research, 2014,13(1):205-219.
[13] 生秀梅,熊 丽,唐红枫,等.细胞色素P450酶系作为生物标志物在毒理学上的应用 [J]. 四川环境, 2005,24(3):74-78.
[14] Meskar A, Pleegautier E, Amet Y, et al. [Alcohol-xenobiotic interactions. Role of cytochrome P4502E1] [J]. Pathologie Biologie, 2001,49(9):696-702.
[15] 张 荣,朱大岭. CYP3A基因表达分子机制的研究进展 [J]. 医学研究杂志, 2005,34(2):57-59.
[16] 吴 伟,瞿建宏,聂凤琴,等.多溴联苯醚胁迫下鲫鱼肝脏微粒体CYP3A1和 GST的响应 [J]. 生态环境学报, 2009,18(3):805-810.
[17] 孙 坤.青蒿素类抗疟药与药物代谢酶相互作用研究 [D]. 太原:山西医科大学, 2011.
[18] 张芳芳,朱心强. P X R、C A R和P P A R对U G T基因转录的调节[ J ].环境卫生学杂志, 2005 , 32 ( 2 ) : 99 -104 .
[19] 周一平.用E x c e l软件进行药物毒理实验的随机分组 [ J ].药学进展, 2005 , 29 ( 9 ) : 425 -427 .
[20] 杨海峰,覃少华,江善祥.地塞米松和利福平对鸡肝C Y P 450酶系的影响 [ J ].畜牧与兽医, 2006 , 38 ( 10 ) : 37 -38 .
[21] 谢丹君,徐晶莹,诸葛淳淳,等.多环芳烃类物质对细胞色素P 4501 A 1的诱导表达 [ J ].同济大学学报(医学版) , 2013 , 34 ( 2 ) : 1 -5 .
[22] 马玉忠,刘玉芝,仲 飞,等.安妥明对大鼠细胞色素酶 P 4503 A 1的影响 [ J ].农业生物技术学报, 2008 , 16 ( 1 ) : 82 -84 .
[23] 李 苗,张育辉. D E H P对中国林蛙精巢中 S t A R、C Y P 17和C Y P 19基因表达的影响 [ J ].生态学杂志, 2012 , 31 ( 7 ) : 1785 -1790 .
[24] 田 雨,李 玲,李丰宝.邻苯二甲酸二丁酯和邻苯二甲酸二( 2 -乙基己基)酯联合染毒对雄性大鼠肝脏 P 450酶的影响 [ J ].环境与健康杂志, 2014 , 31 ( 1 ) : 19 -22 .
[25] Kim N Y, Kim T H, Lee E, et al. Functional role of phospholipase D (PLD) in di(2-ethylhexyl) phthalate-induced hepatotoxicity in Sprague-Dawley rats. [J]. Journal of Toxicology &Environmental Health, Part A. 2010,73(21/22):1560-1569.
[26] 胡冰芳,毕惠嫦,黄 民.孕烷 X受体及组成性雄甾烷受体的研究新进展 [ J ].药学学报, 2011 , 46 ( 10 ) : 1173−1177 .
[27] Kliewer S A. The nuclear pregnane X receptor regulates xenobiotic detoxification [J]. Journal of Nutrition, 2003,133(7):2444S-2447S.
[28] 夏延哲,陈 杰,潘裕华,等. 6种中药单体对人孕烷 X受体介导细胞色素酶 P 4503 A 4转录的调节作用 [ J ].热带医学杂志, 2012 , 12 ( 4 ) : 369 -372 .
Effects of DEHP on hepatic tissue and cytochrome P450 enzymes in liver of rats.
L
IU Rui-jing1, HE Yong-jian1, LIU Huan1, ZHENG Dong-dong1, FAN Jia-sheng1, LIU Chun-hong1,2∗(1.Food College, South China Agricultural University, Guangzhou 510624, China;2.Guangdong Provincial Key Laboratory of Food Quality and Safety, Guangzhou 510642, China). China Environmental Science, 2017,37(7):2749~2754
To study the effects of di-(2-ethylhexyl) phthalate (DEHP) on hepatic tissue and cytochrome enzyme 450 in rat liver. A total of 32 male SD rats were randomly divided into 4groups (n=8per group): control group, low-dose group, medium-dose group, and high-dose group. DEHP was intragastrically administrated at the dosage of 0, 300, 1000 and 3000mg/kg (body weight) for 28days. The pathological changes of hepatic tissues were observed by HE staining. ELISA method was used to determine the content of CYP450, CYP2E1, CYP3A1 and PXR. Inflammatory cellular infiltration, hyperemia, vacuoles and fatty degeneration were observed in the low, middle, and high dosage groups respectively. The contents of CYP450 and CYP2E1 in the middle dosage group [(203.61±34.44)pmol/gprot, (14.57±3.03)U/gprot] and in the high dosage group [(263.73±63.78)pmol/gprot, (20.06±2.90)U/gprot] were significantly higher than that of the control group [(141.12±20.24)pmol/gprot, (10.76±2.24)U/gprot] (P<0.01). CYP3A1 and PXR in all dosage groups increased significantly compared with the control group (P<0.05, P<0.01). DEHP exposure induced the levels of CYP450, CYP2E1, CYP3A1 and PXR in rat liver.
di-(2-ethylhexyl) phthalate;hepatic injury;cytochrome enzyme 450;PXR
X18,R994.6,R285.5
A
1000-6923(2017)07-2749-06
刘瑞菁( 1992 -) ,女,河南开封人,华南农业大学食品学院硕士研究生,主要从事食品质量与安全研究.
2016-11-24
农业部农产品质量安全监管项目(GJFP201601101);广东省科技计划项目(2013B020204001);广东省现代农业产业技术体系创新团队项目(2016LM2152)
* 责任作者, 教授, liuch@scau.edu.cn

