非小细胞肺癌放疗前后血清TGF-β1水平测定的临床意义
王 静,贾敬好,杨海芳,王志武
(河北省唐山市人民医院放化疗科,河北 唐山 063001)
·论 著·
非小细胞肺癌放疗前后血清TGF-β1水平测定的临床意义
王 静,贾敬好,杨海芳,王志武*
(河北省唐山市人民医院放化疗科,河北 唐山 063001)
目的探讨血清转化生长因子β1(transforming growth factor-β1,TGF-β1)在非小细胞肺癌(non-small cell lung cancer,NSCLC)放疗后疗效评价的意义以及与症状性放射性肺炎(radioactive pneumonia,RP)发生的相关性。方法 收集经病理学证实为NSCLC并接受3D-CRT的患者264例。放疗前及放疗结束时空腹采肘静脉血检测血清TGF-β1水平。放疗结束后 1个月按照 WHO 统一评价标准评价近期疗效。放疗开始至结束后3个月内每周按美国肿瘤放射治疗协作组织(Radiation Therapy Oncology Group,RTOG)急性放射损伤分级标准评价RP。结果患者放疗前血清TGF-β1水平为442.20~12 840.0 ng/L,中位数和四分位数间距分别为677.5 ng/L和2 186.7 ng/L,放疗后血清TGF-β1水平为280.0~11753.0 ng/L,中位数和四分位数间距位为605.0 ng/L和1 172.6 ng/L,放疗前后差异有统计学意义(Z=-4.617,P=0.000)。男性较女性RP发生率高,吸烟者较不吸烟者RP发生率高,PTV>450 cm3者较≤450 cm3者RP发生率高,放疗时间≤45 d者较>45 d者RP发生率高,放疗剂量<60 Gy者较≥60 Gy者RP发生率高,放疗后血清TGF-β1水平升高者较下降者RP发生率高,差异均有统计学意义(P<0.05)。同期化疗者较非同期化疗者总有效率高,放疗剂量≥60 Gy者较<60 Gy者总有效率高,放疗前血清TGF-β1≤677.5 ng/L较>677.5 ng/L者总有效率高,差异均有统计学意义(P<0.05)。Logistic回归分析显示,吸烟、PTV>450 cm3、放疗后血清TGF-β1水平升高是RP发生的危险因素;同期化疗、放疗剂量≥60 Gy、中央型肺癌、放疗前血清TGF-β1水平≤677.5 ng/L者近期疗效更好(P<0.05)。结论放疗后血清TGF-β1水平升高者RP发生风险增大,放疗前TGF-β1低水平者相对高水平者预后好,血清TGF-β1水平测定可作为NSCLC预后的预测因子。
癌;非小细胞肺;辐射性肺炎;转化生长因子β1
肺癌是常见的恶性肿瘤,且就诊时40%失去手术机会,放射治疗成为局部晚期非小细胞肺癌(non-small cell lung cancer,NSCLC)患者的重要治疗手段之一。转化生长因子β1(transforming growth factor-β1,TGF-β1)是人体多种上皮起源细胞的生长调节因子,TGF-β信号通路是一条重要的细胞内信号转导途径,参与胚胎发育、肿瘤发生、创伤愈合及炎症反应等生理或病理生理过程。本研究观察局部晚期NSCLC患者放疗前后TGF-β1水平变化,探讨其与近期疗效及放射性肺炎(radioactive pneumonia, RP)的相关性,旨在为肺癌放疗计划个体化的制定提供参考。
1 资料与方法
1.1 一般资料 选择2013年1月—2015年12月我院收治的NSCLC患者264例,男性198例,女性66例;年龄35~74岁,中位年龄58岁;鳞癌179例,腺癌85例。纳入标准:所有患者均在我科接受适形或调强放射治疗并经病理学证实为NSCLC患者;预期生存≥6个月;卡氏功能状态评分≥80分。排除标准:Ⅳ期广泛转移者;行肺部手术者;有胸部放疗史者;有哮喘、严重慢性支气管炎、肺气肿、肺心病、严重肺部感染者或有其他严重疾病如6个月内发生过心肌梗死者。
1.2 治疗方法 入组患者均由体部热缩膜固定,在CT下扫描定位,靶区由主任医师勾画审核,在肺窗勾画肺部原发灶大体肿瘤(gross tumor volume,GTV)和纵隔窗勾画考虑为转移的肿大淋巴结(gross tumor volume-node,GTVnd)。GTV 外放5~8 mm及肿大淋巴结累及区命名为临床靶区(clinical target volume,CTV)。CTV外扩5~10 mm命名为计划靶区(planning target volume,PTV)。PTV处方剂量在50~68 Gy,1.8~2.0 Gy/次,5次/周,采用三维适形或调强放射治疗计划。两肺的V20≤30%,V30≤20%;脊髓0体积剂量≤45 Gy;心脏的V30≤40%,V40≤30%。患者可采用序贯放化疗,或同期化疗及靶向治疗。
1.3 血清TGF-β1水平测定 放疗前和放疗结束时,用乙二胺四乙酸抗凝管采集空腹肘静脉血液标本5 mL,4℃低温冷藏,12 h内4 ℃低温离心,3 000 r/min离心10 min,上清液-20 ℃冻存备用,检测TGF-β1细胞因子时室温下融化后2 h内测量。采用酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)双抗体夹心法。操作步骤严格按照说明书要求进行,ELISA试剂盒购自欣博盛生物科技有限公司。
1.4 RP判定标准 放疗结束后 1个月按照 WHO 统一评价标准评价近期疗效。放疗开始至结束后3个月内每周按美国肿瘤放射治疗协作组织(Radiation Therapy Oncology Group,RTOG)急性放射损伤分级标准评价急性RP。RP的分级标准:0级,无变化;Ⅰ级,轻度干咳或劳累时呼吸困难;Ⅱ级,持续咳嗽,需麻醉性止咳药,稍活动即呼吸困难,但休息时无呼吸困难;Ⅲ级,重度咳嗽,对麻醉性止咳药无效,或休息时呼吸困难,临床或影像有急性RP的证据,间断吸氧或可能需类固醇治疗;Ⅳ级,严重呼吸功能不全,持续吸氧或辅助通气治疗。
1.5 统计学方法 应用SPSS 17.0统计软件分析数据。TGF-β1 指标因非正态分布,治疗前后比较采用秩和检验;计数资料比较采用χ2检验;危险因素分析采用Logistic回归分析。P<0.05为差异有统计学意义。
2 结 果
2.1 治疗前后血清TGF-β1水平比较 全组病例放疗前血清TGF-β1水平为442.20~12 840.0 ng/L,中位数和四分位数间距位分别为677.5 ng/L和2 186.7 ng/L,放疗后TGF-β1水平为280.0~11 753.0 ng/L,中位数和四分位数间距位为605.0 ng/L和1 172.6 ng/L,放疗前后差异有统计学意义(Z=-4.617,P=0.000)。
2.2 RP发生率 RP总发生率为28.41%(75/264),其中1级23例,2级44例,3级8例,无4级发生。2级及以上RP发生率为19.70%(52/264),2级及以上RP为症状性RP,占69.3%(52/75)。
2.3 不同临床特征RP发生率和近期疗效 不同年龄、是否同期化疗、不同肿瘤分型、不同临床分期、不同病理类型、放疗前血清TGF-β1水平高低RP发生率差异均无统计学意义(P>0.05)。男性比女性RP发生率高,吸烟者较不吸烟者RP发生率高,PTV>450 cm3者较≤450 cm3者RP发生率高,放疗时间≤45 d者较>45 d者RP发生率高,放疗剂量<60 Gy者较≥60 Gy者RP发生率高,放疗后血清TGF-β1水平升高者较下降者RP发生率高,差异均有统计学意义(P<0.05)。
不同年龄、不同性别、是否吸烟、不同临床分期、不同病理类型、不同PTV、不同放疗时间及放疗后血清TGF-β1是否升高总有效率差异均无统计学意义(P>0.05)。同期化疗者较非同期化疗者总有效率高,放疗剂量≥60 Gy者较<60 Gy者总有效率高,放疗前血清TGF-β1≤677.5 ng/L者较>677.5 ng/L者总有效率高,差异有统计学意义(P<0.05)。见表1。

表1 不同临床特征RP发生率和近期疗效比较Table 1 Comparison of RP incidence and short-term efficacy with different clinical features (例数,%)

表1 (续)
2.4 Logistic回归分析 ①以RP(未发生=0,发生=1)发生为因变量,以性别(男性=0,女性=1)、吸烟(否=0,是=1)、放疗时间(≤45 d=0,>45 d=1)、PTV(≤450 cm3=0,>450 cm3=1)、放疗剂量(<60 Gy=0,≥60 Gy=1)、放疗后TGF-β1(下降=0,升高=1)为自变量进行Logistic多因素回归分析,结果显示吸烟者、PTV>450 cm3者及放疗后血清TGF-β1升高者RP发生率更高。②以近期疗效(无效=0,有效=1)为因变量,以同期化疗(否=0,是=1)、放疗剂量(<60 Gy=0,≥60 Gy=1)、肿瘤分型(周围型=0,中央型=1),放疗前血清TGF-β1水平(≤677.5 ng/L=0,>677.5 ng/L=1)为自变量进行Logistic多因素回归分析,结果显示同期化疗、放疗剂量≥60 Gy、中央型、放疗前血清TGF-β1水平≤677.5 ng/L者近期疗效更好。见表2,3。
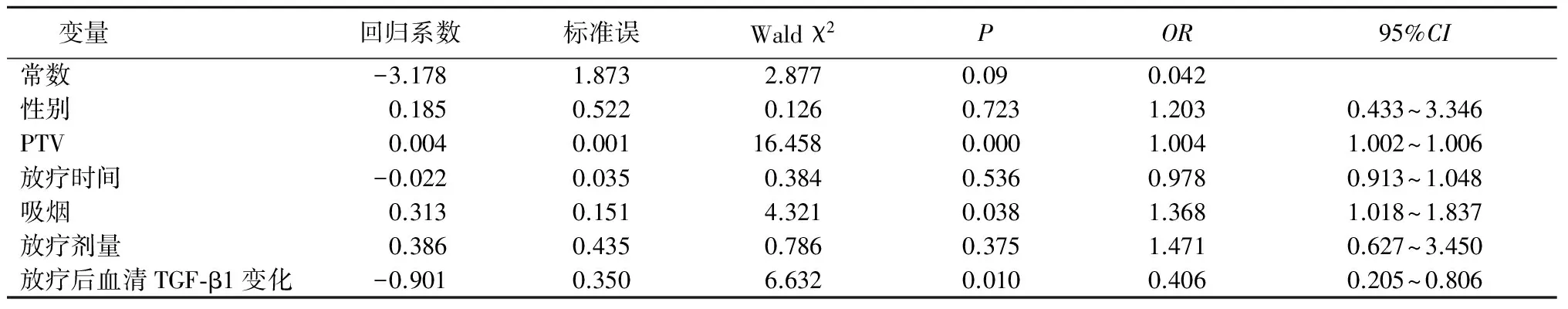
表2 RP发生相关因素Logistic回归分析Table 2 Logistic regression analysis of influencing factors related with RP
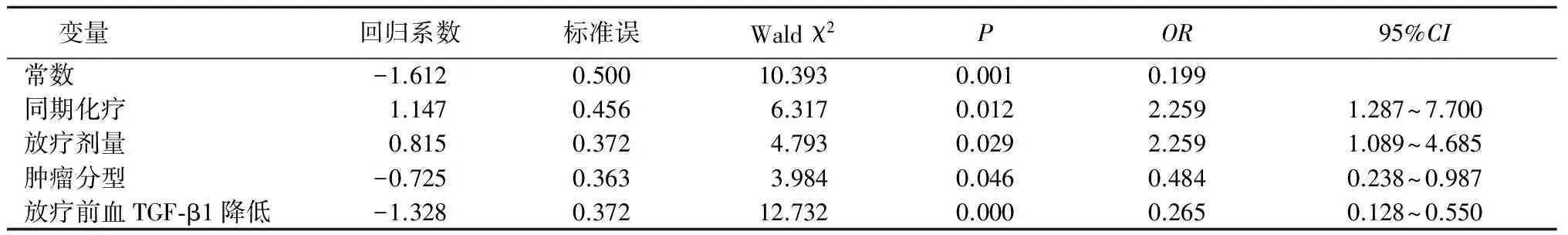
表3 近期疗效影响因素Logistic回归分析Table 3 Logistic regression analysis of influencing factors related with short-term efficacy
3 讨 论
TGF-β信号通路与肿瘤发生密切相关,并可通过增强侵袭性质、影响肿瘤微环境及抑制免疫功能等促进肿瘤转移发挥重要作用。Gao等[1]对105例肺癌患者标本进行免疫组化检测,52.38%伴有TGF-β阳性表达,显示TGF-β阳性表达是预后好的独立预后因素。Pajares等[2]研究同样显示肿瘤组织中高水平TGF-β1有更好的总生存和疾病无进展生存时间。然而多项研究表明肺癌患者血清TGF-β1水平显著高于良性疾病患者,且与TNM分期及有无远处转移密切相关[3-4]。Fu等[5]分析58例不能手术的晚期老年肺癌患者,治疗有效的患者放疗后血清TGF-β1水平是下降的,但是治疗无效的患者放疗前后血清TGF-β1无明显变化,认为TGF-β1可作为预测老年肺癌患者放疗敏感性的指标。另有报道对65例NSCLC患者同步吉西他滨+顺铂方案放化疗前后血清TGF-β进行检测,CR+PR患者治疗后血清TGF-β水平降低,相反SD+PD患者治疗后升高[6]。Xie等[7]研究手术切除NSCLC标本中TGF-β1的表达,考虑肺腺癌中TGF-β1表达阳性为生存期不良预后因素。Wang等[8]分析了口服厄洛替尼治疗的134局部晚期NSCLC患者,显示具有高水平TGF-β1的患者有更短的总生存时间。本研究结果显示,放疗前TGF-β1高水平者治疗总有效率为73.5%,低水平者治疗总有效率为 90.9%。表明放疗前TGF-β1高水平者近期疗效较差。Cao等[9]研究认为基于TGF-β1介导的肺癌上皮细胞向间质转化在手术切缘阴性NSCLC的预后更差,可作为NSCLC预后判断的潜在生物标志物。有望通过TGF-β1基因多态性作为NSCLC进展的遗传改性剂,改善NSCLC患者的预后[10]。本研究结果显示放疗前血清TGF-β1高水平的局部晚期NSCLC患者放疗后近期总有效率较差,至于其对长期生存的影响需要进一步随访统计。
TGF-β1不仅介导肿瘤细胞的浸润转移还与放疗后免疫介导的成纤维化机制有关。Sohn 等[11]通过照射小鼠肺后免疫组化显示TGF-β1表达上调与RP及放射性肺纤维化相关。Stenmark等[12]通过对58 例肺癌患者观察发现急性放射性肺损伤与治疗后TGF-β1升高弱相关。Liu等[13]分析接受三维适形放疗的局部晚期NSCLC患者,每2周测定一次TGF-β1 水平,发现放疗第2周开始逐渐升高,第6周时达到最高,TGF-β1可作为RP的预测因素。Li等[14]通过监测63例食管癌患者放疗前后血清TGF-β1、ACE及IL-1β水平,发现>60 Gy放疗剂量和血清TGF-β1水平升高与RP发生相关。笔者前期研究显示放疗后诱导痰中TGF-β1阳性表达者及血清TGF-β1水平升高者RP发生率有升高趋势,有可能成为RP的预测因子[15]。本研究分析了264例接受放疗局部晚期NSCLC患者放疗前后血清TGF-β1 水平,发现放疗结束后血清TGF-β1升高者RP发生率升高,且差异有统计学意义,再次提示放疗后血清TGF-β1的升高可作为RP发生的危险因素。Dadrich 等[16]试验表明PDGF和TGF-β信号通路小分子抑制剂在小鼠模型是一种安全有效的治疗RP和纤维化的方法,有望为人类肺纤维化疾病的治疗提供一种新的途径。
总之,血清TGF-β信号通路是一复杂信号通路,在肿瘤的发生发展及肺纤维化方面均发挥作用,可根据疗前血清TGF-β1水平高低及放疗前后水平变化制定个体化治疗方案,从而在不增加放射性肺损伤基础上提高局部控制率。
[1] Gao Y,Wang Y,Sun L,et al. Expression of TGF-β1 and EHD1 correlated with survival of non-small cell lung cancer[J]. Tumour Biol,2014,35(9):9371-9380.
[2] Pajares MJ,Agorreta J,Salvo E,et al. TGF-β1 expression is an independent predictor of survival in adjuvant-treated lung squamous cell carcinoma patients[J]. Br J Cancer,2014,110(6):1545-1551.
[3] Liu SG,Yuan SH,Wu HY,et al. The clinical research of serum VEGF,TGF-β1,and endostatin in non-small cell lung cancer[J]. Cell Biochem Biophys,2015,72(1):165-169.
[4] Huang AL,Liu SG,Qi WJ,et al. TGF-β1 protein expression in non-small cell lung cancers is correlated with prognosis[J]. Asian Pac J Cancer Prev,2014,15(19):8143-8147.
[5] Fu ZZ,Gu T,Fu BH,et al. Relationship of serum levels of VEGF and TGF-β1 with radiosensitivity of elderly patients with unresectable non-small cell lung cancer[J]. Tumour Biol,2014,35(5):4785-4789.
[6] Fu BH,Fu ZZ,Meng W,et al. Platelet VEGF and serum TGF-β1 levels predict chemotherapy response in non-small cell lung cancer patients[J]. Tumour Biol,2015,36(8):6477-6483.
[7] Xie M,He C,Wei S. Relationship between expression of TGF-β1,smad2,smad4 and prognosis of patients with resected non-small cell lung cancer[J]. Zhongguo Fei Ai Za Zhi,2015,18(9):543-548.
[8] Wang S,Han X,Hu X,et al. Clinical significance of pretreatment plasma biomarkers in advanced non-small cell lung cancer patients[J]. Clin Chim Acta,2014,430:63-70.
[9] Cao B,Feng L,Lu D,et al. Prognostic value of molecular events from negative surgical margin of non-small-cell lung cancer[J]. Oncotarget,2016[Epub ahead of print].
[10] 张柳琴,施敏骅.免疫靶向治疗在非小细胞肺癌中的研究进展[J].国际呼吸杂志, 201636(4):304-308.
[11] Sohn SH,Lee JM,Park S,et al. The inflammasome accelerates radiation-induced lung inflammation and fibrosis in mice[J]. Environ Toxicol Pharmacol,2015,39(2):917-926.
[12] Stenmark MH,Cai XW,Shedden K,et al. Combining physical and biologic parameters to predict radiation-induced lung toxicity in patients with non-small-cell lung cancer treated with definitive radiation therapy[J]. Int J Radiat Oncol Biol Phys,2012,84(2):e217-222.
[13] Liu Y,Xia T,Zhang W,et al. Variations of circulating endothelial progenitor cells and transforming growth factor-beta-1 (TGF-β1) during thoracic radiotherapy are predictive for radiation pneumonitis[J]. Radiat Oncol,2013,8:189.
[14] Li J,Mu S,Mu L,et al,Transforming growth factor-beta-1 is a serum biomarker of radiation-induced pneumonitis in esophageal cancer patients treated with thoracic radiotherapy:preliminary results of a prospective study[J]. Onco Targets Ther,2015,8:1129-1136.
[15] Wang J,Qiao XY,Lu FH,et al. TGF-beta1 in serum and induced sputum for predicting radiation pneumonitis in patients with non-small cell lung cancer after radiotherapy[J]. Chin J Cancer,2010,29(3):325-329.
[16] Dadrich M,Nicolay NH,Flechsig P,et al. Combined inhibition of TGF-β1 and PDGF signaling attenuates radiation-induced pulmonary fibrosis[J]. Oncoimmunology,2015,5(5):e1123366.
(本文编辑:许卓文)
Clinical study of serum TGF-β1 in non-small cell lung cancer before and after radiotherapy
WANG Jing, JIA Jing-hao, YANG Hai-fang, WANG Zhi-wu*
(DepartmentofChemo-Radiotherapy,TangshanPeople′sHospital,HebeiProvince,Tangshan063001,China)
Objective To assess the value of serum transforming growth factor-β1(TGF-β1) in predicting the radioactive pneumonia(RP) and the short-term effect, and to provide a reference for radiotherapy(RT) of non-small cell lung cancer(NSCLC). Methods An analysis was performed on the medical records of 264 cases with NSCLC. The pathology was confirmed via histology or cytology, using three dimensional conformal radiation therapy. The serum TGF-β1 level was detected before and after RT for all the patients. The TGF-β1 level in serum was detected with enzyme-linked immunosorbent assay. Short-term effect was evaluated according to the WHO unified evaluation criterion after a month of radiotherapy and RP was diagnosed by Radiation Therapy Oncology Group(RTOG) grading standard of acute radiation injury. SPSS 17.0 statistical software was used for statistics. Results The level of serum TGF-β1 pre-radiotherapy was 442.20-12 840.00 ng/L, the median and the quartile values were 677.5 ng/L and 2 186.7 ng/L. The levels of TGF-β1 post-radiotherapy were 280.0-11 753.0 ng/L, median and quartile values were 605.0 ng/L and 1 172.6 ng/L, respectively(Z=-4.617,P=0.000). There were higher incidence of RP in male than female patients, smokers than non-smokers, PTV>450 cm3than≤450 cm3, radiotherapy period≤45 d than>45 d(P<0.05), in patients with radiotherapy dose<60 Gy, and with increased levels of TGF-β1 after radiotherapy(P<0.05). Patients with concurrent chemo-radiotherapy, radiotherapy dose higher than 60 Gy, serum TGF-β1<677.5 ng/L pre-radiotherapy preferred to have better response rate(P<0.05). Multivariate analysis showed that smoking, PTV>450 cm3, increased serum levels of TGF-β1 after chemotherapy were RP risk factors(P<0.05). Patients with concurrent chemotherapy, radiotherapy dose≥60 Gy, central lung cancer, serum TGF-β1 levels≤677.5 ng/L pre-radiotherapy had better efficacy(P<0.05). Conclusion Lower level of TGF-β1 before radiotherapy predicted a better prognosis. Patients with increased serum TGF-β1 levels after radiotherapy had more RP risks. Serum TGF-β1 levels could be considered as a predictor of NSCLC prognosis.
carcinoma, non-small-cell lung; radiation pneumonia; transforming growth factor beta1
2016-12-30;
2017-05-18
国家自然科学基金资助项目(81603475)
王静(1982-),女,河北安国人,河北省唐山市人民医院主治医师,医学硕士,从事恶性肿瘤放化疗研究。
*通讯作者。E-mail:zhiwuwangtcm2000@163.com
R730.26
A
1007-3205(2017)06-0654-05
10.3969/j.issn.1007-3205.2017.06.009

