颈动脉内膜剥脱术前他汀应用对患者转归影响的观察性研究
刘慧慧,黄亚波,张艳林,尤寿江,曹勇军,刘春风
·论著·
颈动脉内膜剥脱术前他汀应用对患者转归影响的观察性研究
刘慧慧,黄亚波,张艳林,尤寿江,曹勇军,刘春风
目的 观察颈动脉内膜剥脱术(CEA)前长期应用他汀和围手术期应用他汀对颈动脉狭窄患者转归的影响。方法 收集行CEA治疗患者(31例)的临床资料,其中长期他汀组15例,围手术期他汀组16例。对比两组之间血管再狭窄、死亡、卒中再发的情况。结果 两组患者基线资料无差异,但入院时长期他汀组患者低密度脂蛋白胆固醇水平低于围手术期他汀组患者(P<0.05)。两组患者术前症状及狭窄程度均无明显统计学差异。两组患者术后随访期间未有卒中再发。围手术期他汀组死亡1例,再狭窄1例;长期他汀组无死亡和再狭窄发生,两组患者再狭窄率和总死亡率无统计学差异。结论 CEA患者术后转归在围手术期他汀组和长期他汀组无明显区别,提示了围手期他汀应用的重要性。
他汀;颈动脉内膜剥脱术;转归
脑卒中是我国国民的首位死亡原因[1],颈动脉粥样硬化性病变伴狭窄是缺血性卒中的最常见病因之一,并具有高发病率、高死亡率、高致残率及高复发率的特点,也是成年人致残的主要病因[2]。自从1953年Debakey首次成功进行了颈动脉内膜剥脱术(CEA)以来,该手术逐渐成为治疗颈动脉粥样硬化性狭窄的金标准。NASCET[3]、ECST[4]、ACAS[5]、ACST[6]等数个国际大型随机前瞻性临床研究均表明,对于血管中重度狭窄的患者,手术能明显降低缺血性脑卒中的发生率,并被列入指南。术前使用他汀则可以明显降低围手术期卒中、心肌梗死、死亡的风险[7-9],术后长期使用他汀则可以降低死亡率,血管再狭窄等风险[10-11]。本研究回顾性分析了2014年1月~2015年9月在苏州大学附属第一医院行CEA的患者,比较术前应用他汀至少3个月以上与仅围手术期应用他汀(﹤7 d)两组之间基线资料和狭窄程度等临床特征,观察两组之间血管再狭窄、死亡、卒中再发等转归的情况。
1 对象与方法
1.1 对象 系2014年1月~2015年9月在苏州大学附属第一医院收治的颈动脉粥样硬化性狭窄行CEA的患者31例,男28例,女3例,平均年龄(70.00±7.86)岁。纳入标准:(1)年龄﹥18岁;(2)患者存在病变血管同侧脑缺血性事件,如黑朦、视物模糊、TIA、缺血性脑卒中(偏瘫、偏身麻木、失语)等,且NIHSS评分≤4分,或无症状的颈动脉狭窄,伴有头晕等非特异性症状,或在体检时发现一侧或双侧颅外颈动脉狭窄;(3)术前影像学检查证实有症状患者同侧颈动脉直径狭窄率>50%,无症状颈动脉狭窄患者一侧或双侧颈动脉狭窄﹥70%;(4)出院后能够经门诊随访或电话回访取得随访资料。CEA手术排除标准:(1)患侧颈动脉完全闭塞;(2)合并严重手术禁忌症;(3)无法经门诊或电话取得随访资料的患者。
1.2 方法
1.2.1 资料收集 收集患者入院时提供的基本信息,包括患者性别、年龄、基础疾病、既往史、吸烟、饮酒史等。具体包括:(1)高血压:既往或入院后发现收缩压≥140 mmHg(1 mmHg=0.0133 kPa)和/或舒张压≥90 mmHg;(2)糖尿病:既往存在糖尿病史、饮食或药物控制的,或入院后发现空腹血糖或随机血糖偏高,符合糖尿病诊断;(3)血脂情况:入院时空腹12 h后,翌日清晨抽取静脉血检测,包括低密度脂蛋白胆固醇(LDL-C)、总胆固醇(CHO)、高密度脂蛋白胆固醇(HDL-C)、三酰甘油(TG);(4)血尿酸水平:男性和绝经后女性>420 μmol/L或>绝经前女性350 μmol/L为升高;(5)超敏C反应蛋白(hs-CRP);(6)脑卒中史;(7)抽烟史:包括未戒烟和已戒烟的患者,戒烟定义为戒烟时间至少半年以上;(8)饮酒史:指有长期饮酒史超过5年,或2周内有大量饮酒。
1.2.2 颈动脉超声检测 颈动脉超声检查采用PHILIPS CX50型超声仪,检查步骤依据中国医师协会制定的血管超声检查指南[12]。狭窄程度根据2003年北美放射年会超声会议及相关专业委员会发布的标准[13]。
1.2.3 颈部CTA 检查 检查采用双源CT(Somatom Definition,Siemens公司,德国),图像包括主动脉弓到C1椎体水平;经肘前静脉以5 ml/s流速注入80 ml非离子造影剂碘普罗胺(优维显,拜耳);扫描参数:准直64 mm×0.6 mm,螺距1.2,管电压120 kV,管电流200 mA,层厚0.75 mm。进行矢状位及冠状位最大密度投影重建。动脉狭窄:应用NASCET法,公式:狭窄率=(狭窄远端正常直径-狭窄段直径)/狭窄远端正常直径×100%。
1.2.4 随访 所有患者均在2016年3月经电话随访,询问术后存活、恢复情况、术后是否再发脑梗死及血管再狭窄、术后他汀和抗血小板药使用情况。
1.2.5 统计学方法 运用SPSS 17.0软件进行统计学分析。两组间正态分布的计量资料均数比较采用两独立样本t检验,非正态分布的计量资料采用Wilcoxon秩和检验,计数资料采用χ2检验进行比较,用Kaplan-Meier方法绘制生存曲线,检测两组间在随访期间内终点事件的发生有无区别。P﹤0.05为差异具有统计学意义。
2 结 果
2.1 两组间基线资料比较 见表1。本研究中CEA患者31例,根据术前应用他汀至少3个月以上与仅围手术期应用他汀(﹤7 d)分为长期他汀组15例,围手术期他汀组16例。两组患者在年龄、性别、基础疾病(包括高血压、糖尿病)、吸烟、饮酒、hs-CRP、胆固醇、血尿酸等方面比较均没有统计学差异;但是长期他汀组患者LDL-C水平明显低于围手术期他汀组患者(P<0.05)。
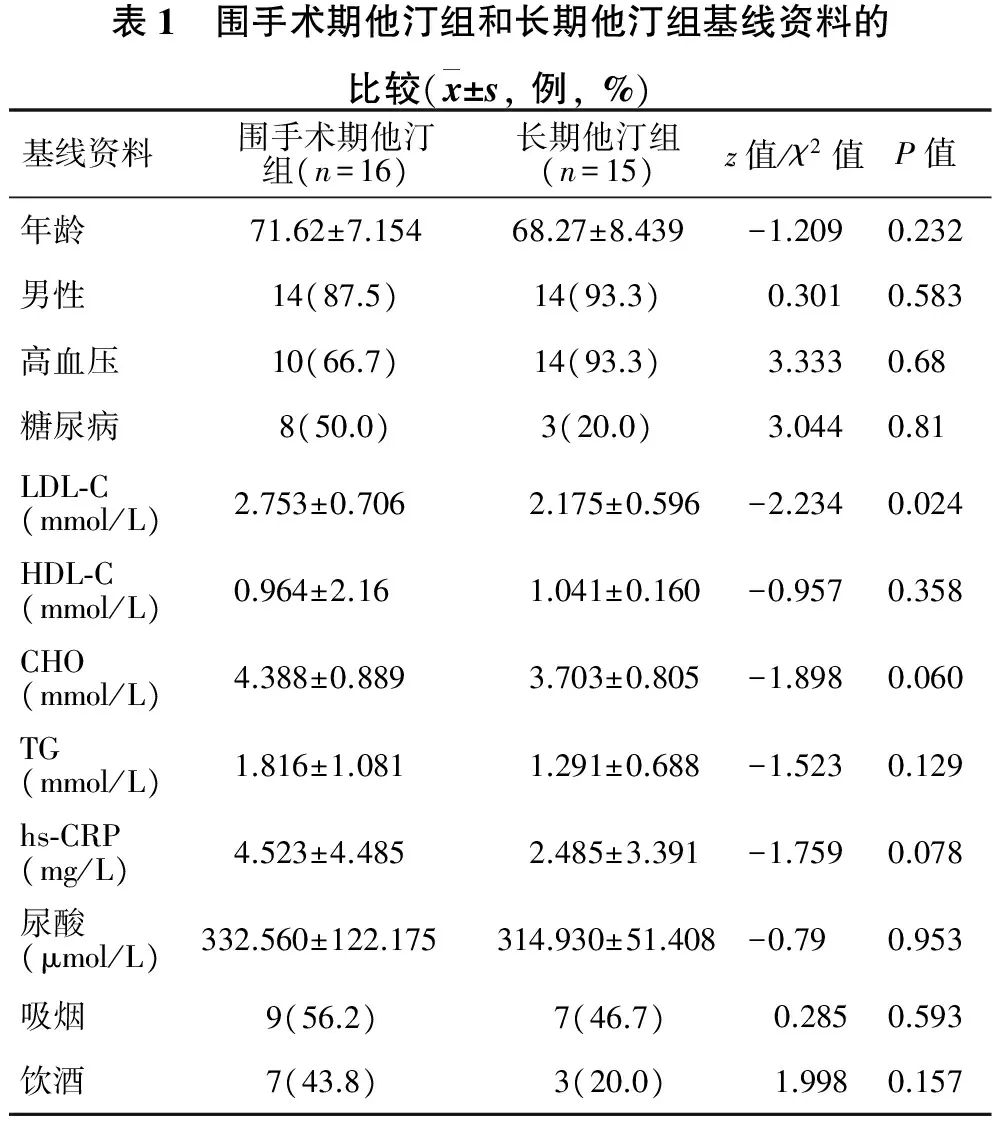
表1 围手术期他汀组和长期他汀组基线资料的比较(x±s,例,%)基线资料围手术期他汀组(n=16)长期他汀组(n=15)z值/χ2值P值年龄71.62±7.15468.27±8.439-1.2090.232男性14(87.5)14(93.3)0.3010.583高血压10(66.7)14(93.3)3.3330.68糖尿病8(50.0)3(20.0)3.0440.81LDL⁃C(mmol/L)2.753±0.706 2.175±0.596-2.2340.024HDL⁃C(mmol/L)0.964±2.161.041±0.160-0.9570.358CHO(mmol/L)4.388±0.8893.703±0.805-1.8980.060TG(mmol/L)1.816±1.0811.291±0.688-1.5230.129hs⁃CRP(mg/L)4.523±4.4852.485±3.391-1.7590.078尿酸(μmol/L)332.560±122.175314.930±51.408-0.790.953吸烟9(56.2) 7(46.7) 0.2850.593饮酒7(43.8)3(20.0)1.9980.157
2.2 两组患者临床症状及术前血管狭窄情况 见表2。15例长期他汀组的患者中,因缺血性脑卒中或(各种程度的偏瘫、偏身麻木、面瘫、失语等)TIA表现入院的患者有10例(66.7%),无症状的患者5例(33.3%);围手术期他汀组患者有症状的为13例(81.2%),无症状患者3例(19.8%)。术前CTA或颈动脉超声检查发现,长期他汀组右侧颈动脉血管中重度狭窄9例(69.2%),左侧颈动脉血管中重度狭窄6例(30.8%),未见有双侧血管中重度以上狭窄;围手术期他汀组有双侧颈动脉血管中重度狭窄3例(20.0%),右侧颈动脉中重度狭窄5例(33.3%),左侧颈动脉中重度狭窄7例(46.7%);两组在症状分布、血管狭窄部位及狭窄程度方面均无统计学差异。

表2 围手术期他汀组和长期他汀组临床症状和术前血管狭窄情况的比较(x±s,例,%)项目围手术期他汀组(n=16)长期他汀组(n=15)z值/χ2值P值有症状患者13(81.2)10(66.7)0.860.354狭窄程度0.836±0.1190.856±0.109-0.5370.599狭窄部位4.8430.089 左7(46.7)4(30.8) 右5(33.3)9(69.2) 双侧3(35.7)0(0.0)
2.3 随访结果的比较 见表3。围手术期他汀组共16例患者,失访2例,长期他汀组共15例患者,失访0例,随访时间5~26个月(围手术期他汀组中位数是18个月,长期他汀组中位数是8个月)。其中1例围手术期他汀患者1年半后因消化道肿瘤死亡,另1例患者因术后再狭窄再次入院行CEA手术。两组患者均未有卒中再发。长期他汀组出院后2例患者自行停用抗血小板和他汀药物(非因药物不良反应),围手术期他汀组未有患者停药。两组患者再狭窄率和总死亡率差异无统计学意义。考虑两组间随访时间波动较大,采用Kaplan-Meier方法绘制生存曲线(图1),结果发现两组间在转归上仍没有差别(P=0.251),但两组间的转归有分离趋势。

表3 两组患者转归比较(x±s,例,%)项目围手术期他汀组(n=14)长期他汀组(n=15)z值/χ2值P值随访时间(个月)16.375±7.72812.467±8.070-1.1730.241总死亡率1(6.7)0(0.0)0.9691.000再狭窄率1(6.7)0(0.0)0.9691.000
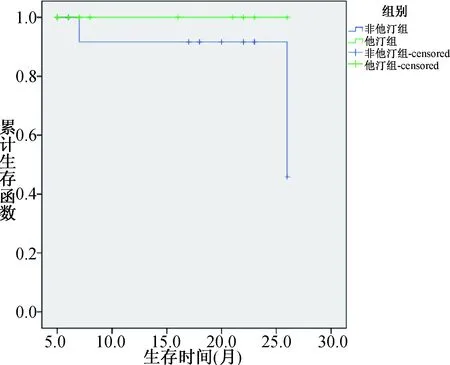
图1 两组间预后的Kaplan-Meier生存曲线分析
3 讨 论
自上世纪末,随着一系列关于CEA大型前瞻性多中心研究结果的公布,CEA已成为当前治疗颈动脉狭窄的金标准。与单纯内科药物治疗相比,CEA可以明显降低同侧卒中发生率和死亡率[3-4,9]。无论有症状的颈动脉狭窄或无症状颈动脉狭窄患者,均能从CEA手术获益。对于有症状颈动脉狭窄患者,近年的临床指南更倾向于早期行CEA 手术治疗[14]。
而当前,随着他汀在缺血性卒中治疗的研究发现,卒中前应用他汀可以改善患者早期转归,包括神经功能恶化,死亡率和致残率[15-16]。最近的Meta分析[17]显示,他汀的早期应用可以减少死亡风险,提高3个月的功能良好转归。同样,在CEA术前使用他汀也可以明显改善术后结局,无论在有症状[8]还是无症状的CEA[18]患者。对于颈动脉狭窄支架植入术的患者,术前应用他汀可以显著改善围手术期和术后功能转归[19-20]。因此,血管重建手术前应用他汀有助于改善患者预后,尽管当前指南并没有强调术前他汀的应用。但是对于他汀应用时间长短和剂量目前尚缺少相关研究资料。
本研究回顾性分析了术前长期应用他汀和仅围手术期应用他汀患者的一般临床资料,包括性别、年龄、血管危险因素(高血压、糖尿病等)、血脂水平、hs-CRP等,发现两组患者在性别、年龄、血管危险因素方面无差别,就诊患者均是男性占绝大多数。但是入院时的血脂水平,特别是LDL-C在长期他汀组明显低于围手术期他汀组。他汀不仅可以降低血脂,主要为LDL-C,同时具有抗炎、稳定斑块的作用[21]。血尿酸被认为是心脑血管疾病的重要危险因素。近来研究[22-23]发现,高水平的血尿酸与急性冠脉综合征患者斑块脂质体积有关,侧面反应了血尿酸与斑块的易损性有关,而两组之间尿酸水平无统计学差异(P= 0.953),排除了尿酸对患者临床事件的影响。
在两组患者症状方面,均以有症状的颈动脉狭窄为主,这其中包括了既往和本次新发卒中。管腔狭窄方面两组之间也没有差别,但是可以看出两组之间的管腔狭窄均以重度以上狭窄为主。两组之间狭窄部位无明显差异,但围手术期他汀有3例伴有双侧颈动脉中重度以上狭窄,可能会增加卒中风险,而长期他汀组没有。
在随访时间和预后方面,长达5~26个月的时间跨度,围手术期他汀组(中位数是18个月)和长期他汀组(中位数是8个月)平均随访时间统计学上无差异,但相对而言围手术期组随访时间长于长期他汀组。围手术期他汀组有2例患者失访,1例死亡(6.7%),1例再狭窄(6.7%);长期他汀组没有患者失访,无死亡和再狭窄,围手术期他汀组不良预后发生高于长期他汀组,但差异无统计学意义。考虑到随访时间和发生终点事件时间的长短不一(以及censored数据),进一步应用kaplan-Meier方法进行分析,结果发现两组间的预后仍没有差别,但是两组间有分开趋势,增加样本量或延长随访时间可能会有阳性结果。另外,两组之间均未有卒中再发,尽管长期他汀组有2例患者在随访期间自行停用抗血小板和他汀药物。
本研究显示,围手术期应用他汀对患者长期转归,包括死亡、卒中复发和血管再狭窄与术前长期应用他汀并无明显区别,提示了围手期他汀应用的重要性。另一方面,由于入组样本量偏小,对于有症状和无症状患者是否该作用一致尚不清楚。并且,从生存曲线的趋势可见长期他汀组仍优于围手术期他汀组,提示了他汀的保护作用呈时间依赖性。因此,对于发现颈动脉中重度以上狭窄的患者,在充分评估手术风险、时机的同时,应尽早启动他汀的应用。未来需要前瞻性大样本研究,评估术前他汀应用的时间和剂量对转归的影响。
[1]Wang W, Jiang B, Sun H, et al. Prevalence, incidence, and mortality of stroke in China: results from a nationwide population-based survey of 480 687 adults[J]. Circulation, 2017, 135: 759.
[2]Wang YJ, Zhang SM, Zhang L, et al. Chinese guidelines for the secondary prevention of ischemic stroke and transient ischemic attack 2010[J]. CNS Neurosci Ther, 2012, 18: 93.
[3]North AC. Beneficial effect of carotid endarterectomy in symptomatic patients with high-grade carotid stenosis[J]. N Engl J Med, 1991,325: 445.
[4]MRC European Carotid Surgery Trial:interim results for symptomatic patients with severe. (70%-99%)or with mild(0%-29%)carotid stenosis.European Carotid Surgery Trialists'Collaborative Group[J]. Lancet, 1991,337: 1235.
[5]Endarterectomy for asymptomatic carotid artery stenosis. Executive committee for the asymptomatic carotid atherosclerosis study[J]. JAMA, 1995,273: 1421.
[6]Halliday A, Mansfield A, Marro J, et al. Prevention of disabling and fatal strokes by successful carotid endarterectomy in patients without recent neurological symptoms: randomised controlled trial[J]. Lancet, 2004, 363: 1491.
[7]Mcgirt MJ, Perler BA, Brooke BS, et al. 3-hydroxy-3-methylglutaryl coenzyme A reductase inhibitors reduce the risk of perioperative stroke and mortality after carotid endarterectomy[J]. J Vasc Surg, 2005, 42: 829.
[8]Kennedy J, Quan H, Buchan AM, et al. Statins are associated with better outcomes after carotid endarterectomy in symptomatic patients[J]. Stroke, 2005, 36: 2072.
[9]Brooke BS, Mcgirt MJ, Woodworth GF, et al. Preoperative statin and diuretic use influence the presentation of patients undergoing carotid endarterectomy: results of a large single-institution case-control study[J]. J Vasc Surg, 2007, 45: 298.
[10]Aburahma AF, Srivastava M, Stone PA, et al. Effect of statins on early and late clinical outcomes of carotid endarterectomy and the rate of post-carotid endarterectomy restenosis[J]. J Am Coll Surg, 2015, 220: 481.
[11]de Martino RR, Eldrup-Jorgensen J, Nolan BW, et al. Perioperative management with antiplatelet and statin medication is associated with reduced mortality following vascular surgery[J]. J Vasc Surg, 2014, 59: 1615.
[12]Galarza-Delgado DA, Azpiri-Lopez JR, Colunga-Pedraza IJ, et al. Comparison of statin eligibility according to the adult treatment panel Ⅲ, ACC/AHA blood cholesterol guideline, and presence of carotid plaque by ultrasound in Mexican mestizo patients with rheumatoid arthritis[J]. Clin Rheumatol, 2016, 35: 2823.
[13]中国医师协会超声医师分会.血管超声检查指南[J].中华超声影像学杂志,2009,18:993.
[14]Sacco RL, Adams R, Albers G, et al. Guidelines for prevention of stroke in patients with ischemic stroke or transient ischemic attack:a statement for healthcare professionals from the American heart association/American stroke association council on stroke:co-sponsored by the council on cardiovascular radiology and intervention:the American academy of neurology affirms the value of this guideline[J]. Circulation, 2006,14: 113.
[15]Flint AC, Kamel H, Navi BB, et al. Inpatient statin use predicts improved ischemic stroke discharge disposition[J]. Neurology, 2012, 78: 1678.
[16]Flint AC, Kamel H, Navi BB, et al. Statin use during ischemic stroke hospitalization is strongly associated with improved poststroke survival[J]. Stroke, 2012, 43: 147.
[17]Chroinin DN, Asplund K, Asberg SA, et al. Statin therapy and outcome after ischemic stroke systematic review and Meta-Analysis of observational studies and randomized trials[J]. Stroke, 2013, 44: 448.
[18]Heyer EJ, Mergeche JL, Bruce SS, et al. Statins reduce neurologic injury in asymptomatic carotid endarterectomy patients[J]. Stroke, 2013, 44: 1150.
[19]Takayama K, Taki W, Toma N, et al. Effect of pitavastatin on preventing ischemic complications with carotid artery stenting: a multicenter prospective Study-EPOCH-CAS study[J]. Cardiovasc Intervent Radiol, 2014, 37: 1436.
[20]Reiff T, Amiri H, Rohde S, et al. Statins reduce peri-procedural complications in carotid stenting[J]. Eur J Vasc Endovasc Surg, 2014, 48: 626.
[21]Koskinas KC, Zaugg S, Yamaji K, et al. Changes of coronary plaque composition correlate with C-reactive protein levels in patients with ST-elevation myocardial infarction following high-intensity statin therapy[J]. Atherosclerosis. 2016,247:154.
[22]Saito Y, Nakayama T, Sugimoto K, et al. Relation of lipid content of coronary plaque to level of serum uric acid[J]. Am J Cardiol, 2015, 116, 1346.
[23]Ando K, Takahashi H, Watanabe T, et al. Impact of serum uric acid levels on coronary plaque stability evaluated using integrated backscatter intravascular ultrasound in patients with coronary artery disease[J]. J Atheroscler Thromb, 2016, 23: 932.
Effect on the outcomes with statins pre-treatment before carotid endarterectomy in patients with atherosclerotic carotid stenosis
LIUHui-hui,HUANGYa-bo,ZHANGYan-lin,etal.
DepartementofNeurology,theSecondAffiliatedHospitalofSoochowUniversity,Suzhou215004,China
Objective To oberve the effect on outcomes of patients with atherosclerotic carotid stenosis with long-term statins pre-treatment (LST) or peri-procedure statins (PST) treatment before carotid endarterectomy (CEA). Methods The clinical data about 31 patients with carotid stenosis who
CEA were collected, of which 15 cases in LST group, another 16 cases in PST group. The clinical data of these two groups were observed as the status of restenosis, death and stroke reoccurrence were compared parallelly. Results Both groups did not differ each other in baseline data, while the level low density lipoprotein cholesterin in LST was lower significantly than that in PST group (P<0.05). No statistical difference was found between two groups in preoperative symptoms and degree of stenosis. Both groups had no stroke reoccurrence. In PST group, there were one death case and one restenosis case, while there was none of death and restenosis in LST group. Therefore, there was no statistic difference in the restenosis and death between two groups.Conclusion There is no remarked difference on the outcome for CEA patients between PST group and LST group, which suggested that peri-procedural statin treatment is of significance for CEA patients.
statin;carotid endarterectomy;outcome
国家自然科学青年基金(81200894); 国家自然科学基金面上项目(81471195); 江苏省自然科学基金(BK20122172)
215004苏州大学附属第二医院神经内科(刘慧慧,张艳林,尤寿江,曹勇军,刘春风); 苏州大学附属第一医院神经外科(黄亚波)
刘春风
R743
A
1004-1648(2017)03-0175-04
2016-12-12
2017-01-13)

