布伦口湖群湿地产蛋白酶耐低温菌株的筛选及初步鉴定
王继莲,李明源,任 羽
(喀什大学生命与地理科学学院,叶尔羌绿洲生态与生物资源研究高校重点实验室,新疆 喀什 844006)
布伦口湖群湿地产蛋白酶耐低温菌株的筛选及初步鉴定
王继莲,李明源,任 羽
(喀什大学生命与地理科学学院,叶尔羌绿洲生态与生物资源研究高校重点实验室,新疆 喀什 844006)
【目的】从新疆东帕米尔高原布伦口湖群湿地分离产蛋白酶耐低温细菌,对其进行初步分类鉴定,为后续低温酶制剂的研究应用奠定理论基础。【方法】利用脱脂乳选择培养基筛选产低温蛋白酶菌株,并对其表型特征、生长特性及产酶性状等进行研究,结合16S rRNA 基因序列确定布伦口湖群湿地产低温蛋白酶功能菌株的遗传多样性及分类地位。【结果】共筛选出6株产蛋白酶菌株,其在15 ℃条件下均能生长繁殖,属耐冷菌,但耐盐性一般,能在低温条件下发酵产酶,生长稳定期达到产酶高峰。16S rRNA 基因序列初步确定4株为假单胞菌(Pseudomonassp.),另外2株分别为芽孢杆菌(Bacillussp. ) 和节杆菌(Arthrobactersp.)。【结论】本研究筛选到的同属近缘种群较多,但生理特征各异,这进一步拓展了低温酶菌种资源库,为深入探究低温蛋白酶结构特性及在生物工程领域的应用潜力奠定坚实基础。
布伦口湖群湿地;低温蛋白酶;耐冷菌;16S rRNA
【研究意义】低温蛋白酶主要由生活在低温生境中的微生物产生[1-2],其在低温(0~20 ℃)下仍能有效催化蛋白质肽键水解,最适催化温度一般不超过40 ℃,远低于同功能常温酶(50 ℃),但高温下(>60 ℃)易失活[3-4]。这一特性使其在食品医药、日用化工、环境污染物治理等对冷要求较高的行业有重要应用潜力和开发价值[5-6],有着中高温酶无可比拟的优越性。如在糕点烘烤过程中,低温蛋白酶能有效降低生面团发酵时间,提升面包心质量,改善面包香味及湿度,且经高温短时处理即失活,阻止酶作用过度,不至使面包变得太软或太粘。随着世界各国逐步加强对低温酶制剂产业的科研开发支持力度,从极端低温环境中开发产酶功能微生物资源成为研究热点。【前人研究进展】自20世纪70 年代以来,人们相继自深海、极地、冰川雪冰、常年冻土等常年酷寒生境中筛选低温蛋白酶高产菌株[7-9],并从中挖掘到一些优质高效、具有新特性的产酶新菌种,但对湿地这一富有生物多样性的自然生态系统的研究却鲜有报道。湿地是水域和陆地生态系统之间的过渡综合体,具有独特的生态系统服务价值和资源潜力,与森林、海洋一起并称为全球三大生态系统[10-11]。湿地同时还是天然的微生物基因库,为研究不同历史时期自然环境演变对微生物时空格局影响以及丰富物种多样性提供了极好框架。【本研究切入点】布伦口湖群湿地位于新疆喀什西南部,属塔里木河水系(平均海拔3300 m,38°25′~39°00′N,74°40′~75°00′E),由发源于西昆仑山及帕米尔高原的许多河流及山泉供水形成的微咸水湖泊和沼泽、滩地组成,面积20 km2[12]。作为我国最西部的高原湖泊群湿地,布伦口湖群湿地冬季受西伯利亚高压影响强烈,寒冷漫长,平均气温-4.8 ℃,是低温微生物的生存栖息地,也是分泌新型活性先导化合物,如酶、色素、多糖、抗冻蛋白等菌株的潜在种源地。【拟解决的关键问题】本文自布伦口湖群湿地分离高产低温蛋白酶细菌菌株,了解其生理特征并揭示菌株的系统发育关系,为深入探究极端酶的结构特性及在生物工程领域的研发奠定基础。
1 材料与方法
1.1 材料试剂
1.1.1 主要试剂设备 细菌基因组DNA提取及胶回收试剂盒:北京康为世纪生物公司;PCR 扩增全套试剂及扩增引物:TaKaRa(大连)公司;相关生理生化试剂:天津市致远化学试剂厂和天津登科化学试剂厂。
高速冷冻离心机5430R、PCR仪 Mastercycler pro S:德国 Eppendorf公司;DYY-6C电泳仪:北京六一仪器厂;JY04S-3C凝胶成像系统:北京君意东方电泳设备有限公司。
1.1.2 培养基 蛋白酶筛选培养基:脱脂乳粉20 g/L、酵母提取物10 g/L、蛋白胨20 g/L、琼脂20 g/L,pH值7.2。种子培养基:胰蛋白胨10 g/L、酵母提取物5 g/L、葡萄糖10 g/L、氯化钠10 g/L,pH值7.2。发酵培养基:胰蛋白胨20 g /L、酵母提取物10 g/L、葡萄糖5 g/L、KH2PO42 g/L、MgSO4·7H2O 1g/L,KCl 0.5 g/L,pH值7.2。
1.3 试验方法
1.3.1 样品采集 采集布伦口湖群湿地不同积水状态样品,采集时环境温度4 ℃。所得样品混合置于含冰袋的保鲜盒内,12 h内运回实验室处理备用。在超净工作台将样品与蒸馏水按照1∶5比例混匀,置于摇床震荡15 min,静置20 min备用。
1.3.2 产酶菌株筛选 将样品悬液适度稀释,用移液枪吸取100 μl均匀涂布到蛋白酶筛选培养基上,15 ℃低温倒置培养1~2 d,观察平板上蛋白水解圈形成情况,并测量水解圈直径D(mm)和菌落直径d(mm)。选取D/d值较大菌株在选择平板上不断划线纯化,直至获得纯培养物,即为初筛到的产蛋白酶低温菌株。将其保存到一定浓度的灭菌甘油保藏管中,-80 ℃冻存。
用接种针挑取一环纯培养菌株至5 mL种子培养基试管中,经15 ℃,180 r /min摇床振荡培养18 h即得种子液。按照3 %接种量将种子液接入150 mL发酵培养基,相同条件培养48 h。发酵液经12 000 r/min高速离心5 min,弃下层菌体沉淀,所得上清即为蛋白酶粗酶液。
1.3.3 低温蛋白酶活力测定 采用Folin-酚显色法测定粗酶活力[13]。酶活力单位定义: 在15 ℃和pH 7.0条件下,样品每分钟水解底物酪蛋白降解释放出1 μg酪氨酸所需酶量为1个酶活单位(U)。
1.3.4 理化因素对菌株生长及产酶特性影响 ①最适生长温度及耐盐性测定。将培养好的菌悬液按3 %接种量接入5 mL种子培养基试管中,分别于不同温度梯度(10、15、18、25、30、37 ℃)下200 r/min振荡培养24 h,测定不同温度下各菌株OD420nm值,确定其最适宜生长温度。将各菌种分别接入不同NaCl含量 (1 %、4 %、6 %、8 %、10 %、12 %、14 %、16 % )的发酵培养基中,最适生长温度下培养48 h后测OD420nm值。②菌株的生长曲线及其产酶特性。将产酶菌株种子液按3 %接入量接入装有150 mL发酵培养基中,在各自最适生长温度下180 r/min摇床振荡培养,每隔12 h测定培养基中各菌株OD420nm光密度值及蛋白酶活力,确定菌株生长情况及产酶状况,并绘制生长和产酶曲线。
1.3.5 产蛋白酶菌株的16S rRNA 基因序列与系统发育分析 用试剂盒提取产酶菌株的基因组DNA,以细菌通用引物27f(5′-AGAGTTTGATCCTGGCTCAG-3′),1492r(5′-GGTTACCTTGTTACGACTT-3′) 进行PCR 扩增。目的产物经上海生工的胶回收试剂盒纯化完成测序。测序返回结果利用BLAST工具从GenBank 数据库中进行序列同源性搜索,选取基因库中相似度较高的16S rRNA基因序列,通过MEGA 6.0软件分析产酶菌株遗传关系并生成系统发育树状图。
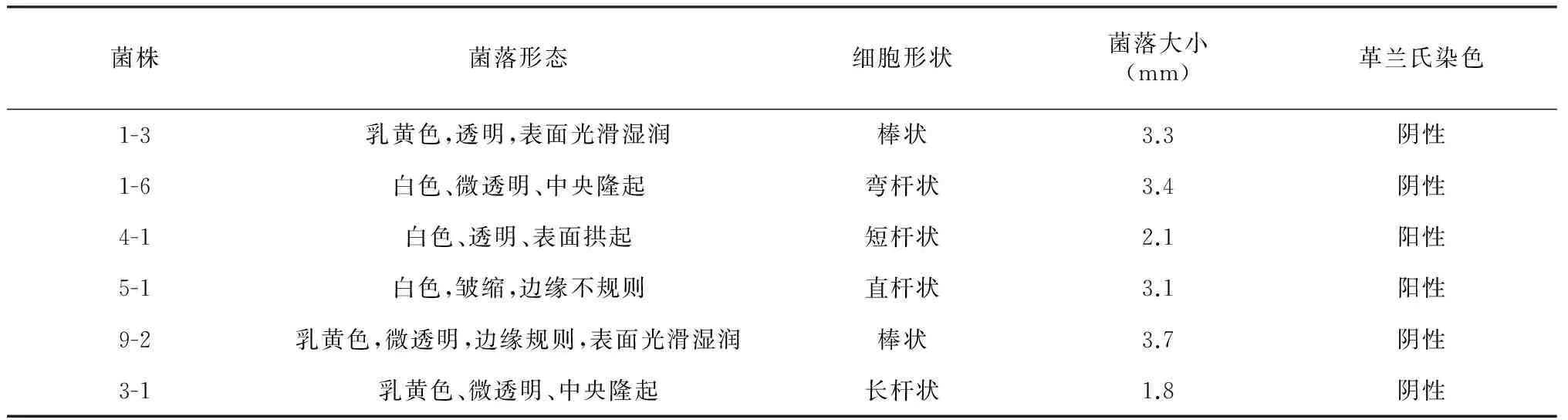
表1 产酶菌株的形态特征

图1 6株菌株在脱脂乳鉴别培养基上的产酶水解圈Fig.1 Transparent circle of 6 cold protease-producing strains on skim milk plate
2 结果与分析
2.1 低温蛋白酶菌株的筛选
以脱脂乳鉴别培养基为模型,从布伦口湖群不同湿地类型样品中共分离到24 株疑似产蛋白酶的可培养菌株。将水解圈直径D/菌落直径d较大的纯培养物划线纯化,进行摇瓶发酵培养,Folin-酚显色法测定粗酶液酶活力,最终获得6株分泌低温蛋白酶性能良好的细菌菌株。
图1为产低温蛋白酶功能菌株在脱脂乳鉴别培养基上产生的相应水解圈。革兰氏染色结果表明,6株产酶菌株中4株为阴性,其余2株为阳性,具体表型特征见表1。

图2 产低温蛋白酶菌株生长温度的测定Fig.2 Determination of growth temperature of cold-protease producing strains
2.2 产酶菌株的生长及产酶特性
2.2.1 产酶菌株的最适生长温度及耐盐性测定 由图2可知,产酶菌株的最佳生长温度在18~25 ℃左右,生长温度介于4~37 ℃,属耐冷菌。耐盐性研究中,6株产酶菌株耐盐性一般,最高不超过6 %。菌株5-1在6 % 高盐度下虽可以生长,但生长极为缓慢。1-3耐盐性最差,盐浓度高于4 %即停止生长。
2.2.2 产酶菌株生长曲线及产酶特性 将产酶菌株接入液体培养基进行发酵,每间隔12 h取样测定其光密度和发酵上清液粗酶活力。由图3可知,6株低温菌均有明显的延滞期,培养24~36 h后进入对数期。1-4、4-1、5-1生长速度较快,发酵48 h后即到达生长稳定期,其余3株菌则在培养60 h后进入平稳期。
图4表明,菌株的产酶速度各异,3-1和5-1初始产酶速度较快,但1-3、5-1在发酵60 h后即先到达酶活最高点,其它菌株则在72 h后达到酶活高峰。之后随着培养时间延长,所有菌株酶活力开始减低。综合图3~4可知,6株菌的产酶能力与生长具有一定偶联性,随菌体密度增大,产酶活力也在明显上升,至平稳期达到酶活高峰,说明其在生长平稳期酶催化能力最强,酶活力最高。
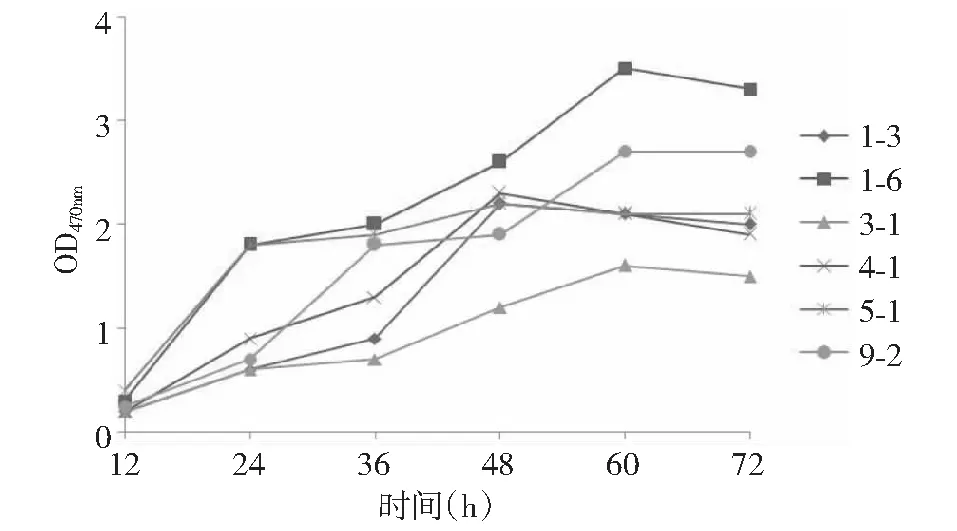
图3 低温蛋白酶菌株的生长曲线Fig.3 Growth curve of cold-protease producing strains

图4 低温蛋白酶菌株的产酶特性Fig.4 Enzymatic activity of cold-lipase producing strains
2.3 产蛋白酶菌株的16S rRNA 基因序列与系统发育分析
以6株产低温蛋白酶菌株的基因组为模板进行 PCR扩增,获得16S rDNA片段约1500 bp,PCR产物经试剂盒纯化后,交由上海生工完成测序工作。测序结果提交至美国国家生物技术信息中心(National Center of Biotechnology Information,NCBI),用BLAST在GenBank数据库中进行同源序列搜索比对,并构建低温蛋白酶产生菌的系统发育树。由图5可知,1-3、1-6、3-1、9-2属于假单胞菌(Pseudomonassp.),4-1属于节杆菌(Arthrobactersp.),5-1属于芽孢杆菌(Bacillussp.) 。
3 讨 论
低温蛋白酶在食品加工保鲜、洗涤纺织、植物保护、生物环境修复等领域具有重要应用发展潜力。虽然生物圈超过80 %部分为永久性低温地区,为极端微生物资源的发掘提供了丰富源泉,但目前极端酶生物工程技术的开发并不成熟,低温蛋白酶资源开发广度及低温酶结构特征、作用机制、基因工程改造等尚需进一步探索研究。
本实验通过对布伦口湖泊湿地可培养产酶细菌的分离和筛选,了解高原湖泊湿地产低温蛋白酶细菌的生长特征、产酶性能及遗传多样性。研究分离到的6株产酶功能菌株的最适生长温度不超过25 ℃,符合低温微生物的生理特性,属于耐冷菌范畴。菌株的生长范围介于4~37 ℃,在常温和低温下均能正常生存生长,推测可能是常温菌长期适应低温条件自然选择的结果。目前国内针对分泌低温蛋白酶菌株的分子鉴定、系统发育及酶学性质基础研究尚不多,分离到的产酶菌株多隶属于以下菌属:Pseudomonas、Pseudoalteromona、Shewanella、Colwellia、Sphingobacterium、Flavobacterium及Arthrobacter属等。本研究从布伦口湖群湿地分离的6株产低温蛋白耐冷菌,能在15 ℃条件下发酵分泌低温蛋白酶,耐盐性一般。结合形态学及16S rDNA序列同源性分析,鉴定其中四株菌属于假单胞菌(Pseudomonassp.),与倪永清[14]、易浪波[15]、高云航[16]等结果一致。而假单胞菌是低温生境中的优势菌群,广泛存在于极地、冰川雪山、常年冻土、深海等常年酷寒环境中[17-20],是目前微生物中较丰富的酶库,表现出较强的降解能力。另外两株菌分属于节杆菌属(Arthrobactersp.)和芽孢杆菌属(Bacillussp.),在四川若尔盖高原[21]、西藏尼玛县甲热布错湖[22]、渤海和黄海[23]地区同样分离到。
本研究自东帕米尔高原湖泊群湿地中分离到的6株产酶菌株,其16S rDNA序列与已知分类地位的同属模式菌株相似度在98 %以上,因此最多只能区分到属(genus),不能到种[24]。此外,尽管分离到的4株假单胞菌株的16S rRNA 基因序列同源性在98 %~99 %左右,但菌落形态、大小等表型特征及生长、产酶性能存在差异,说明目前主要依据的可培养菌株16S rRNA基因序列差异并不能准确反映产低温酶功能微生物的遗传多样性。在后续实验或可尝试采用重复序列rep-PCR指纹分析技术,结合菌株的生理学代谢谱、产酶性状谱等将同源性较高的Pseudomonas菌株划分到不同的亚群,进而对应于同属不同的种或者种组[25-26],以更加全面地揭示极端环境中产酶菌株遗传多样性与种群进化关系,挖掘出优质高效、具有新特性的高产低温蛋白酶新菌种,为低温酶制剂的研究应用奠定更坚实的理论基础。
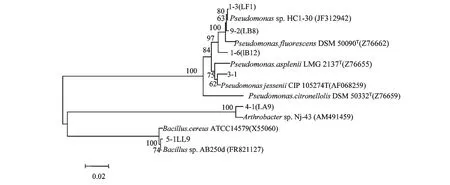
图5 基于16S rDNA序列产酶菌株的系统发育树Fig.5 Phylogenetic tree of cold-adapted bacteria producing protease based on 16S rDNA sequence
4 结 论
从新疆东帕米尔高原布伦口湖群湿地共筛选到6株高产低温蛋白酶菌株,其在15 ℃条件下均能生长繁殖,但耐盐能力一般,在生长稳定期达到产酶高峰。16S rRNA 基因序列初步确定4株为假单胞菌 (Pseudomonassp.) ,另2株分属于芽孢杆菌(Bacillussp. ) 和节杆菌(Arthrobactersp.)。
[1]Huston A L. Biotechnological aspects of cold-adapted enzymes[M]. Psychrophiles: from biodiversity to biotechnology. Springer Berlin Heidelberg, 2008: 347-363.
[2]邱 天,杨基先,崔 迪,等. 适冷微生物研究进展及应用现状[J]. 环境科学与技术,2012(s1):124-127.
[3]Wang Q F, Hou Y H, Xu Z, et al. Purification and properties of an extracellular cold-active protease from the psychrophilic bacteriumPseudoalteromonas, sp. NJ276[J]. Biochemical Engineering Journal, 2008, 38(3):362-368.
[4]Dastager S G, Dayanand A, Li W J, et al. Proteolytic Activity from an Alkali-ThermotolerantStreptomycesgulbargensissp. nov[J]. Current Microbiology, 2008, 57(6): 638-642.
[5]朱 非,王 珊,周培瑾. 低温酶冷适应的分子机制及其在生物技术中的应用[J]. 微生物学报,2002,42(5):640-644.
[6]于 鹏,刘静雯. 微生物适冷酶及其应用研究新进展[J]. 微生物学杂志, 2014,34(2):77-81.
[7]莫清珊,张会图,田 耀,等. 低温蛋白酶产生菌的筛选及其酶学性质的初步研究[J]. 天津科技大学学报,2015(3):19-23.
[8]Orna A, Ana G, Noa G, et al. The crystal structures of the psychrophilic subtilisin S41 and the mesophilic subtilisin Sph reveal the same calcium-loaded state[J]. Proteins, 2009, 74(2):489-496.
[9] Singh S K, Singh S K, Tripathi V R, et al. A novel psychrotrophic, solvent tolerant Pseudomonas putida, SKG-1 and solvent stability of its psychro-thermoalkalistable protease[J]. Process Biochemistry, 2011, 46(7):1430-1435.
[10]侯 鹏,申文明,王 桥,等. 基于水文平衡的湿地退化驱动因子定量研究[J]. 生态学报,2014,34(3):660-666.
[11]孔凡亭,郗 敏,李 悦,等. 基于RS和GIS技术的湿地景观格局变化研究进展[J].应用生态学报,2013,24(4):941-946.
[12]江晓珩,蔡新斌,布早拉木,等. 布伦口湖群湿地保护区现状及其保护措施研究[J].防护林科技,2013(12):57-59.
[13]中华人民共和国国家技术监管局. GB/T23527-2009,蛋白酶制剂[S]. 北京:中国标准出版社,2009.
[14]倪永清,顾燕玲,史学伟,等. 天山一号冰川底部沉积层产蛋白酶耐低温菌株的筛选及其系统发育[J]. 微生物学报,2013,53(2):164-172.
[15]易浪波,舒 琅,唐云涛,等. 常温土壤中耐冷菌的分离, 鉴定及产酶分析[J].生物技术通讯,2012,23(1):60-64.
[16]高云航,勾长龙,王雨琼,等. 湖水中低温菌的筛选及其产酶特性[J].中国农学通报, 2014,30(30):273-277.
[17]Olivera N L, Sequeiros C, Nievas M L. Diversity and enzyme properties of protease-producing bacteria isolated from sub-Antarctic sediments of Isla de Los Estados, Argentina[J]. Extremophiles, 2007, 11(3): 517-526.
[18]Kim E H, Cho K H, Lee Y M, et al. Diversity of cold-active protease-producing bacteria from arctic terrestrial and marine environments revealed by enrichment culture[J].The Journal of Microbiology, 2010, 48(4): 426-432.
[19]于清武,胡丽琴,李 菲,等. 低温环境下南海深海沉积物中可培养细菌的多样性及其抑菌活性分析[J]. 西南农业学报,2015,28(6):2803-2808.
[20]Vazquez S C, Coria S H, Mac Cormack W P. Extracellular proteases from eight psychrotolerant Antarctic strains[J]. Microbiological Research, 2004, 159(2): 157-166.
[21]辜运富,郑有坤,Penttinen,等. 若尔盖高原泥炭沼泽土嗜冷细菌系统发育分析[J]. 湿地科学,2014,12(5):631-637.
[22]刘国红,刘 波,陈 峥,等. 一株产低温蛋白酶芽胞杆菌FJAT-24893的筛选与鉴定[J]. 福建农业学报,2015,30(10):954-957.
[23]迟乃玉,张庆芳,王晓辉,等. 海洋低温蛋白酶菌株发酵条件的研究(Ⅱ)[J]. 微生物学通报,2006,33(2):106-108.
[24]Rosselló-Mora R, Amann R. The species concept for prokaryotes[J]. FEMS Microbiology Reviews, 2001, 25(1): 39-67.
[25]Cho J C, Tiedje J M. Biogeography and degree of endemicity of fluorescent Pseudomonas strains in soil[J]. Applied & Environmental Microbiology, 2000, 66(12): 5448-5456.
[26]Rosselló-Mora R, Lucio M, Pea A, et al. Metabolic evidence for biogeographic isolation of the extremophilic bacteriumSalinibacterruber[J]. Isme Journal, 2008, 2(3): 242-253.
(责任编辑 陈 虹 )
Isolation and Identification of Cold-adapted Bacteria Producing Protease from Bulunkou-lake Group Wetlands
WANG Ji-lian, LI Ming-yuan, REN Yu
(College of Biology and Geographic Sciences, Kashgar University, Key Laboratory of Ecology and Biological Resources in Yarkand Oasis of Education of Xinjiang Uygur Autonomous Region, Xinjiang Kashgar 844006, China)
【Objective】The bacterial strains producing cold-adapted protease from the Bulunkou-lake group wetlands, East Pamirs were isolated and identified, which would provided a useful basis for further study of cold-adapted protease.【Method】The bacterial strains by the screening media containing skim milk were isolated. The phenotypic characteristics, the optimum growth temperature, salt resistance, growth characteristic and enzyme properties of the strains were studied, and their taxonomic identity and genetic variability by the 16S rRNA gene sequences were determined. 【Result】6 high-yield protease-producing strains growing at 15 ℃ were obtained and belonged to psychrotrophs. The 6 strains had low salt-resistance but could be fermented under relative low temperature, which could reach the peak production of enzyme in the stable phase. Primary identification showed that 4 strains belonged to the genusPseudomonas, the other two belonged to the genusBacillusandArthrobacter. 【Conclusion】Although many closely related populations were isolated, they had different physiological characteristics, which would expand the existing resource database of cold-adapted strains producing protease and provide a basis for the further study of structure characteristics of cold-active protease and application in the field of biological engineering.
Bulunkou-lake group wetlands; Cold-adapted protease; Psychrotrophs; 16S rRNA
1001-4829(2017)6-1330-05
10.16213/j.cnki.scjas.2017.6.016
2016-07-12
新疆维吾尔自治区高校科研计划项目(XJEDU2016 S072);新疆维吾尔自治区自然科学基金(2016D01B011)
王继莲(1986-),女,山东郓城人,讲师,研究方向:低温微生物学,E-mail:wjilian0710@sina.com。
X172
A

