人工接种CGMMV的增殖及其对西瓜光合作用的影响
王艳红, 陈 平, 王聪慧, 毛 赫, 张孝宗, 李立梅*
(1.黑龙江八一农垦大学生命科学技术学院, 大庆 163319; 2. 吉林省林业科学研究院, 长春 130033)
人工接种CGMMV的增殖及其对西瓜光合作用的影响
王艳红1, 陈 平2, 王聪慧2, 毛 赫2, 张孝宗1, 李立梅2*
(1.黑龙江八一农垦大学生命科学技术学院, 大庆 163319; 2. 吉林省林业科学研究院, 长春 130033)
为明确西瓜感染黄瓜绿斑驳花叶病毒CGMMV后病毒的增殖过程及其对光合作用的影响,本研究以辽宁省田间主栽西瓜品种‘京欣’为试材,测定了人工接种CGMMV后,西瓜植株体内病毒含量、光合色素、光合作用相关指标以及参与光合作用的关键酶活性的变化,结果显示:接种3 d后,即可检测到病毒,24 d植株内病毒含量达最高;叶绿素a、叶绿素b及类胡萝卜素的含量均有所降低,叶绿素a在9 d后均低于健康对照,而叶绿素b和类胡萝卜素在15 d后明显低于健康对照,第18天时,健康对照的叶绿素b含量达接种处理的1.33倍;ALA脱水酶活性除第15天与对照无显著差异外,整个测定期间均低于健康对照,21 d时健康对照的ALA脱水酶的活性达29.9 U/h,为接种处理的2.18倍;PEP羧化酶的活性显著低于健康对照,测定期间接种处理的PEP羧化酶活性变化不大;乙醇酸氧化酶活性明显升高,测定期间其活性均显著高于健康对照;西瓜叶片的光合速率、气孔导度和蒸腾速率均远小于健康对照,而细胞间隙CO2浓度却比对照高,本研究为揭示西瓜感染CGMMV后的光合作用变化规律奠定了基础。
西瓜; 黄瓜绿斑驳花叶病毒; 病毒增殖; 光合作用
黄瓜绿斑驳花叶病毒Cucumbergreenmottlemosaicvirus(CGMMV)2006年被列为中华人民共和国进境植物检疫性有害生物[1]。西瓜感染该病毒后,果实内部严重变色或腐烂,果肉纤维化,水渍状,并伴有酸化、腐败,俗称西瓜倒瓤病,严重时西瓜丧失食用价值,给世界各地的西瓜产业带来巨大经济损失[2-6],至今尚无有效的防治手段。因此,黄瓜绿斑驳花叶病毒的致病机理是目前西瓜生产中亟待解决的问题。现阶段相关的研究报道较少,主要集中在西瓜感病后其品质、糖分代谢及相关酶活性的研究[7-9]。
光合作用是通过合成一些有机化合物将光能转变为化学能的过程,是绿色植物一个特殊的和最基本的生命过程,是决定产量和品质的主要因素。叶绿素实际上存在于所有能进行光合作用的生物体中,是植物进行光合作用的色素。光合速率是衡量寄主光合作用的一个重要指标,相关研究表明病毒侵染植物后其植株的光合速率明显下降,叶绿素含量降低,叶绿体超微结构受到明显的破坏,光合磷酸化作用减弱,气孔导度、蒸腾速率都出现了不同程度的降低,而细胞间CO2浓度有所升高[10-16]。因此,病毒胁迫如何影响植株内部的生理活性进而抑制光合作用始终是致病机理研究的重点。本文以辽宁省主栽品种‘京欣’为试材,测定了西瓜感染CGMMV后,病毒的积累及西瓜光合色素、光合作用相关指标及参与光合作用的关键酶活性的改变,以期明确西瓜感染该病毒后对光合作用的影响,为揭示CGMMV的致病机理提供理论依据和参考指标。
1 材料与方法
1.1 材料
1.1.1 供试植物
砧木:葫芦Lagenariasiceraria(Molina) Standl.(品种:‘不死鸟’);接穗:西瓜Citrulluslanatus(Thunb.) Matsum.etNakai(品种:‘京欣’)。
1.1.2 供试毒原
黄瓜绿斑驳花叶病毒(CGMMV),采自辽宁省盖县,由本实验室纯化并繁殖保存在无虫温室中的葫芦上。
1.1.3 CGMMV抗体和病毒阳性质控物
CGMMV抗体和阳性质控物均购于美国Agdia公司,阳性质控物的病毒浓度8.25 mg/mL。
1.2 方法
1.2.1 处理方法
采用常规汁液摩擦法接种 CGMMV,于西瓜3片真叶期接种,以接种PBS缓冲液为对照,每处理50株,3 次重复。分别于接种0、3、6、9、12、15、18、21、24、27 d测定光合作用相关指标,同时取每株西瓜下部叶片,混合后,按每份0.5 g称取,保存于-80℃冰箱备用,用于测定病毒含量,每处理3次重复。接种CGMMV的西瓜植株于成熟期观察西瓜果实倒瓤情况。
1.2.2 病情指数调查
参考苏小记等[17]的方法,略有改动。调查标准:0级,无任何症状;1级,心叶明脉,轻微花叶;2级,心叶及少数叶片花叶;3级,叶片皱缩、畸形;4级,严重花叶,多数叶片皱缩畸形; 5级,全株发病,病叶严重畸形,植株严重矮化,茎部有褐色坏死斑。接种后每天观察西瓜长势,并调查记录病情指数。
1.2.3 病毒含量测定
利用双抗夹心法(DAS-ELISA)进行病毒含量检测。以该病毒阳性质控物为标准液,稀释不同的倍数后,以病毒浓度为横坐标,A450为纵坐标,作标准曲线,并根据样品的A450值计算待测样品病毒含量。
病毒浓度(mg/mL)=(A260×稀释倍数)/E
式中,E为消光系数,为在波长260 nm、悬浮液浓度为0.1%(1 mg/mL)及光程为1 cm时的光吸收值。CGMMV的E=3.1,A260/A280=1.71。
1.2.4 叶绿素含量的测定
采用丙酮法进行测定[18]:
(1) 准确称取洗净且吸干表面水分的叶片0.5 g,剪碎后放入研钵中。
(2) 加5 mL 80%丙酮,少许CaCO3和石英砂研磨到溶液变绿,组织变白,暗处静止3~5 min后,过滤到50 mL容量瓶中。再加80%丙酮继续研磨到组织完全变白。连同残渣一并倒入漏斗的滤纸上,用吸管吸取80%丙酮沿滤纸的周围洗脱色素,最后定容。
(3) 色素提取液倒入光径为1 cm的比色杯中,将波长分别调到663 nm和645 nm处,以80%丙酮调零,测定两波长处的光密度值。
(4) 将测得的光密度值代入下面公式,计算出提取液中叶绿素a、叶绿素b和总叶绿素的浓度。
结果计算:CA=12.7A663-2.59A645;
CB=22.9A645-4.67A663。
1.2.5 类胡萝卜素含量的测定
准确称取0.5 g样品,放入试管内,加入20 mL石油醚∶丙酮(1∶1)浸提液,加塞放置摇床(100 r/min)上暗处浸提6 h,提取后的溶液在450 nm处测定吸光值[6]。
结果计算:类胡萝卜素含量(mg/100 g)=A450×V(石油醚体积)
1.2.6 氨基乙酰丙酸脱水酶(ALA脱水酶)活性测定
Ehrlich 试剂的配制:2 g 对二甲氨基苯甲醛溶解于50 mL HCl中,蒸馏水定容至100 mL。
粗酶液的提取[19]:准确称取0.5 g样品,加入内含0.1 mmol/L DTT的0.05 mol/L Tris-HCl缓冲液(pH8.2)中,研磨至匀浆,15 000 g离心15 min,上清液用于酶活性测定。
酶活性的测定[7]:反应体系含0.5 mL酶粗提液,2 mL内含0.1 mmol/L DTT 的0.05 mol/L Tris-HCl缓冲液(pH8.2),0.02 mol/L MgCl237℃水浴2.5 h,用0.3 mL 3 mol/L三氯乙酸终止反应,2 000 g离心15 min后,取2 mL上清液,加入2 mL Ehrlich 试剂,室温静置15 min后。测定555 nm处的吸光值,酶活性以37℃下每2.5 h形成的PBG为一个酶活单位。
1.2.7 磷酸烯醇式丙酮酸羧化酶(PEP羧化酶)活性测定
酶的提取[19]:叶片用提取缓冲液(0.1 mol/L pH8.3 Tris-H2SO4缓冲液,内含7 mmol/L巯基乙醇,1 mmol/L EDTA,5%甘油)以1∶4(W/V)捣碎提取,4层纱布去粗残渣,滤液以5 000 r/min 离心20 min,上清液进行硫酸铵分部沉淀,收集30%~55%的硫酸铵饱和度沉淀物,用5 mL提取缓冲液重新悬浮,置于透析袋(D27 mm)中透析8 h,脱盐后的酶提取液用于酶活性分析,所有操作均在冰浴下进行。
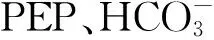
反应系统含有下列成分:酶反应缓冲液为0.1 mol/L Tris-H2SO4缓冲液(pH 9.2),总体积3 mL内含MgCl210 μmol、NaHCO310 μmol、磷酸烯醇式丙酮酸4 μmol,NADH 0.3 mg,过量的苹果酸脱氢酶,适量酶液。
1.2.8 乙醇酸氧化酶活性的测定
酶粗提液的制备[19]:将西瓜叶片在-80℃深度冷冻,加入5 mL 0.1 mol/L磷酸氢二钠缓冲液(pH8.0)混合,冰浴研磨至匀浆,滤液用冷的10%乙酸溶液调整到pH5.3,12 000 g冷冻离心除去沉淀。上清液立即用0.1 mol/L NaOH调整pH6.5。上清液进行硫酸铵分部,取25%~45%(NH4)2SO4饱和度的酶蛋白沉淀,并重新溶解于15 mL 0.1 mol/L磷酸钾缓冲液(pH8.3)中,整个操作在0~4℃低温下进行。
酶活性测定[19]:测定乙醛酸苯腙的形成。在光径为1.0 cm 的比色杯中加入2 mL 0.1 mol/L磷酸钾缓冲液(pH8.3),0.1 mL 0.1 mol/L半胱氨酸盐酸盐(使用当天制备),0.1 mL 0.1 mol/L盐酸化苯肼和0.5 mL 0.5 mol/L乙醇酸钠,反应在25℃下进行,由加入适量的酶液(使最终体积为3.0 mL)开始。用紫外分光光度计在324 nm处记录光密度的变化。以每分钟增加1.0光密度为1个酶活单位。比活为每mg蛋白的酶活性。
1.2.9 光合作用指标的测定
采用便携式 LI-6400 型光合检测系统(美国LI-COR公司)进行活体测定。采用夜视模式,光照强度为 1 000 lx,光合测定的指标为净光合速率(Pn)、细胞间隙 CO2浓度(Ci)和气孔导度(Gs)。光合测定时,环境条件是室内 CO2浓度 (272±0.5) μmol/mol,叶温(TL)为 (19.5±0.5)℃,相对湿度(RH)为 60%±2%,室内温度为 (18.4±0.5)℃,大气压为 100.8 kPa。
2 结果与分析
2.1 西瓜苗感染CGMMV后病情指数
病情指数调查结果表明,接种后9 d植株开始出现明脉症状,18 d后病情迅速发展,出现明显花叶现象,21 d后病情基本稳定,病情继续发展的趋势不明显(表1)。
2.2 西瓜苗接种CGMMV后不同时间的病毒含量变化
2.2.1 病毒浓度检测标准曲线
图1为病毒含量计算标准曲线,其相关性达到0.986 6,相关性较高,因此可用于病毒含量的计算。
表1 接种CGMMV后西瓜苗病情指数1)
Table 1 Disease indexes of watermelon seedlings after inoculated by CGMMV
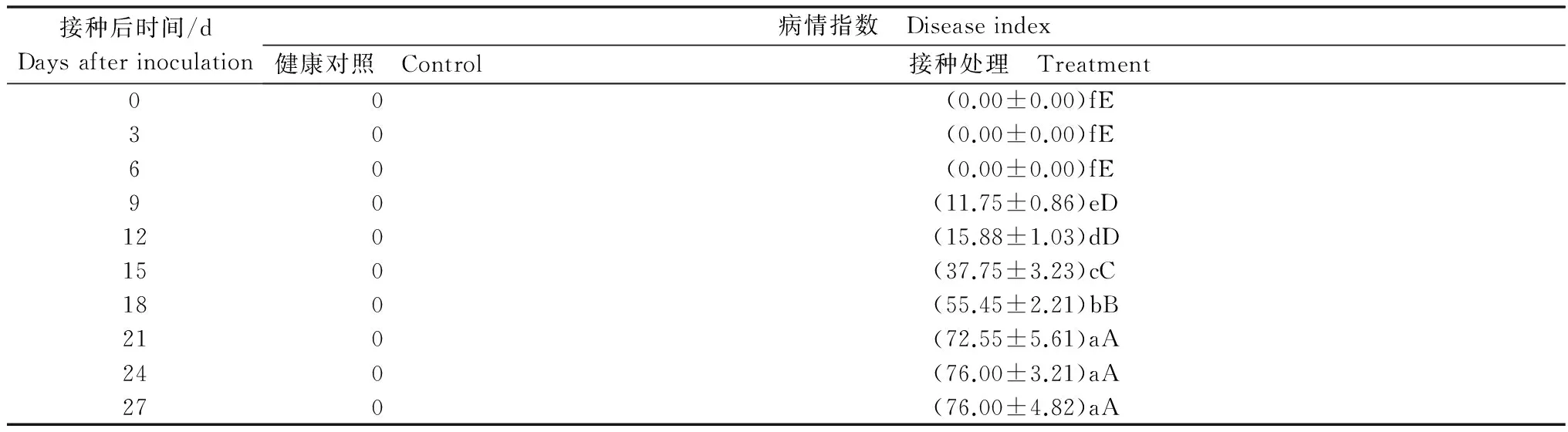
接种后时间/dDaysafterinoculation病情指数 Diseaseindex健康对照 Control接种处理 Treatment00(0.00±0.00)fE30(0.00±0.00)fE60(0.00±0.00)fE90(11.75±0.86)eD120(15.88±1.03)dD150(37.75±3.23)cC180(55.45±2.21)bB210(72.55±5.61)aA240(76.00±3.21)aA270(76.00±4.82)aA
1) 同列数据后,不同大小写字母分别表示经Duncan’s 新复极差测验,在P=0.01和P=0.05 水平上差异显著。下同。 Values followed by the same capital letters and small letters in the same column indicate no significant difference atP=0. 01 andP=0.05 according to Duncan’ s New Multiple Range Test. The same below.

图1 病毒含量标准曲线Fig.1 Standard curve of virus content
2.2.2 温室西瓜苗感染CGMMV后体内病毒含量变化
于接种后不同时间取样测定西瓜苗体内CGMMV含量的变化,结果表明(图2):27 d内健康对照均未检测到病毒,接种第3天西瓜苗就可以通过血清学检测到该病毒,接种21 d后寄主植物体内病毒含量剧增,24 d时西瓜苗CGMMV含量最高,之后略有下降,这正与该病害病情发展基本对应。
2.3 西瓜感染CGMMV后对其叶绿素含量的影响
由图3可知,随着西瓜的生长,健康对照叶绿素a含量逐渐增加,18 d时叶绿素a含量最高,随后叶绿素a含量有所降低。而接种处理后的西瓜幼苗体内的叶绿素a含量,在测定时间内第9天后均低于健康对照。在测定期间,0~12 d对照与接种处理间叶绿素b含量无明显差别,15 d后健康对照叶绿素b含量增加,而接种处理叶绿素b含量降低,第18天时,健康对照的叶绿素b含量达接种处理的1.33倍(图4)。无论叶绿素a、叶绿素b在接种后第9天其含量均低于健康对照。
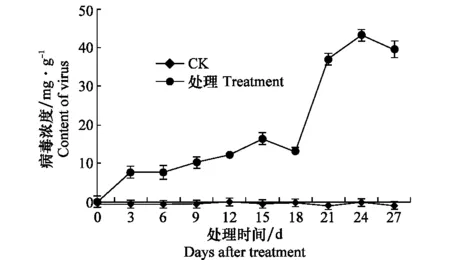
图2 接种CGMMV后西瓜苗病毒含量随时间的变化Fig.2 Change of virus contents in watermelon seedlings after inoculation with CGMMV

图3 感染CGMMV后西瓜苗叶绿素a含量的变化Fig.3 Contents of chlorophyll a in watermelon seedlings inoculated with CGMMV
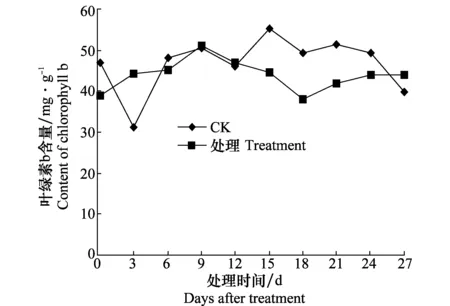
图4 感染CGMMV后西瓜苗叶绿素b含量的变化Fig.4 Contents of chlorophyll b in watermelon seedlings inoculated with CGMMV
2.4 西瓜感染CGMMV后对类胡萝卜素含量的影响
健康对照类胡萝卜素含量在测定期间,21 d 达到最高后又下降,而接种处理后的西瓜苗体内类胡萝卜素含量在0~9 d内与对照无明显差异,但15 d后,在测定期间均低于对照(图5)。
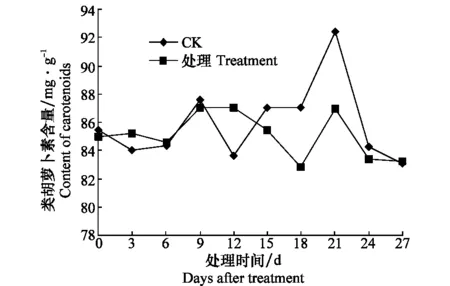
图5 感染CGMMV后西瓜苗体内类胡萝卜素含量的变化Fig.5 Contents of carotenoids in watermelon inoculated with CGMMV
2.5 西瓜感染CGMMV后对ALA脱水酶活性的影响
健康对照的ALA脱水酶活性前期6 d出现活性高峰后,迅速降低,15d后活性又上升,而接种处理后的西瓜幼苗,ALA脱水酶活性除第15天与健康对照无显著差异外,整个测定期间均低于健康对照,21 d健康对照的ALA脱水酶的活性达29.9 U/h,为接种处理的2.18倍(图6)。

图6 感染CGMMV后西瓜苗ALA脱水酶活性的变化Fig.6 Activities of ALA anhydrase in watermelon seedlings inoculated with CGMMV
2.6 西瓜感染CGMMV后对磷酸烯醇式丙酮酸羧化酶(PEP羧化酶)活性的影响
健康对照的PEP羧化酶的活性测定期间0~15 d内变化不明显,在18 d时活性达到最高,18~24 d其活性基本保持不变,随后下降。而接种处理后PEP羧化酶的活性显著低于健康对照,且整个测定期间其活性变化不大(图7)。

图7 感染CGMMV后西瓜苗PEP羧化酶活性的变化Fig.7 Activities of phosphoenolpyruvate carboxykinase in watermelon seedlings inoculated with CGMMV
2.7 西瓜感染CGMMV后对乙醇酸氧化酶活性的影响
接种CGMMV后西瓜苗乙醇酸氧化酶活性明显升高,整个测定期间,其活性均明显高于健康对照,且健康对照与接种处理均于第9天达活性高峰(图8)。
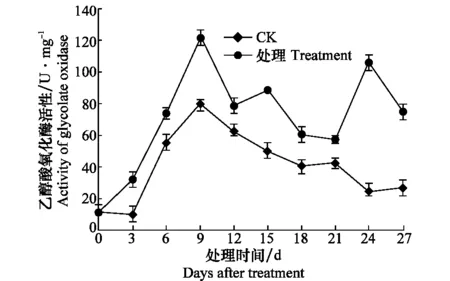
图8 感染CGMMV后西瓜苗乙醇酸氧化酶活性的变化Fig.8 Activities of glycolate oxidase in watermelon seedlings inoculated with CGMMV
2.8 西瓜感染CGMMV后光合指标的变化
在相同的光照、温度、湿度和大气压力条件下,测定了接种CGMMV后对西瓜幼苗的光合速率、蒸腾速率、气孔导度和胞间CO2浓度等一系列光合指标。
测定结果见表2:接种CGMMV后,西瓜叶片的光合速率、气孔导度和蒸腾速率均远远小于健康对照,而细胞间隙CO2浓度却比对照高,这说明病毒侵染后西瓜的叶绿体受到了破坏,叶绿素合成受阻,西瓜叶片的气孔关闭,阻碍了气体交换,从而导致了西瓜的净光合速率的下降。同时病毒侵染后期也使叶片的蒸腾速率下降,但蒸腾速率下降的幅度小于光合速率下降的幅度,表明西瓜苗的光合组织受到了破坏,胞间CO2不能被利用,从而使得胞间CO2浓度增加。同时蒸腾速率作为叶片水分交换的参数,它的下降反映了感病叶片存在着组织损伤和功能的衰退。
表2 西瓜感染CGMMV后对其光合指标的影响1)
Table 2 Photosynthetic indexes in watermelon seedlings inoculated with CGMMV

处理时间/dDaysaftertreatment健康对照光合指标PhotosynthesisindexesofthecontrolPnGsCiTr接种CGMMV光合指标PhotosynthesisindexesofwatermeloninoculatedwithCGMMVPnGsCiTr02.58fE 0.03gF 252.75bBC0.73gF2.44cC0.13bABC203.9fF1.62bB33.64efDE0.05fEF263.50aAB1.04fE3.72bB0.14bAB201.6fF1.94aA63.76efDE0.05fEF254.33bBC1.06fE1.32fF0.18aA250.4cC1.70bB94.98deD0.08deCD271.10aA1.47dD1.43fEF0.08cCDE131.8iI1.16dD125.54dD0.07eDE244.40cC1.38deD1.70eE0.09cBCD156.2hH1.34cC1510.99cC0.09cdBCD127.90eE2.45aA4.97aA0.07cDEF192.5gG1.17dD1812.31cBC0.10bcBC94.80gG1.77cC2.05dD0.01dG340.0aA0.21gG2116.68aA0.14aA78.69hH1.92bB2.18dCD0.02dFG210.75eE0.40fF2416.73aA0.11bB112.00fF1.84bcBC2.49cC0.03dEFG233.55dD0.69eE2714.29bB0.11bB146.64dD1.37eD2.11dD0.07cDE304.5bB1.14dD
1) Pn,净光合速率(μmol·m-2·s-1);Gs,气孔导度(mmol·m-2·s-1);Ci,胞间CO2浓度(μL·L-1);Tr,蒸腾速率(mol·m-2·s-1)。 Pn,photosynthesis (μmol·m-2·s-1);Gs,stomatal conductance (mmol·m-2·s-1);Ci,intracellular concentration of CO2(μL·L-1);Tr,transpiration rate (mol·m-2·s-1).
2.9 健瓜成熟及病瓜倒瓤过程观察
西瓜果实生长状况见图9,正常西瓜在授粉后21 d时果肉呈粉色,28 d时西瓜成熟良好,生产上可以选择在这一时期采摘,而35 d时,西瓜完全成熟,此时期西瓜口味更好。而接种病毒处理的西瓜果实在授粉后21 d时西瓜果实种子周围出现颜色明显发红的水渍状,28 d时病组织脱水,种子周围凹陷,果肉呈纤维化,35 d时果肉组织严重纤维化形成空腔,有明显腐烂、酸化等气味,“倒瓤”现象严重。

图9 健瓜成熟度及病瓜倒瓤程度Fig.9 Healthy watermelon maturity and blood-flesh of watermelon
3 结论与讨论
测定结果表明,采用摩擦法对西瓜接种CGMMV 3 d后即可在样品中检测到病毒的存在,21 d时病毒含量骤增,24 d达到最高,之后略有下降,这与裘维蕃的报道基本吻合,即接种3周左右,寄主体内病毒含量最高,而后会出现病毒增殖衰退现象[20]。
光合作用是植物生长的生理基础,反映植株的生长势和抗逆性。西瓜感染CGMMV后,其光合色素、光合作用指标及参与光合作用的关键酶活性均受到影响。据报道,寄主植物受病毒侵染后叶绿素和类胡萝卜素的形成会受到强烈抑制,光合速率降低,呼吸强度上升,甚至叶绿体解体[21-27]。植物进行光合作用的能量主要来源于光合色素捕获的光能,所以光合色素含量的高低与光合功能密切相关[28]。光合色素中叶绿素 a 是光反应的中心色素分子,而叶绿素 b 是捕光色素分子。类胡萝卜素一方面是光合色素,吸收光能并传递给反应中心,参与光合作用;另一方面又是细胞内源抗氧化剂,能够吸收剩余光能,淬灭活性氧,防止细胞膜脂过氧化[29]。本研究发现,西瓜感染CGMMV后,叶绿素a、叶绿素b以及类胡萝卜素含量均有不同程度的降低,说明CGMMV不仅使光合色素的合成受阻,同时可能促进光合色素的降解。其主要原因可能是西瓜感染CGMMV后,导致叶绿素分解酶活性上升,使叶绿素转化为叶绿素酯和叶绿素醇,因此叶绿素含量降低[26]; 也有可能是CGMMV侵染破坏叶绿体结构和功能,导致叶绿素含量下降。CGMMV侵染导致光合色素含量降低,在一定程度上减少西瓜植株的有效光合面积,限制碳素同化能力,从而抑制光合作用。同时,由于类胡萝卜素含量下降,减弱对活性氧的猝灭,导致细胞内积累较多的活性氧自由基,破坏叶绿体膜结构,加速叶绿素降解,从而降低光合作用中光能的吸收和传递[30]。

CGMMV侵染后西瓜叶片的光合速率、气孔导度和蒸腾速率均远远小于健康对照,细胞间隙CO2浓度却比对照高,表明CGMMV侵染后西瓜叶绿素合成受阻,西瓜叶片的气孔关闭,阻碍了气体交换,从而导致了西瓜的净光合速率的下降。
综上,西瓜感染CGMMV后,光合色素、光合作用关键酶均受到了不同程度的破坏,阻碍了西瓜光合作用的正常进行,光合作用是提供植物生长能量的源,因此西瓜的生长受到严重影响。
[1] 农业部.中华人民共和国农业部第788 号公告[EB].2006-12-21.
[2] Hollings M, Komuro Y, Tochihara H.Cucumbergreenmottlemosaicvirus[M]. Descriptions of Plant Virus Kew:CMI / AAB, 1975:154.
[3] Shahwan I M, Abdalla O A.A strain ofCucumbergreenmottlemosaicvirus(CGMMV) from bottle gourd in Saudi Arabia [J].Journal of Phytopathology, 1992, 134(2):152-156.
[4] 周玲玲, 吴元华, 赵秀香, 等.黄瓜绿斑驳花叶病毒生物学特性及对西瓜产量和质量的影响[J]. 沈阳农业大学学报, 2008, 39(4):417-422.
[5] Chen M J, Wang S M. A strain ofCucumbergreenmottlevirusin bottle gourd in Taiwan [M]// Plant virus disease of horticultural crop in tropics and subtropics. Food Fertilizer Technology Center for Asian and Pacific Region. Taiwan: Book Series, 1986, 33: 38-42.
[6] Choi Gugseoun, Choi G S.Occurrence of two Tobamovirus diseases in cucurbits and control measures in Korea [J]. Plant Pathology Journal, 2001, 17(5):243-248.
[7] 李立梅, 吴元华, 赵秀香, 等.西瓜感染黄瓜绿斑驳花叶病毒后糖的变化与倒瓤关系的研究[J].植物病理学报,2011,41(3):319-323.
[8] 李立梅,吴元华,赵秀香,等. 黄瓜绿斑驳花叶病毒对西瓜产量、品质及种子带毒的影响[J]. 植物保护,2010,36(6):82-86.
[9] 李立梅, 陈越渠, 李晓冬, 等. 人工接种CGMMV后与西瓜倒瓤相关部分生理指标的研究[J].植物病理学报,2015,45(5):461-467.
[10]杨志晓, 丁燕芳, 张小全,等. 赤星病胁迫对不同抗性烟草品种光合作用和叶绿素荧光特性的影响[J].生态学报,2015,35(12): 4146-4154.
[11]彭晏辉,雷娟丽,黄黎锋,等.马铃薯Y病毒侵染对叶绿体超微结构、光合和荧光参数的影响[J].植物病理学报,2004,34(1):32-36.
[12]郭兴启,温孚江, 朱汉城. 马铃薯Y病毒(PVY)的侵染对烟草叶片光合作用的影响[J]. 浙江大学学报(农业与生命科学版), 2000,26(1):75-78.
[13]洪健,徐颖,徐正. 植物病毒感染寄主叶绿体的形态结构变化[J]. 电子显微学报, 2000, 19(3):335-336.
[14]Doke L. Incorporation of14CO2into free and bound amino acids in tobacco leaves infected withTobaccomasaicvirus[J].Phytopathology, 1972,73:215-226.
[15]David M M, Coelho D, Barrote I. Leaf age effects on photosynthetic activity and sugar accumulation in droughted and rewateredLupinusalbusplants[J].Australian Journal of Plant Physiology, 1998, 25:299-306.
[16]Funayama S,Sonoike K,Terashima I. Photosynthetic properties of leaves ofEupatoriummakinoiinfected by a geminivirus[J].Photosynthesis Research,1997,53: 253-261.
[17]苏小记, 贾丽娜, 王亚红, 等. 2.0%氨基寡糖素水剂防治西瓜病毒病药效试验[J]. 陕西农业科学,2004(4):8-9
[18]郝建军, 刘延吉. 植物生理学实验技术[M].沈阳:辽宁科学技术出版社, 2001.
[19]薛应龙. 植物生理学实验手册[M].上海:上海科学技术出版社.1985.
[20]裘维蕃. 植物病毒学(修订版)[M].北京:农业出版社, 1984:253-270.
[21]洪健,徐颖,黎军英,等.芜菁花叶病毒(TuMV)侵染对寄主植物光合作用的影响[J].电子显微学报,2002,21(2):110-113.
[22]王春梅,施定基,朱水芳,等.黄瓜花叶病毒对烟草叶片和叶绿体光合活性的影响[J].植物学报, 2000,42(4):355-392.
[23]沈喜, 李红玉. 病毒侵染后植物叶绿体光合作用变化的分子机制[J].2003,33(4): 289-291.
[24]Roger D A, Corbett M K. Reduced photosynthesis in tobacco plant infected withTobaccoringspotvirus[J]. Phytopathology,1965, 55: 370-371.
[25]Hall A E, Loomis R S.An explanation for the difference in photosynthetic capabilities of healthy and beet yellows virus-infected sugar beets(BetavulgarisL.)[J]. Plant Physiology, 1972, 50: 576-580.
[26]李燕宏,洪健,谢礼,等. 蚕豆萎蔫病毒2 号分离物侵染对蚕豆叶片光合活性和叶绿体超微结构的影响[J]. 植物生理与分子生物学学报,2006,32(4): 490-496.
[27]宋丽丽, 郭延平, 徐凯, 等. 温州蜜柑叶片光合作用光抑制的保护机理[J]. 应用生态学报,2003,14(1): 47-50.
[28]Li X G,Meng Q W,Jiang G Q,et al. The susceptibility of cucumber and sweet pepper to chilling under low irradiance is related to energy dissipation and water-water cycle [J].Photosynthetica,2003,41(2): 259-265.
[29]Willekens H,van Camp W,van Montagu M,et al. Ozone,sulfurdioxide,and ultraviolet B have similar effects on mRNA accumulation of antioxidant genes inNicotianaplumbaginifoliaL. [J].Plant Physiology,1994,106(3): 1007-1014.
[30]Sakaki T,Kondo N,Sugahra K.Breakdown of photosynthetic pigment and lipids in spinach leaves with ozone fumigation: Role of active oxygen [J].Physiologia Plantarum,1983,59(1): 28-34.
[31]潘瑞志. 植物生理学[M]. 北京:高等教育出版社,2001.
(责任编辑:田 喆)
Studies on viral multiplication and its effect on photosynthesis of the watermelon inoculated byCucumbergreenmottlemosaicvirus
Wang Yanhong1, Chen Ping2, Wang Conghui2, Mao He2, Zhang Xiaozong1, Li Limei2
(1.CollegeofLifeScienceandTechnology,HeilongjiangBayiAgriculturalUniversity,Daqing163319,China; 2.JilinAcademyofForestrySciences,Changchun130033,China)
Studies were conducted with the watermelon cultivar ‘Jingxin’ in Liaoning Province. In order to reveal the viral multiplication process after watermelon was inoculated byCucumbergreenmottlemosaicvirus(CGMMV) and its influence on photosynthesis, some physiological and biochemical indexes such as concentration of virus and photosynthetic pigment, activity of key enzymes and related physiological indexes were studied. The results indicated that the virus was detected on the 3rd day after watermelons were inoculated by CGMMV, and the concentration of virus was highest on the 24th day. Meanwhile the concentrations of chlorophyll a,chlorophyll b and carotenoids were significantly lower than those of the control. The concentration of chlorophyll a was lower than that of healthy control after 9 days. The concentration of chlorophyll b and carotenoids were significantly decreased on the 15th day. On the 18th day, the concentration of chlorophyll b was equivalent to 1.33 times of the control. In this study, the activity of ALA anhydrase was tested. It was 29.9 U/h, much higher than that of the control and equivalent to 2.18 times on the 21st day. The tests showed that the activity of phosphoenolpyruvate carboxykinase was significantly lower than that of the control, but the activity of glycolate oxidase was higher than that of the control during the experimental period. The photosynthesis (Pn), stomatal conductance (Gs) and transpiration rate (Tr) of watermelon leaves were lower than those of the control, while the concentration of CO2in the cells was higher than that of the control. This research established foundation for revealing the change in photosynthesis after watermelon was inoculated by CGMMV.
watermelon;Cucumbergreenmottlemosaicvirus; viral multiplication; photosynthesis
2016-10-24
2016-12-22
辽宁省科技攻关项目(2006215003);黑龙江省大学生创业实践项目(201610223064)
S 436.5
A
10.3969/j.issn.0529-1542.2017.04.005
* 通信作者 E-mail: lilimei19820406@163.com

