胰岛素对2型糖尿病心肌病大鼠的心肌保护机制
刘雅玲 周辰 潘晓东 尹冬华
胰岛素对2型糖尿病心肌病大鼠的心肌保护机制
刘雅玲 周辰 潘晓东 尹冬华
目的 探讨胰岛素干预对2型糖尿病心肌病(DCM)大鼠体内氧化应激和白介素-6(IL-6)水平的影响。 方法 16只雄性Wistar大鼠采用链脲佐菌素(STZ)+高脂饮食诱发2型糖尿病。随机分为干预组(IN组,n=8)和糖尿病组(DM组,n=8),另选8只作为正常对照组(Con组,n=8)。IN组于成模第1周给予诺和灵30R皮下注射,而DM组和Con组予以等量生理盐水皮下注射。成模8周后比较各组超氧化物歧化酶(SOD)、谷胱甘肽(GSH)、丙二醛(MDA)、IL-6水平的差异,并观察心肌细胞病理学改变。 结果 心肌组织HE染色显示DM组大鼠心肌纤维明显减少、排列紊乱,横纹消失,细胞核固缩或增大,间质反应性增生。与Con组比较,DM组大鼠血糖、心重(HW)/体重(BW) 比、MDA、IL-6水平升高(P<0.05),SOD、GSH水平均降低(P<0.05),IN组上述指标均较DM组有改善(P<0.05)。 结论 胰岛素对DCM大鼠心肌细胞有抗炎、抗氧化作用。
胰岛素; 白介素-6; 氧化应激; 糖尿病; 心肌病
糖尿病发病率逐年上升,其并发症的危害不容忽视。其中糖尿病心肌病(diabetic cardiomyopathy,DCM)作为一项远期并发症,越来越引起人们的重视。DCM是指排除了冠心病、高血压及其他已知的疾病所致的心肌损伤后而诊断的一类独立的、特异性的心肌病,其早期表现为心室舒张功能障碍,随后可出现收缩功能受损,逐渐发展为充血性心力衰竭。DCM的发病机制尚未明了。近年来认为,糖尿病是一种炎症反应性疾病,氧化应激和炎症反应在糖尿病心脏远期并发症中有促进作用[1]。胰岛素作为体内唯一降糖激素,其抗炎抗氧化的作用正引起广泛关注[2]。本文拟探讨胰岛素在DCM大鼠中发挥抗炎、抗氧化作用的机制。
1 材料与方法
1.1 实验材料 实验动物:南京军区南京总医院动物实验中心购入健康雄性Wistar大鼠28只。链脲佐菌素(STZ)购自美国Sigma公司,诺和灵30R(批号:VVG0316)购自丹麦诺和诺德公司,盐酸氯胺酮(2 ml:0.1 g)购自江苏恒瑞医药公司,丙二醛(MDA)测定试剂盒、超氧化物歧化酶(SOD)测定试剂盒和谷胱甘肽(GSH)测定试剂盒购自南京建成生物研究所,白介素-6(IL-6)测定试剂盒购自上海超研生物科技公司,罗氏血糖仪购自罗氏公司,723可见分光光度计购自上海光谱仪器公司,光学显微镜(Olympus-BH2)购自日本Olympus公司。
1.2 2型糖尿病大鼠模型的建立及分组动物处理 20只6月龄的健康雄性Wistar大鼠,体质量200~220 g,予以高脂饲养4周,过夜禁食12 h后,每只按25 mg/kg腹腔注射链脲佐菌素(STZ溶于pH 4.4的0.1 mol/L柠檬酸缓冲液),于72 h、7 d断尾取静脉血测血糖,2次随机血糖浓度均≥16.7 mmol/L为2型糖尿病造模成功。其中死亡1只,建模未成功3只,符合标准的16只大鼠进入实验,随机分成2组:胰岛素干预组(IN组,n=8)和糖尿病组(DM组,n=8),继续高脂饲养。另选8只做正常对照(Con组,n=8),基础饲料喂养,每只腹腔注射等量柠檬酸缓冲液。IN组每日下午五点至六点,给予4 U诺和灵30R皮下注射,注射前及注射后2 h测血糖,避免低血糖。DM组和Con组予以等量生理盐水皮下注射,共干预8周。
1.3 动物处理 实验终点,测终末点血糖,称取大鼠体质量(BW),予以盐酸氯胺酮2 ml:生理盐水8 ml,稀释后按1 ml/100 g右下腹腔麻醉,打开腹腔,下腔静脉采血5 ml备用后,迅速打开胸腔取出心脏放入冰生理盐水中漂洗后称心重(HW),取左室前壁。
1.4 SOD、GSH、MDA测定 抽取下腔静脉血约3 ml,2500 r/min离心10 min,取上清,采用化学比色法,按试剂盒说明书制备空白管、标准管和各测定管,充分混匀,蒸馏水调零,测定各管吸光度(A)值,根据公式:样品含量=(测定管A值-空白管A值)/(标准管A值-空白管A值)×标准品浓度,计算样品中SOD、GSH、MDA含量。
1.5 IL-6测定 抽取下腔静脉血约2 ml,1000 r/min离心20 min,取上清,用酶联免疫分析方法(ELISA)按试剂盒说明经过加样、洗涤、温育等步骤测定IL-6。
1.6 HE染色 左室前壁心肌组织经甲醛固定、石蜡包埋、连续切片、浸染、冲洗、封胶,盖片等步骤后,光镜下观察病理学变化,摄片。

2 结果
2.1 一般情况 Con组大鼠无糖尿病症状,生长及营养状况良好,毛发有光泽,体重逐渐增加。DM组大鼠明显多饮、多尿、多食及消瘦,皮毛污秽无泽;而IN组上述表现减轻,糖尿病症状得以改善。
2.2 大鼠终点血糖、HW/BW的比较 与Con组比较,DM组和IN组血糖水平、HW/BW明显增高(P<0.05);与DM组比较,IN组血糖水平、HW/BW降低(P<0.05)。见表1。
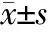
表1 各组大鼠实验终点时血糖浓度和HW/BW比值(, n=8)
注:与Con组比较,*P<0.05,与DM组比较,△P<0.05
2.3 各组SOD、GSH、MDA水平的比较 与Con组比较,DM组和IN组大鼠SOD、GSH水平明显降低(P<0.05),MDA水平增高(P<0.05),与DM组比较,IN组SOD、GSH水平增高(P<0.05),MDA水平降低(P<0.05)。见表2。
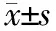
表2 各组大鼠SOD、GSH、MDA水平的比较(, n=8)
注:与Con组比较,*P<0.05,与DM组比较,△P<0.05
2.4 各组IL-6水平比较 与Con组比较,DM组和IN组大鼠IL-6水平明显升高(P<0.05),与DM组比较,IN组IL-6水平明显降低(P<0.05),见表3。

表3 各组大鼠IL-6水平比较(, n=8)
注:与Con组比较,*P<0.05,与DM组比较,△P<0.05
2.5 心肌细胞HE染色 光镜下观察Con组心肌纤维结构清晰,肌纤维呈短柱状,相互连接成网,排列整齐致密,横纹清晰可见,细胞核居中呈圆形,大小均一(图1-A);DM组心肌纤维减少、断裂且排列紊乱,大量横纹消失或模糊,细胞核增大,有固缩的细胞核,间质增生,炎细胞浸润(图1-B);IN组心肌纤维结构尚清晰,部分排列紊乱,横纹可见,可见少量固缩的细胞核,间质轻度增生性反应(图1-C)。

注:A:Con组;B:DM组;C:IN组图1 大鼠心肌细胞HE染色(×200)
3 讨论
DCM是一种不可逆的慢性心肌损害。近年来国内外研究表明DCM存在氧化应激。长期的高糖高脂损害,使心肌细胞的线粒体在能量代谢过程中产生过多的氧自由基(ROS),从而消耗大量的ROS清除剂SOD、GSH,导致脂质过氧化而产生MDA。过量的ROS一方面造成心肌细胞自由基损伤,使心肌细胞能量代谢障碍,脂肪酸氧化增加;另一方面过多的ROS可能通过磷酸化激活Akt、JAK/STAT等多种通路上调IL-6的表达[3-4]。IL-6是一种多肽物质,可由免疫细胞、损伤心肌细胞等多种细胞分泌。正常情况下,体内存在一定低水平的IL-6以维持促进生长和分化等多种生理功能。而持续过量的IL-6会破坏细胞网络结构导致心肌细胞炎性损伤[5-6]。这种作用是通过IL-6及其受体(IL-6R)的信号转导实现的。IL-6R由两种不同的膜蛋白组成,即特异性配基结合链IL-6Rα和信号转导链gp130。IL-6与IL-6Rα结合,再与gp130连接,形成gp130同源二聚体,通过gp130亚单位激活细胞内JAK-STAT信号转导通路,使STAT磷酸化聚合为复合体,进入胞核中,与靶基因启动子序列的特定位点结合,促进更多炎症介质转录,造成细胞损伤[7]。心肌细胞存在大量的gp130,是IL-6作用的靶细胞,大量炎症介质释放导致心肌纤维破坏,心肌肥厚,间质纤维化。
本实验采用小剂量STZ部分破坏了大鼠胰岛导致胰岛素产生不足,配以高脂饲养产生胰岛素抵抗,较好地模拟了T2DM的疾病特点。根据黄昶荃等[8]采用小剂量的STZ配合高脂饲料喂养,诱导2型糖尿病模型,成模8周后即出现DCM。本实验结果显示,DM组大鼠出现“三多一少”的典型糖尿病症状,血糖增高,心体比(HW/BW)增加,提示DM组大鼠存在心脏肥大。在光镜下DM组心肌纤维明显减少且排列紊乱,间质反应性增生,与DCM的心肌病理变化一致。实验中发现,DM组MDA高于Con组,SOD、GSH低于Con组,表明DM组大鼠体内存在氧化应激,生成过多的ROS,大量消耗了SOD、GSH,过氧化脂质生成过量的MDA。同时DM组IL-6亦显著高于Con组,表明IL-6在DM组大鼠中过度表达,过量的IL-6会造成心肌炎性损伤,因此光镜下看到DM组较Con组心肌组织损害加重。
经胰岛素干预后,IN组大鼠的血糖、HW/BW显著低于DM组,光镜下心肌纤维的结构和间质增生情况均较DM组有所改善,提示胰岛素可减轻糖尿病心肌病大鼠的心肌损伤。进一步研究发现,IN组MDA、IL-6水平低于DM组,高于Con组;SOD、GSH高于DM组,低于Con组;表明胰岛素干预后,IN组氧化应激减轻,IL-6表达降低,提示胰岛素存在降糖之外的作用。相关研究表明:一方面胰岛素能减轻氧化应激,如通过其信号传导通路降低线粒体产生的活性氧水平[9]、上调细胞内抗氧化酶的表达,从而消除过多的ROS[10];另一方面胰岛素可通过ERK通路、PI3K/FOXO-1通路影响STAT转录,阻断IL-6信号转导通路,抑制炎症介质的生成,从而抑制炎性反应,发挥保护作用[11-12]。
综上,本实验研究显示DCM大鼠体内存在氧化应激和过度表达的IL-6,造成心肌炎性损伤和氧化损伤。氧化应激和炎性反应可能相互促进,共同参与了2型糖尿病心肌病发病机制。而胰岛素具有抗炎、抗氧化等降血糖之外的作用,从而抑制炎性反应,发挥保护心肌的作用。这些作用机制还有待更深入的研究和发掘,为以后疾病治疗提供新的思路和策略。
[1] Elmarakby AA, Sullivan JC. Relationship between oxidative stress and inflammatory cytokines in diabetic nephropathy[J].Cardiovasc Ther, 2012,30(1):49-59.
[2] 姜冬冬,韩亭亭,胡耀敏.胰岛素抗炎机制研究进展[J]. 国际内分泌代谢杂志,2012,32(5):331-334.
[3] 吴建宇,王淑秋,王柏欣,等.实验性2型糖尿病大鼠心肌线粒体的氧自由基损伤[J].中国病理生理杂志,2010,26(1):233-237.
[4] 王映梅,曲萍,铁茹,等. 氧自由基增强脂肪细胞IL-6表达的实验研究[J].陕西医学杂志,2010,39(2):146-149.
[5] Fischer P, Hilfiker-Kleiner D. Survival pathways in hypertrophy and heart failure: the gp130-STAT axis[J]. Basic Res Cardiol,2007,102(5):393-411.
[6] 周凤华,贾钰华,李丽君,等. IL-6预处理保护H2O2致心肌细胞损伤作用机制初探[J]. 热带医学杂志,2011,11(9):1014-1017.
[7] Rose-John S, Waetzig GH, Scheller J, et al. The IL-6/sIL-6R complex as a novel target for therapeutic approaches[J]. Expert Opin Ther Targets, 2007,11(5):613-624.
[8] 黄昶荃,肖谦,赵柯湘,等. 2型糖尿病心肌病变模型建立方法的实验研究[J].重庆医科大学学报,2007,32(1):15-17.
[9] 刘雅玲,程训民,江时森,等.胰岛素抑制糖尿病大鼠心肌细胞凋亡的作用及机制[J].解放军医学杂志,2010, 35(7):798-801.
[10]Wang X, Tao L, Hai CX.Redox-regulating role of insulin: the essence of insulin effect[J]. Mol Cell Endocrinol,2012,349(2):111-127.
[11]Anderson CX, Sopasakis VR, Wallerstedt E, et al. Insulin antagonizes interleukin-6 signaling and is anti-inflammatory in 3T3-L1 adipocytes[J]. J Biol Chem,2007,282(13):9430-9435.
[12]Wallerstedt E, Sandqvist M, Smith U, et al. Anti-inflammatory effect of insulin in the human hepatoma cell line HepG2 involves decreased transcription of IL-6 target genes and nuclear exclusion of FOXO-1[J].Mol Cell Biochem,2011,352(1):47-55.
Effect of insulin on myocardial protection in type 2 diabetic rats with cardiomyopathy
LIUYa-ling,ZHOUChen,PANXiao-dong,YINDong-hua.
DepartmentofCadresofHealth,JiangsuProvinceOfficialHospital,Nanjing210024,China
Objective To investigate the influence of insulin on oxidative stress and interleukin-6(IL-6) in type 2 diabetic rats with cardiomyopathy. Methods Sixteen male Wistar rats were induced to type 2 diabetes(T2DM) by streptozotocin(STZ) and high fat diet. They were randomly divided into intervention group (IN group,n=8) and diabetes mellitus group (DM group,n=8). Another eight rats fed with ordinary diet were chosen as normal control group (Con group,n=8). Novolin 30R was subcutaneously injected to the IN group in the first week, while the DM group and the Con group
the same amount of saline by subcutaneous injection. Eight weeks later the levels of superoxide dismutase (SOD), glutathione (GSH), malondialdehyde (MDA) and IL-6 were compared among the three groups, and the pathological changes of myocardial cells were observed. Results HE staining showed that the cardiac muscle fibers in DM group was decreased and disarranged and cross striation disappeared, with karyopyknosis or enlarged nuclear. At the same time interstitial reactive proliferation were also observed in DM group. Compared with Con group, the levels of blood glucose, HW/BW, MDA and IL-6 were higher (P<0.05) in DM group; while the levels of SOD and GSH were lower (P<0.05). The above indexes were all improved in IN group than those in DM group(P<0.05). Conclusions Insulin has the anti-inflammatory and anti-oxidative effects in myocardial cells in diabetic cardiomyopathy rats.
insulin; IL-6; oxidative stress; diabetes mellitus; cardiomyopathy
210024江苏省南京市,江苏省省级机关医院干部保健科
周辰,Email:zcly789@sina.com
R 587.2
A
10.3969/j.issn.1003-9198.2017.08.009
2016-03-25)

