红菇多糖对小鼠肝脏衰老的抑制效果
魏 杰, 张 潇, 张国坤, 万冬梅, 林景峰, 孙淑华
(1.辽宁大学 生命科学院, 辽宁 沈阳 110036; 2.辽宁仙人洞国家级自然保护区管理局, 辽宁 大连 116407)
红菇多糖对小鼠肝脏衰老的抑制效果
魏 杰1, 张 潇1, 张国坤1, 万冬梅1, 林景峰2, 孙淑华2
(1.辽宁大学 生命科学院, 辽宁 沈阳 110036; 2.辽宁仙人洞国家级自然保护区管理局, 辽宁 大连 116407)
研究红菇多糖对衰老昆明小鼠肝功能衰退的抑制作用。使用D -半乳糖建立衰老模型,并在此期间给予75 mg/L与150 mg/L红菇多糖饮水。8周后断颈处死,检测肝指数、血清和肝组织的谷胱甘肽过氧化物酶、超氧化物歧化酶活性及丙二醛含量,同时对肝组织Ca2+-ATPase活性及形态学进行分析。结果表明,8周内给予红菇多糖150 mg/L饮水时,小鼠肝指数、谷胱甘肽过氧化物酶、超氧化物歧化酶活性得到显著提高,丙二醛含量显著下降,小鼠肝功能衰退得到了显著抑制(p<0.05),肝脏的衰老及损伤也得到了有效抵制。
红菇多糖; 肝脏; 抗衰老

1 材料与方法
1.1 材料与试剂
粉柄红菇:采自辽宁仙人洞自然保护区,选择菌柄、伞盖完整的粉柄红菇。
超微量ATP酶(Ca2+-ATPase)测试盒、丙二醛(malondialdehyde,MDA)试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH -Px)检测试剂盒、SOD检测试剂盒,均购自南京建成生物工程研究所;D -半乳糖、体积分数4%多聚甲醛固定液,购自生工生物工程(上海)股份有限公司;体积分数95%的乙醇(分析纯),购自天津市大茂化学试剂厂。
1.2 仪器与设备
BSA223S型电子精密天平,德国赛多利斯公司;DS- 1型高速组织捣碎机,无锡沃信仪器有限公司;UV- 2700型紫外分光光度计,日本岛津公司;BCD- 218(KK22F66TI)型冰箱,德国西门子公司; CR- 22型高速冷冻离心机,日本日立公司;SHZ- 82A型气浴恒温振荡器,金坛市华城创威实验仪器厂; FE20型酸度计,梅特勒- 托利多公司。
1.3 实验方法
1.3.1 红菇多糖的制备
将干燥的粉柄红菇子实体用研磨机粉碎,过60目筛,得到粉柄红菇干粉,称取红菇干粉100 g,加入500 mL圆底烧瓶中,按照液料比(mL/g)3∶1,加入体积分数为80%的乙醇在80 ℃恒温水浴锅中提取90 min,再抽滤去除杂质,使用Sevage法去除蛋白,最后将滤渣放在干净的不锈钢托盘中,放入60 ℃烘箱中烘干备用,纯度为81.3%。
1.3.2 红菇多糖含量测定
使用硫酸- 苯酚法测定。首先制备标准曲线:制备葡萄糖0.1 mg/mL的标准溶液,精确吸取0.2,0.4,0.8,1.2,1.6,2.0 mL的葡萄糖标准溶液于10 mL具塞刻度试管中,每管用蒸馏水补齐至2 mL,加入体积分数5%的苯酚1 mL,迅速混匀后再加入体积分数98%的浓硫酸 5 mL,摇匀后放置至室温。待溶液冷却后,以蒸馏水作为空白对照调零,使用紫外分光光度计在490 nm波长处测定其吸光度。以葡萄糖标准溶液质量浓度ρ(mg/mL)为横坐标,以吸光度A为纵坐标,绘制标准曲线,并计算标准曲线方程。将红菇多糖样品稀释至合适倍数,吸取2.0 mL样品稀释液,按照上述步骤操作,在490 nm波长处测定其吸光度,以标准曲线方程计算红菇多糖含量。
1.3.3 小鼠模型的建立与分组
参照文献[13],将52只昆明(KM)小鼠随机均分为正常组(13只)和实验组(模型组、红菇多糖75 mg/L饮水组和150 mg/L饮水组,每组13只)。实验组背部皮下注射D -半乳糖150 mg/(kg·d)建立衰老模型(连续8周),每周称量体重。其中正常组和模型组正常饮水。8周结束后,禁食12 h,称取小鼠体重,眼球取血,处死小鼠后取肝脏称重并分别于-80 ℃冻存,用体积分数4%的多聚甲醛固定。
1.3.4 小鼠肝指数的计算
肝指数即为小鼠肝脏质量(g)与其体重(g)的比值,将每只小鼠的肝脏质量与体重对应,按照公式(1)进行计算:
肝指数=小鼠肝脏质量/小鼠体重×100%。
(1)
1.3.5 小鼠血清GSH -Px、SOD活性及MDA含量的测定
参照文献[14-15],从小鼠眼球取出的血液,在4 ℃静置1 h后,以3 500 r/min于4 ℃离心10 min,上清液即为血清。按照试剂盒操作方法测定血清中GSH -Px与SOD活性及MDA含量。
1.3.6 小鼠肝组织GSH -Px、SOD、Ca2+-ATPase活性及MDA含量的测定
取肝组织1 g,加入9 mL的生理盐水,制成0.1 g/mL匀浆。按照试剂盒操作方法分别测定GSH -Px、SOD、Ca2+-ATPase[16]活性及MDA含量。
1.3.7 小鼠肝脏的HE染色
参照文献[17],取小鼠肝脏用体积分数4%多聚甲醛固定,常规石蜡包埋切片,切片常规用二甲苯脱蜡,经各级乙醇至水洗,苏木素染色5 min,自来水冲洗,盐酸乙醇分化30 s,自来水浸泡15 min,置伊红液2 min,常规脱水、透明、封片。用显微镜观察并拍照。
1.4 数据处理
采用Graphpad Prism 5绘图并进行实验数据分析,采用多因素方差分析和多重比较分析,当p<0.05时为显著性差异,p>0.05时差异不显著。
2 结果与分析
2.1 红菇多糖对小鼠肝指数的影响
肝指数可以反映肝的病变情况,若外物使肝脏受损,肝指数将会发生明显下降[12]。正常组肝指数为正常值,表明肝脏未受损(见图1)。模型组与正常组相比,其肝指数下降了39.24%,差异显著(p<0.05),说明模型组建模成功。红菇多糖高剂量组肝指数与模型组肝指数相比,其肝指数比模型组高出37.93%,具有显著性差异(p<0.05),说明400 mL 150 mg/L红菇多糖饮水能显著地抑制小鼠肝脏衰老。而红菇多糖低剂量组与模型组相比差异不显著(p>0.05)。

*表示与正常组对比,#表示与模型组对比,** 和##表示p<0.05。图1 8周后各组小鼠的肝指数Fig.1 Liver index of mice
2.2 红菇多糖对血清和肝组织中GSH -Px活性的影响
GSH -Px是广泛存在于机体内的、一种重要的催化过氧化物分解的酶。在机体中,清除自由基和体内抗氧化物质与酶活性呈正相关[14]。模型组小鼠血清和肝组织中GSH -Px活性明显低于正常组,差异达到显著水平(p<0.05),说明D -半乳糖致使模型组小鼠清除自由基能力降低,从而使小鼠体内GSH -Px活性降低(见图2)。与模型组相比,红菇多糖高剂量组小鼠血清和肝组织中GSH -Px活性分别提高了48.66%,40.39%,效果显著(p<0.05),说明高剂量红菇多糖可有效地激活GSH -Px,以清除体内的自由基等氧化性物质。而红菇多糖低剂量组的GSH -Px活性与模型组没有显著性差异。

*表示与正常组对比,#表示与模型组对比,**和##表示p<0.05。图2 红菇多糖对小鼠血清和肝脏GSH -Px活性的影响Fig.2 Effects of Russula polysaccharide on hepatic and serum GSH -Px contents
2.3 红菇多糖对血清和肝组织中SOD活性的影响


*表示与正常组对比,#表示与模型组对比,**和##表示p<0.05。图3 红菇多糖对小鼠血清和肝脏SOD活性的影响Fig.3 Effects of Russula polysaccharide on hepatic and serum SOD contents
2.4 红菇多糖对血清和肝组织中MDA含量的影响
机体中的氧自由基通过攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化作用,形成MDA等脂质过氧化物。MDA含量的高低间接地反映了机体细胞受自由基攻击的严重程度,MDA含量越高,说明机体受到自由基的攻击越严重[14]。模型组小鼠血清MDA含量显著高于正常组(p<0.05),如图4。说明经D -半乳糖诱导,小鼠体内脂质过氧化物明显增多。与模型组相比,红菇多糖高剂量组小鼠血清和肝中MDA含量分别降低了33.86%,37.63%,效果显著(p<0.05)。表明红菇多糖高剂量组能有效抑制D -半乳糖导致的衰老小鼠体内脂质过氧化。

*表示与正常组对比,#表示与模型组对比,** 和##表示p<0.05。图4 红菇多糖对小鼠血清和肝脏MDA含量的影响Fig.4 Effects of Russula polysaccharide on hepatic and serum MDA contents
2.5 红菇多糖对肝组织中Ca2+-ATPase活性的影响
Ca2+-ATPase是细胞膜上的重要转运蛋白,其活性是反映细胞活力以及相关蛋白和机体氧化程度的重要标准之一,储藏过程中细胞活性不断下降、氧化程度不断升高,这会导致Ca2+-ATPase 活性下降[16]。模型组的Ca2+-ATPase活性显著低于正常组(p<0.05),说明实验在小鼠Ca2+-ATPase方面建模成功(见图5)。与模型组相比,红菇多糖高剂量组中的Ca2+-ATPase活性分别提高了48.23%,41.17%,效果较为显著(p<0.05)。

*表示与正常组对比,#表示与模型组对比,**和##表示p<0.05。图5 红菇多糖对小鼠肝脏Ca2+ -ATPase活性的影响Fig.5 Effects of Russula polysaccharide on liver Ca2+ -ATPase activities
2.6 红菇多糖对小鼠肝脏苏木精- 伊红染色的影响
小鼠肝脏的苏木精- 伊红染色(hematoxylin -eosin staining,HE)结果表明,电镜下正常组肝小叶及肝细胞结构正常,肝索排列整齐、中央静脉无异常;模型组肝细胞体积缩小、细胞核体积缩小,肝细胞之间连接松散,部分肝细胞可见轻度脂肪变性,肝窦轻度扩张;红菇多糖高剂量组肝细胞及细胞核结构、大小及其染色未见明显异常,个别肝细胞胞浆内可见脂滴颗粒,肝窦无扩张;红菇多糖低剂量组肝细胞及细胞核体积增大,部分肝细胞可见脂肪变性,少量肝细胞胞浆嗜酸性增强,肝索结构未见明显异常(见图6)。
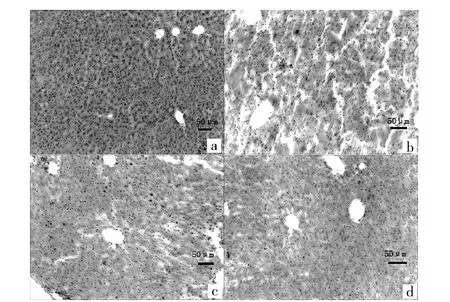
a、b、c、d分别为正常组、模型组、红菇多糖高剂量组、红菇多糖低剂量组。图6 电镜下小鼠肝脏的HE染色图片Fig.6 Representative photography of hematoxylin -eosin staining of liver in mice
3 结 论
与模型组相比,150 mg/L浓度的红菇多糖使昆明小鼠的体重明显增加,血清和肝中的GSH -Px、SOD活性显著增强,MDA含量显著降低,Ca2+-ATPase活性显著增强,表明红菇多糖对小鼠肝功能衰退有显著(p<0.05)抑制和推迟效果。
[1] 宋斌,李泰辉,吴兴亮,等. 中国红菇属种类及其分布[J]. 菌物研究,2007(1):20-42. SONG B,LI T H,WU X L, et al. Known species ofRussulafrom China and their distribution[J]. Journal of Fungal Research,2007(1):20-42.
[2] 陈旭健,甘耀坤,吴慧慧,等. 红菇子实体对小鼠血糖、血脂的影响[J]. 食品科技,2008,33(4):237-239. CHEN X J, GAN Y K, WU H H, et al. The effect ofRussulaon rats’ serum glucose and serum lipid[J]. Food Science and Technology,2008,33(4):237-239.
[3] 王青云,石木标. 中国红菇的研究现状与展望[J]. 中国食用菌,2004(4):10-12. WANG Q Y, SHI M B. Present and future ofRussulain China [J]. Edible Fungi of China,2004(4):10-12.
[4] CHEM H Y, YEN G C. Antioxidant activity and free radical -scavenging capacity of extracts from guava (PsidiumguajavaL.) leaves[J]. Food Chemistry, 2007, 101(2):686-694.
[5] ZHAO W, JIANG X, DENG W, et al. Antioxidant activities ofGanodermalucidumpolysaccharides and their role on DNA damage in mice induced by cobalt -60 gamma -irradiation[J]. Food and Chemical Toxicology, 2012, 50(2):303-309.
[6] PAN K, JIANG Q, LIU G, et al. Optimization extraction ofGanodermalucidumpolysaccharides and its immunity and antioxidant activities[J]. International Journal of Biological Macromolecules, 2013, 55(2):301-306.
[7] LI X, WANG Z, WANG L, et al.Invitroantioxidant and anti -proliferation activities of polysaccharides from various extracts of different mushrooms[J]. International Journal of Molecular Sciences, 2012, 13(5):5801-5817.
[8] 贺婷. 正红菇多糖结构分析及其生物活性研究[D].广州:华南理工大学,2015.
[9] 杜志强,任大明,石皎,等. 猴头菌丝多糖抗氧化功能研究[J]. 食品研究与开发,2007(4):105-107. DU Z Q, REN D M, SHI J, et al. Studies on antioxidation function ofHericiumerinaceuspolysaccharide of mycella[J].Food Research and Development,2007(4):105-107.
[10] 周国亮,宋翼升,辛艳飞,等. 灵芝多糖抗氧化和抗肿瘤活性的研究进展[J]. 中华中医药学刊,2014(5):1002-1005. ZHOU G L, SONG Y S, XIN Y F, et al.Present on antioxygen activity ofGanodermalucidumpolysaccharides [J]. Chinese Archives of Traditional Chinese Medicine,2014(5):1002-1005.
[11] 邢增威. 红菇多糖的提取及体外抗氧化抗肿瘤性质研究[D].广州:华南理工大学,2013.
[12] 高尚龙. 三种姬松茸多糖的抗氧化、抗衰老活性与结构研究[D].泰安:山东农业大学,2014.
[13] 文镜,贺素华,杨育颖,等. 保健食品清除自由基作用的体外测定方法和原理[J]. 食品科学,2004(1):190-195. WEN J, HE S H, YANG Y Y, et al.Invitroexperimental methods and principles for the elimination of free radicals by health functional foods[J]. Food Science,2004(1):190-195.
[14] 赵丰丽,张云鸽,宁良丹. 红菇多糖的提取分离及其抗氧化活性的研究[J]. 中国酿造,2009(11):98-101. ZHAO F L, ZHANG Y G, NING L D, et al. Extraction, isolation and antioxidant activity ofRussulapolysaccharide[J]. China Brewing,2009(11):98-101.
[15] REIS F S, MARTINS A, BARROS L, et al. Antioxidant properties and phenolic profile of the most widely appreciated cultivated mushrooms: a comparative study betweeninvivo, andinvitro, samples[J]. Food and Chemical Toxicology, 2012, 50(5):1201-1207.
[16] 王凤杰,陈显兵,张书毓,等. 富硒绿茶对大鼠非酒精性脂肪肝Ca2+-ATPase活性和表达的影响[J]. 食品科学,2014(21):219-222. WANG F J, CHEN X B, ZHANG S Y, et al. Effect of selenium -enriched green tea on activity and expression of sarco(endo) plasmic reticulum Ca2+-ATPase in rats with nonalcoholic fatty liver disease [J]. Food Science, 2014(21):219-222.
[17] 王君巧,聂少平,余强,等. 黑灵芝多糖对免疫抑制小鼠的免疫调节和抗氧化作用[J]. 食品科学,2012(23):274-277. WANG J Q, NIE S P, YU Q, et al. Immune modulation of polysaccharides fromGanodermaatrumon immuno -suppressed mice[J]. Food Science,2012(23):274-277.
(责任编辑:张逸群)
Inhibitory Effect ofRussulafarinipesRomell Polysaccharide on Mice Liver Senescence
WEI Jie1, ZHANG Xiao1, ZHANG Guokun1, WAN Dongmei1, LIU Jingfeng2, SUN Shuhua2
(1.SchoolofLifeScience,LiaoningUniversity,Shenyang110036,China; 2.LiaoningXianrendongNationalNatureReserveAdministrationBureau,Dalian116407,China)
Effects ofRussulapolysaccharide on mice hepatic insufficiency were investigated in this study. The senile model mice were established by D -galactose and mice were treated by 75 mg/L and 150 mg/LRussulapolysaccharide. After 8 weeks, liver index, serum and hepatic GSH -Px, SOD activity, MDA contents, Ca2+-ATPase activity and hematoxylin -eosin staining of mice were determined. The results showed that the treatment of 150 mg/LRussulapolysaccharide could increase liver index, GSH -Px and SOD activity, and decrease the MDA content, which could inhibit the aging of liver.
Russulapolysaccharide; liver; anti -aging
10.3969/j.issn.2095 -6002.2017.03.007
2095 -6002(2017)03 -0050 -05

魏杰,张潇,张国坤,等. 红菇多糖对小鼠肝脏衰老的抑制效果[J]. 食品科学技术学报,2017,35(3):50-54.
WEI Jie, ZHANG Xiao, ZHANG Guokun, et al. Inhibitory effect ofRussulafarinipesRomell polysaccharide on mice liver senescence[J]. Journal of Food Science and Technology, 2017,35(3):50-54.
2016 -09 -21
辽宁仙人洞国家级自然保护区大型真菌资源调查项目; 辽宁省教育厅教学研究项目(LYB201611); 辽宁省社会科学规划基金资助项目(L15BJY029)。
魏 杰, 女, 副教授, 博士, 主要从事生物活性物质及其功能方面的研究。
TS201.6; R151.3; S646
A

