油茶粕中黄酮化合物的分离鉴定及抗氧化性研究
高进勇,高永平,余炎炎,李 欢,卢志萍,卜付军,班龙海
(1.信阳学院 理工学院,河南信阳 464000;2.信阳市林业科学研究所,河南信阳 464031;3.河南省国有泌阳马道林场,河南泌阳 463721)
油茶粕中黄酮化合物的分离鉴定及抗氧化性研究
高进勇1,高永平1,余炎炎1,李 欢1,卢志萍1,卜付军2,班龙海3
(1.信阳学院 理工学院,河南信阳 464000;2.信阳市林业科学研究所,河南信阳 464031;3.河南省国有泌阳马道林场,河南泌阳 463721)
为了探索油茶粕中黄酮化合物的分子组成及其抗氧化活性,本研究运用优化的分离纯化方法对油茶粕中黄酮进行粗提和HZ816大孔吸附树脂富集纯化,然后再经硅胶柱对其黄酮化合物层析,得到2种黄酮化合物,分别记为化合物Ⅰ和化合物Ⅱ。随后利用核磁共振、质谱、红外和紫外光谱对上述分离得到的2种黄酮化合物进行结构鉴定。结果表明:这2种物质分别为山奈酚3-O-[2-O-β-D-木糖-6-O-α-L-鼠李糖]-β-D-葡萄糖苷(化合物Ⅰ)和山奈酚3-O-[2-O-β-D-半乳糖-6-O-α-L-鼠李糖]-β-D-葡萄糖苷(化合物Ⅱ)。对分离的黄酮化合物采用 1,1-二苯基-3-硝基苯肼自由基清除法(DPPH法)、邻苯三酚自氧化法在体外进行抗氧化实验,结果显示总黄酮、化合物Ⅰ和化合物Ⅱ清除DPPH自由基半抑制浓度(IC50)分别为0.44、1.88、2.41 mg/mL,清除超氧阴离子IC50分别为1.38、1.13、1.29 mg/mL。
油茶粕,黄酮苷,分离纯化,结构,抗氧化
黄酮类化合物是一类生物活性很强的物质[1]。大量研究表明,黄酮类物质具有抗菌、抗病毒、抗发炎、抗过敏以及血管舒张作用[2-4];此外,它还能抑制脂质过氧化作用(LPO)、多种酶的活性、血小板凝聚、毛细管渗透性以及脆性;黄酮的此类效果大都与它的抗氧化性相关[5]。油茶粕是油茶籽提取油脂之后的副产物,含有多种有效成分,其中0.6%~1.71%[6]为山奈酚、柚皮素及其衍生物等黄酮类生物活性物质[7-9]。研究者们对茶饼粕中的这些活性成分进行分析分离研究,并运用于饲料开发等方面,但由于其分离提纯等方法的低效性,其利用层次依然较低。
从油茶粕中提取分离纯化黄酮类化合物的常规方法是溶剂提取、热回流提取、超声波辅助提取和微波辅助提取[10]。对于油茶粕黄酮的分离纯化多采用中压柱层析法,制备型高效液相色谱,高速逆流色谱分离纯化等进行分离纯化[11]。陈虹霞[12]等采用茶籽饼粕经过乙醇水溶液提取,浸膏采用甲醇溶解并冷冻后去除不溶物,通过中低压色谱制备得到黄酮苷类化合物,再进一步通过高效液相制备得到黄酮苷化合物Ⅰ和Ⅱ;侯留鑫[13]采用醇提,提取液冷藏静置12 h后过滤,经浓缩后进行大孔吸附树脂纯化,得茶叶籽黄酮。此后进行ODS柱分离,然后进行两次Sephadex LH-20分离,用40%体积分数的甲醇洗脱,得到纯度为98%的茶叶籽黄酮单体。这些提取纯化方法步骤繁琐且提取率较低,因此,为了改进简化油茶粕中黄酮类化学成分的提取方法,本文利用大孔吸附树脂、硅胶柱层析、结晶方法对油茶粕中的黄酮类化合物进行分离纯化,采用高效液相、质谱、红外光谱和核磁共振等方法对黄酮进行鉴定,并对提取纯化的黄酮进行体外抗氧化分析研究,以期得到更高的分离提取率,并为提高其医药方面的应用范围,提高油茶的综合开发利用价值提供技术支撑。
1 材料与方法
1.1 材料与仪器
油茶粕 河南绿达山茶油股份有限公司提供;黄酮标准品 信阳市食品药品监督管理局提供;大孔吸附树脂HZ816 郑州华溢科技新材料有限公司;柱层析硅胶 200~300目 青岛海洋化工有限公司;提取过程中:水 超纯水,乙醇 食用级;液相色谱试剂:甲醇 色谱纯,天津康科德科技有限公司;乙酸乙酯、甲醇,乙醇等均为分析纯,天津博迪化工股份有限公司。
高效液相色谱仪 岛津公司;依利特C18(Φ4.6 mm×200 mm,4 μm)色谱柱 大连依利特有限公司;低压玻璃层析柱(Φ1.0 cm×40 cm,Φ1.0 cm×50 cm) 上海沪西分析仪器有限公司;X-4显微熔点测定仪 上海精密科学仪器有限公司;傅里叶红外光谱 美国PE公司;LC-MS液质联用仪 日本岛津公司;核磁共振仪,400 MHz 德国Braker公司。
1.2 实验方法
1.2.1 油茶粕黄酮的薄层色谱法(TLC)定性分析 将硅胶H预制板(10 cm×10 cm,0.2 mm)置于110 ℃烘箱中活化1 h,取出后点样5 μL,以乙酸乙酯:甲醇:水(100∶35∶10,v/v)为展开剂,展开距离8 cm,将硅胶板在碘缸中进行显色,计算其Rf值,计算公式为:Rf=薄层色谱法中原点到斑点中心的距离与原点到溶剂前沿的距离的比值。
1.2.2 油茶粕黄酮高效液相色谱法(HPLC)测定 按照色谱柱为依利特C18色谱条件,在5 min内流动相甲醇浓度从20%上升到45%,然后45%甲醇浓度保持10 min;柱温条件为30 ℃,流速为1.0 mL/min,进样量10 μL,检测波长266 nm;以黄酮标准品为参照。
标准曲线制作:精密称取黄酮标准品5 mg,用甲醇溶解后定容至100 mL,配制浓度为2、4、6、8、10 μg/mL。进样至HPLC检测,以浓度(X)为横坐标,峰面积(Y)为纵坐标制作黄酮的标准曲线,黄酮的回归方程为:Y=2.26×106X+1731(R2=0.9996)。测定样品时采用归一化法计算样品中黄酮含量。
黄酮得率(%)=样品浓度×稀释倍数×提取总体积/油茶粕干重×100
样品纯度(%)=样品浓度×稀释倍数×体积/样品干重×100
1.2.3 油茶粕总黄酮的提取及分离 准确称量100.0 g油茶粕,用10倍量95%乙醇60 ℃加热提取2次,每次2 h,提取液减压回收乙醇至无醇味,加适量超纯水,配制成一定浓度的油茶粕黄酮粗提液。应用1.0 cm×40 cm的凝胶层析柱对油茶粕粗提物经HZ816大孔吸附树脂进行初步的分离纯化,动态吸附工艺条件(以5.0 mg/mL黄酮,流速1.0 BV(床层体积)/h,上柱量10.5 BV)和动态洗脱条件(体积分数为30%乙醇洗脱油茶粕总黄酮,洗脱流速1.0 BV/h,洗脱液体积4 BV)。收集30%洗脱液浓缩冻干得到油茶粕总黄酮。
1.2.4 硅胶柱层析纯化油茶粕黄酮 精确称取经大孔吸附树脂纯化后的总黄酮冻干品1.0 g,加入少量甲醇溶解进行硅胶柱层析,以硅胶(200~300目)湿法装柱分离纯化。层析基本条件:上样量1/45(g样品/g硅胶),以乙酸乙酯:甲醇:水(200∶35∶10,v/v)为洗脱液,以 0.8 BV/h的流速洗脱、分部收集洗脱剂。以TLC定性分析,按照方法1.2.1进行TLC法检测洗脱液,合并Rf值相同的洗脱液,得到2个黄酮组分:化合物Ⅰ和化合物Ⅱ。化合物Ⅱ直接由洗脱液经甲醇结晶得到。化合物Ⅰ需重复一次硅胶柱层析,收集洗脱液经甲醇结晶得到。
1.2.5 水解反应 称取化合物Ⅰ和化合物Ⅱ各200 mg,加入10 mol/L的盐酸溶液10 mL,水浴加热4 h,过滤,得苷元(沉淀)和糖(溶液)。沉淀经TLC(展开剂为氯仿∶甲醇∶水=12∶1∶0.3),母液用NaOH调至中性,过滤,经TLC(展开剂为正丁醇∶丙酮∶水=4∶5∶1),用茴香醛-硫酸喷雾显色。
区块链技术的应用对于信用风险防范有利也有弊,优势具体表现在区块链技术共识机制的去中心化特性更能灵活应对网络攻击,黑客的一次成功攻击必须篡改区块链中51%以上的节点数据,区块链中的节点越多数据越难篡改。缺点在于城市商业银行作为地方法人银行机构,市场把控能力相对全国性商业银行而言较弱,故而形成的银行联盟较小,需慎重设立节点银行白名单制。如在区块链票链业务中制定银行承兑汇票承兑人白名单制度,初步圈定可信任节点银行。如针对城市商业银行主要信贷服务对象为中小企业,其普遍具有规模小、财务管理制度不规范、经营状态相对不稳定的特点,区块链技术的分布式记账方式可清晰跟踪企业的每一交易,实现有效监督。
1.2.6 利用红外、质谱以及核磁共振鉴定油茶粕黄酮的结构 根据薄层色谱(TLC)以及 HPLC 结果的初步推断,进行初步鉴定。再用核磁共振、质谱、红外进行结构鉴定。
红外光谱分析:波数测量范围为400~4000 cm-1,光谱分辨率为4 cm-1,信号扫描累加16次。实验时,分别取化合物Ⅰ和化合物Ⅱ少许,加入200倍量的溴化钾,在玛瑙乳钵中混合均匀,研磨,将混合粉末转移到模具中,在压片机上压片,放入样品室,分别测定各自红外吸收光谱图。
质谱测定条件:样品注射流速:240 μL/min;雾化气流速:7.0 L/min;雾化压力,34.5 kPa;雾化温度:350 ℃;毛细管电压为3.5 kv,扫描范围:m/z 100~1500。
核磁共振分析:溶剂DMSO-d6,内标为四甲基硅烷(TMS),测定温度 303 K。氢谱测定频率为400 MHz,碳谱测定频率为125 MHz。
1.2.7 油茶粕黄酮体外抗氧化能力实验 以最优工艺制备的油茶粕黄酮(油茶粕总黄酮、化合物Ⅰ和化合物Ⅱ)为原料进行体外抗氧化活性实验。分别配制质量浓度为0.05、0.1、0.2、0.5、1.0、1.5、2.0 mg/mL的油茶粕黄酮,采用DPPH法测定DPPH自由基清除率[14]。分别配制质量浓度为0.5、0.75、1.0、1.25、1.5、1.75、2.0 mg/mL的油茶粕黄酮,采用邻苯三酚自氧化法测定超氧阴离子清除率[15]。将油茶粕黄酮的质量浓度对DPPH自由基、超氧阴离子的清除率作图并进行线性拟合,根据拟合的线性方程,当清除率为50%时所对应油茶粕黄酮的质量浓度即IC50,以IC50值作为评价油茶粕黄酮的抗氧化能力指标。
1.3 数据处理与分析方法
采用DPS软件、Origin8.0、Excel 2010进行实验数据处理、分析及绘图。
2 结果与分析
2.1 分离纯化
本实验所用的油茶粕中黄酮总含量为2.2 g/100 g茶粕,总黄酮提取量为1.9 g/100 g茶粕,油茶粕总黄酮得率为1.9%,经HZ816大孔吸附树脂及硅胶柱层析富集纯化后,其中化合物Ⅰ得率为0.87%,化合物Ⅱ得率为0.95%,按此条件制备的总黄酮纯度为85.2%。按照方法1.2.4得到2个黄酮组分:化合物Ⅰ和化合物Ⅱ,其Rf值分别为0.59(化合物Ⅰ)与0.38(化合物Ⅱ),经测定纯度分别达89.3%和92.5%,化合物Ⅱ在甲醇中结晶纯度达到98.4%。化合物Ⅰ经重复一次硅胶柱层析,经甲醇结晶,纯度达到95.3%。
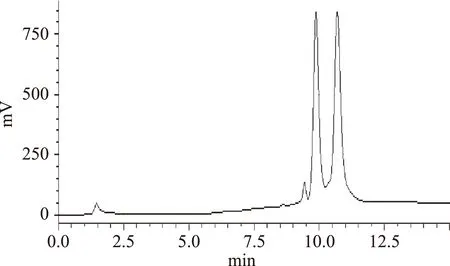
图1 总黄酮样品HPLC图谱Fig.1 HPLC spectra of total flavonoids

图2 化合物ⅠHPLC图谱Fig.2 HPLC spectra of compoundⅠ

图3 化合物ⅡHPLC图谱Fig.3 HPLC spectra of compoundⅡ

图4 化合物Ⅰ的红外光谱图Fig.4 FT-IR spectrum of compoundⅠ
2.2 黄酮单体的结构鉴定
由图4可知,3400.19 cm-1处吸收峰为黄酮分子中-OH的伸缩振动峰,2971.01 cm-1为苯环上C-H伸缩振动峰,1656.18cm-1处吸收峰为C-O的伸缩振动,1608.53,1505.20和1450.22 cm-1为苯环骨架伸缩振动信号,1359.77,1280.28,1209.19,1177.48,1066.52 cm-1处的吸收峰为C-O的伸缩振动峰,837.99 cm-1处的吸收峰为=C-H的面外变形振动峰,与文献报道一致[12,16-17]。
由图5质谱图谱给出ESI-MS分子离子峰m/z:765.3 [M+K],749.3 [M+Na],725.3 [M-H],以上数据与文献对照[6,10,12]一致,确定化合物Ⅰ的分子量为726。
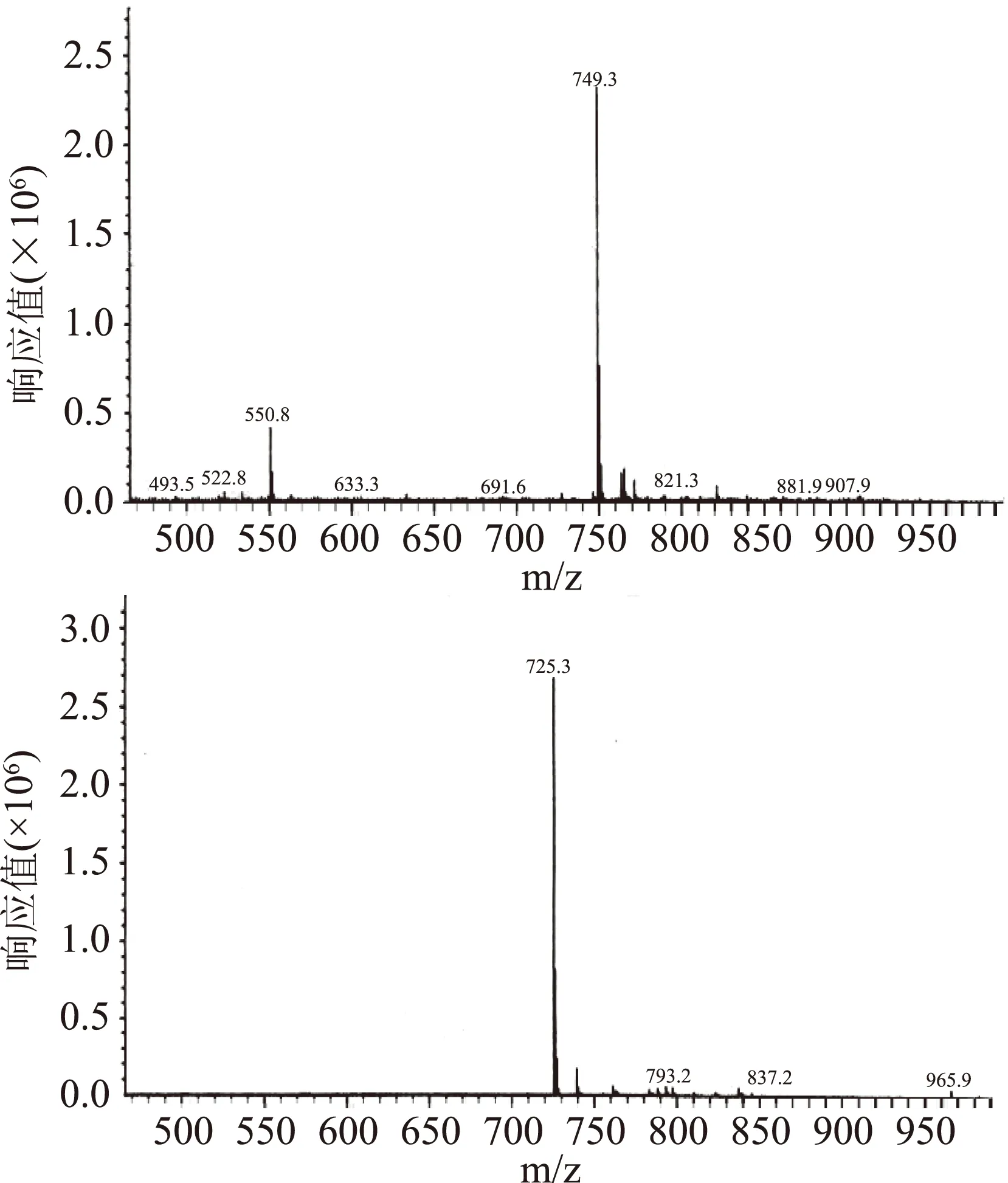
图5 化合物Ⅰ的质谱图Fig.5 ESI-MS spectrum of compoundⅠ
1H-NMR图谱在低场区出现了三个活泼酚羟基质子信号δ12.647(1 H,s);δ10.812(1 H,s),δ10.172(1 H,s),分别归属为5-OH,7-OH,4′-OH。1H-NMR还显示δ8.03和δ6.88(各2H,d,J=7.2Hz),分别归属于B环的2′、6′与3′、5′信号,δ6.19和δ6.4(d,1H,J=1.8 Hz)分别归属与A环的H-6和H-8。13C-NMR谱给出了30个碳信号,δ115.61和δ131.42的峰均比其他峰高,显示这两个峰分别可能是两个位移相同的C信号叠加而得到的,所以推测化合物Ⅰ有32个碳。其中有3个位移为δ100左右的碳信号,提示化合物可能含有两个六碳糖和一个五碳糖,苷元为15个碳信号。δ115.61和δ131.42这两个峰的C信号归属于B环的C-3′、5′和C-2′、6′。δ177.84为典型的羰基C-4信号。δ164.39,161.69,160.32,156.83,156.33,131.42,121.36,104.37,99.09和94.09分别归属于C-7,C-5,C-4′,C-9,C-3,C-2,C-1′,C-10,C-6,C-8信号。综上所述,苷元的化学位移值及特征与文献报导[12]山奈酚基本一致,只是C-2向低场位移了10.1 ppm,C-3和C-4向高场移动了3.25 ppm和1.3 ppm,由此可见山奈酚C-3位-OH可能与糖相连,且木糖等的苷化使C-2信号移动约10 ppm[18-19]。13C-NMR给出了δ98.60,100.86和104.86三个糖的端基C原子信号。1H-NMR给出了三个端基糖质子信号δ5.57,5.20和4.58。化合物Ⅰ经盐酸水解后用薄层色谱法检测有鼠李糖,葡萄糖。未检出木糖,可能水解不完全,但根据ESI-MS给出的分子量显示另外一个糖应为五碳糖-木糖。δ104.86,74.22,76.52,70.75,66.11分别归属于木糖的C-6,C-5,C-4,C-3,C-2,C-1;δ100.86,69.96,71.02,68.64,72.61,65.38分别归属鼠李糖的C-6,C-5,C-4,C-3,C-2,C-1;δ98.60,82.05,77.15,69.85,76.21,65.38分别归属葡萄糖的C-6,C-5,C-4,C-3,C-2,C-1。综合以上结果显示,13C-NMR和1H-NMR数值与文献对照[12,20-22],认为化合物Ⅰ结构为:山奈酚3-O-[2-O-β-D-木糖-6-O-α-L-鼠李糖]-β-D-葡萄糖苷。
由图6可知,3386.05 cm-1处有强吸收为黄酮分子中-OH的伸缩振动峰,2926.40 cm-1为苯环上C-H振动,1661.55 cm-1处吸收峰为C-O伸缩振动,1609.88 cm-1,1499.02 cm-1和1449.65 cm-1为苯环骨架伸缩振动信号,与文献报道[6,10,12]黄酮的特征吸收一致。
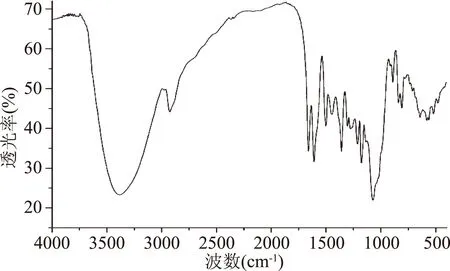
图6 化合物Ⅱ红外光谱图Fig.6 FT-IR spectrum of compoundⅡ
图7质谱图谱给出ESI-MS的准分子离子峰m/z:795.3 [M+K],779.3 [M+Na]和755.3 [M-H],确定化合物Ⅱ的分子量为756。
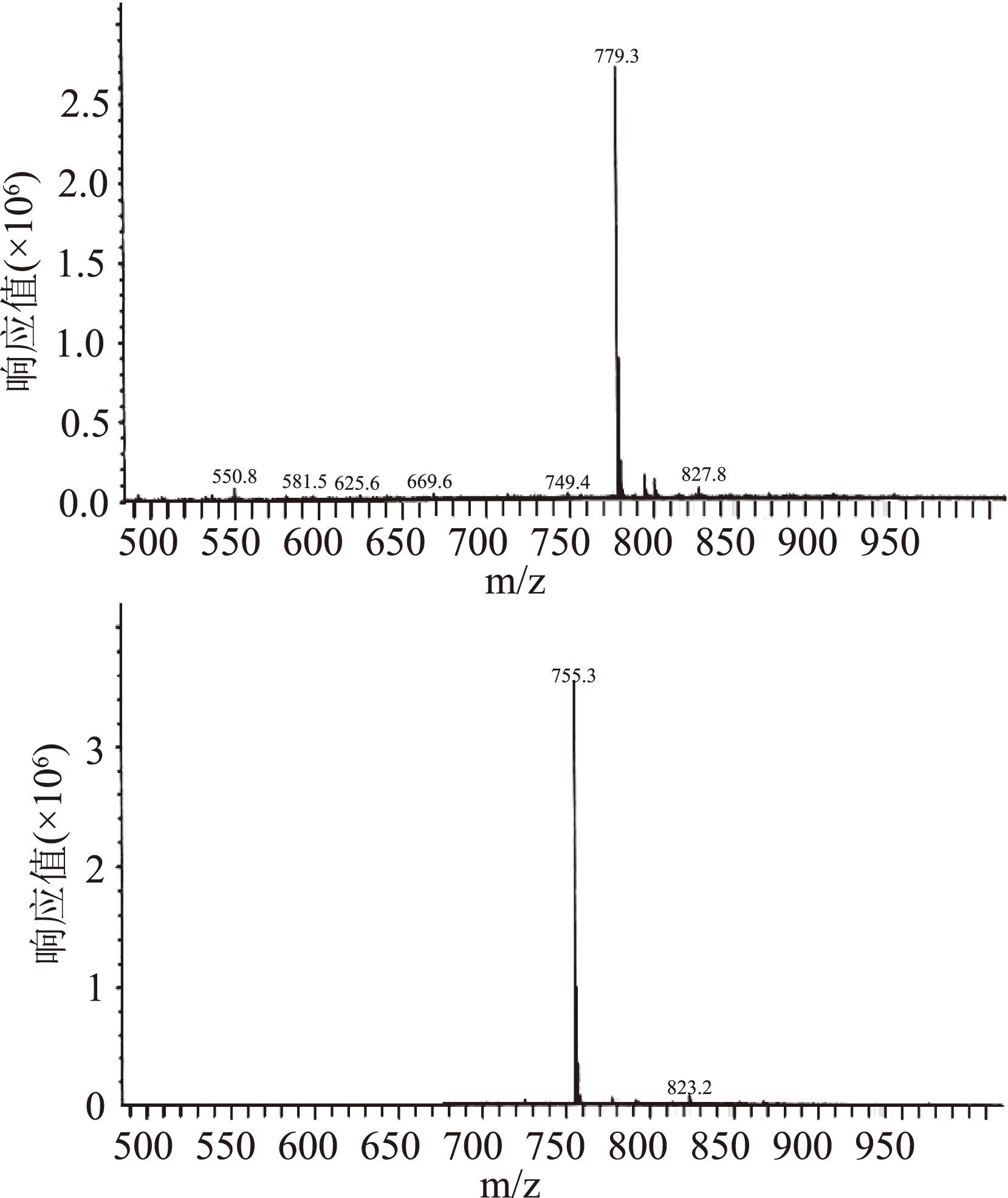
图7 化合物Ⅱ质谱图Fig.7 ESI-MS spectrum of compoundⅡ
1H-NMR(TMS,DMSO-d6,400 MHz)图谱低场区出现了三个活泼酚羟基质子信号δ12.639(1H,s),δ10.796(1H,s),δ12.639(1H,s),分别归属为5-OH,7-OH,4′-OH。这些信号在向样品中加重水(D2O)后即消失。1H-NMR还显示δ8.0和δ6.9(各2H,d,J=7.2Hz),分别归属于B环的2′、6′与3′、5′信号,δ6.19和δ6.4(d,1H,J=1.8 Hz)分别归属与A环的H-6和H-8。13C-NMR(TMS,DMSO-d6,400 MHz)谱给出了31个碳信号,δ115.08和δ131.05的峰均比其他峰高,显示这两个峰分别可能是两个位移相同的C信号叠加而得到的,所以推测化合物Ⅰ有33个碳。其中有3个位移为δ100左右的碳信号,提示化合物可能含有三个六碳糖,苷元为15个碳信号。δ115.08 ppm和δ131.05这两个峰的C信号归属于B环的C-3′、5′和C-2′、6′。δ177.68为典型的羰基C-4信号。δ162.84,159.85,158.47,156.16,133.31,157.90,121.43,102.09,98.72,和99.85分别归属于C-7,C-5,C-4′,C-9,C-3,C-2,C-1′,C-10,C-6,C-8信号。综上所述,苷元的化学位移值及特征与文献[12]山奈酚基本一致,只是C-2向低场位移了11 ppm,C-3和C-4向高场移动了3.29 ppm和1.18 ppm,由此可见山奈酚C-3位-OH可能与糖相连。化合物Ⅱ经盐酸水解后经薄层色谱法检测有半乳糖、鼠李糖和葡萄糖。综合质谱,红外及其核磁共振显示及文献值[16,20-23]认为化合物Ⅱ结构为:山奈酚3-O-[2-O-β-D-半乳糖-6-O-α-L-鼠李糖]-β-D-葡萄糖苷。
2.3 体外抗氧化能力
运用两种检测方法对油茶粕总黄酮,化合物Ⅰ和化合物Ⅱ进行DPPH自由基和超氧阴离子清除测定,结果表明其三种物质均具有较好清除效果,且浓度在0.05~1.0 mg/mL存在剂量效应关系。在DPPH清除实验中可以看出,在一定的浓度剂量下,油茶粕中的总黄酮和分离到的化合物Ⅰ和化合物Ⅱ均表现出良好的清除DPPH自由基的能力,但清除能力低于VC。油茶粕总黄酮在浓度为0.53 mg/mL时,对DPPH自由基的清除率达到了50%以上,清除率明显高于化合物Ⅰ和化合物Ⅱ,考虑油茶粕中还含有其他种类的黄酮,有待进一步分离。总黄酮、化合物Ⅰ和化合物Ⅱ清除DPPH自由基IC50分别为0.44、1.88、2.41 mg/mL。在对超氧阴离子清除实验中三者均具有很强的清除能力,且三者清除率相当。该结果表明油茶粕黄酮具有很强的抗氧化活性。总黄酮、化合物Ⅰ和化合物Ⅱ清除超氧阴离子自由基IC50分别为1.38、1.13、1.29 mg/mL,与DPPH自由基清除结果不同,可能与不同的评价方法机理不同有关。实验结果显示油茶粕黄酮具有很大的开发价值,今后可应用于抗氧化食品配料的开发。
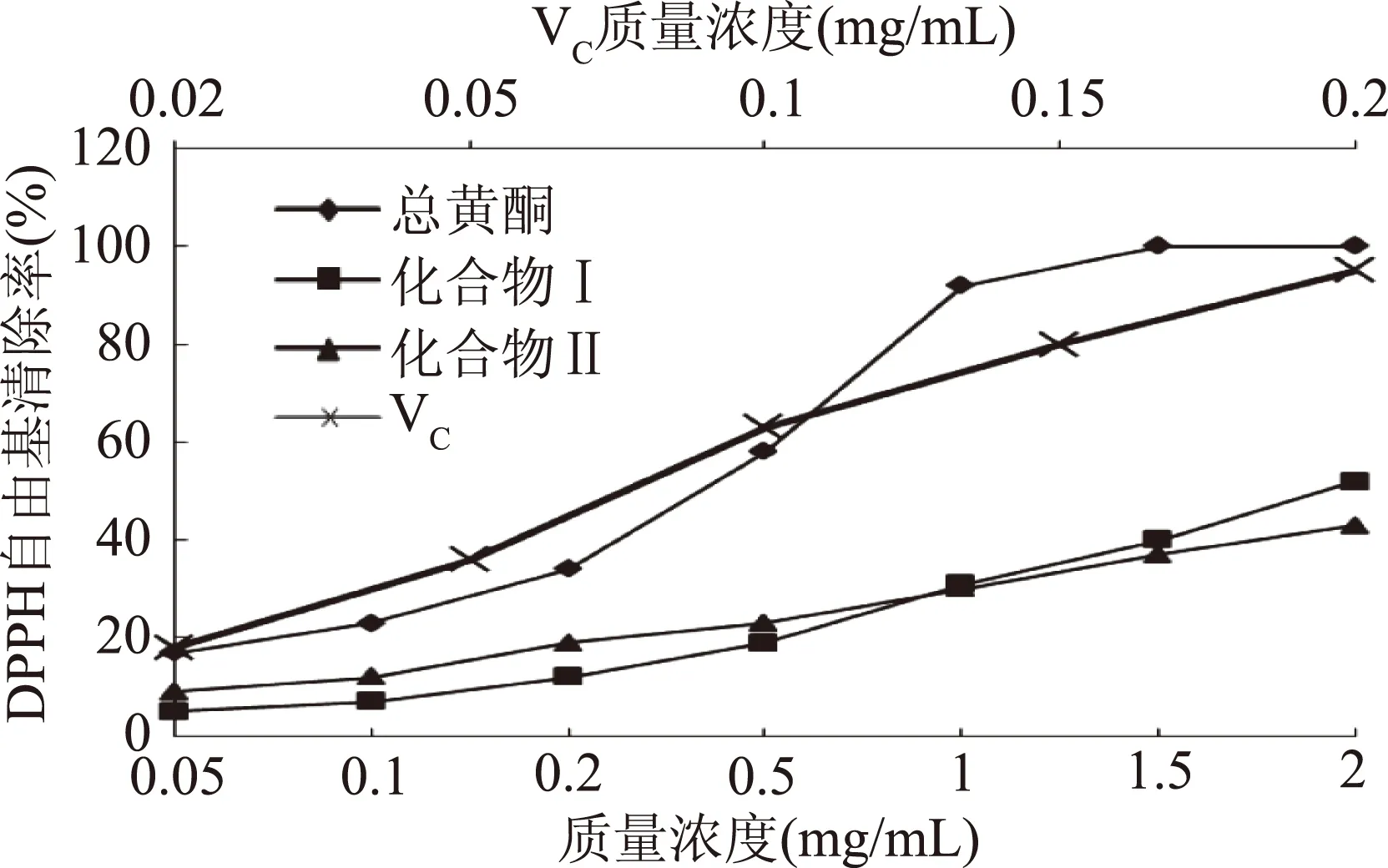
图8 油茶粕黄酮的DPPH·清除率Fig.8 DPPH free radical scavenging rate of total flavonoids,compounds Ⅰ and Ⅱ

图9 油茶粕黄酮的超氧阴离子清除率Fig.9 Superoxide anionfree radical scavenging rate of total flavonoids,compounds Ⅰ and Ⅱ
3 结论与讨论
油茶粕中含有丰富的黄酮类化合物,但油茶粕黄酮单体的制备报道较少。陈虹霞[12]等采用茶籽饼粕经过乙醇水溶液提取,浸膏采用甲醇溶解并冷冻后去除不溶物,通过中低压色谱制备得到黄酮苷类化合物,再进一步通过高效液相制备得到黄酮苷化合物Ⅰ和Ⅱ;王成章[24]等的专利公开了一种中压柱快速分离油茶饼粕中黄酮苷的制备方法,其采用乙醇提取中压柱层析加高效液相色谱制备得到纯度95%以上的黄酮苷单体两个。本实验通过研究油茶粕黄酮化合物的醇提及大孔吸附树脂富集,硅胶柱层析分离纯化,得到化合物Ⅰ和化合物Ⅱ单体。采用红外,质谱,核磁共振手段对化合物Ⅰ和化合物Ⅱ进行结构鉴定,这2种物质分别为山奈酚3-O-[2-O-β-D-木糖-6-O-α-L-鼠李糖]-β-D-葡萄糖苷(化合物Ⅰ)和山奈酚3-O-[2-O-β-D-半乳糖-6-O-α-L-鼠李糖]-β-D-葡萄糖苷(化合物Ⅱ)。本实验不需要大型精密设备,操作简单,能有效的对油茶粕中活性成分黄酮化合物进行分离,有望为进一步放大实验和工业化生产提供了重要依据。
李利敏等[25]采用 HPLC 法分析测定了不同品种油茶蒲提取物多酚类物质组成,发现不同品种之间酚类物质组成差别比较大。本实验初步发现油茶粕黄酮对DPPH自由基和超氧阴离子自由基均有较强的清除能力,总黄酮、化合物Ⅰ和化合物Ⅱ清除DPPH自由基IC50分别为0.44、1.88、2.41 mg/mL,清除超氧阴离子自由基IC50分别为1.38、1.13、1.29 mg/mL。实验结果期望为其构效关系的研究奠定基础;为油茶粕黄酮在食品和药品领域的开发提供参考依据。
[1]张鞍灵,高锦明,王姝清.黄酮类化合物的分布及开发利用[J].西北林学院学报,2000,15(1):69-74.
[2]肖燕,林海敏,吴秋平,等.油茶枯饼中黄酮类化合物的提取及抗氧化活性研究[J].林业实用技术,2011,(9):52-53.
[3]李姣娟,龚建良,周尽花,等.油茶叶总黄酮的提取及其抗氧化活性的研究[J].食品研究与开发,2008,29(12):93-96.
[4]肖新生,张敏,袁先友,等.油茶叶中黄酮类物质的提取及纯化工艺研究[J].中国食品添加剂,2012,(4):93-97.
[5]覃佐东,全沁果,敖艳,等.油茶不同部位黄酮的提取及活性研究进展[J].科技通报,2016,32(7):67-71.
[6]罗永明,李斌,谢一辉.油茶化学成分的研究[J].中草药,2003,34(2):117-118.
[7]江和源,柯昌强,王川丕,等.茶籽饼粕中黄酮苷的HPLC分析、制备与MS鉴定[J]. 茶叶科学,2005,25(4):289-294.
[8]曹清明,邬靖宇,钟海雁,等.油茶叶中黄酮的超声辅助提取及其抗氧化活性研究[J]. 食品与机械,2015,(3):162-166.
[9]Li Bo,Xu Yi,Jin Yuxia,et al. Response surface optimization of supercritical fluid extraction of kaempferol glycosides from tea seed cake[J]. Industrial Crops and Products,2010,32(2):123-128.
[10]俞斌.油茶枯饼中天然抗氧化剂的提取和筛选[D].南昌:南昌航空大学,2008.
[11]陈力.茶饼粕黄酮苷的提取分离、化学结构表征及生物活性研究[D].南昌:南昌大学,2011.
[12]陈虹霞,王成章,叶建中,等.油茶饼粕中黄酮苷类化合物的分离与结构鉴定[J].林产化学与工业,2011,31(1):13-16.
[13]侯留鑫,王华清,郑铁松,等.一种新型茶叶籽黄酮单体的分离鉴定及其抗氧化活性[J]. 食品科学,2013,34(21):115-120.
[14]顾玮蕾,王春丽.六种中药水提物体外抗氧化活性研究[J].食品工业科技,2010,31(11):190-192.
[15]郭雪峰,岳永德,汤锋,等.用清除超氧阴离子自由基法评价竹叶提取物抗氧化能力[J].光谱学与光谱分析,2008,28(8):1823-1826.
[16]李少魁,亮少伟,陈忠良,等.黄酮类化合物-O-甙的13CNMR谱[J].波谱学杂志,1998,15(5):473-484.
[17]贺波,李小定,彭定祥,等. 苎麻叶中黄酮类化合物的提取工艺研究[J].食品工业科技,2010,31(10):259-262.
[18]王玲琼,徐巧林,董丽梅,等. 油茶果壳化学成分研究[J].热带亚热带植物学报,2017,(1):81-86.
[19]Toshikazus,Jiroa,Atsukoy,et al.Two flavonol glycosides from seeds of Camellia sinensis[J].Phytochemistry,1991,30(3):991-995.
[20]姚新生,吴立军编.天然药物化学(第四版)[M].北京:人民卫生出版社,2003:235-250.
[21]桑圣民,劳爱娜.中药王不留行化学成分的研究(Ⅱ)[J].中草药,2000,31(3):1-4.
[22]Chen Junghui,Liu Bingchung,Jong Tingting,et al. Extraction and purification of flavanone glycosides and kaemferol glycosides from defatted Camellia oleifera seeds by salting-out using hydrophilic isopropanol[J]. Separation and Purification Technology,2009,67(1):31-37.
[23]王华清,李起弘,郑铁松.茶叶籽中总黄酮的提取及结构的初步鉴定[J].食品工业科技,2012,7(41):282-286.
[24]王成章,陈虹霞,叶建中,等.一种中压柱快速分离油茶饼粕中黄酮苷的制备方法[P].中国专利:ZL10899070,2010,7-19.
[25]李利敏,沈建福,吴晓琴,等.8种油茶蒲提取物中活性物质含量及其抗氧化能力的比较研究[J].中国粮油学报,2013,28(1):41-47.
Extraction,antioxidant activity of flavonoids from oil-tea camellia seed cake
GAO Jin-yong1,GAO Yong-ping1,YU Yan-yan1,LI Huan1,LU Zhi-ping1,BU Fu-jun2,BAN Long-hai3
(1.Xinyang University,School of Science and Technology,Henan,Xinyang 464000,China;2.Xinyang Forestry Science Research Institute,Henan,Xinyang 464031,China;3. Madao Forestry Farm of Henan Province,Biyang 463721,China)
To explore the molecular composition and antioxidant activity of flavonoids in oil-tea camellia seed cake,the optimized extraction and purification method was used to purify the flavonoids in the seed cake and the HZ816 macroporous adsorption resin was used for the enrichment and purification,then the silica gel column was used to chromatograph the flavonoid compounds and two flavonoid compounds were obtained,which were designated as compounds Ⅰ and Ⅱ. The two flavonoid compounds were identified by nuclear magnetic resonance,mass spectrometry,infrared and ultraviolet spectroscopy. The results revealed that:the two substances were kaempferol 3-O-[2-O-β-D-xylopyranosyl-6-O-α-L-rhamnopyranosyl]-β-D-glucopyranoside(Ⅰ)and kaempferol 3-O-[2-O-β-D-galactopyranosyl-6-O-α-L-rhamnopyranosyl]-β-D-glucopyranoside(Ⅱ). The antioxidant test was carried out on the isolated flavonoid compounds using 1,1-diphenyl-3-nitrophenylhydrazine radical scavenging(DPPH method)and pyrogallol autoxidationinvitro. The results showed that the IC50of DPPH free radicals of the total flavonoids,compound I and compound II was 0.44,1.88,2.41 mg/mL respectively,and the IC50of superoxide anion free radicals was 1.38,1.13,1.29 mg/mL respectively.
oil-tea camellia seed cake;flavonoids;extraction;structure;antioxidant activity
2016-12-27
高进勇(1984-),女,硕士,讲师,主要从事生物制药研究,E-mail:jygao0019@163.com。
十一五国家科技支撑项目(2009BADB1B010209);河南省高等学校重点科研项目(15A180060);大学生创新创业训练计划项目(CX20170074)。
TS201.1
A
1002-0306(2017)15-0035-06
10.13386/j.issn1002-0306.2017.15.008

