基于掺氮碳量子点与Fe3+纳米开关的抗坏血酸荧光传感器*
王嘉君, 刘 青, 冯施施, 冯志玲, 阮永明, 翁雪香
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
基于掺氮碳量子点与Fe3+纳米开关的抗坏血酸荧光传感器*
王嘉君, 刘 青, 冯施施, 冯志玲, 阮永明, 翁雪香
(浙江师范大学 化学与生命科学学院,浙江 金华 321004)
以壳聚糖为前驱体,在较低温度下通过水热法一步合成了掺氮碳量子点(N-FCDs),合成得到的N-FCDs具有良好的水溶性、pH稳定性及优良的荧光特性.实验表明:Fe3+能猝灭N-FCDs 溶液的荧光,灵敏度高且选择性好;当还原性的抗坏血酸加入荧光猝灭的Fe3+-N-FCDs体系后,体系猝灭的荧光因Fe3+的还原反应又得以恢复.由此,可实现对抗坏血酸的灵敏检测,检测的线性范围为1~200 μmol/L,检出限为0.06 μmol/L.此外,Fe3+-N-FCDs的抗干扰能力强,可实现维生素C药片中抗坏血酸含量的检测,检测结果令人满意.
传感器;掺氮碳量子点;铁离子;荧光开关;抗坏血酸
抗坏血酸(ascorbic acid,AA),又名维生素C,是一种重要的抗氧化剂,在人类的饮食平衡中起着重要的作用,且广泛使用于感冒、精神病、不孕、艾滋病和癌症等疾病的预防和治疗中[1].因此,在环境、医药、食品等行业中实现抗坏血酸的灵敏及选择性地检测具有重要意义.目前,检测抗坏血酸常用的方法有:酶分析法[2-4]、色谱分析法[5-7]、电化学分析法[8-13]及荧光分析法[14-15]等.其中,荧光分析法具有灵敏度高、响应线性范围宽和检测限低等优点.
在荧光分析法中,合成荧光强及性能稳定的荧光探针对实现高灵敏度的分析检测尤为重要.近年来,碳家族中的新成员——碳量子点(carbon-based nanodots,CDs)在分析检测领域引起了广泛关注.CDs是2004年文献[16]报道的在分离和纯化单壁碳纳米管时意外发现的一种光致发光的纳米颗粒,由于它具有合成方法简单、原材料来源丰富、成本低、发光稳定、荧光寿命长及生物相容性好等优异的特性,目前已广泛应用于荧光识别探针和生物样品检测领域[17-20].文献[21]发现,石墨烯量子点的荧光被铜离子猝灭后又能在抗坏血酸存在下恢复,从而建立了抗坏血酸的荧光开关分析方法.最近,科学家们发现化学掺杂能通过完善CDs的缺陷从而提高其各方面的性能[22].如文献[23]采用海藻酸钠和色氨酸为碳源合成了氮掺杂的碳颗粒,认为空间效应和氢键作用使抗坏血酸能直接猝灭碳颗粒的荧光,从而实现抗坏血酸的检测.采用单一碳源合成掺氮碳量子点并采用荧光开关方式快速检测抗坏血酸的方法尚未见报道.
本文采用无生物毒性且自带氮源的壳聚糖,通过一步水热法合成了掺氮碳量子点(N-FCDs),合成过程绿色环保、简单易行,得到的N-FCDs生物相容性好、荧光性能稳定.本文还考察了该材料对常见金属离子的响应,发现Fe3+能选择性地猝灭N-FCDs的荧光[24];当还原剂抗坏血酸加入Fe3+-N-FCDs体系后,由于三价铁离子的还原反应,使得体系的荧光恢复,从而可实现对抗坏血酸的选择性检测,线性范围为1~200 μmol/L,检测限为0.06 μmol/L.此外,Fe3+-N-FCDs抗干扰能力强,可实现维生素C药片中抗坏血酸含量的检测,检测结果令人满意.
1 实验过程
1.1 N-FCDs的合成
首先,将0.075 g壳聚糖溶于20 mL 2.5%乙酸溶液中[25].随后,将溶液转入体积为50 mL聚四氟乙烯内胆的不锈钢反应釜中,于烘箱中200 ℃加热4 h后冷却至室温.最后,将反应得到的黄色溶液用0.22 μm滤膜过滤除去较大的颗粒后,用分子量为1 000 Da的透析袋透析24 h以除去未反应的反应物.
1.2 产物的表征
产物的形貌采用JEM-2100F型透射电子显微镜(TEM)测定,加速电压为200 kV.产物的构成性能采用Kratos Axis型X射线光电子能谱仪(XPS)测定,以Al Kα X射线作为激发光源.荧光检测由Perkin Elmer公司的LS-55型荧光仪完成.紫外可见吸收采用Perkin Elmer公司的Lambda 950光谱仪测定.pH值由PHS-3C pH计测得.
1.3 抗坏血酸对Fe3+-N-FCDs的荧光响应
将20 μL N-FCDs溶液和10 mL含有200 μmol/L Fe3+的醋酸钠-醋酸缓冲溶液(pH=4.0)在室温下混合,再加入不同浓度的抗坏血酸.放置5 min后,以325 nm为激发波长记录各物质的荧光发射光谱.在抗坏血酸的选择性测量中,将抗坏血酸替换成可能的干扰物质,所有可能的干扰物质的浓度均为50 μmol/L,测量条件同上.
1.4 维生素C片中抗坏血酸的检测
研磨0.1 g维生素C片(浙江瑞新药业股份有限公司)于20 mL去离子水中,得到维生素C分散液,10 000 r/min离心20 min后,经0.22 μm滤膜过滤,收集上清液.将制得的上清液用醋酸钠-醋酸缓冲溶液(pH=4.0)稀释10倍后备用.检测时,将20 μL N-FCDs分散液和10 mL含有200 μmol/L Fe3+和100 μL稀释后的抗坏血酸样品的醋酸钠缓冲液混合,室温下反应5 min后,测量并记录溶液的荧光光谱.
2 实验结果及分析
2.1 N-FCDs的光谱性质和表征
图1为N-FCDs形成及其检测抗坏血酸的示意图.由图1可知:溶解于乙酸溶液的壳聚糖,在高温高压过程中壳聚糖断裂、脱水、碳化及成核,从而形成发蓝色荧光的N-FCDs(以硫酸奎宁为标准,荧光量子产率为24.5%,λex=325 nm);由于Fe3+与N-FCDs的亲和作用,使得N-FCDs的荧光猝灭;当加入还原性的抗坏血酸时,Fe3+被还原,使体系的荧光恢复.
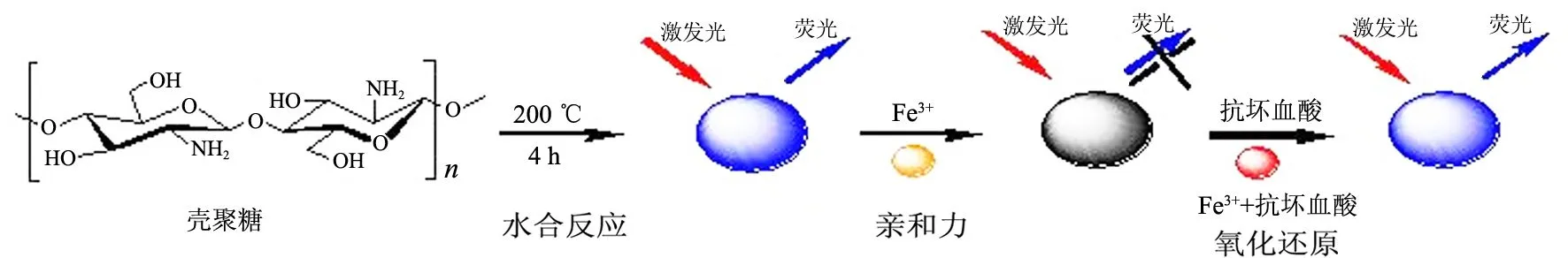
图1 N-FCDs的制备过程及抗坏血酸检测的示意图
图2是N-FCDs的透射电子显微照片,可见所制备的N-FCDs在水中具有良好的分散性.图3为N-FCDs的粒径分布直方图,其主要粒径分布在20 nm附近.

图2 N-FCDs的透射电子显微图

图3 N-FCDs的粒径分布图


(a)紫外吸收、激发和发射光谱 (b)不同激发波长下的荧光发射光谱图4 N-FCDs的紫外-可见吸收光谱和荧光光谱图
发射峰;当激发波长从315 nm变化到365 nm时,N-FCDs的最大发射峰从400 nm红移到434 nm.这种依赖激发波长的荧光性能,可能与N-FCDs表面所带的基团有关.水热碳化过程中,大量的官能团,如羧基和氨基,在N-FCDs表面上形成不同的缺陷,这些缺陷作为激发能量陷阱,从而形成不同的荧光性质.也可能与碳量子点的尺寸有关.这种激发波长依赖的荧光特征也是目前报道的多数碳量子点的荧光特征[28-29].


图5 N-FCDs的红外光谱图
明,N-FCDs表面存在大量的羟基和氨基.这也是N-FCDs在水中具有良好的分散性的原因[30].


图6 N-FCDs的X射线光电子能谱图
2.2 反应条件对荧光强度的影响
本实验对制备N-FCDs的反应条件如壳聚糖的浓度、反应温度和反应时间等做了优化.如图7(a)所示:壳聚糖的浓度增加到3.75 mg/mL时,合成的N-FCDs的荧光强度最大;但进一步增加壳聚糖的浓度,其荧光强度反而下降,这可能是由于高浓度的壳聚糖使生成的N-FCDs颗粒团聚从而导致其荧光强度降低[32].将壳聚糖溶液在不同温度(140~220 ℃)下加热4 h,得到不同温度下的N-FCDs.如图7(b)所示:随着反应温度的不断上升,合成的N-FCDs荧光强度明显增大;当温度高于190 ℃时,其荧光强度增加缓慢;当温度达到200 ℃时,N-FCDs的荧光强度达到最大值并相对稳定.因此,200 ℃是最佳的反应温度.反应时间的优化是提高N-FCDs荧光强度的关键.如图7(c)所示:当反应时间为240 min时,N-FCDs的荧光强度最大;随着反应时间的延长,导致N-FCDs聚集,从而导致其荧光强度减弱.因此,优化后合成N-FCDs的反应时间为4 h.

(a)壳聚糖浓度 (b)反应温度 (c)反应时间 图7 制备N-FCDs的反应条件优化
在荧光传感器中,复杂环境条件下的荧光纳米粒子的稳定性是一个关系到该纳米粒子能否进一步在实际检测中应用的重要问题.因此,本实验考察了溶液的pH及盐度等环境条件对N-FCDs荧光强度的影响.实验发现,当溶液pH值从2变化到10时(见图8(a)),N-FCDs的荧光强度基本保持不变.此外,在不同浓度的NaCl溶液中,N-FCDs 的荧光强度也几乎保持不变(见图8(b)).表明制备的N-FCDs可适用于复杂条件下的传感器分析.
为了考察N-FCDs对不同金属离子的响应,本实验在荧光强度较高的N-FCDs溶液中加入相同浓度的不同的金属离子,如Fe3+,Fe2+,Cu2+,Hg2+,Al3+,Cd2+,Na+,K+,Mn2+,Ba2+,Ni2+,Mg2+,Co2+,Ca2+,Pb2+和Zn2+等,在激发波长为325 nm时,这些常见金属离子对N-FCDs荧光强度的响应如图9所示.可见,与空白对照及其他离子相比,Fe3+可高效猝灭N-FCDs的荧光.该荧光淬灭可归因于N-FCDs表面的N和O对Fe3+有很强的亲和力,致使N-FCDs团聚,进而发生荧光猝灭.另外,该猝灭过程也可能是Fe3+与N-FCDs

(a)pH的影响 (b)NaCl浓度的影响图8 溶液的pH及盐度对N-FCDs荧光强度的影响
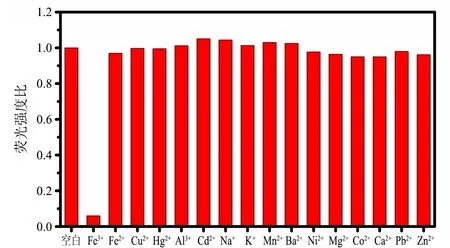
cB=200 μmol/L;醋酸钠-醋酸缓冲液,pH=4图9 不同金属离子对N-FCDs荧光强度的响应
之间发生了非辐射电子转移[27].
合适的Fe3+浓度对建立高灵敏度的抗坏血酸传感器至关重要.过高浓度的Fe3+影响抗坏血酸的检测限,而过低浓度的Fe3+又直接影响抗坏血酸的检测范围.如图10(a)所示,随着Fe3+浓度的增加,N-FCDs的荧光强度逐渐减弱.当荧光淬灭程度达到94.8%时,Fe3+浓度为200 μmol/L(见图10(b)).因此,后续实验中Fe3+浓度定为200 μmol/L.
2.3 抗坏血酸的检测

(a)Fe3+浓度对N-FCDs荧光强度的影响(λ激发=325 nm) (b)荧光强度与Fe3+浓度的响应关系 图10 Fe3+浓度对抗坏血酸传感器灵敏度的影响
图11(a)显示了抗坏血酸的开关荧光响应,由此可知:不含Fe3+的N-FCDs溶液在404 nm波长处展现出较强的荧光发射性能;当在该溶液中加入200 μmol/L Fe3+时,溶液的荧光强度明显减弱;而当还原性的抗坏血酸(500 μmol/L)加入到混合液中时,由于Fe3+与抗坏血酸发生氧化还原反应,使Fe3+转化为Fe2+而从N-FCDs表面脱离,从而使体系的荧光恢复到最大值的93%.
图11(b)是Fe3+(200 μmol/L)-N-FCDs体系中加入不同浓度的抗坏血酸(0~500 μmol/L)后溶液的荧光强度变化.如图11(b)所示,随着抗坏血酸浓度的增加,体系的荧光强度不断增大.当抗坏血酸浓度为1~200 μmol/L时,与F/F0呈线性关系(见图11(c)),线性方程为
Y=0.052 81x+1.136 87(R=0.997 7).
在信噪比为3的条件下,抗坏血酸的检测限为0.06 μmol/L.
为了考察其他干扰物对Fe3+-N-FCDs体系检测抗坏血酸的影响,在相同的实验条件下,分别测试了牛血清白蛋白(BSA)、赖氨酸(Lys)、谷胱甘肽(GSH)、葡萄糖(Glu)、甘氨酸(Gly)、半胱氨酸(Cys)、多巴胺(DA)、尿酸(UA)和过氧化氢等物质对Fe3+-N-FCDs体系荧光强度的影响,实验结果如图11(d)所示.可以看出,与空白样品相比,加入抗坏血酸的样品荧光恢复程度远超出加入其他物质的荧光恢复程度.表明Fe3+-N-FCDs体系对抗坏血酸的检测有良好的选择性.

图11 Fe3+-N-FCDs体系检测抗坏血酸
2.4 维生素C片中抗坏血酸的检测
为了评估此方法是否可用于实际样品中抗坏血酸的检测,本实验用醋酸缓冲液将维生素C片中的抗坏血酸稀释10倍后,在样品液中加入标准抗坏血酸溶液(50,100,150 μmol/L)测定其回收率,结果如表1所示,样品的加标回收率为96.9%~106%,表明该传感器适合于实际样品的分析.
表2从线性范围和检测限方面比较了本文制作的传感器与文献已报道的其他传感器的性能,可知本文传感器对抗坏血酸的分析性能相当或略优于其他传感器.

表1 维生素C药片中抗坏血酸的加标回收率
注:回收率=100%×(加标后浓度-加标前浓度)/加标量.

表2 不同方法检测抗坏血酸的检出限比较
3 结 论
本文以壳聚糖为前驱体一步合成了N-FCDs,采用Fe3+-N-FCDs体系,将荧光纳米材料独特的光学性质和其对金属离子的选择性及抗坏血酸的还原性结合起来,从而实现了对抗坏血酸的快速、简单检测,检测的灵敏度高、选择性好.另外,Fe3+-N-FCDs体系还可应用于实际样品维生素C药片中抗坏血酸的检测,检测结果令人满意,在临床中具有潜在的应用价值.
[1]Du J,Cullen J J,Buettner G R.Ascorbic acid:Chemistry,biology and the treatment of cancer[J].Biochim Biophys Acta,2012,1826(2):443-457.
[2]Melino V J,Soole K L,Ford C M.A method for determination of fruit derived ascorbic,tartaric,oxalic and malic acids and its application to the study of ascorbic acid catabolism in grapevines[J].Aust J Grape Wine R,2009,15(3):293-302.
[3]Shekhovtsova T N,Muginova S V,Luchinina J A,et al.Enzymatic methods in food analysis:Determination of ascorbic acid[J].Anal Chim Acta,2006,573:125-132.
[4]Li Fengxia,Wu Hongjuan,Cui Miao,et al.L-ascorbic acid biosensing assay from enzyme-immobilized pig bladder membrane as a novel platform[J].Anal Methods,2013,5(5):1253-1258.
[5]León-Ruiz V,Vera S,González-Porto A V,et al.Analysis of water-soluble vitamins in honey by isocratic RP-HPLC[J].Food Anal Methods,2013,6(2):488-496.
[6]Matei N,Radu G L,Truica G,et al.Rapid HPLC method for the determination of ascorbic acid in grape samples[J].Anal Methods,2013,5(18):4675-4679.
[7]Szultka M,Buszewska-Forajta M,Kaliszan R,et al.Determination of ascorbic acid and its degradation products by high-performance liquid chromatography-triple quadrupole mass spectrometry[J].Electrophoresis,2014,35(4):585-592.
[8]Lawal A.Synthesis and utilisation of graphene for fabrication of electrochemical sensors[J].Talanta,2015,131:424-443.
[9]Sanghavi B J,Wolfbeis O S,Hirsch T,et al.Nanomaterial-based electrochemical sensing of neurological drugs and neurotransmitters[J].Mikrochim Acta,2015,182(1/2):1-41.
[10]Mirzaei M,Sawan M.Microelectronics-based biosensors dedicated to the detection of neurotransmitters:A review[J].Sensors,2014,14(10):17981-18008.
[11]Zhang L,Wang J,Tian Y.Electrochemical in-vivo sensors using nanomaterials made from carbon species,noble metals,or semiconductors[J].Microchim Acta,2014,181(13):1471-1484.
[12]Wu S,He Q,Tan C,et al.Graphene-based electrochemical sensors[J].Small,2013,9(8):1160-1172.
[13]Chen A,Chatterjee S.Nanomaterials based electrochemical sensors for biomedical applications[J].Chem Soc Rev,2013,42(12):5425-5438.
[14]Zhai W,Wang C,Yu P,et al.Single-layer MnO2nanosheets suppressed fluorescence of 7- hydroxycoumarin:Mechanistic study and application for sensitive sensing of ascorbic acid in vivo[J].Anal Chem,2014,86:12206-12213.
[15]Ma Q,Li Y,Lin Z H,et al.A novel ascorbic acid sensor based on the Fe3+/Fe2+modulated photoluminescence of CdTe quantum dots@SiO2nanobeads[J].Nanoscale,2013,5(20):9726-9731.
[16]Xu X,Ray R,Gu Y,et al.Electrophoretic analysis and purification of fluorescent single-walled carbon nanotube fragments[J].J Am Chem Soc,2004,126(40):12736-12737.
[17]Lim S Y,Shen W,Gao Z.Carbon quantum dots and their applications[J].Chem Soc Rev,2015,44(1):362-381.
[18]Li H,Chen L,Wu H,et al.Ionic liquid-functionalized fluorescent carbon nanodots and their applications in electrocatalysis,biosensing,and cell imaging[J].Langmuir,2014,30(49):15016-15021.
[19]Guo Y,Zhang L,Zhang S,et al.Fluorescent carbon nanoparticles for the fluorescent detection of metal ions[J].Biosens Bioelectron,2015,63:61-71.
[20]Jahanbakhshi M,Habibi B.A novel and facile synthesis of carbon quantum dots via salep hydrothermal treatment as the silver nanoparticles support:Application to electroanalytical determination of H2O2in fetal bovine serum[J].Biosens Bioelectron,2016,81:143-150.
[21]Liu Jingjing,Chen Zhitao,Tang Duosi,et al.Graphene quantum dots-based fluorescent probe for turn-on sensing of ascorbic acid[J].Sens Actuators B:Chemical,2015,212:214-219.
[22]Jahan S,Mansoor F,Naz S,et al.Oxidative synthesis of highly fluorescent boron/nitrogen co-doped carbon nanodots enabling detection of photosensitizer and carcinogenic dye[J].Anal Chem,2013,85(21):10232-10239.
[23]Zhu X,Zhao T,Nie Z,et al.Non-redox modulated fluorescence strategy for sensitive and selective ascorbic acid detection with highly photoluminescent nitrogen-doped carbon nanoparticles via solid-state synthesis[J].Anal Chem,2015,87(16):8524-8530.
[24]Lai T,Zheng E,Chen L,et al.Hybrid carbon source for producing nitrogen-doped polymer nanodots:One-pot hydrothermal synthesis,fluorescence enhancement and highly selective detection of Fe(Ⅲ)[J].Nanoscale,2013,5(17):8015-8021.
[25]Yang Y,Cui J,Zheng M,et al.One-step synthesis of amino-functionalized fluorescent carbon nanoparticles by hydrothermal carbonization of chitosan[J].Chem Commun,2012,48(3):380-382.
[26]Yang X,Zhuo Y,Zhu S,et al.Novel and green synthesis of high-fluorescent carbon dots originated from honey for sensing and imaging[J].Biosens Bioelectron,2014,60:292-298.
[27]Li W,Zhang Z,Kong B,et al.Simple and green synthesis of nitrogen-doped photoluminescent carbonaceous nanospheres for bioimaging[J].Angew Chem Int Ed,2013,52(31):8151-8155.
[28]Chen B,Li F,Li S,et al.Large scale synthesis of photoluminescent carbon nanodots and their application for bioimaging[J].Nanoscale,2013,5(5):1967-1971.
[29]Wang X,Qu K,Xu B,et al.Microwave assisted one-step green synthesis of cell-permeable multicolor photoluminescent carbon dots without surface passivation reagents[J].J Mater Chem,2011,21(8):2445-2450.
[30]Qu D,Zheng M,Du P,et al.Highly luminescent S,N co-doped graphene quantum dots with broad visible absorption bands for visible light photocatalysts[J].Nanoscale,2013,5(24):12272-12277.
[31]Zheng Y,Jiao Y,Ge L,et al.Two-step boron and nitrogen doping in graphene for enhanced synergistic catalysis[J].Angewandte Chemie International Edition,2013,52(11):3110-3116.
[32]Li H,Zhai J,Tian J,et al.Carbon nanoparticle for highly sensitive and selective fluorescent detection of mercury(Ⅱ) ion in aqueous solution[J].Biosens Bioelectron,2011,26(12):4656-4660.
[33]Wang X,Wu P,Hou X,et al.An ascorbic acid sensor based on protein-modified Au nanoclusters[J].Analyst,2013,138(1):229-233.
[34]Jirimali H D,Nagarale R K,Saravanakumar D,et al.Hydroquinone modified chitosan/carbon film electrode for the selective detection of ascorbic acid[J].Carbohydr Polym,2013,92(1):641-644.
(责任编辑 薛 荣)
A fluorescence sensor for ascorbic acid based on nanocomposite "switch" of Fe3+and nitrogen-doped carbon nanodots generated from chitosan
WANG Jiajun, LIU Qing, FENG Shishi, FENG Zhiling, RUAN Yongming, WENG Xuexiang
(CollegeofChemistryandLifeSciences,ZhejiangNormalUniversity,Jinhua321004,China)
Ascorbic acid (AA) was detected by using a nano-switch of ferric ions (Fe3+), the nitrogen-doped fluorescence carbon nanodots (N-FCDs) was synthesized by one-step hydrothermal carbonization of chitosan at a mild temperature. The as-obtained N-FCDs exhibited good water dispersibility, excellent pH stability, and strong fluorescence. The results showed that the fluorescence of the N-FCDs could be effectively quenched by Fe3+and then be sensitively turned on in the presence of AA via an "off-on" fluorescence response through the oxidation-reduction between Fe3+and AA. A wide detection linear range for AA was found to be from 1 μmol/L to 200 μmol/L with a detection limit of 0.06 μmol/L. The switch sensor was also successfully applied to detect vitamin C tablets with satisfactory recovery ranging from 96.9% to 106%, exhibited great opportunities for practical application in food and clinical system.
sensor; nitrogen-doped fluorescence carbon nanodots; ferric ions; off-on fluorescence switch; ascorbic acid
10.16218/j.issn.1001-5051.2017.03.009
�2016-10-25;
2017-03-03
浙江省自然科学基金资助项目(LY15C040002)
王嘉君(1993-),女,安徽黄山人,硕士研究生.研究方向:纳米材料在生化分析中的应用.
翁雪香.E-mail: xuexian@zjnu.cn>
O657
A
1001-5051(2017)03-0299-08

