双歧杆菌细菌素Bifidocin A对金黄色葡萄球菌的抑菌作用及其机制
刘国荣,郜亚昆,王 欣,2,刘玉洁,曹季林,王成涛,*
(1.北京食品营养与人类健康高精尖创新中心,北京市食品添加剂工程技术研究中心,北京工商大学,北京 100048;2.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319)
双歧杆菌细菌素Bifidocin A对金黄色葡萄球菌的抑菌作用及其机制
刘国荣1,郜亚昆1,王 欣1,2,刘玉洁1,曹季林1,王成涛1,*
(1.北京食品营养与人类健康高精尖创新中心,北京市食品添加剂工程技术研究中心,北京工商大学,北京 100048;2.黑龙江八一农垦大学食品学院,黑龙江 大庆 163319)
Bifidocin A是由Bifi dobacterium animalis BB04代谢合成的一种新型广谱高效细菌素。以革兰氏阳性的金黄色葡萄球菌为测试敏感菌,分析细菌素Bifidocin A的最低抑菌浓度及不同质量浓度下的抑菌效果,并从敏感菌细胞形态与结构、细胞膜的通透性、细胞膜的完整性以及细胞膜质子移动势的变化4 个角度分别探讨该细菌素的抑菌作用机制。结果表明,细菌素Bifidocin A对金黄色葡萄球菌CVCC 26112的最低抑菌浓度为0.058 μg/mL,抑菌活性较强且存在浓度依赖性;并初步推测其抑菌作用机制是通过耗散细胞膜质子移动势,增加细胞膜通透性,形成孔洞,进而破坏细胞膜完整性,并最终瓦解细胞。
细菌素;双歧杆菌;金黄色葡萄球菌;抑菌活性;抑菌机制
乳酸菌细菌素是乳酸菌在代谢过程中通过核糖体机制合成并分泌到环境中的一类具有抑菌活性的多肽或蛋白类物质,它在人体内可被降解,具有高效、无抗药性、无毒、无残留等优点,已成为天然食品生物防腐剂研究与开发的热点[1]。
对乳酸菌细菌素抑菌作用机制的研究是评价其在食品中应用安全性的重要依据[2-3]。目前乳酸菌细菌素抑菌作用机理的研究主体主要集中在Ⅰ类和Ⅱ类细菌素上,Ⅲ类和Ⅳ类细菌素由于分子质量较大且结构复杂,对其作用机理的研究较少[4]。所研究的靶细胞基本都围绕G+细菌展开,如单核细胞增生李斯特菌、金黄色葡萄球菌等[5-6]。目前已确认部分乳酸菌细菌素对G+细菌的主要作用机制是改变敏感菌细胞膜通透性,释放胞内的离子(如K+),ATP、乳酸脱氢酶及紫外吸收物质,引起质子驱动势(proton motive force,PMF)的丧失,干扰膜运输,导致能量代谢以及蛋白质和核酸合成受阻甚至无法进行,最终引起细胞的死亡[7-9]。也有部分学者发现,乳酸菌细菌素在改变细胞膜通透性的同时,还可能会破坏敏感菌细胞结构完整性[10-11]。
双歧杆菌(Bifidobacterium spp.)是寄生在人和动物肠道内的典型有益乳酸菌,它可以对宿主发挥生物屏障、营养、免疫、延缓衰老、抗肿瘤等生理作用。已发现极少数双歧杆菌属菌株也可产生细菌素[12-16],如两歧双歧杆菌(B. bifidum)NCFB1454、嗜热双歧杆菌(B. thermophilum)RBL67、婴儿双歧杆菌(B. infants)BCRC14602、动物双歧杆菌(B. animals)BB04等。而有关双歧杆菌细菌素的抑菌作用机理目前鲜见研究报道[12,17]。
B. animalis BB04可代谢合成广谱高效细菌素Bifidocin A,是国内外首次报道的产细菌素动物双歧杆菌[16]。课题组前期已建立Bifidocin A的提取纯化方法,分析了该细菌素的分子结构、抑菌谱和应用特性,确定其有作为天然食品生物防腐剂的巨大应用潜力。为评价细菌素Bifidocin A的应用安全性,本研究重点分析该细菌素对敏感菌之一——金黄色葡萄球菌(Staphylococcus aureus)CVCC 26112的抑菌作用机理,旨在为进一步阐释双歧杆菌细菌素的抑菌机制提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种及培养基
细菌素Bifidocin A(质量浓度为1.85 mg/mL,纯度为95.3%),由本实验室自主分离提取纯化[16];敏感菌:金黄色葡萄球菌CVCC 26112,购自中国兽医微生物菌种保藏中心。
1.1.2 试剂
胰蛋白酶大豆肉汤(tryptic soy,TSB)培养基北京陆桥技术有限责任公司;ATP分析测定试剂盒 北京半夏化工产品有限公司;碘化丙啶(propidium iodide,PI)、SYTO9 美国Sigma公司。
1.2 仪器与设备
UV-2450紫外分光光度计 上海美析仪器有限公司;RF-5301PC荧光分光光度计 日本岛津仪器有限公司;S-4800场发射扫描电子显微镜(scanning electron microscope,SEM)、ZA-3000原子吸收光谱仪 日本日立有限公司;JEM 1200EX透射电子显微镜(transmission electron microscope,TEM) 日本电子株式会社;FV-1200激光共聚焦扫描显微镜 日本奥林巴斯株式会社。
1.3 方法
1.3.1 抑菌活性分析
1.3.1.1 最低抑菌浓度的确定
收集培养至对数生长期的金黄色葡萄球菌CVCC 26112菌体细胞,制备浓度为106CFU/mL的菌悬液,并向其中加入不同质量浓度的细菌素Bifidocin A纯品溶液,使其最终质量浓度分别为1.85、0.925、0.463、0.232、0.116、0.058、0.029、0.015 mg/mL,37 ℃条件下温育处理24 h,测定各管OD600nm。对照采用同样体积蒸馏水代替细菌素Bifidocin A样品。以未见指示菌生长(即OD600nm不增高)的最低细菌素质量浓度为该细菌素对金黄色葡萄球菌CVCC 26112的最低抑菌浓度(minimum inhibitory concentration,MIC)[18]。
1.3.1.2 不同质量浓度细菌素Bifidocin A对敏感菌生长的抑制作用
参考Bendali等[19]报道方法,收集培养至对数生长期的金黄色葡萄球菌CVCC 26112菌体细胞,制备浓度为106CFU/mL的菌悬液,并向其中加入不同质量浓度的细菌素纯品溶液,使其最终浓度分别为1×MIC、2×MIC及4×MIC水平,37 ℃温育处理24 h,采用平板计数法测其活菌数。以不添加细菌素培养组为对照,观察不同质量浓度细菌素处理下敏感菌活菌数的变化情况。
1.3.2 抑菌机理研究
1.3.2.1 敏感菌培养及细菌素Bifidocin A处理菌悬液的制备
收集培养至对数生长期的金黄色葡萄球菌CVCC 26112菌体细胞,用0.1 mol/L pH 7.0的羟乙基哌嗪乙磺酸(4-(2-hydroxyethyl)-1-piperazineethanesulfonic acid,HEPES)缓冲液反复洗涤3 次后,重悬于含10 mmol/L葡萄糖的HEPES缓冲液中,制备成菌悬液(106CFU/mL),并向其中加入适量细菌素Bifidocin A纯品溶液,使最终作用浓度为1×MIC水平,37℃温育处理3 h。以未添加细菌素的菌悬液为对照。
1.3.2.2 细菌素对敏感菌细胞形态及内部结构的影响
采用SEM观察敏感菌细胞外部形态变化,采用TEM观察敏感菌细胞内部结构变化[20]。具体方法为:将1.3.2.1节中菌悬液样品在4 ℃、8 000 r/min离心10 min,保留菌体细胞并用0.1 mol/L的磷酸盐缓冲液(pH 6.0)反复清洗3 遍,加入2.5%戊二醛预固定3 h,再用1%锇酸固定1.5 h。接着采用30%、50%、70%、80%、90%的乙醇溶液对样品进行洗脱,每步15 min,之后在100%乙醇的水溶液中脱水2 次,每次15 min;再将样品置于乙醇-叔丁醇(1∶1,V/V)混合液中15 min;最后置样品于叔丁醇中悬浮15 min左右,作为SEM观察细胞样品,待用。其中,取一部分处理好的细胞样品滴加于5 mm×5 mm的盖玻片上,置-80 ℃冰箱冻存后放入冷冻干燥机中进行冷冻干燥。采用SEM观察并采集图像;剩余细胞样品用丙酮和树脂进行浸透和包埋后,在超薄切片机上切成约100 nm薄片,5%磷钨酸染色后,采用TEM观察敏感菌细胞内部结构并采集图像。
1.3.2.3 细菌素对敏感菌细胞膜通透性的影响
通过监测细胞内外小分子物质(K+和无机磷)及大分子物质(ATP)的含量变化,分析细菌素Bifidocin A对敏感菌细胞膜通透性的影响作用[9]。具体方法为:将
1.3.2.1 节中菌悬液样品在4 ℃、10 000 r/min离心5 min,留取上清液作为胞外样品;剩余菌体细胞沉淀用1 mL 5%三氯乙酸悬浮,-20 ℃冷冻过夜,解冻后95 ℃温育10 min,每个样品加4 mL去离子水,10 000 r/min离心15 min,留取上清液作为胞内样品。采用原子吸收光谱仪测定K+浓度;钼锑抗比色法来测定无机磷浓度;荧光素-荧光素酶试剂盒测定ATP含量。
1.3.2.4 细菌素对敏感菌细胞膜完整性的影响
首先通过在260 nm和280 nm波长处在线监测细胞内外紫外吸收物质的含量变化,初步分析细菌素Bifidocin A对敏感菌细胞膜完整性的影响作用。然后,根据绿色荧光染料SYTO 9能够渗透进入所有细胞,包括膜受损及膜完整的细胞,而红色荧光染料PI只能够进入膜破损的细胞并且与SYTO 9竞争结合位点的原理,采用PI和SYTO 9荧光探针对敏感菌细胞进行双荧光标记,再次验证分析观察细胞完整性情况[21]。具体方法为:1.3.2.1节中菌悬液样品中加入2 μL PI-SYTO 9(1∶1,V/V)的混合荧光探针,室温条件下避光育孵30 min,4 ℃、12 000 r/min离心10 min,收集标记后菌体细胞,无菌生理盐水重复漂洗3次。采用FV-1200激光共聚焦扫描显微镜观察细胞染色情况并采集复合图片。
1.3.2.5 细菌素对敏感菌细胞膜PMF的影响
分别通过监测细胞膜Δψ和ΔpH值变化分析细菌素Bifidocin A对细胞膜PMF的影响[8]。
ΔpH值的测定:经10 mmol/L葡萄糖能量化的菌悬液分成4 管,每管20 μL。加入1 μL 50 mg/mL(10 mmol/L)的2 ,7 -二羧乙基-5(6)-羧基荧光素(2 ,7 -bis-(2-carboxyethyl)5(6)-carboxyfluorescein,BCECF),混匀,室温条件下放置5 min,然后加入1 mL缓冲液摇匀,12 000 r/min离心1 min,沉淀含有一定数量的BCECF(通过黄色程度可判断)。加入2~3 μL HCl酸处理后,用1 mL缓冲液洗4 次,摇匀后离心,最终悬浮于200 μL缓冲液中。一管作对照,其他3 管分别加入1 μmol/L Nigericin、Valinomycin、Bifidocin A,立即用荧光光度计测其胞内BCECF的荧光值,用5 nm的狭缝,激发波长502 nm,发射波长525 nm,扫描5 min。
Δψ的测定:将含有10 mmol/L葡萄糖的细胞悬浮液和0.4 μmol/L DISC3(5)混合,直到DISC3(5)达到最大吸收。然后加入100 mmol/L KCl来平衡细胞外和胞内的K+浓度,各取1 mL细胞悬浮液,分别加入1 μmol/L Nigericin、Valinomycin、Bifidocin A,立即测其荧光强度,激发波长622 nm,发射波长670 nm,扫描10 min。由于细胞膜受到破坏,最大吸收荧光量将上升。用细胞和染料的混合物做空白调零。
1.4 数据处理与分析
每个实验重复3 次,取其平均值。采用SAS 8.1、Microsoft Excel 2003及Design Expert 7.1.3软件对数据进行分析。
2 结果与分析
2.1 抑菌活性分析
2.1.1 MIC测定结果
当细菌素Bifidocin A样品质量浓度大于或等于0.058 μg/mL时,样品菌悬液中OD600nm未见增大,由此确定该细菌素对金黄色葡萄球菌CVCC 26112的最低抑菌浓度为0.058 μg/mL。
2.1.2 细菌素Bifidocin A对敏感菌生长的抑制作用

图 1 细菌素Bifidocin A处理后金黄色葡萄球菌活菌数变化曲线Fig. 1 Effect of bifi docin A on viable Staphylococcus aureus counts
由图1可知,当细菌素质量浓度为1×MIC(0.058 μg/mL)时,敏感菌活菌数变化不显著(P>0.05),说明1×MIC水平细菌素对该敏感菌的作用表现抑菌作用方式;当细菌素浓度为2×MIC(0.116 μg/mL)时,敏感菌活菌数变化显著(P<0.05),但是处理24 h内活菌数的下降值
不足3(lg(CFU/mL))(即致死率<99.9%),说明2×MIC水平细菌素对该敏感菌的作用仍表现抑菌作用方式;当细菌素质量浓度为4×MIC(0.232 μg/mL)时,敏感菌活菌数变化显著(P<0.05),且在处理12 h后活菌数的下降已达3.13(lg(CFU/mL))(即致死率>99.9%),说明4×MIC水平细菌素对该敏感菌表现为杀菌作用方式。以上结果表明,细菌素Bifidocin A对金黄色葡萄球菌CVCC 26112的抑制作用存在浓度依赖性。
2.2 抑菌机理研究
2.2.1 对敏感菌细胞形态及内部结构的影响

图 2 细菌素Bifidocin A处理前后金黄色葡萄球菌细胞的SEM图Fig. 2 SEM of Staphylococcus aureus cells treated with bifi docin A for 0 (A), 1 (B), 2 (C) and 3 (D) h
如图2所示,可知未经细菌素处理的金黄色葡萄球菌细胞表面光滑、外形规则;经过细菌素处理至1 h左右的细胞表面出现少量粗糙及褶皱,形态轻微不规则;当细菌素作用时间延长至2~3 h时,细胞表面粗糙加重、褶皱变多,出现严重塌陷且形态扭曲;并且出现少量细胞破洞。未经细菌素作用的金黄色葡萄球菌细胞膜完整、细胞表面光滑、外形规则,经细菌素处理至1 h左右,细胞膜表面出现少量塌陷、凹槽并伴有有褶皱;处理2 h后,细胞表面粗糙、有褶皱,并且出现大量塌陷;当时间延长至3 h左右时,褶皱加深,塌陷加重。以上结果表明,细菌素的作用明显改变了细胞外部形态。如图3所示,可知未经细菌素处理的细胞内部原生质体分布均匀、细胞完整;经细菌素Bifidocin A处理1 h后细胞中原生质无明显变化;但是处理2 h后,细胞中原生质团聚、分布不均匀,有少量胞内物质流失;而当处理时间延长至3 h时,内部结构破坏程度较严重,有大量胞内物质流失。以上均表明,细菌素Bifidocin A可改变敏感菌细胞的内部结构。对比图2和图3结果,发现细菌素作用后,细胞内部结构与外部结构在不同时间的变化程度有差异。
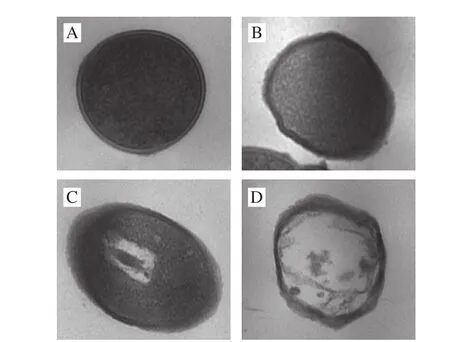
图 3 细菌素Bifidocin A处理前后金黄色葡萄球菌细胞的TEM图Fig. 3 Transmission electron micrographs of Staphylococcus aureus cells treated and not treated with bifi docin A
2.2.2 对敏感菌细胞膜通透性的影响

图 4 细菌素Bifidocin A处理前后金黄色葡萄球菌细胞内外K+(A)、无机磷离子(B)及ATP(C)浓度变化Fig. 4 Changes in intracellular and extracellular K+(A), inorganic phosphate (B) and ATP levels (C) in Staphylococcus aureus cells before and after treatment with bifi docin A
由图4可知,经细菌素Bifidocin A作用后,敏感菌胞内K+、无机磷离子及ATP在短时间内均发生一定程度的泄漏;处理2 h后胞内K+浓度明显由64 μmol/L下降至17 μmol/L左右(图4A);处理至1.5 h时,其胞内无机磷离子浓度明显由72 μmol/L下降至22 μmol/L(图4B);处理1.5 h后,ATP浓度最初的180 μmol/L下降至78 μmol/L(图4C);同时,胞外的各类物质浓度相应提高。以上结果表明,细菌素Bifidocin A可增加敏感菌细胞膜的通透性,形成孔洞,使小分子物质和大分子物质同时泄漏。
2.2.3 对敏感菌细胞膜完整性的影响

图 5 细菌素Bifidocin A处理前后金黄色葡萄球菌细胞胞外紫外吸收物质的泄漏Fig. 5 Release of extracellular UV-absorbing materials from Staphylococcus aureus cells detected at 260 nm and 280 nm
如图5所示,经细菌素作用2 h左右,敏感菌胞外紫外吸收物质浓度快速上升,与对照相比,OD260nm由0.03上升至0.590,而OD280nm则由0.02迅速增加至0.370。结果表明,该细菌素增加敏感菌细胞膜的通透性的同时,也破坏了其完整性。
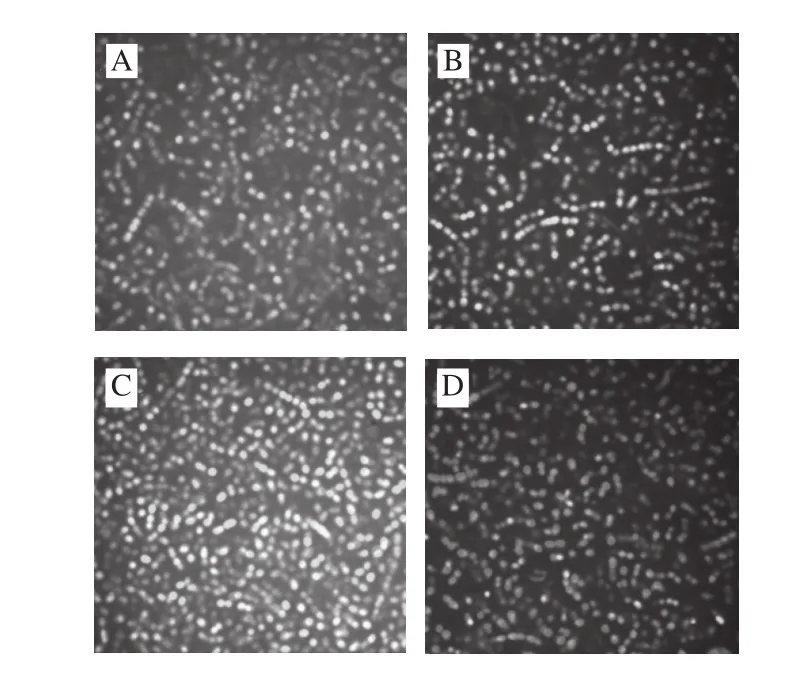
图 6 细菌素Bifidocin A处理前后金黄色葡萄球菌细胞的激光共聚扫描显微镜图Fig. 6 Confocal laser scanning micrographs of Staphylococcus aureus cells not treated (A) and treated with bifi docin A for 1 (B), 2 (C), and 3 (D) h
如图6所示,对照组和经细菌素作用1 h左右的细胞中大部分细胞发绿色荧光,随着处理时间延长,发绿色荧光的细胞逐渐减少,而发黄色或红色荧光的细胞逐渐增多;当处理时间延长到3 h时,绝大多数细胞都发红色荧光或中间态的黄色荧光,且红色荧光细胞荧光强度高于中间态的黄色荧光及少数量的绿色荧光。以上表明,在未经细菌素作用和短时间作用的样品中大多数细胞的细胞膜完整,排斥PI,细胞主要显示为绿色荧光;随着作用时间的延长,PI逐渐进入细胞与SYTO 9竞争取代结合位点,荧光颜色由绿色转变为红色或黄色,细胞膜受损程度增加,细菌素处理破坏了敏感菌细胞膜的完整性。
2.2.4 对敏感菌细胞膜PMF的影响
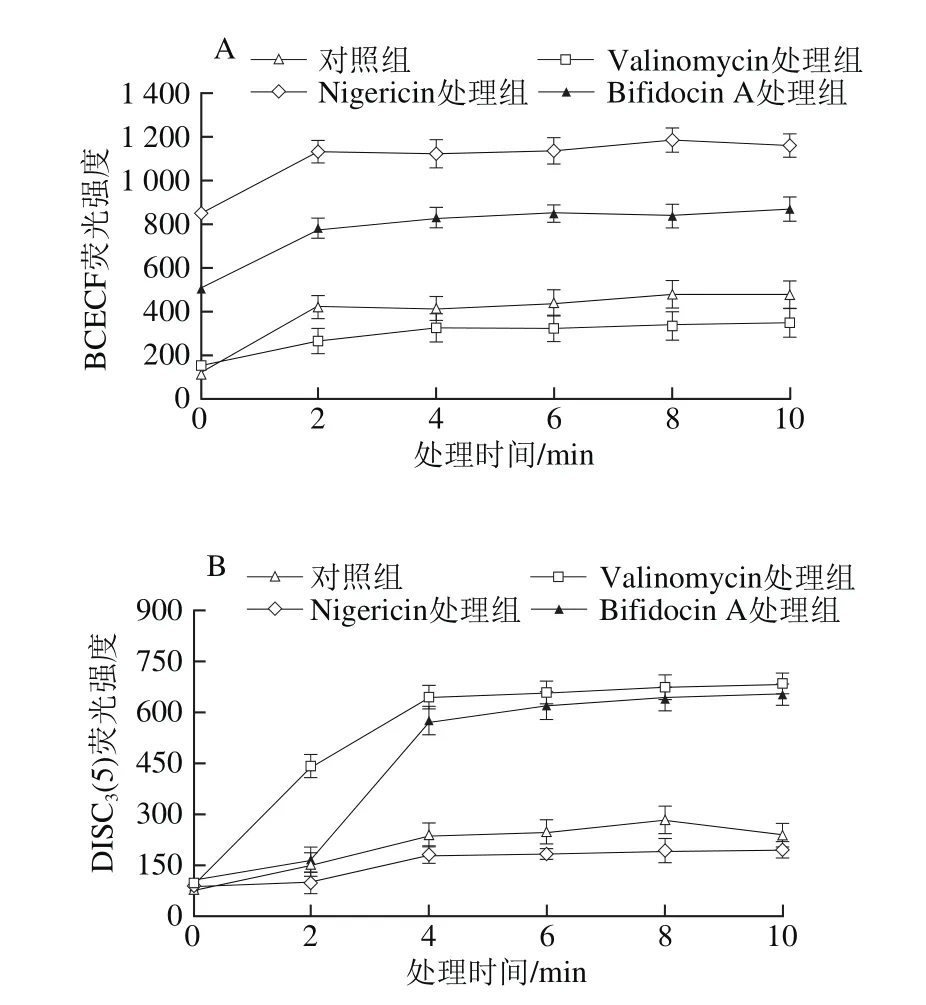
图 7 细菌素Bifidocin A处理前后金黄色葡萄球菌细胞膜上Δψ(A)和ΔpH(B)值的变化Fig. 7 Transmembrane electrical potential (Δψ) (A) and transmembrane pH gradient (ΔpH) (B) in Staphylococcus aureus cells
1.0 μmol/L的K+/H+离子交换剂Nigericin可以迅速破坏胞内外ΔpH值,导致胞内外界pH值相同。为了确定ΔpH值是唯一变量,加入1.0 μmol/L的K+离子载体Valinomycin将Δψ转化为最大ΔpH值。由图7A可以看出,菌悬液细胞经Valinomycin处理与对照相比,荧光强度较接近,表明pH值维持在正常水平,未受到破坏;而细菌素Bifidocin A处理可导致敏感菌胞内荧光强度2 min内迅速上升至782左右水平,处理至4 min时,荧光强度变化趋于平稳状态并保持稳定(图7A);细菌素作用与Nigericin处理相比,敏感菌经细菌素作用所引起荧光强度增加程度均低于Nigericin作用效果,可见,细菌素Bifidocin A处理引起敏感菌细胞氢离子的部分耗散,而不是完全丧失。
采用荧光探针DISC3(5)来定量测定敏感菌细胞膜Δψ,如果膜受到破坏,膜电势将耗散,DISC3(5)将释放到培养基中,引起荧光强度上升。在1.0 μmol/L Nigericin存在情况下,敏感菌细胞可以维持最大的Δψ,而1.0 μmol/L的Valinomycin可以完全破坏Δψ。由图7B可知,和对照相比,细菌素Bifidocin A的添加可引起荧光强度的迅速上升,最初4 min内荧光强度即由106上升至577,非常接近Valinomycin的破坏效果,随着时间的延长,荧光强度变化趋于平稳。这些结果表明,细菌素Bifidocin A作用引起敏感菌细胞Δψ的几乎完全耗散。
3 讨论与结论
首先研究了双歧杆菌细菌素Bifidocin A对金黄色葡萄球菌的抑菌作用,确定其MIC为0.058 μg/mL,发现其MIC维持在相对较低的质量浓度范围,且明显低于已报道的Bifidocin B[22]、Bifidin I[23]等其他双歧杆菌细菌素,说明该细菌素的抑菌活性较强,有较大的应用潜力;同时发现该细菌素对金黄色葡萄球菌CVCC 26112的抑制作用存在浓度依赖性,所获研究数据可为将来的工业化应用添加质量浓度的选择提供直接参考依据。
其次,重点从细胞形态与结构、细胞膜的通透性、细胞膜的完整性以及细胞膜质子移动势的变化4 个角度分别探讨了细菌素Bifidocin A对金黄色葡萄球菌的抑菌作用机制。结果表明,和其他乳酸菌细菌素一样,双歧杆菌细菌素Bifidocin A作用的主要部位同样是在敏感菌细胞膜上,其抑菌机制主要是通过耗散细胞膜质子移动势,增加细胞膜通透性,形成孔洞,进而破坏细胞膜完整性,并最终瓦解细胞。综合细胞膜通透性及质子移动势测定指标,推测质子动力势的成分Δψ和ΔpH值的消耗可以帮助细菌素插入敏感菌细胞膜形成孔洞并导致包内物质泄漏,这与Moll[24]、Sharma[25]以及Zhou Kang[26]等研究结论一致。然而,与已报道的Piscicocin CS526[27]、Lacticin 3147[28]等细菌素抑菌机制所不同的是,这些细菌素作用后形成的是只能通过小分子的选择性孔洞,而双歧杆菌细菌素Bifidocin A作用后形成的是无选择性孔洞,它可使小分子物质(K+和无机磷离子)和大分子物质(ATP)同时泄漏。结合SEM和TEM分析结果,可以看出,在敏感菌细胞发生严重形态变化前细胞内部结构已经被破坏,表明与敏感菌外部形态相比,其内部结构(包括蛋白质、核酸、细胞器如核糖体等)对细菌素的作用表现得更加敏感。结合激光共聚焦显微镜分析结果,可以推测在细菌素处理后,存在一些细胞膜结构相对完整但是内部组织破坏严重且已不可被培养的细胞。
此外,已有研究报道部分细菌素对敏感菌的抑菌作用还可能与其细胞内能量代谢及糖类转运系统等部分相关蛋白表达有关[29]。如Ramnath等[30]研究发现,细菌素Mesentericin Y105对单增李斯特菌的抑制作用与受体细胞中甘露糖特定磷酸转移酶系统有关。Bendali等[19]通过十二烷基硫酸钠-聚乙烯酰胺凝胶电泳发现干酪乳杆菌细菌素处理后李斯特菌细胞内少数蛋白表达量明显下降,但未对这些蛋白进行鉴定,对造成这种现象的原因也未给出合理解释。基于此,未来将考虑采用差异蛋白组学技术分析细菌素Bifidocin A对敏感菌细胞膜蛋白组成及表达的影响。
[1] CLEVELAND J, MONTVILLE T J, NES I F, et al. Bacteriocins: safe, natural antimicrobials for food preservation[J]. International Journal of Food Microbiology, 2001, 71: 1-20. DOI:10.1016/S0168-1605(01)00560-8.
[2] DEEGAN L H, COTTER P D, HILL C, et al. Bacteriocins: biological tools for bio-preservation and shelf-life extension[J]. International Dairy Journal, 2006, 16: 1058-1071. DOI:10.1016/ j.idairyj.2005.10.026.
[3] GÁLVEZ A, ABRIOUEL H, LÓPEZ R L, et al. Bacteriocinbased strategies for food biopreservation[J]. International Journal of Food Microbiology, 2007, 120(1): 51-70. DOI:10.1016/ j.ijfoodmicro.2007.06.001.
[4] HÉCHARD Y, SAHL H G. Mode of action of modified and unmodified bacteriocins from Gram-positive bacteria[J]. Biochimie, 2002, 84: 545-557. DOI:10.1016/S0300-9084(02)01417-7.
[5] MINAHK C J, FARÍAS M E, SESMA F, et al. Effect of enterocin CRL35 on Listeria monocytogenes cell membrane[J]. FEMS Microbiology Letters, 2000, 192: 79-83. DOI:10.1016/ j.foodcont.2016.09.036.
[6] GAO Y R, JIA S R, GAO Q, et al. A novel bacteriocin with a broad inhibitory spectrum produced by Lactobacillus sakei C2, isolated from traditional Chinese fermented cabbage[J]. Food Control, 2010, 21: 76-81. DOI:10.1016/j.foodcont.2009.04.003.
[7] ATRIH A, REKHIF N, MOIR A J G, et al. Mode of action, purification and amino acid sequence of plantaricin C19, an anti-Listeria bacteriocin produced by Lactobacillus plantarum C19[J]. International Journal of Food Microbiology, 2001, 68(1/2): 93-104. DOI:10.1016/S0168-1605(01)00482-2.
[8] CASTELLANO P, RAYA R, VIGNOLO G. Mode of action of lactocin 705, a two-component bacteriocin from Lactobacillus casei CRL705[J]. International Journal of Food Microbiology, 2003, 85(1): 35-43. DOI:10.1016/S0168-1605(02)00479-8.
[9] 周伟, 刘国荣, 李平兰, 等. 植物乳杆菌素L-1对单核细胞增生李斯特氏菌作用机理的研究[J]. 微生物学报, 2007, 47(2): 260-264. DOI:10.3321/j.issn:0001-6209.2007.02.015.
[10] CASTELLANO P, VIGNOLO G, FARIAS R N, et al. Molecular view by fourier transform infrared spectroscopy of the relationship between lactocin 705 and membranes: speculations on antimicrobial mechanism[J]. Applied and Environmental Microbiology, 2007, 73(2): 415-420. DOI:10.1128/AEM.01293-06.
[11] 李丽. 乳酸片球菌素抑菌机理研究[D]. 天津: 天津大学, 2009: 53-64.
[12] MARTINEZ F A C, BALCIUNAS E M, CONVERTI A, et al. Bacteriocin production by Bifi dobacterium spp.: a review[J]. Biotechnology Advances, 2013, 31(4): 482-488. DOI:10.1016/j.biotechadv.2013.01.010.
[13] YILDIRIM Z, JOHNSON M G. Characterization and antimicrobial spectrum of bifidocin B, a bacteriocin produced by Bifidobacterium bifi dum NCFB 1454[J]. Journal of Food Protection, 1998, 6(1): 47-51. DOI:10.4315/0362-028X-61.1.47.
[14] VON-AH U. Identifi cation of Bifi dobacterium thermophilum RBL67 isolated from baby faeces and partial purifi cation of its bacteriocin[D]. Zurich: Swiss Federal Institute of Technology Zurich, 2006.
[15] CHEIKHYOUSSEF A, POGORI N, CHEN H Q, et al. Antimicrobial activity and partial characterization of bacteriocin-like inhibitory substances (BLIS) produced by Bifidobacterium infantis BCRC 14602[J]. Food Control, 2009, 20(6): 553-559. DOI:10.1016/ j.foodcont.2008.08.003.
[16] LIU G, REN L, SONG Z, et al. Purification and characteristics of Bifidocin A, a novel bacteriocin produced by Bifi dobacterium animals BB04 from centenarians’ intestine[J]. Food Control, 2015, 50: 889-895. DOI:10.1016/j.foodcont.2014.10.049.
[17] CHEIKHYOUSSEF A, POGORI N, CHEN W. Antimicrobial proteinaceous compounds obtained from bifidobacteria: from production to their application[J]. International Journal of Food Microbiology, 2008, 125(3): 215-222. DOI:10.1016/ j.ijfoodmicro.2008.03.012.
[18] LU X, YI L, DANG J, et al. Purification of novel bacteriocin produced by Lactobacillus coryniformis MXJ 32 for inhibiting bacterial foodborne pathogens including antibiotic-resistant microorganisms[J]. Food Control, 2014, 46: 264-271. DOI:10.1016/ j.foodcont.2014.05.028.
[19] BENDALI F, GAILLARD-MARTINIE B, HEBRAUD M, et al. Kinetic of production and mode of action of the Lactobacillus paracasei subsp. paracasei anti-listerial bacteriocin, an Algerian isolate[J]. LWTFood Science and Technology, 2008, 41: 1784-1792. DOI:10.1016/ j.lwt.2008.02.010.
[20] YI L H, DANG J, ZHANG L H, et al. Purifi cation, characterization and bactericidal mechanism of a broad spectrum bacteriocin with antimicrobial activity against multidrugresistant strains produced by Lactobacillus coryniformis XN8[J]. Food Control, 2016, 67: 53-62. DOI:10.1016/j.foodcont.2016.02.008.
[21] MOUSSA M, PERRIER-CORNET J M, GERVAIS P. Damage in Escherichia coli cells treated with a combination of high hydrostatic pressure and subzero temperature[J]. Applied and Environmental Microbiology, 2007, 73: 6508-6518. DOI:10.1128/AEM.01212-07.
[22] YILDIRIM Z, WINTERS D K, JOHNSON M G. Purification, amino acid sequence and mode of action of bifidocin B produced by Bifidobacterium bifidum NCFB 1454[J]. Journal of Applied Microbiology, 1999, 86: 45-54. DOI:10.1046/j.1365-2672.1999.00629.x.
[23] CHEIKHYOUSSEF A, CHEIKHYOUSSEF N, CHEN H, et al. Bifi din I: a new bacteriocin produced by Bifi dobacterium infantis BCRC 14602: purifi cation and partial amino acid sequence[J]. Food Control, 2010, 121: 746-753. DOI:10.1016/j.foodcont.2009.11.003.
[24] MOLL G N, KONINGS W N, DRIESSEN A J M. Bacteriocins: mechanism of membrane insertion and pore formation[J]. Antonie van Leeuwenhoek, 1999, 76: 185-198. DOI:10.1007/978-94-017-2027-4_8.
[25] SHARMA A, SRIVASTAVA S. Anti-Candida activity of twopeptide bacteriocins, plantaricins (Pln E/F and J/K) and their mode of action[J]. Fungal Biology, 2014, 118: 264-275. DOI:10.1016/ j.funbio.2013.12.006.
[26] ZHOU Kang, ZHOU Wei, LI Pinglan, et al. Mode of action of pentocin 31-1: an antilisteria bacteriocin produced by Lactobacillus pentosus from Chinese traditional ham[J]. Food Control, 2008, 19(8): 817-822. DOI:10.1016/j.foodcont.2007.08.008.
[27] SUZUKI M, YAMAMOTO T, KAWAI Y, et al. Mode of action of piscicocin CS526 produced by Carnobacterium piscicola CS526[J]. Journal of Applied Microbiology, 2005, 98: 1146-1151. DOI:10.1111/ j.1365-2672.2005.02546.x.
[28] MCAULIFFE O, RYAN M P, ROSS R P, et al. Lacticin 3147, a broadspectrum bacteriocin which selectively dissipates the membrane potential[J]. Applied and Environmental Microbiology, 1998, 64: 439-445.
[29] DALET K, CENATIEMPO Y, COSSART P, et al. A sigma(54)-dependent PTS permease of the mannose family is responsible for sensitivity of Listeria monocytogenes to mesentericin Y105[J]. Microbiology, 2001, 147(12): 3263-3269. DOI:10.1099/00221287-147-12-3263.
[30] RAMNATH M, BEUKES M, TAMURA K, et al. Absence of a putative mannose-specific phosphotransferase system enzyme IIAB component in a leucocin A-resistant strain of Listeria monocytogenes, as shown by two-dimensional sodium dodecyl sulfate-polyacrylamide gel e1ectrophoresis[J]. Applied and Environmental Microbiology, 2000, 66(7): 3098-3101.
Antibacterial Activity and Mechanism of Bifidocin A against Staphylococcus aureus
LIU Guorong1, GAO Yakun1, WANG Xin1,2, LIU Yujie1, CAO Jilin1, WANG Chengtao1,*
(1. Beijing Advanced Innovation Center for Food Nutrition and Human Health, Beijing Engineering and Technology Research Center of Food Additives, Beijing Technology and Business University, Beijing 100048, China; 2. College of Food Science, Heilongjiang Bayi Agricultural University, Daqing 163319, China)
Bifidocin A, produced by Bifidobacterium animalis BB04, is a novel bacteriocin with antimicrobial activity against a wide range of foodborne bacteria. The objective of this study was to investigate the antibacterial activity and mechanism of action of bifidocin A against Staphylococcus aureus. The minimum inhibitory concentration (MIC) of bifi docin A for Staphylococcus aureus CVCC 26112 was 0.058 μg/mL. Time-kill assays showed that bifi docin A effectively inhibited the growth of Staphylococcus aureus CVCC 26112 in a time- and concentration-dependent manner. Results also suggested that bifi docin A exerted its anti-Staphylococcus aureus effect through the dissipation of the cytoplasmic membrane proton motive force (PMF), increased membrane permeability, and the formation of cell membrane pores, leading to the destruction of membrane integrity and ultimately complete disintegration of the cells.
bacteriocin; Bifi dobacterium spp.; Staphylococcus aureus; antibacterial activity; antibacterial mechanism
10.7506/spkx1002-6630-201717001
TS201.3
A
1002-6630(2017)17-0001-07
刘国荣, 郜亚昆, 王欣, 等. 双歧杆菌细菌素Bifidocin A对金黄色葡萄球菌的抑菌作用及其机制[J]. 食品科学, 2017, 38(17): 1-7. DOI:10.7506/spkx1002-6630-201717001. http://www.spkx.net.cn
LIU Guorong, GAO Yakun, WANG Xin, et al. Antibacterial activity and mechanism of bifi docin A against Staphylococcus aureus[J]. Food Science, 2017, 38(17): 1-7. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201717001. http://www.spkx.net.cn
2016-11-12
国家自然科学基金面上项目(31671832);北京市属高校高水平教师队伍建设支持计划青年拔尖人才培育计划项目(CIT&TCD201704034);国家自然科学基金青年科学基金项目(31201407)
刘国荣(1983—),女,副教授,博士,研究方向为乳酸菌及其活性代谢产物的理论与应用。E-mail:liuguorong@th.btbu.edu.cn
*通信作者:王成涛(1969—),男,教授,博士,研究方向为食品微生物与发酵技术。E-mail:wangchengtao@th.btbu.edu.cn

