肠内置管外引流术治疗新生儿坏死性小肠结肠炎的疗效分析
姬响华,王文华,郭凯娜
(郑州儿童医院,河南 郑州 450000)
肠内置管外引流术治疗新生儿坏死性小肠结肠炎的疗效分析
姬响华,王文华,郭凯娜
(郑州儿童医院,河南 郑州 450000)
目的:通过评价肠内置管外引流术治疗新生儿坏死性小肠结肠炎的临床疗效,探讨其临床应用前景。方法:选用2012年8月至2015年8月本院小儿外科重症监护室收治的由于肠道存在广泛病变而无法立即确认手术切除范围的80例坏死性小肠结肠炎新生儿作为研究对象,随机分为常规手术组和肠内置管外引流术组,各40例。常规手术组行常规手术治疗,肠内置管外引流术组采用肠内置管外引流术结合常规手术治疗。比较这两种手术方式治愈率的差异,术后6个月对痊愈的患儿进行定向回访,调查患儿术后体质量的改变情况、并发症的发生情况及预后情况。结果:肠内置管外引流术组患儿的治愈率为67.5%,明显高于常规手术组的47.5%(χ2=3.274,P=0.070);肠内置管外引流术组患儿的手术时间为(55.78±10.94)min,显著低于常规手术组的(80.28±11.62)min(t=9.711,P=0.000);术后回访结果显示,常规手术组的患儿体质量为(5.89±0.94)kg,明显低于肠内置管外引流术组的(6.28±0.61)kg(t=2.176,P=0.033);术后常规手术组患儿排便异常发生率为68.4%,明显高于肠内置管外引流术组的37%(χ2=4.394,P=0.036);术后常规手术组患儿不完全肠梗阻发生率为57.9%,明显高于肠内置管外引流术组的25.9%(χ2=4.785,P=0.029)。手术后大于3处的肠穿孔以及循环的衰竭是影响治疗效果及预后的主要因素。结论:肠内置管外引流术治疗新生儿坏死性小肠结肠炎能够缩短手术时间,提高该病的手术治愈率,有效减少术后并发症的发生,值得在临床进一步推广。
肠内置管外引流术; 新生儿; 坏死性小肠结肠炎
新生儿坏死性小肠结肠炎(necrotizing enterocolitis,NEC)是一种在新生儿中较为常见的消化系统疾病,其主要的临床表现为腹胀、腹痛、便血,严重时出现休克。NEC病情发展迅速,伴随较多并发症,这一疾病在我国的病死率高达10%~50%[1]。绝大部分NEC患儿通过早期内科保守治疗能够取得较好的临床效果,治愈率达82.1%[2]。临床20%~60%的患儿需要进行手术治疗[3],对内科保守治疗无效、病情继续加重的患儿,外科手术的治疗就起到了至关重要的作用。
目前NEC手术治疗的方式主要包括一期肠切除肠吻合术、坏死肠段切除结合双腔造瘘术、穿孔修补结合近段肠管造瘘术、单纯的肠造瘘管减压术、单纯的腹腔冲洗引流术以及在病房床旁进行的局麻下腹腔引流术[2- 4]。在手术治疗中最棘手的情况之一是肠管病变广泛,这种情况下肠道坏死程度较严重,手术过程中确定具体的切除范围难度较高,术后患儿的存活率较低[5]。
面对现阶段存在的广泛肠道病变的患儿,本院小儿外科近几年引进了一种新的手术方式,即肠内置管外引流术。这一手术治疗方式在临床上取得了较为满意的治疗效果,也积累了一部分临床治疗经验及病例,现将这些病例与传统的新生儿坏死性结肠炎手术治疗方式进行比较,探讨这种新的手术治疗方式的临床应用前景。
1 对象与方法
1.1 研究对象
选用2012年8月至2015年8月本院小儿外科重症监护室收治的80例坏死性小肠结肠炎新生儿,将其随机分为常规手术组和肠内置管外引流术组,各40例。两组患儿的各项基础资料之间差异无统计学意义(P>0.05),见表1。
1.2 诊断及分期标准
参照《诸福棠实用儿科学》第7版[6]和《实用新生儿学》[1]中有关于新生儿坏死性小肠结肠炎的诊断标准,具备以下4项中的2项特征:腹胀、呕吐、腹泻,呕吐物中夹带胆汁或呈现咖啡样,腹泻开始时呈现出水样便,日行4、5次至10余次不等,患儿肌张力表现低下并伴随出现嗜睡、呼吸暂停等症状。腹部X线平片显示部分肠壁呈现出囊样积气,病理检查特征为回肠远端、结肠近端坏死。便检色深、隐血试验呈现阳性,镜下检查发现数量不等的白细胞、红细胞。大便细菌培养以大肠埃希菌、克雷白菌以及桐绿杆菌多见[6]。具体分期标准参照修正的Bell- NEC分期标准[7]。
患儿不完全肠梗阻的诊断参考《外科学》中有关于不完全肠梗阻诊断的相关标准,并排除肠绞窄、急性腹膜炎以及腹部固定压痛等原因引起的肠梗阻[8]。
1.3 纳入标准
(1) 符合新生儿坏死性小肠结肠炎的诊断标准;(2)依据修正的Bell- NEC标准分期确认属于ⅡB期病例、符合肠道广泛病变无法立刻确认手术切除范围;(3)患儿法定监护人签署知情同意书;(4)所有患儿的手术均在本院小儿外科手术室进行,保证术前术后的各项检查资料以及随访资料完整。
1.4 排除标准
(1) 合并其他疾病如先心病、先天消化道畸形;(2)依据修正Bell分期标准不属于ⅡB期,不符合肠道广泛病变无法立刻确认手术切除范围;(3)术前术后的各项检查资料以及随访资料不够完整。
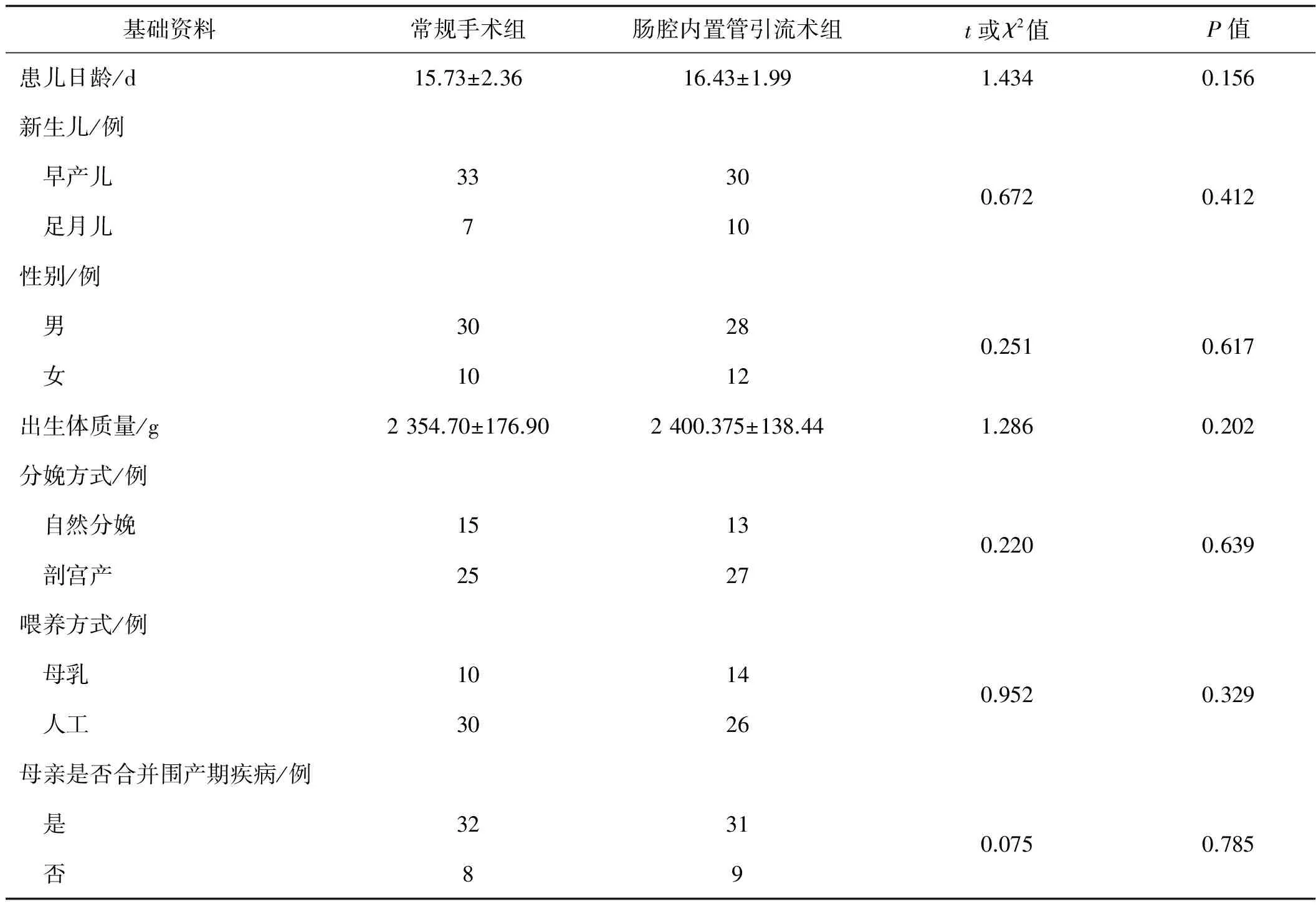
表1 两组坏死性小肠结肠炎患儿各项基础资料比较(n=40) 例
1.5 治疗方式
1.5.1 内科治疗 所有患儿术前术后均采用积极的内科对症治疗方式,包括禁食、胃肠减压、抗感染以及营养支持等。
1.5.2 常规手术治疗 局部病灶明显的患儿首先进行肠造瘘术,术后2~3个月再进行肠闭瘘术。或者先进行肠外置术,术后24 h进行手术探查,观察可疑肠管的恢复情况,根据恢复情况决定需要切除肠管的范围,进行肠造瘘术,凡是进行肠造瘘术存活的患儿均在术后2~3个月进行肠闭瘘术。
1.5.3 肠内置管外引流术治疗 在距离回盲部14~20 cm的肠壁处切一个长度约2 cm的切口。用吸引器将肠腔内的粪便、淤血与液体吸空,之后从切口处放入引流管(蘑菇头18号),固定肠管进行荷包缝合,引流管经腹壁切口引出,腹腔经过充分清洗之后常规留置腹腔的引流管,与此同时在腹腔上做另一个大约5 cm的切口引出,进行手术缝合,术后同时给予积极的内科治疗,7~10 d后对生命体征、病情稳定的患儿再次进行开腹手术。根据患儿的具体情况决定手术过程中选用的术式:如果患儿肠道恢复正常则进行一期肠吻合术;如果观察发现存在局限的病理改变,则在病变肠管切除之后再进行肠吻合术或者肠造瘘术,进行肠造瘘术后生存的患儿在手术完成2~3个月之后进行肠闭瘘术。
研究期间不同时间点同组患儿的治疗方式与治疗环境尽量保持一致,减小治疗过程中的误差。
1.6 预后判断
NEC手术治疗的预后判断主要包括治愈及死亡。治愈:无论进行手术治疗还是内科保守治疗,手术治疗无论是采用一期或者二期造瘘关闭术,亦或者一期肠切除吻合术,患儿在治疗后能够恢复正常的饮食,体质量逐步增加,即可定义为痊愈[9]。死亡:在外科手术治疗后死亡或者家长监护人放弃救治而自动出院造成的死亡。
患儿失访原因主要包括以下几个方面:(1)家长监护人放弃救治,自动出院造成的死亡;(2)家庭经济原因;(3)家长对这一疾病的认识存在不足。
1.7 观察指标
观察两组患儿的手术时间、治愈率以及术后6个月患儿的随访情况(包括体质量、排便以及肠梗阻情况)。
1.8 统计学处理
采用SPSS 17.0统计软件,计量资料用均数±标准差表示,行独立样本t检验,计数资料行卡方检验,P<0.05为差异具有统计学意义。
2 结 果
2.1 两组患儿手术时间、治愈率以及预后因素比较
常规手术组治愈19人,治愈率为47.5%,显著低于肠内置管外引流术组的67.5%(χ2=3.274,P=0.070);常规手术组的手术时间为(80.28±11.62)min,显著高于肠内置管外引流术组的(55.78±10.94)min(t=9.711,P=0.000);术后肠穿孔大于3处常规手术组13例,肠内置管外引流术组5例,两组差异显著(χ2=4.588,P=0.032);循环衰竭常规手术组14例,肠内置管外引流术组9例,两组差异显著(χ2=4.173,P=0.041)。
2.2 两组患儿术后并发症发生率及随访结果比较
术后6个月对治愈患儿进行随访,随访患儿未出现丢失现象,肠内置管外引流术组术后6个月体质量平均值为(6.28±0.61)kg,显著高于常规手术组的(5.89±0.94)kg;术后常规手术组排便异常发生率为68.4%,显著高于肠内置管外引流术组的37%;常规手术组不完全肠梗阻概率为57.9%,显著高于肠内置管外引流术组的25.9%。见表2。

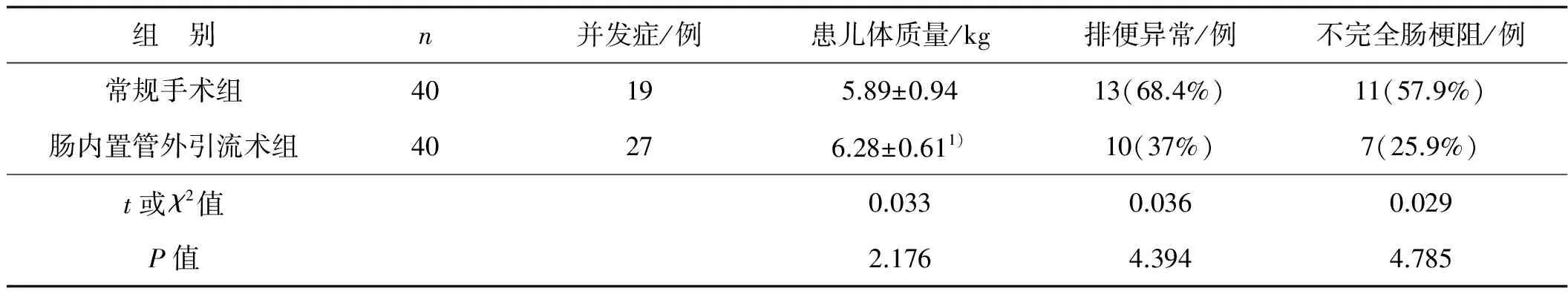
组 别n并发症/例患儿体质量/kg排便异常/例不完全肠梗阻/例常规手术组40195.89±0.9413(68.4%)11(57.9%)肠内置管外引流术组40276.28±0.611)10(37%)7(25.9%)t或χ2值0.0330.0360.029P值2.1764.3944.785
3 讨 论
新生儿坏死性小肠结肠炎是一种在新生儿中较为常见的消化系统疾病,病情发展迅速,并发症多,是造成新生儿死亡的主要疾病之一,在早产儿以及低体质量患儿中的发病率和死亡率最高,对内科治疗无效、病情进一步加重的患儿,外科手术治疗就起到了至关重要的作用。NEC产生的病因尚不明确,目前认为发生NEC的基本条件主要包括以下方面:肠黏膜损伤、肠道细菌作用结果及肠胃喂养,与此同时胎龄不足、致病菌增长过度、缺氧缺血性损伤、高渗配方奶粉的喂养以及胃肠道的屏障功能低下等,这一系列的高危因素均可能导致NEC的产生[10- 11]。
目前针对NEC的治疗方法包括内科保守治疗以及手术治疗。内科治疗方式主要有禁食、抗感染、胃肠减压、营养的支持以及人工通便等方式。对于NECⅡ期的患儿,大多数情况下通过保守治疗的方式是可以治愈的,但仍旧有相当一部分的患儿病情会发生进一步的进展,逐渐发展成为Ⅲ期,在疾病发展的过程中十分容易导致一系列严重并发症的产生,如腹膜炎、肠壁坏死穿孔、败血症、结肠炎等[12]。因此在正确合适的时间对NEC患儿进行及时有效的手术治疗,不仅能够有效延缓病情的进一步发展,减少并发症发生率,而且能够尽量保留肠道组织,避免短肠综合征的出现,达到减少病死率的最终目的[13]。在治疗NEC时传统外科常常将患儿是否出现肠穿孔作为是否需要进行手术的判断依据,这样容易延误患儿的最佳手术时机,从而增加了术后死亡率。目前研究结果[14]显示,患儿即使在病变的初期也可以接受手术的治疗,当患儿的肠壁出现了局部的缺血性组织坏死时,就可以进行手术的治疗,尽管此时患儿尚未出现肠穿孔。根据代谢紊乱频数也能确定手术时机,如血培养呈现阳性、血小板减少、低血压、低血钠、酸中毒等,这样就能在肠穿孔之前及时地进行确诊和手术干预,改善预后[15]。在手术治疗过程中常见的治疗方式有肠切除肠吻合术、肠穿孔修补术、肠管造瘘术、单纯腹腔冲洗引流、床旁进行的局麻下腹腔引流术[16]。手术方案要根据患儿病情进行具体选择,在各种NEC患儿的手术方案中,最棘手的情况就是肠道广泛病变,这种广泛病变使我们无法在术中确定患病肠道的具体切除范围,对于此类病变的传统治疗方式是先采用肠造瘘术或者肠外置术,待24 h后再进行手术来寻找病变的肠道,确定切除范围,研究结果显示这种手术方式的存活率较低,仅为47.5%。
肠内置管外引流术是本院近几年来开展的一项全新的手术方式,采用Ⅰ期肠内置管外引流术来代替传统的Ⅰ期肠造瘘术或者肠外置术,取得了较好的临床效果,这种手术方式有效地提高了NEC患儿的存活率,使其从47.5%提高到了67.5%,差异显著(P<0.05)。从手术进行时间来看,采用肠内置管外引流术的手术时间为(55.78±10.94)min,明显短于常规术式的(80.28±11.62)min,差异显著(P<0.01),说明采用肠内置管外引流术进行治疗减少了手术步骤,有效减少手术时间,避免手术时间过长对患儿生命体征造成影响。术后6个月,接受肠内置管外引流术的患儿平均体质量为(6.28±0.61)kg,接受常规手术患儿的体质量为(5.89±0.94)kg。常规手术方式术后有68.4%的患儿出现了腹泻等排便异常情况,57.9%的患儿出现了不完全肠梗阻,而肠内置管外引流术的患儿腹泻与不完全肠梗阻的发病率仅为37%与25.9%,各项指标比较,两组之间的差异均具有统计学意义(P<0.05)。这一结果说明肠内置管外引流术能够有效减轻患儿肠管压力,有助于肠管营养吸收功能的恢复,降低术后并发症的发生率。通过分析两组治愈与死亡患儿的预后因素后发现,肠穿孔(大于3处)以及循环衰竭是影响预后以及手术治疗效果最主要的因素。术中见多处肠穿孔说明该患儿肠道病变较为广泛,手术难度大,术后恢复受影响,而循环衰竭标志着疾病严重,循环衰竭会加重肠道缺血缺氧的程度,加速病情的发展,患儿多表现休克,预后往往不良,这与唐维兵等[17]的研究结果一致。
NEC的诊断与治疗对新生儿科来说仍旧是一个挑战,该病发展迅速、治疗难度大、死亡率高,严重威胁着新生儿的生命健康。对内科保守治疗效果不佳的患儿应及时进行手术治疗,从而有效降低患儿的死亡率。从肠内置管外引流术在手术时间、患儿生存率及术后并发症的发生等方面均显著优于常规手术组,在治疗的过程中有效地节约了手术时间,避免了在手术过程中肠道长时间的暴露所引起的患儿生命体征的不稳定,缓解了肠壁的张力,减少了患儿对附着于肠壁上的细菌和毒素的吸收量,有助于患儿术后的恢复。选用肠内置管外引流术,还能够有效缓解肠壁压力,同时促进血流的恢复,避免了常规手术在造瘘过程中切除过多的肠管,使得更多肠管得以保留,有助于术后患儿营养功能的恢复,从而有效避免了并发症的产生。
[1] 邵肖梅,叶鸿瑁,丘小汕.实用新生儿学[M].北京:人民卫生出版社,2011:477- 483.
[2] WRIGHT N J, THYOKA M, KIELY E M, et al. The outcome of critically ill neonates undergoing laparotomy for necrotizing enterocolitis in the neonatal intensive care unit:a 10- year review[J]. J Pediatr Surg, 2014,49(8):1210- 1214.
[3] 王暋果,李振东.小儿外科手术学[M].北京:人民卫生出版社,2000:581- 584.
[4] 刘贵林.手术学全集:小儿外科卷[M].北京:人民军医出版社,1996:120- 136.
[5] PIKOULIS C, PETRIDES N, KYRIAKOS I, et al. Pneumatosis cystoides intestinalis after cetuximab chemotherapy for squamous cell carcinoma of parotid gland[J]. Case Rep Surg, 2015,20(15):530- 536.
[6] 胡亚美,江载芳.诸福棠实用儿科学[M].7版.北京:北京人民出版社,2005:475
[7] WALSH M C, KLIEGMAN R M. Necrotizing enterocolitis:treatment based on staging criteria[J]. Pediatr Clin North Am,1986,33(1):179- 201.
[8] 陶钧. 中西医结合治疗小儿不完全性肠梗阻疗效分析[J].实用中医药杂志,2017,33 (2):158- 159.
[9] 吴少祯.常见疾病的诊断与疗效判定标准[M].北京:中国中医药出版社,1999:562- 563.
[10] CILIEBORG M S, BOYE M, SANGILD P T.Bacterial colonization and gut development in preterm neonates[J].Early Hum,2012,88(1):S41- 49.
[11] El- DIB M, NARANG S, LEE E, et al.Red blood cell transfusion, feeding and necrotizing enterocolitis in preterm infants[J].J Perinatol, 2011,31(3):183- 187.
[12] 余珍珠,黄惠君,刘晓红,等.手术治疗新生儿坏死性小肠结肠炎28例临床分析[J].中国小儿急救医学,2014,21(1):36- 38.
[13] 刘宗印,王莉,赵雪卉,等.肠内置管外引流术治疗坏死性小肠结肠炎患儿的临床疗效[J].中国现代普通外科进展,2016,19(1):53- 55.
[14] 汪健.新生儿坏死性小肠结肠炎的预防和外科治疗[J].中华实用儿科临床杂志,2013,28(23):1771- 1772.
[15] TEPAS J J 3rd, SHARMA R, LEAPHART C L, et al. Timing of surgical intervention in nerotizing enterocolitis can be determined. By trajectory of metabolic derangement[J]. Pediatr Surg, 2010,45(2):310- 314.
[16] 李红卫,梁振,王国彦,等.新生儿坏死性小肠结肠炎外科手术时机和术式的决策[J].医学理论与实践,2015,28(17):2363- 2365.
[17] 唐维兵,刘翔,耿其明,等.新生儿坏死性小肠结肠炎的手术指征探讨[J].中华小儿外科杂志,2015,36(2):100- 104.
2016- 10- 01
2017- 04- 26
河南省2013年基础与前沿技术研究计划项目(132300410251)
姬响华(1982-),女,河南郑州人,主管护师。E- mail:haa0608@sina.com
姬响华,王文华,郭凯娜.肠内置管外引流术治疗新生儿坏死性小肠结肠炎的疗效分析[J].东南大学学报:医学版,2017,36(4):542- 546.
R656.7; R656.9
A
1671- 6264(2017)04- 0542- 05
10.3969/j.issn.1671- 6264.2017.04.008

