川芎嗪对人肝癌细胞TGF- β1/Smads通路的影响
李克跃,石承先,汤可立,魏国微,张帅民,徐闲刚,刘振华,黎涛
(贵州省人民医院 肝胆外科,贵州 贵阳 550002)
川芎嗪对人肝癌细胞TGF- β1/Smads通路的影响
李克跃,石承先,汤可立,魏国微,张帅民,徐闲刚,刘振华,黎涛
(贵州省人民医院 肝胆外科,贵州 贵阳 550002)
目的:研究川芎嗪(tetramethylpyrazine,TMP)对人肝癌细胞TGF- β1/Smads通路的影响,以探讨其抑制肝癌的原因。方法:将人肝癌细胞分为4个组,即对照组和不同质量浓度的TMP组(0.04、0.2、1.0 mg·ml-1),各组给予对应药物干预24 h,CCK- 8细胞计数法测定细胞增殖水平的变化,real- time PCR方法检测各组肝癌细胞TGF- β1、Smad4及Smad7 mRNA表达,Western blotting方法检测各组细胞TGF- β1及Smad4蛋白表达。结果:在TMP干预24 h后,肝癌细胞的增殖明显受到抑制,肝癌细胞TGF- β1及Smad7的mRNA及蛋白表达明显下调,而Smad4的mRNA及蛋白表达明显上调(均P<0.05),呈现浓度依赖性。结论:TMP的抗肝癌作用可能与它对肝癌细胞TGF- β1/Smads通路的调控有关。
肝癌; TGF- β1/Smads; 川芎嗪
肝细胞癌(hepatocellular carcinoma,HCC)是临床常见的恶性肿瘤,全世界每年有将近600 000患者死于肝细胞癌[1]。手术切除是唯一可能治愈肝细胞癌的手段,但是肝细胞癌患者术后5年生存率仅为30%~40%[2],其原因是肝细胞癌具有较高的复发和转移率。转化生长因子β1(transforming growth factor- β1,TGF- β1)在肝癌组织中明显高表达,已被用于判断肝癌恶性程度及预后[3- 5]。TGF- β1主要通过TGF- β1/Smads信号转导通路发挥生物学作用,该通路在肝癌的形成、进展及转移等过程中发挥了重要作用[6- 7]。川芎嗪(tetramethylpyrazine,TMP)是中药川芎提取的单体,有一定的抗肝癌作用[8- 10],具有副作用小等特点,其抗肝癌的机制未彻底阐明,对HCC中TGF- β1/Smads信号转导通路的作用也不清楚。本研究对体外培养的人肝癌细胞使用不同质量浓度的川芎嗪干预,观察它们对细胞增殖及TGF- β1、Smad4、Smad7 mRNA和蛋白表达的影响,为合理应用川芎嗪治疗HCC提供理论依据。
1 材料与方法
1.1 材料
Hep 3B人肝癌细胞系购买于中国科学院典型培养物保藏中心;胎牛血清(Gibco公司);DMEM、0.25%胰蛋白酶及青霉素-链霉素溶液(Hyclone公司);SYBRR Premix Ex TaqTM实时PCR试剂盒(RP820A,TaKaRa公司);RNA提取试剂盒、反转录试剂盒(上海生工生物有限公司);TGF- β1上游引物序列5′- ACAATTCCTGGCGATACCTC- 3′,下游引物序列5′- TAAGGCGAAAGCCCTCAAT- 3′;Smad4上游引物序列5′- ACGAACGAGTTGTATCACCTGG- 3′,下游引物序列5′- TGCACGATTACTTGGTGGATG- 3′;Smad7上游引物序列5′- GGACGCTGTTGGTACACAAG- 3′,下游引物序列5′- GCTGCATAAACTCGTGGTCATTG- 3′;GAPDH上游引物序列5′- TGACTTCAACAGCGACACCCA- 3′,下游引物序列5′- CACCCTGTTGCTGTAGCCAAA- 3′(引物由Introgen公司合成);抗TGF- β1抗体(ab92486)、抗Smad4抗体(ab40759)(Abcam公司);抗β- actin抗体、山羊抗兔lgG- HRP(北京全是金生物技术有限公司)。注射用盐酸川芎嗪(北京四环科宝制药有限公司,批号14032015)用DMEM培养液溶解为指定的质量浓度,0.22m滤器除菌,临用时配制。
1.2 细胞培养
采用6孔板培养实验所用细胞,用含5%FBS的完全培养基2 ml培养,细胞密度为(4~5)×104孔-1,培养箱条件为37 ℃、体积分数5%的CO2。1~2 d换培养液1次,2~4 d细胞布满瓶底后用胰酶消化传代,所用细胞为8~10代。
1.3 细胞分组及其处理
细胞总共分为4个组,即对照组和肝癌细胞+不同质量浓度的TMP(0.04、0.2、1.0 mg·ml-1)组。待细胞生长到50%左右后使用无血清的DMEM饥饿过夜,次日各组细胞加入含有上述不同组别药物的培养基培养24 h。
1.4 观察指标
1.4.1 细胞增殖水平的测定 采用CCK- 8法。转移细胞至96孔板,将细胞浓度调整为5×104ml-1,每孔100 μl,做5个复孔,细胞培养条件为37 ℃、体积分数5%的CO2。细胞经饥饿过夜后加入上述对应质量浓度药物分别培养24 h,然后每孔加入CCK- 8试剂10 μl培养2.5 h,在酶标仪450 nm波长处测定各组细胞的光密度值(OD值),采用扣除本底的策略来消除误差。
1.4.2 细胞TGF- β1、Smad4及Smad7 mRNA的表达 采用real- time PCR方法检测。各组细胞分别提取RNA,选择完整性高、纯度好的RNA进行cDNA的合成。real- time PCR反应体系为20 μl,其中2×SYBRRPremix 10 μl,上下游引物各0.4 μl,cDNA 2 μl,ddH2O 7.2 μl。反应条件为95 ℃预热30 s后进行40个循环,循环的条件为95 ℃ 5 s、60 ℃ 30 s。以GAPDH作为内参测定目的基因的相对表达量,以2-ΔΔct法计算目的基因的相对表达量。
1.4.3 细胞TGF- β1及Smad4蛋白的表达 使用Western blotting方法检测。将各组细胞分别提取总蛋白后通过BCA法测定蛋白浓度,将蛋白配平后放置于聚丙烯酰胺凝胶中进行电泳,进行PVDF转膜后以足量的封闭液给予封闭,按1∶5 000比例稀释目的蛋白的一抗,在4 ℃冰箱内孵育过夜。回收一抗后以足量的TBST在摇床上洗PVDF膜3次,每次10 min。按1∶5 000比例稀释二抗后在室温下振荡孵育2 h,倒掉二抗孵育液后以足量的TBST清洗PVDF膜3次,每次10 min。电化学发光后用显影和定影方法对胶片进行拍照及扫描,以β- actin蛋白为内参蛋白,用Quantity one系统分析目的条带的相对灰度值。
1.5 统计学处理
2 结 果
2.1 不同质量浓度的TMP对人肝癌细胞增殖水平的影响
使用不同质量浓度的TMP干预后,肝癌细胞的增殖明显受到抑制(0.489±0.011vs0.516±0.005,P=0.001;0.460±0.006vs0.516±0.005,P=0.000;0.405±0.014vs0.516±0.005,P=0.000),呈现浓度依赖性。
2.2 不同质量浓度的TMP对人肝癌细胞TGF- β1、Smad4及Smad7 mRNA表达的影响
使用不同质量浓度的TMP干预后,人肝癌细胞的TGF- β1(0.937±0.025vs1.000±0.088,P=0.808;0.875±0.045vs1.000±0.088,P=0.044;0.634±0.041vs1.000±0.088,P=0.000)及Smad7(0.944±0.032vs1.000±0.019,P=0.114;0.840±0.036vs1.000±0.019,P=0.000;0.767±0.026vs1.000±0.019,P=0.000)mRNA表达明显下调,Smad4(0.738±0.037vs0.656±0.042,P=0.073;0.869±0.020vs0.656±0.042,P=0.000;1.000±0.053vs0.656±0.042,P=0.000)mRNA的表达明显上调,呈现浓度依赖性。
2.3 不同质量浓度的TMP对人肝癌细胞TGF- β1及Smad4蛋白表达的影响
使用不同质量浓度的TMP干预后,肝癌细胞的TGF- β1(0.931±0.013vs1.000±0.092,P=0.512;0.855±0.037vs1.000±0.092,P=0.012;0.734±0.031vs1.000±0.092,P=0.000)蛋白表达明显下调,而Smad4(0.787±0.019vs0.735±0.024,P=0.053;0.876±0.023vs0.735±0.024,P=0.000;1.000±0.029vs0.735±0.024,P=0.000)蛋白表达明显上调,与mRNA表达变化趋势一致,呈现明显的浓度依赖性,见图1。
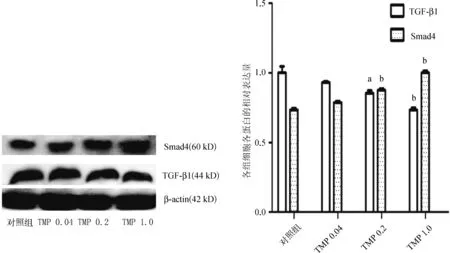
图1 不同质量浓度的川芎嗪对人肝癌细胞TGF- β1及Smad4蛋白表达的影响
Fig 1 Effects of different concentration of TMP on proteins expression of TGF- β1 and Smad4
3 讨 论
TGF- β1在调节细胞的增殖、分化以及凋亡等过程中发挥了重要作用,在肝癌细胞中表达明显增高[3,11]。TGF- β1在肝癌的发生过程中起双向调节作用,即在肝癌形成早期抑制肿瘤的生长,在肝癌进展期则促进肿瘤的生长[12- 14]。TGF- β1主要是通过与其受体TβRⅠ、TβRⅡ及TβRⅢ形成复合物后调控Smad2/Smad3、Smad4、Smad6/Smad7等蛋白,形成TGF- β1/Smads信号转导通路发挥生物学作用,在该通路中Smad4是通用Smad(Co- Smad),Smad2/Smad3是受体Smad(R- Smad),Smad6/Smad7是抑制Smad(I- Smad)[14]。在肝细胞肝癌组织中TGF- β1及Smad7的表达明显上调,而Smad4的表达明显下调,提示TGF- β1/Smads信号传导通路在肝癌的形成、进展及转移等过程中可能发挥了重要作用[4,11]。研究表明,Smad4可能通过诱导肿瘤细胞凋亡、降低癌细胞中VEGF的表达、与其它细胞外基质或信号通路相互作用等途径抑制肿瘤生长[15- 17]。肝癌组织中TGF- β1的过高表达可能是由肝癌细胞的自分泌及旁分泌产生的[18- 19]。TGF- β1/Smads信号传导通路在肝癌的形成、进展及转移等过程中发挥了重要作用。因此,调控TGF- β1/Smads通路的表达已经成为了治疗肝癌的主要手段之一[7,20]。
川芎嗪是中药川芎的提取单体,具有抗组织纤维化、抗氧自由基、改变血液流变学、免疫抗肿瘤等功效,副作用较小,其抗肝癌机制可能与诱导肝癌细胞的凋亡及自噬等因素有关[9],也有可能与其调控Bax、Bcl- 2基因的表达从而调控细胞的凋亡及增殖周期有关[8],还有可能与其调控肝癌细胞中MDR1、MRP2、MRP3、MRP5、P- gp170基因的表达[10,21]及NF- κB/p65、COX- 2的表达有关[22]。本实验结果提示,川芎嗪抑制体外培养的HCC细胞增殖,下调TGF- β1及Smad7的mRNA及蛋白表达,同时上调Smad4的mRNA及蛋白表达,提示川芎嗪的抗肝癌机制之一可能与其对该细胞中TGF- β1/Smads通路进行调控有关。
综上所述,TMP的抗肝癌作用可能与它对肝癌细胞TGF- β1/Smads通路的调控有关。
[1] TSOCHATZIS E A,MEYER T,BURROUGHS A K.Hepatocellular carcinoma[J].N Engl J Med,2012,366(1):92- 93.
[2] MALUCCIO M,COVEY A.Recent progress in understanding,diagnosing,and treating hepatocellular carcinoma[J].CA Cancer J Clin,2012,62(6):394- 399.
[3] DONG Z Z,YAO D F,YAO M,et al.Clinical impact of plasma TGF- beta1 and circulating TGF- beta1 mRNA in diagnosis of hepatocellular carcinoma[J].Hepatobiliary Pancreat Dis Int,2008,7(3):288- 295.
[4] LU Y,WU L Q,LI C S,et al.Expression of transforming growth factors in hepatocellular carcinoma and its relations with clinicopathological parameters and prognosis[J].Hepatobiliary Pancreat Dis Int,2008,7(2):174- 178.
[5] PAIK S Y,PARK Y N,KIM H,et al.Expression of transforming growth factor-beta1 and transforming growth factor- beta receptors in hepatocellular carcinoma and dysplastic nodules[J].Mod Pathol,2003,16(1):86- 96.
[6] MACIAS M J,MARTIN- MALPARTIDA P,MASSAGUE J.Structural determinants of Smad function in TGF- β signaling[J].Trends Biochem Sci,2015,40(6):296- 308.
[7] WANG Y,WU J,LIN B,et al.Galangin suppresses HepG2 cell proliferation by activating the TGF- beta receptor/Smad pathway[J].Toxicology,2014,326:9- 17.
[8] CAO J,MIAO Q,ZHANG J,et al.Inhibitory effect of tetramethylpyrazine on hepatocellular carcinoma:possible role of apoptosis and cell cycle arrest[J].J Biol Regul Homeost Agents,2015,29(2):297- 306.
[9] CAO J,MIAO Q,MIAO S,et al.Tetramethylpyrazine (TMP) exerts antitumor effects by inducing apoptosis and autophagy in hepatocellular carcinoma[J].Int Immunopharmacol,2015,26(1):212- 220.
[10] WANG X B,WANG S S,ZHANG Q F,et al.Inhibition of tetramethylpyrazine on P- gp,MRP2,MRP3 and MRP5 in multidrug resistant human hepatocellular carcinoma cells[J].Oncol Rep,2010,23(1):211- 215.
[11] JI G Z,WANG X H,MIAO L,et al.Role of transforming growth factor- beta1- smad signal transduction pathway in patients with hepatocellular carcinoma[J].World J Gastroenterol,2006,12(4):644- 648.
[12] AKHURST R J,DERYNCK R.TGF- beta signaling in cancer- - a double- edged sword[J].Trends Cell Biol,2001,11(11):S44- 51.
[13] TIAN M,SCHIEMANN W P.The TGF- beta paradox in human cancer:an update[J].Future Oncol,2009,5(2):259- 271.
[14] Correction:role of transforming growth factor (beta) in human disease[J].N Engl J Med,2000,343(3):228.
[15] IMAMICHI Y,WAIDMANN O,HEIN R,et al.TGF beta- induced focal complex formation in epithelial cells is mediated by activated ERK and JNK MAP kinases and is independent of Smad4[J].Biol Chem,2005,386(3):225- 236.
[16] SAHA D,DATTA P K,BEAUCHAMP R D.Oncogenic ras represses transforming growth factor- beta/Smad signaling by degrading tumor suppressor Smad4[J].J Biol Chem,2001,276(31):29531- 29537.
[17] TANNAPFEL A,ANHALT K,HAUSERMANN P,et al.Identification of novel proteins associated with hepatocellular carcinomas using protein microarrays[J].J Pathol,2003,201(2):238- 249.
[18] SUGANO Y,MATSUZAKI K,TAHASHI Y,et al.Distortion of autocrine transforming growth factor beta signal accelerates malignant potential by enhancing cell growth as well as PAI- 1 and VEGF production in human hepatocellular carcinoma cells[J].Oncogene,2003,22(15):2309- 2321.
[19] ABOU- SHADY M,BAER H U,FRIESS H,et al.Transforming growth factor betas and their signaling receptors in human hepatocellular carcinoma[J].Am J Surg,1999,177(3):209- 215.
[20] HU X,RUI W,WU C,et al.Compound Astragalus and Salvia miltiorrhiza extracts suppress hepatocarcinogenesis by modulating transforming growth factor- beta/Smad signaling[J].J Gastroenterol Hepatol,2014,29(6):1284- 1291.
[21] 梅英,石毓君,左国庆,等.川芎嗪逆转HepG2/ADM细胞多药耐药性的体外研究[J].中国中药杂志,2004,29(10):970- 973.
[22] ZHANG C,YAN W,LI B,et al.A New Ligustrazine derivative- selective cytotoxicity by suppression of NF- κB/p65 and COX- 2 expression on human hepatoma cells.Part 3[J].Int J Mol Sci,2015,16(7):16401- 16413.
Effect of tetramethylpyrazine on TGF- β1/Smads signaling pathway in hepatocellular carcinoma
LI Ke- yue,SHI Cheng- xian,TANG Ke- li,WEI Guo- wei,ZHANG Shuai- min,XU Xian- gang,LIU Zhen- hua,LI Tao
(DepartmentofHepatobiliarySurgery,GuizhouProvincialPeople’sHospital,Guiyang550002,China)
Objective: To investigate tetramethylpyrazine(TMP) effects on transforming growth factor- β1 (TGF- β1)/Smads signaling pathway in hepatocellular carcinoma (HCC). Methods: HCC cells were divided into four groups:control group, different concentration of TMP(0.04,0.2 and 1.0 mg·ml-1). After respectively incubated with 24 h, cells proliferation was investigated by CCK- 8, Relative mRNA expression of TGF- β1, Smad4 and Smad7 in HCC were assessed by real- time PCR. Relative proteins expression of TGF- β1 and Smad4 were investigated by Western blotting. Results: TMP significantly attenuated cells proliferation, significantly down- regulated both the mRNA and protein expression of TGF- β1 and Smad7, significantly up- regulated the mRNA and protein expression of Smad4 (allP<0.05). Conclusion: TMP effects anti- HCC possibly through modulating TGF- β1/Smads signaling pathway.
hepatocellular carcinoma; TGF- β1/Smads; tetramethylpyrazine
2016- 11- 17
2017- 04- 26
贵州省中医药、民族医药科学技术研究课题资助(GZYY- 2015- 002)
李克跃(1978-),男,贵州贵阳人,副主任医师,医学博士。E- mail:keyuelee@sohu.com
李克跃,石承先,汤可立,等.川芎嗪对人肝癌细胞TGF- β1/Smads通路的影响[J].东南大学学报:医学版,2017,36(4):554- 558.
R282.710.7; R735.7
A
1671- 6264(2017)04- 0554- 05
10.3969/j.issn.1671- 6264.2017.04.011

