呼吸机相关性肺炎新生儿血清及支气管肺泡灌洗液中炎症因子和氧化指标的动态变化及其临床意义
邓毅,谭媛,杨伟丽,雷凤,蒙真,唐正荣,谢勇,欧维琳
(1.桂林医学院第二附属医院 新生儿科,广西 桂林 541001; 2.桂林医学院附属医院 儿科,广西 桂林 541001)
呼吸机相关性肺炎新生儿血清及支气管肺泡灌洗液中炎症因子和氧化指标的动态变化及其临床意义
邓毅1,谭媛1,杨伟丽1,雷凤1,蒙真1,唐正荣1,谢勇1,欧维琳2
(1.桂林医学院第二附属医院 新生儿科,广西 桂林 541001; 2.桂林医学院附属医院 儿科,广西 桂林 541001)
目的:探讨呼吸机相关性肺炎(ventilator associatel peneumonia,VAP)新生儿血清和支气管肺泡灌洗液(bronchial pulmonary dysplasia, BALF)中白介素1(interleukin- 1,IL- 1)、白介素2(interleukin- 2,IL- 2)、白介素6(interleukin- 6,IL- 6)、白介素8(interleukin- 8,IL- 8)和肿瘤坏死因子- α(tumor necrosis factor alpha, TNF- α)等炎症因子以及超氧化歧化酶(superoxide dimutase,SOD)、丙二醛(malondialdehyde,MDA)和髓过氧化物酶(Myeloperoxidase,MPO)等氧化指标动态变化及临床意义。方法:对80例接受机械通气的新生儿进行临床分析,分别在气管插管后24、48、96 h采集外周血和BALF,测定IL- 1、IL- 2、IL- 6、IL- 8、TNF- α、SOD、MDA和MPO水平。将新生儿根据是否发生VAP分为VAP组和NVAP组,其中VAP组40例,NVAP组40例。结果:两组气管插管后24 h血清和BALF中炎症因子和氧化指标均无显著性差异(P>0.05)。气管插管后48、96 h两组血清和BALF中IL- 1、IL- 6、IL- 8、TNF- α、MDA和MPO水平明显增高(P<0.05),IL- 2和SOD水平明显降低(P<0.05);与NVAP组比,VAP组血清和BALF中IL- 1、IL- 6、IL- 8、TNF- α、MDA和MPO水平明显增高(P<0.05),IL- 2和SOD水平明显降低(P<0.05)。结论:随着机械通气时间的延长,VAP组血清及BALF中IL- 1、IL- 6、IL- 8和TNF- α促炎因子水平升高,IL- 2抗炎因子水平降低,促炎和抗炎平衡打破;MDA和MPO水平增高,SOD抗氧能力降低,氧化还原系统平衡打破。临床中在诊断和评估VAP病情时,尤其应关注血清及BALF中IL- 8的变化。
呼吸机相关性肺炎; 肺泡灌洗液; 炎症因子; 超氧化歧化酶; 丙二醛; 髓过氧化物酶; 炎症因子; 氧化指标; 新生儿
在新生儿重症监护病房(neonatal intensive care unit, NICU)中,呼吸机辅助通气治疗成为危重新生儿生命支持的重要手段,而呼吸机相关性肺炎(ventilator associatel peneumonia,VAP)是机械通气患儿的常见并发症和主要的致死原因。据统计,我国NICU中,VAP发病率及死亡率均较高,分别为42.8%和16.4%[1]。越来越多的研究表明,促炎与抗炎机制失衡在VAP的发生中起了重要的作用[2- 4],而早诊断、早治疗可降低耐药菌出现的几率,降低VAP患儿的死亡率及缩短住院时间[5]。目前VAP还缺乏比较准确和敏感的早期诊断指标。本研究分析炎症因子和氧化相关指标在血清及支气管肺泡灌洗液(bronchial pulmonary dysplasia, BALF)中的动态变化,分析炎症因子和氧化相关指标与VAP的相关性,探讨上述指标在VAP患儿早期诊断中的临床意义。
1 对象与方法
1.1 研究对象
通过医院伦理委员会审查,收集2014年8月至2016年8月桂林医学院第二附属医院新生儿科所有确诊为医院获得性肺炎[6]并采用呼吸机辅助通气治疗的患儿958例为临床分析对象。VAP诊断标准:(1)肺部可闻及湿啰音;(2)胸部影像学提示肺部有浸润阴影;(3)体温>37.5℃;(4)外周血白细胞>10×109L-1。其中(1)、(2)为必要条件,(3)、(4)具备之一。符合研究要求的患儿共80例(66.12%),剔除出生>7 d的患儿469例,剔除气管插管且呼吸机辅助通气<96 h的患儿402例,剔除存在早发型严重感染、原有呼吸道感染、严重先天性心脏病及神经系统畸形的新生儿7例。依据是否发生VAP分为VAP组和NVAP组。其中VAP组男26例,女14例,平均孕周(33.9±4.8)周,出生时间(3.2±0.8)d,平均体质量(3 015.4±154.8)g,平均带管时间(105.4±46.8)h,吸入氧浓度(72.5±9.8)%,吸入气峰压(22.7±2.5)mmHg;NVAP组男25例,女15例,平均孕周(34.2±5.1)周,出生时间(3.1±0.9)d,平均体质量(3 064.4±129.8)g,平均带管时间(103.8±59.7)h,吸入氧浓度(73.8±10.1)%,吸入气峰压(22.6±2.4)mmHg。两组患儿的机械通气模式均为高频振荡通气,且两组患儿基本情况差异均无统计学意义。所有家属均签署参与临床医学研究的知情同意书。
1.2 标本收集
1.2.1 静脉血清采集 于患儿呼吸机辅助通气24、48、96 h在严格无菌操作下抽取股静脉血1.5 ml,以3 000 r·min-1离心10 min,取上清-20 ℃保存。
1.2.2 支气管肺泡灌洗液的采集 于患儿呼吸机辅助通气24、48、96 h,在严格无菌操作下通过气管插管注入0.9%氯化钠注射液0.5~1 ml·kg-1,人工气囊加压3~4次,抽吸气管分泌物于负压管中,再用0.5 ml 0.9%氯化钠将所有标本冲到试管中,3 000 r·min-1,离心10 min,取上清-20 ℃保存。
1.3 血清及肺泡灌洗液中白介素1(interleukin- 1,IL- 1)、白介素2(interleukin- 2,IL- 2)、白介素6(interleukin- 6,IL- 6)、白介素8(interleukin- 8,IL- 8)和肿瘤坏死因子- α(tumor necrosis factorα,TNF- α)的检测人IL- 1、IL- 2、IL- 6、IL- 8和TNF- α ELISA试剂盒购于美国ESBlab公司,严格依照试剂盒说明书进行操作,置于酶标仪中检测。
1.4 血清及肺泡灌洗液中超氧化气化酶(superoxide dimutase,SOD)、丙二醛(malondialdehyde,MDA)和髓过氧化物酶(myeloperoxidase,MPO)活性的检测SOD、MDA和MPO试剂盒由南京建成生物工程研究所提供,根据试剂盒要求进行检测。
1.5 统计学处理
采用SPSS 16.0统计软件进行统计分析,数据以均数±标准差表示,两组比较采用t检验,相关性比较采用双变量相关分析,P<0.05为差异有统计学意义。
2 结 果
2.1 各组不同时段血清和BALF中的IL- 1、IL- 2、IL- 6、IL- 8及TNF- α比较
机械通气24h,VAP和NVAP组血清和BALF中的IL- 1、IL- 2、IL- 6、IL- 8和TNF- α均无显著差异(P>0.05),机械通气48h和96h,VAP和NVAP组血清和BALF中的IL- 1、IL- 6、IL- 8和TNF- α明显增高(P<0.05),IL- 2明显降低(P<0.05),与NVAP组比,VAP血清和BALF中的IL- 1、IL- 6、IL- 8和TNF- α明显增高(P<0.05),IL- 2明显降低(P<0.05)。见表1。
2.2 两组不同时段血清和BALF中SOD、MDA和MPO水平比较
机械通气24 h两组血清和BALF中SOD、MDA和MPO水平均无显著性差异(P>0.05)。机械通气48 h和96 h,两组血清和BALF中MDA和MPO水平明显增高(P<0.05),SOD水平明显降低(P<0.05);与NVAP组比,VAP组血清和BALF中MDA和MPO水平明显增高(P<0.05),SOD水平明显降低(P<0.05)。见表2。
3 讨 论
VAP为机械通气超过48 h或撤机拔管后48 h内发生的肺部炎症。目前临床上尚无早期有效诊断VAP及监测VAP严重程度的敏感指标。当前VAP确诊仍很大程度上依赖于标准的微生物培养技术,但通常微生物培养技术需至少24 h才能获得结果,易延误诊断[5]。如仅凭临床表现则很难精确诊断VAP,反而增加了抗生素的使用和滥用趋势[7],严重者还可产生耐药性甚至恶化病情。
寻找VAP快速诊断敏感指标是目前国内外的研究重点。VAP相关的肺损伤是一个较复杂的过程,除了相关器官和外周循环的炎症/非炎症细胞平衡失调,还包括机体的氧化还原系统的紊乱,即前者为促炎与抗炎机制失衡,后者为抗氧化和氧化指标紊乱。
TNF- α属于早期炎症因子,由单核-巨噬细胞和淋巴细胞激活后产生,具有广泛的作用。当机体TNF- α水平增高时,可引起发热、休克和恶病质等,激活内皮细胞,导致血管通透性增加[8- 9]。IL- 1是体内最强的炎症介质之一,在炎性疼痛中可介导机械或炎性痛敏,给予IL- 1受体拮抗剂可明显减轻炎症性疼痛[8- 9];IL- 6广泛分布在活化的B细胞、静止T细胞表面,是参与免疫和炎症反应的重要因子,细菌和病毒感染均可引起体内IL- 6表达增加,IL- 6水平增高对机体清除感染的细菌具有重要意义,同时IL- 6水平增高对机体也存在保护作用,可抑制TNF- α和IL- 1表达[9- 11];IL- 8是一种炎症趋化因子,可在免疫反应早期出现,对中性粒细胞有很强的趋化作用,可在炎症部位趋化和活化中性粒细胞及其他免疫细胞;与IL- 1、IL- 6、IL- 8和TNF- α不同,IL- 2可由多种细胞产生,介导白细胞与其他细胞的相互作用,同时发挥免疫调节功能的因子,研究显示全身的炎症性疾病与IL- 2及IL- 2R的缺失有关,IL- 2可通过STAT5信号抑制Th17分化,Th17分化有利于炎症激活[9- 10]。上述炎症因子在外周血或BALF异常表达的程度与VAP患儿的无肺外器官衰竭发生率及死亡率呈正相关关系。本研究结果显示,机械通气48 h和96 h,血清和BALF中IL- 1、IL- 6、IL- 8和TNF- α水平明显增高,IL- 2水平明显降低;与NVAP组比,VAP组血清和BALF中IL- 1、IL- 6、IL- 8和TNF- α水平明显增高,IL- 2水平明显降低。可见,血清和BALF中炎症因子变化趋势是一致的,该结果与文献报道相似:呼吸机所致肺损伤大鼠肺组织中TNF- α、IL- 6和IL- 8水平显著增高,给予右旋美托咪啶输注可显著降低上述炎症因子水平[12];电离辐射照射诱导小鼠发生急性肺损伤,可检出外周血IL- 1、IL- 6和TNF- α水平明显增高[13]。
表1 各组不同时段血清和BALF中的IL- 1、IL- 2、IL- 6、IL- 8及TNF- α比较(n=40)
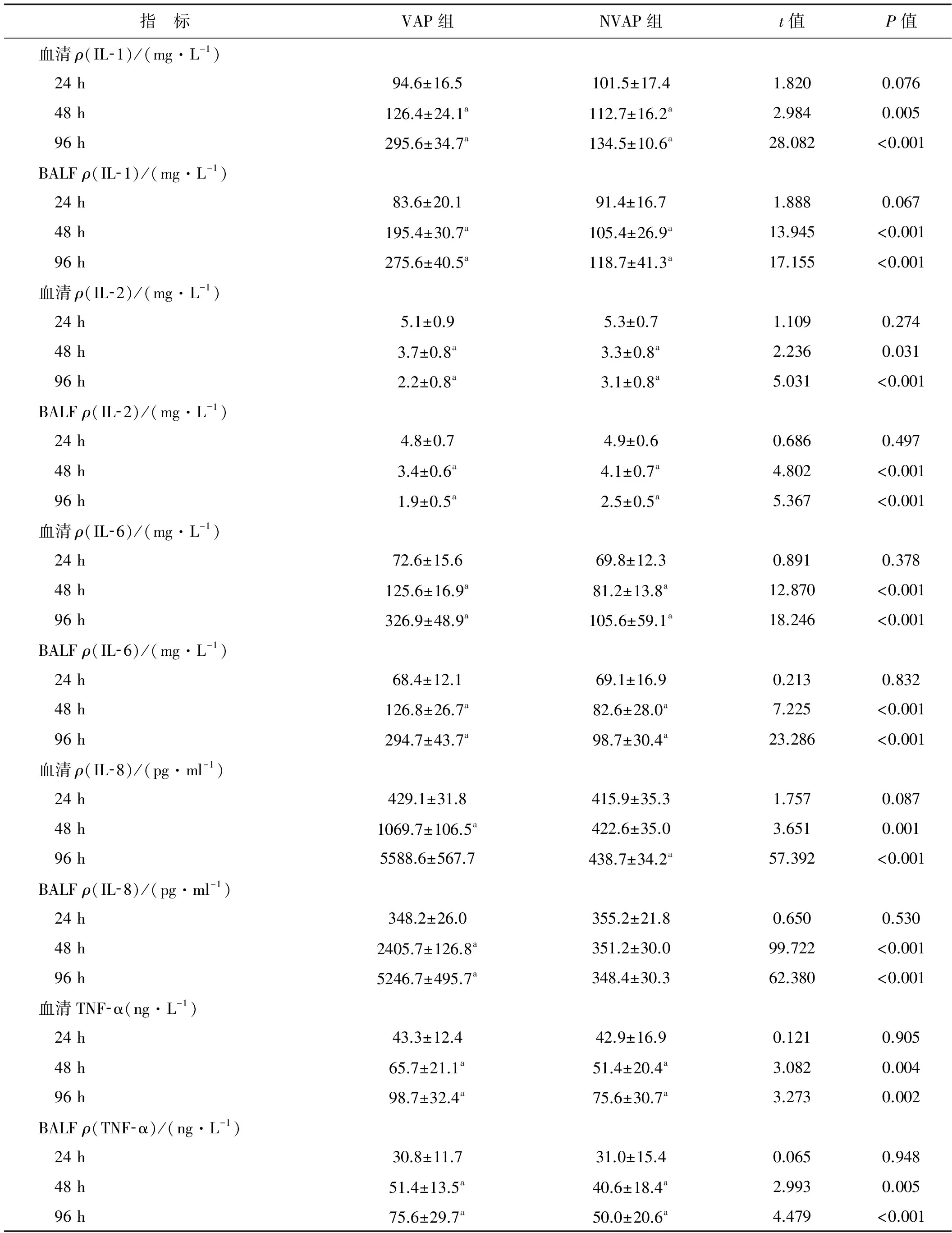
指 标VAP组NVAP组t值P值血清ρ(IL⁃1)/(mg·L-1) 24h94.6±16.5101.5±17.41.8200.076 48h126.4±24.1a112.7±16.2a2.9840.005 96h295.6±34.7a134.5±10.6a28.082<0.001BALFρ(IL⁃1)/(mg·L-1) 24h83.6±20.191.4±16.71.8880.067 48h195.4±30.7a105.4±26.9a13.945<0.001 96h275.6±40.5a118.7±41.3a17.155<0.001血清ρ(IL⁃2)/(mg·L-1) 24h5.1±0.95.3±0.71.1090.274 48h3.7±0.8a3.3±0.8a2.2360.031 96h2.2±0.8a3.1±0.8a5.031<0.001BALFρ(IL⁃2)/(mg·L-1) 24h4.8±0.74.9±0.60.6860.497 48h3.4±0.6a4.1±0.7a4.802<0.001 96h1.9±0.5a2.5±0.5a5.367<0.001血清ρ(IL⁃6)/(mg·L-1) 24h72.6±15.669.8±12.30.8910.378 48h125.6±16.9a81.2±13.8a12.870<0.001 96h326.9±48.9a105.6±59.1a18.246<0.001BALFρ(IL⁃6)/(mg·L-1) 24h68.4±12.169.1±16.90.2130.832 48h126.8±26.7a82.6±28.0a7.225<0.001 96h294.7±43.7a98.7±30.4a23.286<0.001血清ρ(IL⁃8)/(pg·ml-1) 24h429.1±31.8415.9±35.31.7570.087 48h1069.7±106.5a422.6±35.03.6510.001 96h5588.6±567.7438.7±34.2a57.392<0.001BALFρ(IL⁃8)/(pg·ml-1) 24h348.2±26.0355.2±21.80.6500.530 48h2405.7±126.8a351.2±30.099.722<0.001 96h5246.7±495.7a348.4±30.362.380<0.001血清TNF⁃α(ng·L-1) 24h43.3±12.442.9±16.90.1210.905 48h65.7±21.1a51.4±20.4a3.0820.004 96h98.7±32.4a75.6±30.7a3.2730.002BALFρ(TNF⁃α)/(ng·L-1) 24h30.8±11.731.0±15.40.0650.948 48h51.4±13.5a40.6±18.4a2.9930.005 96h75.6±29.7a50.0±20.6a4.479<0.001
与24 h时比较,aP<0.05
表2 两组不同时段血清和BALF中SOD、MDA和MPO水平比较(n=40)
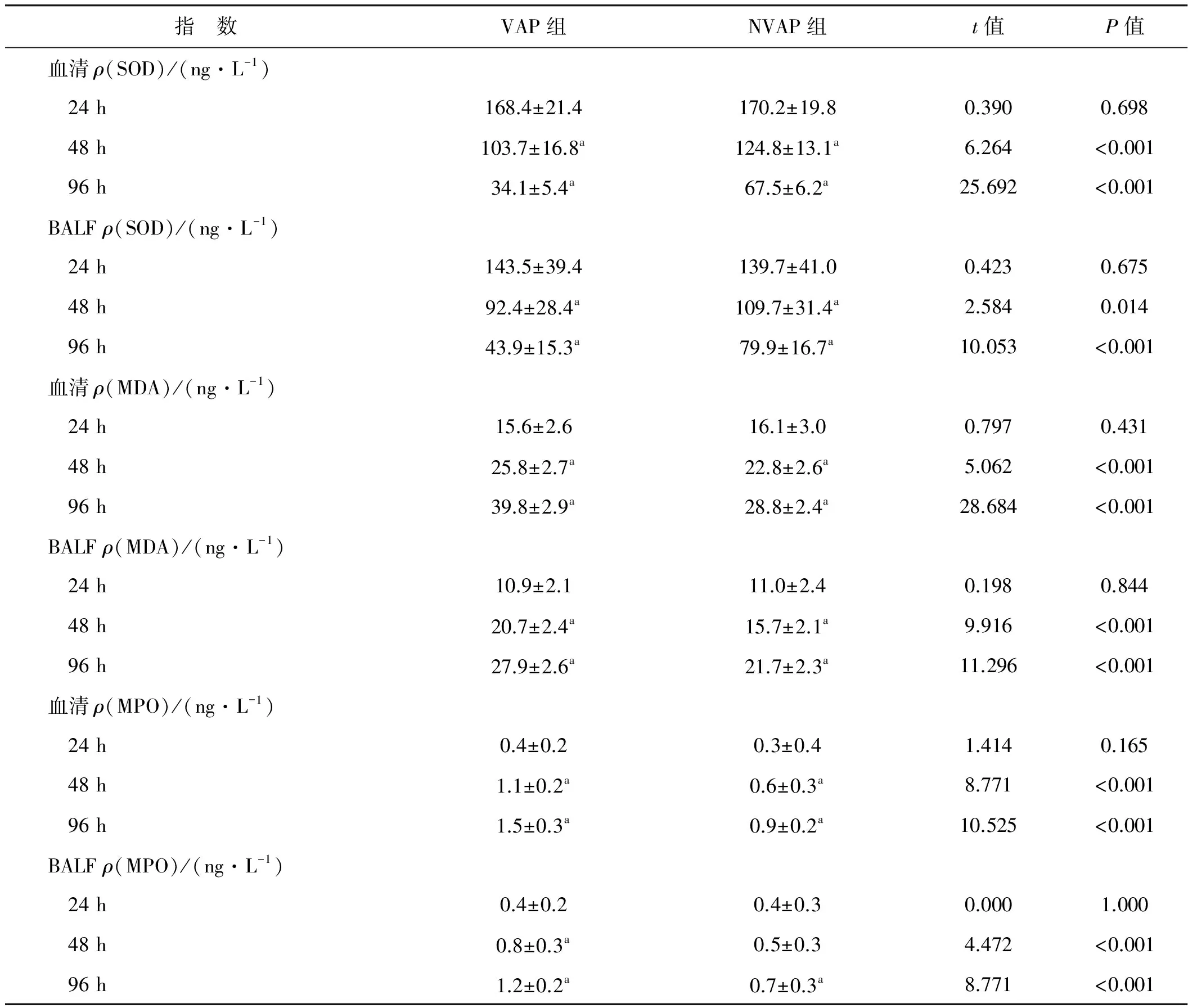
指 数VAP组NVAP组t值P值血清ρ(SOD)/(ng·L-1) 24h168.4±21.4170.2±19.80.3900.698 48h103.7±16.8a124.8±13.1a6.264<0.001 96h34.1±5.4a67.5±6.2a25.692<0.001BALFρ(SOD)/(ng·L-1) 24h143.5±39.4139.7±41.00.4230.675 48h92.4±28.4a109.7±31.4a2.5840.014 96h43.9±15.3a79.9±16.7a10.053<0.001血清ρ(MDA)/(ng·L-1) 24h15.6±2.616.1±3.00.7970.431 48h25.8±2.7a22.8±2.6a5.062<0.001 96h39.8±2.9a28.8±2.4a28.684<0.001BALFρ(MDA)/(ng·L-1) 24h10.9±2.111.0±2.40.1980.844 48h20.7±2.4a15.7±2.1a9.916<0.001 96h27.9±2.6a21.7±2.3a11.296<0.001血清ρ(MPO)/(ng·L-1) 24h0.4±0.20.3±0.41.4140.165 48h1.1±0.2a0.6±0.3a8.771<0.001 96h1.5±0.3a0.9±0.2a10.525<0.001BALFρ(MPO)/(ng·L-1) 24h0.4±0.20.4±0.30.0001.000 48h0.8±0.3a0.5±0.34.472<0.001 96h1.2±0.2a0.7±0.3a8.771<0.001
与24 h时比较,aP<0.05
在VAP组中,与TNF- α和IL- 2相比,IL- 1、IL- 6和IL- 8的动态变化明显,24 h及96 h血清和BALF中的变化倍数分别为3.12、3.30,4.50、4.31,13.0、15.07倍,血清和BALF中变化最大为IL- 8。可见虽然IL- 1、IL- 6、IL- 8和TNF- α均为炎症因子并符合炎症因子级联反应的特征,但IL- 8的变化程度最大,在VAP发病程度上具有较高的灵敏度和特异性。因此众多炎症因子可作为研究VAP发生发展的切入点。
当出现VAP时,机体可通过酶系统或非酶系统导致活性氧物质(ROS)水平增高。当ROS不能被内源或外源的抗氧化分子抑制,则在细胞膜上发生脂质过氧化,导致细胞蛋白及毛细血管内皮损伤,其中SOD活性可反映机体内抗氧化损伤能力[14],MDA和MPO是机体重要的脂质过氧化代谢产物,可反映细胞受氧化损伤的程度[15- 16]。机械通气48 h及96 h,两组血清和BALF中MDA和MPO水平明显增高,SOD水平明显降低;与NVAP组比,VAP血清和BALF中MDA和MPO水平明显增高,SOD水平明显降低。结果提示,VAP患儿体内的脂质过氧化水平明显增高,预后不良。在VAP组中,血清和BALF中SOD、MDA和MPO三者在24 h和96 h的变化程度相似,均在5.0倍之内,提示三者对判断VAP发病程度的灵敏度和特异性相似。
本研究也存在不足之处:(1)获得上述炎症因子及氧化相关指标的参考临界值,有待进一步扩大样本,探讨炎症因子及氧化相关指标与VAP的结局相关关系。(2)难以排除炎症和氧化指标升高是机械通气造成还是肺感染疾病造成。虽然有机械通气相关的肺损伤诊断标准,也在排除标准里明确了剔除存在早发型严重感染、原有呼吸道感染、严重先天性心脏病及神经系统畸形的新生儿,但仍然很难完全区分诊断炎症和氧化指标升高的原因与机械通气相关还是肺感染疾病造成。国内关于机械通气相关的肺损伤报道较少,主要与诊断难度相关。应用呼吸机治疗的患者一般不能随意搬动,只能在床边进行X线检查,而且仰卧位拍X线胸片,胸腔内气体聚集在前胸部,难以反映出机械通气所致的肺损伤;与X线胸片比,CT的诊断价值更高,但患儿的病情不允许做该检查。因此,这种背景下获得的炎症因子及氧化相关指标可影响反映机械通气相关损伤的特异性。
综上所述,VAP组随着机械通气的时间延长,其血清及BALF中IL- 1、IL- 6、IL- 8和TNF- α水平显著增高,IL- 2水平明显降低,多种炎症因子参与了VAP组全身和局部中的炎症反应;血清及BALF中MDA和MPO水平显著增高,SOD水平明显降低,VAP存在明显的脂质过氧化,氧化还原系统紊乱;临床中在诊断和评估VAP病情时,尤其应关注血清及BALF中IL- 8水平的变化。
[1] TAN B,XIAN- YANG X,ZHANG X,et al.Epidemiology of pathogens and drug resistance of ventilator- associated pneumonia in Chinese neonatal intensive care units:a meta- analysis[J].Am J Infect Control,2014,42(8):902- 910.
[2] SMITH M A,HIBINO M,FALCIONE B A,et al.Immunosuppressive aspects of analgesics and sedatives used mechanically ventilated patients:an underappreciated risk factor for the development of ventilator- associated pneumonia in critically ill patients[J].Ann Pharmacother,2014,48(1):77- 85.
[3] MATIN- LOECHES I,PAPIOL E,ALMANSA R,et al.Intubated patients developing tracheobronchitis or pneumonia have distinctive complement system gene expression signatures in the pre- infection period:a pilot study[J].Med Intensiva,2012,36(4):257- 263.
[4] 李征瀛,金未来,章乐,等.sTREM- 1在新生儿肺炎诊断和治疗中的意义[J].现代医学,2014,42(11):1278- 1280.
[5] CHASTRE M P,KALI A,EASOW J M,et al.Ventilator- associated pneumonia[J].Australas Med J,2014,7(8):334- 344.
[6] MORRIS A C,KEFALA K,SIMPSON A J,et al.Evaluation of the effect of diagnostic methodology on the reported incidence of ventilator- associated pneumonia[J].Thorax,2009,64(6):516- 522.
[7] 焦洋,黄怡.《2014NICE临床指南:成人社区和医院获得性肺炎诊断和管理》解读[J].中国实用内科杂志,2015,5:411- 413.
[8] TSAY T B,JIANG Y Z,HSU C M,et al.Pseudomonas aeruginosa colonization enhances ventilator- associated pneumonia- induced lung injury[J].Respir Res,2016,17(1):101.
[9] BARBAR S D,PAUCHARD L A,BRUYRE R,et al.Mechanical ventilation alters the development of staphylococcus aureus pneumonia in rabbit[J].PLoS One,2016,11(7):e0158799.
[10] JIANG M,SONG J J,GUO X L,et al.Airway humidification reduces the inflammatory response during mechanical ventilation[J].Respir Care,2015,60(12):1720- 1728.
[11] 柳湘洁,刘旭华,陈佳,等.不同剂量氨茶碱联合肺康复治疗对老年COPD患者肺功能及相关炎症介质表达的影响[J].现代医学,2016,44(2):205- 208.
[12] 忽新刚.右旋美托咪啶对呼吸机所致肺损伤的保护作用及其机制研究[D].广州:广州医学院,2011.
[13] 王洁.凝溶胶蛋白在急性放射性肺损伤中的作用[D].苏州:苏州大学,2014.
[14] SILVESTRI L,van SAENE H K,ZANDSTRA D F,et al.SDD,SOD,or oropharyngeal chlorhexidine to prevent pneumonia and to reduce mortality in ventilated patients:which manoeuvre is evidence- based?[J].Intensive Care, 2010,36(8):1436- 1437.
[15] TOUFEKOULA C,PAPADAKIS V,TSAGANOS T.Compartmentalization of lipid peroxidation in sepsis by multidrug- resistant gram- negative bacteria:experimental and clinical evidence[J].Crit Care,2013,17(1):R6.
[16] MATHY- HARTERT M,DAMAS P,NYS M.Nitrated proteins in bronchoalveolar lavage fluid of patients at risk of ventilator- associated bronchopneumonia[J].Eur Respir J,2000,16(2):296- 301.
《东南大学学报(医学版)》唯一公共邮箱:bjb@pub.seu.edu.cn
Dynamic changes and significance of cytokine and redox in serum and BALF of VAP neonatal patients
DENG Yi1,TAN Yuan1,YANG Wei- li1,LEI Feng1,MENG Zhen1,TANG Zheng- rong1,XIE Yong1,OU Wei- lin2
(1.DpartmentofNeonatology,theSecondAffiliatedHospitalofGuilinMedicalCollege,Guilin541001,China;2.DepartmentofPediatrics,AffiliatedHospitalofGuilinMedicalCollege,Guilin541001,China)
Objective: To study the serum and bronchoalveolar lavage fluid (BALF) of interleukin - 1 (IL- 1), interleukin - 2 (IL- 2), interleukin- 6 (IL- 6), interleukin- 8 (IL- 8) and tumor necrosis factor- α (TNF- α) and superoxide dismutase(SOD), malondialdehyde(MDA) and myeloperoxidase(MPO) in neonatal ventilator- associated pneumonia (VAP). Methods: 80 patients receiving mechanical ventilation neonate were collected and IL- 1, IL- 2, IL- 6, IL- 8, TNF- α, SOD, MDA and MPO in blood and BALF after intubation 24 h, 48 h and 96 h were collected. 80 patients were divided into 2 groups: 40 cases in the VAP group and 40 cases in the NVAP group. Results: 24 h after intubation, IL- 1, IL- 2, IL- 6, IL- 8, TNF- α, SOD, MDA and MPO in serum and BALF of the two groups had no significant differences (P>0.05). After intubation 48 h and 96 h, IL- 1, IL- 6, IL- 8, TNF- α, MDA and MPO in serum and BALF had increased, IL- 2 and SOD had decreased in the two groups (P<0.05). Compared with the NVAP group, IL- 1, IL- 6, IL- 8, TNF- α, MDA and MPO in serum and BALF had increased, IL- 2 and SOD had decreased in the VAP group(P<0.05). Conclusion: With the prolonging of the mechanical ventilation, the VAP patients’ IL- 1, IL- 6, IL- 8, TNF- α, MDA and MPO in BALF and srum have increased, IL- 2 and SOD have decreased, which measns cytokine and redox play important roles in the development of VAP. IL- 8 in serum and BALF should be paid more attention in VAP development.
ventilator- associated pneumonia; bronchoalveolar lavage fluid; serum;inflammatory factor; oxidative index; newborn
2016- 12- 20
2017- 05- 15
邓毅(1969-),男,广西荔浦人,副主任医师,医学硕士。E- mail:liushan12345624437@126.com
邓毅,谭媛,杨伟丽,等.呼吸机相关性肺炎新生儿血清及支气管肺泡灌洗液中炎症因子和氧化指标的动态变化及其临床意义[J].东南大学学报:医学版,2017,36(4):603- 608.
R722.135
A
1671- 6264(2017)04- 0603- 06
10.3969/j.issn.1671- 6264.2017.04.022

