外源性信号素3A信号通路对转化生长因子- β1诱导肺癌细胞侵袭、增殖的影响
罗燕,徐崇明,段丽群
(湖北省肿瘤医院 胸部放疗科,湖北 武汉 430079)
外源性信号素3A信号通路对转化生长因子- β1诱导肺癌细胞侵袭、增殖的影响
罗燕,徐崇明,段丽群
(湖北省肿瘤医院 胸部放疗科,湖北 武汉 430079)
目的:探讨外源性信号素3A(Sema 3A)信号通路对转化生长因子- β1(TGF- β1)诱导的肺癌A549细胞侵袭、增殖的影响及可能作用机制。方法:将肺癌A549细胞分为3组,即空白对照组、TGF- β1诱导组(TGF- β1组)、Sema 3A预处理组(Sema 3A+TGF- β1组)。空白对照组细胞正常培养;TGF- β1组加入5 μg·L-1TGF- β1;Sema 3A+TGF- β1组首先加入10 μmol·L-1Sema 3A,预处理40~50 min后再加入5 μg·L-1TGF- β1。检测细胞增殖、侵袭能力和E- cadherin、Akt、P- Akt蛋白表达。结果:Sema 3A+TGF- β1组细胞Sema 3A mRNA相对表达水平显著高于空白对照组和TGF- β1组(均P<0.05)。培养36 h~72 h内,TGF- β1组细胞增殖率显著高于Sema 3A+TGF- β1组和空白对照组(均P<0.05),Sema 3A+TGF- β1组细胞增殖率显著高于空白对照组(均P<0.05)。TGF- β1组穿透滤膜细胞数显著高于Sema 3A+TGF- β1组和空白对照组(均P<0.05),Sema 3A+TGF- β1组穿透滤膜细胞数显著高于空白对照组(P<0.05)。TGF- β1组E- cadherin蛋白表达显著低于Sema 3A+TGF- β1组和空白对照组(均P<0.05),P- Akt蛋白显著高于Sema 3A+TGF- β1组和空白对照组(均P<0.05);Sema 3A+TGF- β1组E- cadherin蛋白表达显著低于空白对照组(P<0.05),P- Akt显著高于空白对照组(P<0.05)。结论:Sema 3A能够抑制TGF- β1诱导肺癌细胞侵袭、增殖的效应,其机制可能与抑制Akt磷酸化、上调E- cadherin表达有关。
肺癌;外源性信号素3A;信号通路;转化生长因子- β1;Akt磷酸化
侵袭和转移是影响肺癌复发和死亡的主要原因之一[1- 2]。探讨影响肺癌侵袭转移的信号路径,能够为肺癌基因治疗的分子作用靶点提供依据。研究[3]证实,上皮-间充质转化(epithelial- mesenchymal transition, EMT)与恶性肿瘤多种生物学行为密切相关,也是肿瘤细胞侵袭、转移的始动因素。信号素3A(semaphorin 3A, Sema 3A)属于信号素家族成员之一,能够抑制PI3K和Akt磷酸化而抑制轴突的导向作用[4]。最近一项研究[5]显示,Sema 3A能够抑制非小细胞肺癌发生EMT,使肺癌细胞迁移能够减弱,从而抑制肺癌的发生和发展。本研究首先用外源性Sema 3A对A549细胞进行预处理,再通过转化生长因子- β1(transforming growth factor- β1, TGF- β1)诱导肺癌细胞株A549发生EMT,观察Sema 3A对A549细胞侵袭、迁移的影响及可能的作用机制,旨在为肺癌的基因治疗提供依据,现将研究成果总结如下。
1 材料与方法
1.1 材料
肺癌细胞株A549购自中国科学院细胞资源中心,二甲基亚砜(DMSO)、溴化乙锭、胎牛血清、MTT染料、DMEM培养基、RPMI- 1640培养基购自美国Gibco公司,胰蛋白酶、β- 肌动蛋白(β- actin)购自美国Sigma公司,RIPA裂解液、BCA蛋白定量检测试剂盒、SDS- PAGE凝胶配制试剂盒、SDS- PAGE转膜液、电泳液购自苏州碧云天公司,TGF- β1购自上海吉凯基因化学技术有限公司,小鼠来源Sema 3A多克隆抗体、β- actin抗体、辣根过氧化物酶标记的山羊抗小鼠二抗购均购自北京天根生化科技有限公司,Prime Script®反转录试剂盒、PrimeScript®RT Enzyme MixⅠ、RT Primer Mix、SYBR®Premix EX Taq TMⅡ购自宝生物工程(大连)有限公司,E- 钙黏蛋白(E- cadherin)多克隆抗体购自美国Invitrogen公司,Phospho- Akt(P- Akt)、Akt抗体购自美国Cell Signaling Technology公司,Transwell小室购自美国Costar公司。
1.2 实验方法
1.2.1 细胞培养 将A549细胞接种于含10%胎牛血清的DMEM培养基,37 ℃、体积分数5%CO2条件下培养。取生长旺盛期细胞,胰蛋白酶消化,待细胞间隙增大、细胞收缩变圆时将消化液弃去,加入培养基终止消化。培养基将细胞重悬,并接种于培养瓶中体积分数5%CO2条件下继续培养。
1.2.2 细胞分组及处理 将细胞分为空白对照组、TGF- β1诱导组(TGF- β1组)和Sema 3A预处理组(Sema 3A+TGF- β1组)。取各组对数生长期细胞,空白对照组在含0.5%胎牛血清的DMEM培养基中继续培养;TGF- β1组在DMEM培养基(含0.5%胎牛血清)中加入5 μg·L-1TGF- β1;Sema 3A+TGF- β1组首先向DMEM培养基中加入10 μmol·L-1Sema 3A,预处理40~50 min后再加入5 μg·L-1TGF- β1。各组细胞均在培养基中培养48 h后进行实验。
1.2.3 MTT法检测细胞增殖能力 取对数生长期细胞,以每孔1.0×107个细胞接种于96孔板中,分别于0、12、24、36、48、60、72 h向每孔加入10 μl MTT(质量浓度为5 g·L-1)溶液,培养4 h后将培养基弃去,再向每孔中加入150 μl DMSO,充分振荡,置于酶标仪上,通过测量各时段450 nm处吸光度值评价细胞增殖能力。
1.2.4 Transwell法检测细胞侵袭能力 取对数生长期细胞,用不含血清的培养基将浓度调整为每孔1.0×109个细胞,Transwell上室每孔植入150 μl细胞,下室加入600 μl含有20%胎牛血清的RPMI- 1640培养基,每组分别设置6个复孔,细胞培养48 h,待培养结束后将Transwell小室滤膜用4%多聚甲醛固定,轻轻拭去表面细胞,结晶紫染色10 min,PBS冲洗3次,显微镜下观察穿透滤膜的细胞数。
1.2.5 RT- PCR检测Sema 3A mRNA表达 取对数生长期细胞,参考RNA提取试剂盒说明书提取总RNA,取5 μg总RNA,按照Prime Script®反转录试剂盒说明书进行逆转录,逆转录产物置于冰箱4 ℃保存。采用RT- PCR检测细胞Sema 3A mRNA表达,操作参考SYBR®Premix EX Taq TMⅡ试剂盒说明书,引物委托上海生工生物工程有限公司合成,Sema 3A引物序列上游为5′- GAGAAGCAGCATGAGGTGTATTGGA- 3′,下游为5′- GGATGTAGTTGAGGCACTCTGTCTG- 3′;β- actin引物序列上游为5′- CCAGCAAGAGCACAAGAGGAAGAG- 3′,下游为5′- GGTCTACATGGCAACTGTGAGGAG- 3′。以β- actin作为内参照,检测Sema 3A mRNA相对表达量。
1.2.6 蛋白质印迹法(Western blotting)检测E- cadherin、Akt、P- Akt蛋白表达 向细胞中加入100 μl细胞裂解液充分裂解,4 ℃离心20 min(15 000 r·min-1),吸取上清液,煮沸使蛋白变性。SDS- PAGE电泳分离蛋白,并转移至PVDF膜上,电转后脱脂牛奶封闭2 h,分别加入E- cadherin抗体、AKT抗体、p- AKT抗体、β- actin抗体,4 ℃孵育过夜。PBS冲洗3次,再按照1∶1 000加入二抗,室温下振荡孵育2 h,PBS冲洗3次。ECL显色,凝胶成像分析仪采集图像,测定目的条带灰度值,目的蛋白相对表对量为样本条带与β- actin条带灰度值比值。
1.3 统计学处理
采用SPSS 19.0统计软件包进行数据处理,计量资料用均数±标准差表示,多组间比较采用单因素方差(One- way ANOVA)分析,之后两两比较采用SNK-q检验,P<0.05表示差异有统计学意义。
2 结 果
2.1 细胞形态变化
空白对照组细胞呈椭圆形,细胞间排列紧密;经TGF- β1诱导后,TGF- β1组细胞变成梭形,细胞间连接不明显,呈离散状态;给予Sema 3A处理后,Sema 3A+TGF- β1组细胞恢复椭圆形,细胞间存在连接。见图1。
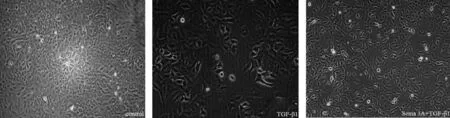
图1 3组细胞形态变化(×200)
2.2 Sema 3A mRNA表达
RT- PCR检测结果显示,Sema 3A+TGF- β1组细胞Sema 3A mRNA相对表达水平显著高于空白对照组和TGF- β1组(均P<0.05),空白对照组Sema 3A mRNA相对表达水平又显著高于TGF- β1组(P<0.05),见图2。
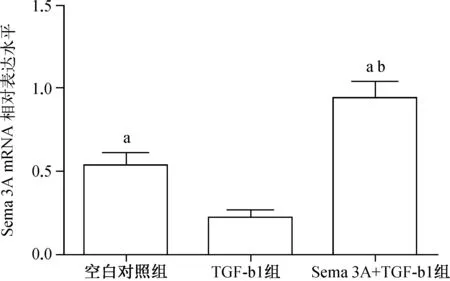
与TGF- β1组比较,aP<0.05; 与空白对照组比较,bP<0.05
图2 3组细胞Sema 3A mRNA表达
2.3 细胞增殖和侵袭能力
MTT实验结果(图3A)显示,培养36~72 h TGF- β1组细胞增殖率显著高于Sema 3A+TGF- β1组和空白对照组(均P<0.05),Sema 3A+TGF- β1组细胞增殖率显著高于空白对照组(P<0.05)。Transwell实验结果(图3B)显示,TGF- β1组穿透滤膜细胞数显著高于Sema 3A+TGF- β1组和空白对照组(均P<0.05),Sema 3A+TGF- β1组穿透滤膜细胞数显著高于空白对照组(P<0.05)。
2.4 E- cadherin、Akt、P- Akt蛋白表达
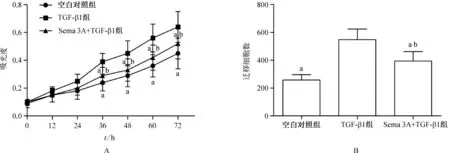
A.细胞增殖能力检测结果; B.细胞侵袭能力检测结果。与TGF- β1组比较,aP<0.05;与空白对照组比较,bP<0.05
图3 细胞增殖和侵袭能力
Western blotting实验结果显示,TGF- β1组E- cadherin蛋白表达显著低于Sema 3A+TGF- β1组和空白对照组(均P<0.05),P- Akt蛋白显著高于Sema 3A+TGF- β1组和空白对照组(均P<0.05);Sema 3A+TGF- β1组E- cadherin蛋白表达显著低于空白对照组(P<0.05),P- Akt显著高于空白对照组(P<0.05);TGF- β1组、Sema 3A+TGF- β1组、空白对照组Akt蛋白表达比较差异无统计学意义(P>0.05)。见图4。
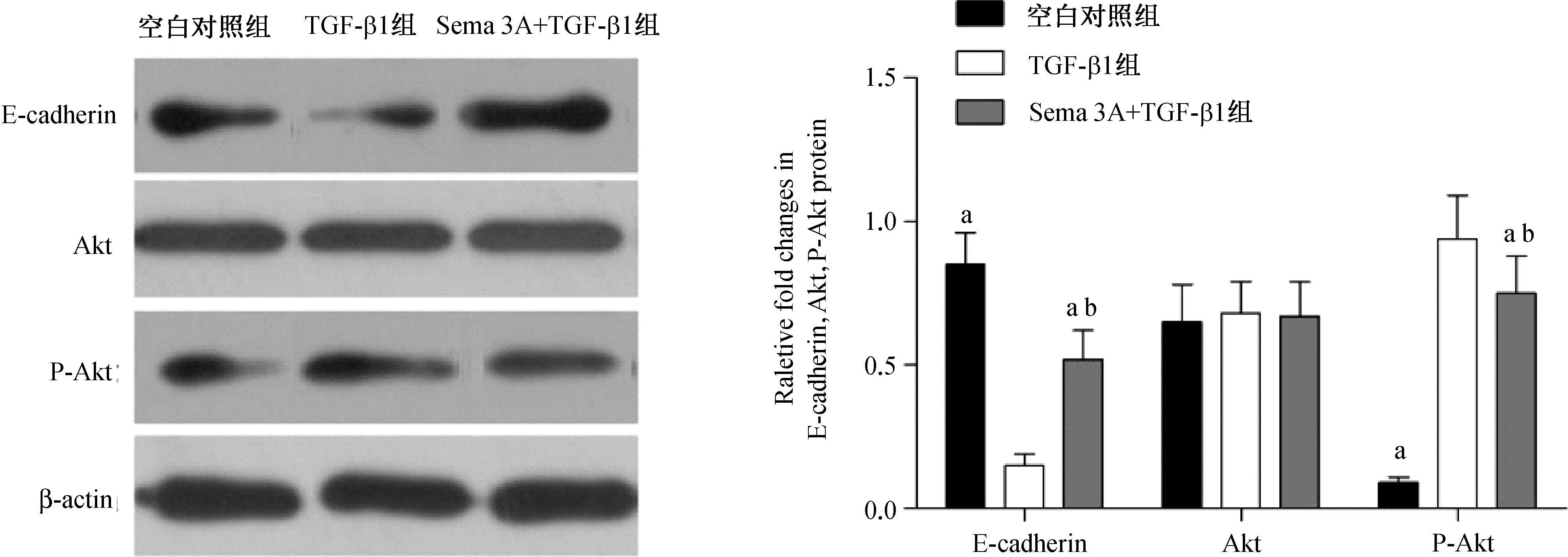
与TGF- β1组比较,aP<0.05;与空白对照组比较,bP<0.05
图4 3组细胞E- cadherin、Akt、P- Akt蛋白表达水平
3 讨 论
EMT是以细胞连接蛋白下调为基础的生物学过程,并参与了肿瘤细胞的侵袭和转移。Sema 3A属于轴突生长抑制因子,具有诱导神经毒性的作用,参与神经细胞凋亡。近年来研究[6]显示,Sema 3A能够抑制肿瘤细胞发生EMT,阻止肿瘤细胞的增殖和迁移功能。在EMT过程中,紧密连接蛋白表达下调,蛋白激酶裂解基底膜,导致肌动蛋白骨架发生重组,细胞间黏附能力降低。另外EMT还会促进应力纤维的形成,增强细胞远处侵袭转移的能力[7]。EMT能够被分化因子和生长因子激活,其中TGF- β1被认为是EMT的始动因素。本研究对肺癌A549细胞株给予TGF- β1诱导,结果显示TGF- β1组细胞呈梭形,细胞间连接不明显,呈离散状态。提示TGF- β1能够诱导A549细胞发生EMT,通过改变细胞的形态和细胞间连接,使A549细胞迁移能力增强。邓陶然等[8]报道,TGF- β1能够减弱细胞间的黏附作用,导致细胞处于离散状态,使非小细胞肺癌获得侵袭和迁移能力。Huang等[9]也证实,TGF- β1是非小细胞化疗耐药、预后不佳的独立危险因素。
动物实验[10]证实,Sema 3A对多巴胺神经元等细胞具有神经毒性,在神经细胞发生损伤时诱导细胞凋亡。Sema 3A通过与神经纤毛蛋白1结合,拮抗血管内皮生长因子的活性,导致肿瘤新生血管受阻,从而降低肿瘤微血管密度,抑制肿瘤细胞的生长和发展。本研究结果显示,在TGF- β1诱导A549细胞前用Sema 3A预处理,细胞离散状态受到抑制,细胞重新恢复紧密的连接,提示Sema 3A能够抑制由TGF- β1诱导的EMT过程。MTT实验和Transwell实验结果显示,Sema 3A预处理能够明显抑制A549细胞的增殖和侵袭能力。Kaczmarek等[11]报道,Sema 3A能够阻断肌动蛋白的重组,抑制张力丝的形成,使细胞间的黏附能力增加,抑制细胞的迁移和侵袭能力。Sema 3A能够介导免疫应答反应,通过激活T淋巴细胞分泌多种细胞因子,发挥细胞毒作用抑制肿瘤细胞的生长[12]。另外,Sema 3A还能诱导巨噬细胞蛋白骨架延伸,并与血管内皮生长因子竞争性结合单核细胞,促进肿瘤生长相关巨噬细胞由诱导肿瘤生长转化为抗肿瘤作用[13]。
PI3K/Akt信号通路是与肿瘤进展、侵袭密切相关的信号通路,PI3K被激活并产生磷脂产物,进一步激活Akt并介导下游级联反应,因此PI3K/Akt也是联系细胞外信号和细胞内应答的重要桥梁信号路径[14]。Sema 3A能够通过第10号染色体同源丢失性磷酸酯酶-张力蛋白参与调节PI3K/Akt信号通路。Vadasz等[15]报道,Sema 3A与Plexin A特异性结合,抑制Ras,钝化PI3K/Akt信号通路。PI3K/Akt信号通路被激活后,活化的Akt第Ser- 136位点发生磷酸化,并释放Bcl- 2蛋白,发挥细胞凋亡作用。Akt磷酸化能够下调E- cadherin蛋白表达,使肿瘤细胞黏附力降低,增强肿瘤细胞的迁移能力[16- 17]。本研究结果显示,Sema 3A预处理后能够抑制P- Akt蛋白表达,增加E- cadherin蛋白表达,说明Sema 3A可能通过钝化PI3K/Akt信号通路,抑制Akt磷酸化,并上调E- cadherin表达,增强A549细胞侵袭、增殖抑制能力。
综上所述,Sema 3A能够抑制TGF- β1诱导的侵袭、增殖作用,其机制可能与抑制Akt磷酸化、上调E- cadherin表达有关。
[1] YINGJIE L,JIAN T,CHANGHAI Y,et al.Numblike regulates proliferation,apoptosis,and invasion of lung cancer cell[J].Tumour Biol,2013,34(5):2773- 2780.
[2] GUPTA G P,MASSAGUÉ J.ID genes mediate tumor reinitiation during breast cancer lung metastasis[J].Proc Natl Acad Sci U S A,2007,104(49):19506- 19511.
[3] KIM S J,CHUNG T W,CHOI H J,et al.Ganglioside GM3 participates in the TGF- β1- induced epithelial- mesenchymal transition of human lens epithelial cells[J].Biochem J,2013,449(1):241- 251.
[4] MAIONE F,CAPANO S,REGANO D,et al.Semaphorin 3A overcomes cancer hypoxia and metastatic dissemination induced by antiangiogenic treatment in mice[J].J Clin Invest,2012,122(5):1832- 1848.
[5] ZHOU H,AIPING W U,WEI F U,et al.Significance of semaphorin- 3A and MMP- 14 protein expression in non- small cell lung cancer[J].Oncol Lett,2014,7(5):1395- 1400.
[6] MISHRA R,THORAT D,SOUNDARARAJAN G,et al.Semaphorin 3A upregulates FOXO 3a- dependent MelCAM expression leading to attenuation of breast tumor growth and angiogenesis[J].Oncogene,2014,34(12):1584- 1595.
[7] MONY S,LEE S J,HARPER J F,et al.Regulation of Na,K- ATPase β1- subunit in TGF- β2- mediated epithelial- to- mesenchymal transition in human retinal pigmented epithelial cells[J].Exp Eye Res,2013,115:113- 122.
[8] 邓陶然,林丹丹,钟波,等.TGF- α、TGF- β1、TIMP- 2 mRNA在非小细胞肺癌中的表达及临床意义[J].临床肺科杂志,2016,21(11):2063- 2067.
[9] HUANG S,HÖLZEL M,KNIJNENBURG T,et al.MED12 controls the response to multiple cancer drugs through regulation of TGF- β receptor signaling[J].Cell,2012,151(5):937- 950.
[10] 王强,王佩佩,孟萍萍,等.强化训练对脑缺血再灌注大鼠臂板蛋白3A及其受体神经纤毛蛋白- 1表达的影响[J].中华物理医学与康复杂志,2012,34(1):2- 7.
[11] KACZMAREK J S,CLAPHAM D E.Calpain cleaves and activates the TRPC5 channel to participate in semaphorin 3A- induced neuronal growth cone collapse[J].Proc Natl Acad Sci U S A,2012,109(20):7888- 7892.
[12] VENKOVA K,CHRISTOV A,KAMALUDDIN Z,et al.Semaphorin 3A signaling through neuropilin- 1 is an early trigger for distal axonopathy in the SOD1G93A mouse model of amyotrophic lateral sclerosis[J].J Neuropathol Exp Neurol,2014,73(7):702- 713.
[13] CASAZZA A,FU X,JOHANSSON I,et al.Systemic and targeted delivery of semaphorin 3A inhibits tumor angiogenesis and progression in mouse tumor models[J].Arterioscler Thromb Vasc Biol,2011,31(4):741- 749.
[14] HOSAKA S,HORIUCHI K,YODA M,et al.A novel multi- kinase inhibitor pazopanib suppresses growth of synovial sarcoma cells through inhibition of the PI3K- AKT pathway[J].J Orthop Res,2012,30(9):1493- 1498.
[15] VADASZ Z,HAJ T,HALASZ K,et al.Semaphorin 3A is a marker for disease activity and a potential immunoregulator in systemic lupus erythematosus[J].Arthritis Res Ther,2012,14(3):R146.
[16] 崔凤鸣,朱海涛,包善华,等.骨髓间充质干细胞作为胰腺癌基因治疗载体的实验研究[J].现代医学,2011,39(4):387- 392.
[17] 匡小跟,张晖辉,许韩峰,等.钙黏蛋白E、桥粒芯糖蛋白2、磷酸化Akt和转录因子Snail在侵袭性前列腺癌中的作用[J].中国现代医学杂志,2016,26(8):38- 43.
Effect of semaphorin 3A signaling pathway on invasion and proliferation of lung cancer cells induced by transforming growth factor- β1
LUO Yan,XU Chong- ming,DUAN Li- qun
(DepartmentofChestRadiotherapy,HubeiProvinceTumorHospital,Wuhan430079,China)
Objective: To explore the effect of semaphorin 3A (Sema 3A) signaling pathway on invasion and proliferation of lung cancer cells induced by transforming growth factor - β1 (TGF- β1) and its mechanisms. Methods: The lung cancer A549 cells were divided into three groups: blank control group (control), TGF- β1 induced group (TGF- β1), 3A Sema pretreatment group (Sema 3A+TGF- β1). The control group was cultured with normal cultured, 5 μg·L-1TGF- β1 was added in TGF- β1 group, 10 μmol·L-1of Sema 3A was firstly added and pretreated for 40- 50 min and then 5 μg·L-1of TGF- β1 added in the Sema 3A+TGF- β1 group. Cell proliferation, invasion ability and the expression level of E- cadherin, Akt, P- Akt protein was measured. Results: After Sema 3A pretreatment, the Sema 3A+TGF- β1 group cells were round or oval. Sema 3A mRNA relative expression level in Sema 3A+TGF- β1 group were significantly higher than that in the control group and the TGF- β1 group(P<0.05). In 36- 72 h, the proliferation rate of TGF- β1 group was significantly higher than in Sema 3A+TGF- β1 group and the control group(P<0.05), the proliferation rate in Sema 3A+TGF- β1 group was significantly higher than that in the control group(P<0.05). The migrated cells number was significantly higher than that in Sema 3A+TGF- β1 group and the control group(P<0.05),migrated cell number in Sema 3A+TGF- β1 group was significantly higher than that in the control group(P<0.05). The expression of E- cadherin protein was significantly lower than that in Sema 3A+TGF- β1 group and the control group, P- Akt protein was significantly higher than that in Sema 3A+TGF- β1 group and the control group(P<0.05). E- cadherin protein in Sema 3A+TGF- β1 group was significantly lower than that in the control group, P- Akt protein was significantly higher than that in the control group(P<0.05). Conclusion: Sema 3A can inhibit invasion and proliferation induced by TGF- β1, the mechanism may be related to the inhibition of Akt phosphorylation and up regulation of E- cadherin expression.
lung cancer; semaphorin 3A; signal pathway; transforming growth factor- β1; Akt phosphorylation
2016- 12- 13
2017- 05- 04
罗燕(1979-),女,湖北武汉人,住院医师,医学博士。E- mail:luoyan197904@163.com
罗燕,徐崇明,段丽群.外源性信号素3A信号通路对转化生长因子- β1诱导肺癌细胞侵袭、增殖的影响[J].东南大学学报:医学版,2017,36(4):609- 614.
R734.2
A
1671- 6264(2017)04- 0609- 06
10.3969/j.issn.1671- 6264.2017.04.023

