雷帕霉素调控自噬在骨关节炎软骨细胞退变中的机制研究
王浩 曹飞 斯海波 沈彬
(四川大学华西医院骨科,成都610041)
·基础研究 ·
雷帕霉素调控自噬在骨关节炎软骨细胞退变中的机制研究
王浩 曹飞 斯海波 沈彬*
(四川大学华西医院骨科,成都610041)
背景:骨关节炎(Osteoarthritis,OA)的发生与软骨细胞自噬活动降低、细胞稳态失衡密切相关。雷帕霉素是一种常用的自噬诱导剂,能上调自噬活动、维持细胞稳态。目的:明确能否通过雷帕霉素提高软骨细胞自噬相关因子的表达,促进软骨细胞生存。方法:收集正常软骨标本5例,中期及晚期OA软骨标本各10例。免疫组织化学检测软骨组织中自噬相关蛋白表达情况。体外分离、培养软骨细胞,进行药物实验。各期OA标本软骨细胞分为低、中、高浓度实验组和对照组,分别予以1 μmol/L、5 μmol/L、10 μmol/L雷帕霉素及相同体积培养基。运用聚合酶链式反应(polymerase chain reaction,PCR)及Western-Blot检测自噬相关因子ULK1、Beclin1、LC3表达变化规律。结果:免疫组织化学检测发现,随着OA退变程度加重,软骨组织中自噬相关蛋白阳性表达率逐渐降低。PCR及Western-Blot发现,雷帕霉素干预正常软骨细胞后,实验组自噬相关因子ULK1、Beclin1、LC3表达量高于对照组,且与雷帕霉素呈浓度依赖性。中期OA软骨细胞结果与正常软骨细胞类似,但组间差异更明显。晚期OA软骨细胞中,实验组自噬相关因子表达量较对照组呈上升趋势,但升高幅度较小。结论:雷帕霉素可以上调自噬相关因子的表达,其中正常及中期OA软骨细胞对雷帕霉素诱导的自噬活动具有良好的反应性,而晚期OA软骨细胞对雷帕霉素刺激反应较差。
骨关节炎;自噬;mTOR信号通路;雷帕霉素
骨关节炎(Osteoarthritis,OA)是一种常见的慢性退行性改变的关节病,其主要病理改变是关节软骨细胞减少和软骨基质降解[1,2]。近年来随着对OA发病机制研究的不断深入,发现软骨细胞稳态失衡与骨关节炎的发生、发展密切相关。
自噬作为细胞的一种保护性机制,广泛参与细胞的发育、增殖、凋亡等多个过程,在软骨细胞的成熟及稳态维持过程中,自噬同样发挥着重要作用。自噬可以调节细胞对外界刺激做出适应性反应,并及时清除受损的细胞器及大分子物质,避免损伤的累积,促进细胞存活[3]。自噬是自噬相关基因(autophagy associated gene,ATG)参与介导的蛋白质加工修饰过程,其中ATG 1、ATG 6、ATG 8(哺乳动物中的同源物分别称作ULK1、Beclin1、LC3)是自噬途径的3个主要管理者,分别充当诱导者、调节者、执行者的角色[4]。自噬的分子机制与信号调控通路十分复杂,其中哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)是诸多信号调控通路与分子机制作用的交汇点,对自噬调节发挥着关键性作用,是自噬的负性调控因子[5]。
雷帕霉素是一种新型大环内酯类免疫抑制剂,可以抑制mTOR信号通路的mTOR复合物1(mTOR complex 1,mTORC1),从而诱导自噬活动[6]。研究[6-8]表明,雷帕霉素可以上调神经细胞、肝癌细胞、肾小球足细胞等多种细胞的自噬活动。设想在OA软骨细胞退变过程中能否通过雷帕霉素抑制mTOR信号通路,从而上调自噬活动,促进OA软骨细胞的自我修复。因此,本研究使用雷帕霉素干预正常软骨细胞,中期OA及晚期OA软骨细胞,运用荧光定量聚合酶链式反应(polymerase chain reaction, PCR)及Western-Blot技术,分别从mRNA及蛋白水平检测自噬相关因子的表达变化规律,从而阐明雷帕霉素在自噬调节中的作用以及与软骨细胞退变的关系。
1 材料与方法
1.1 实验材料
正常组(取自因重度毁损伤行膝上截肢术者)、中期OA组(取自因膝关节中度OA行单间室膝关节置换术者)及晚期OA组(取自因膝关节重度OA行全膝关节置换术者)膝关节软骨均取自四川大学华西医院骨科手术室。分别搜集正常组软骨标本5例,中期及晚期OA组软骨标本各10例。该研究已获得四川大学华西医院伦理委员会批准授权,所有患者均签署知情同意书。
纳入标准:①患者知情同意,并签署知情同意书;②既往体健,否认其他疾患;③符合骨关节炎临床表现、影像学诊断标准。排除标准:①既往有膝关节感染病史、明确的关节外伤史者;②术前传染病筛查乙肝、梅毒等阳性者;③继发性OA者;④类风湿关节炎者。
1.2 主要试剂
Ⅱ型胶原酶、胰蛋白酶、胎牛血清、DMEM低糖培养基(由Hycolon公司提供);反转录试剂盒(由EU Fermentas公司提供);荧光定量PCR试剂盒(由大连宝生物公司提供);Anti-ULK1、Anti-Beclin1和Anti-LC3(由Abcam公司提供);ACTB、ULK1、Beclin1和LC3引物(由上海生工生物工程有限公司提供),雷帕霉素(由北京索莱宝公司提供)。
1.3 实验方法
1.3.1 软骨细胞分离与培养:从手术室获取的标本,浸泡在含DMEM低糖培养基中,低温保存,尽快转移至实验室。在超净工作台内,用组织剪将标本剪成约0.5×0.5 cm2软骨片后,换用眼科剪将软骨片尽量剪碎成约1 mm2的软骨碎块。在物理消化的基础上,0.25%的胰蛋白酶消化20 min,PBS溶液清洗后加含0.2%Ⅱ型胶原酶的DMEM低糖培养基,置于37℃水浴箱中轻微震荡消化30~40 min,加入胎牛血清终止消化,l000 rpm离心5 min,弃上清,即得到消化下的软骨细胞。将上述获得的软骨细胞接种于10 cm培养皿中,置于37℃恒温、5%CO2体积分数及饱和湿度的孵箱中进行培养,定期更换培养液。
1.3.2 雷帕霉素干预各期软骨细胞:将培养成功的软骨细胞分成以下4组:低浓度实验组、中浓度实验组、高浓度实验组和对照组。实验组加入一定浓度的雷帕霉素进行干预,对照组加入相同体积的无血清培养基。低、中、高浓度实验组加入的雷帕霉素浓度分别为低(1 μmol/L)、中(5μmol/L)、高(10 μmol/L)。
将第二代软骨细胞接种到6孔板中,每孔接种1×105个细胞,每孔加入2 ml含10%胎牛血清的DMEM低糖培养基,37℃、5%CO2体积分数的孵箱中培养过夜,待细胞丰度为30%~40%时进行药物实验。1.3.3软骨标本免疫组织化学:软骨标本经固定、脱钙、脱水、浸蜡包埋、常规切片后,二甲苯对石蜡切片进行脱蜡处理,梯度酒精水化;3%H2O2淬灭内源性过氧化物酶;抗原修复;5%山羊血清处理10 min后,室温下一抗孵育孵育1 h;生物素标记的二抗孵育1 h;二氨基联苯胺显色;苏木素复染、脱水、透明、干燥,中性树脂封片,镜检观察。
1.3.4 荧光定量PCR检测:6孔板培养软骨细胞,待细胞融合率达30%~40%进行实验,采用Trizol法提取细胞RNA,核酸蛋白分析仪检测RNA含量与纯度,1%凝胶电泳确定RNA片段的完整性。采用逆转录试剂盒将RNA逆转录成cDNA。按照PCR试剂盒说明书进行ULK1、Beclin1、LC3 mRNA的检测。采用ACTB(β-Actin)为内参照基因。利用2-ΔΔCT法分析相应基因表达,每个样本设置3个重复。引物序列如表1所示。
1.3.5 Western-Blot检测:6孔板培养软骨细胞,待细胞融合率达30%~40%进行实验,用预冷的蛋白提取液裂解软骨细胞提取总蛋白;BCA法测定蛋白浓度;SDSPAGE电泳;70 V,电流300 mA,冰浴下转膜1.5 h后封闭;室温下一抗孵育2 h,TBST洗膜;二抗孵育2 h,TBST洗膜,每次5 min,共3次,加入ECL显色液曝光显影。采用Quantity one凝胶图像分析软件测定目标基因条带灰度值和内参条带灰度值比值,得出目标基因蛋白的相对表达量。
1.4 统计学方法
应用SPSS V20.0(IBM USA)软件进行统计学分析,所有数据使用均数±标准差表示,两组间比较采用t检验,3组或3组以上比较采用单因素方差分析检验,P<0.05为有统计学差异。
2 结果
2.1 软骨标本免疫组织化学检测结果
为了初步探索自噬与骨关节炎的关系,我们采用免疫组织化学对各组软骨标本中自噬相关蛋白的表达情况进行了检测(图1)。采用阳性着色细胞计数法分析发现,自噬相关蛋白ULK1、Beclin1及LC3在正常软骨组织中稳定表达,随着OA的进展,自噬相关蛋白阳性表达率逐渐降低,在晚期OA软骨标本中阳性表达率最低,各组间有统计学差异(图2)。

表 1 荧光定量PCR引物序列

图1 软骨组织免疫组化(100×)

图2 自噬相关蛋白ULK1、Beclin1及LC3在软骨组织中的表达情况
2.2 荧光定量PCR检测结果
雷帕霉素干预正常软骨细胞后,实验组软骨细胞内自噬相关基因ULK1、Beclin1及LC3表达量高于对照组,其中,低浓度组自噬基因表达量较对照组呈升高趋势,但无统计学差异,而中、高浓度组与对照组之间有统计学差异;随着雷帕霉素浓度的增加,3个浓度组自噬相关基因表达量逐渐升高,其表达量与雷帕霉素之间呈浓度依赖性,其中,中、高浓度组较低浓度组有统计学差异,而高浓度组较中浓度组表达量进一步增加,但无统计学差异(图3)。

图3 正常软骨细胞中自噬相关基因表达量
雷帕霉素干预中期OA软骨细胞后,结果与正常软骨细胞类似,但组间差异更加明显。其中,中、高浓度组ULK1表达量较低浓度组有统计学差异,Beclin1及LC3在实验组间均有统计学差异(图4)。

图4 中期OA软骨细胞中自噬相关基因表达量
雷帕霉素干预晚期OA软骨细胞后,实验组软骨细胞内自噬相关基因表达量较对照组呈上升趋势,但升高幅度较小,其中高浓度实验组表达量最高,且与其他各组间有统计学差异,其余各组间均无统计学差异(图5)。

图5 晚期OA软骨细胞中自噬相关基因表达量
2.3 Western-Blott检测结果
雷帕霉素干预正常软骨细胞后,实验组软骨细胞内自噬相关蛋白ULK1、Beclin1及LC3表达量高于对照组,有统计学差异;随着雷帕霉素浓度的增加,3个浓度组自噬相关蛋白表达量逐渐升高,其表达量与雷帕霉素之间呈浓度依赖性,其中,中、高浓度组Beclin1表达量较低浓度组有统计学差异,ULK1及LC3在3实验组间均有统计学差异(图6、7)。

图6 正常软骨细胞中自噬相关蛋白表达条带图

图7 正常软骨细胞中自噬相关蛋白表达量
雷帕霉素干预中期OA软骨细胞后,结果与正常软骨细胞类似(图8、9)。

图8 中期OA软骨细胞中自噬相关蛋白表达条带图
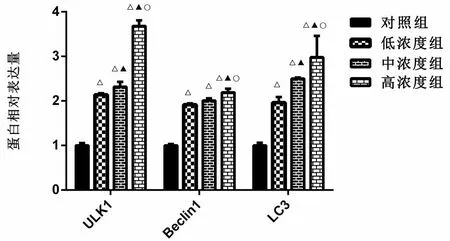
图9 中期OA软骨细胞中自噬相关蛋白表达量
雷帕霉素干预晚期OA软骨细胞后,实验组软骨细胞内自噬相关蛋白表达量较对照组呈上升趋势,但升高幅度较小,其中,高浓度实验组表达量最高,且与其他各组间有统计学差异,而低、中浓度组较对照组无统计学差异(图10、11)。
3 讨论
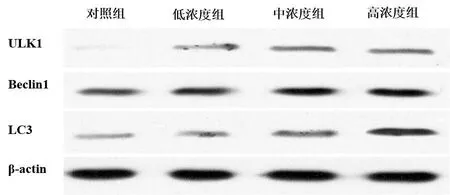
图10 晚期OA软骨细胞中自噬相关蛋白表达条带图

图11 晚期OA软骨细胞中自噬相关蛋白表达量
雷帕霉素是一种常用的自噬诱导剂。Pan等[6]用雷帕霉素干预体外神经细胞帕金森模型后,发现神经细胞中自噬体数量明显增多,损伤的线粒体被自噬体清除,神经细胞恢复了正常的功能状态。Caramés等[9]建立体外软骨机械损伤模型,用雷帕霉素处理软骨块后,发现雷帕霉素能显著提高自噬相关蛋白的表达水平,并能够减少软骨细胞的死亡及蛋白聚糖的丢失。雷帕霉素作为mTOR的负性调控因子,能促进自噬,阻止软骨细胞退变。然而,人骨关节炎是由多种因素共同作用的结果,单纯依靠体外模型获得的软骨可能并不能真正意义上替代人的OA软骨,从而丧失其研究结果对临床的指导意义。因此,本研究通过雷帕霉素干预人不同退变阶段的软骨细胞,观察能否上调自噬活动,从而终止甚至逆转软骨细胞退变。
本研究首先通过免疫组织化学检测自噬相关因子ULK1、Beclin1及LC3在人软骨组织中的表达,结果显示随着OA的进展,自噬相关蛋白阳性表达率逐渐降低,各组间比较有统计学差异。雷帕霉素干预正常软骨细胞及中期OA软骨细胞后,实验组软骨细胞内ULK1、Beclin1、LC3 mRNA及蛋白表达量高于对照组,且随着雷帕霉素浓度的增加,实验组自噬相关因子表达量逐渐升高,与雷帕霉素呈浓度依赖性,组间比较有统计学差异。而雷帕霉素干预晚期OA软骨细胞后,实验组软骨细胞内自噬相关因子表达量较对照组呈上升趋势,但升高幅度较小。这与Sa-saki等[10]和Matsuzaki等[11]的研究结果一致。
本研究发现,雷帕霉素对正常软骨细胞及中期OA软骨细胞自噬的诱导作用更强,而对于晚期OA软骨细胞的自噬诱导能力较弱。因而,推测当高强度的破坏因素持续作用于软骨细胞,自噬活动不堪重负,自噬这种适应性反应难以保护软骨细胞,软骨细胞自噬活性被抑制,凋亡活性增强。此外,晚期OA软骨细胞退变程度较重,细胞功能异常,而自噬本质是自噬相关基因调控的蛋白加工修饰过程,因此,晚期OA软骨细胞对雷帕霉素调控的自噬活动反应性较差。
Chang等[12]研究发现,在正常氧含量条件下,雷帕霉素作用于正常软骨细胞后,正常软骨细胞自噬活动增强,细胞死亡率由干预前的34.47%下降至5.53%;而用自噬抑制剂3-MA抑制低氧条件下的OA软骨细胞自噬活动后,其死亡率由干预前的40.16%下降至9.61%。因此,认为增强正常软骨细胞自噬活动,能促进软骨细胞生存,而增强OA软骨细胞自噬活动,则促进软骨细胞凋亡。而Caramés等[9]的研究表明,雷帕霉素能上调OA软骨细胞自噬活动并降低软骨细胞凋亡率。Sasaki等[10]的研究发现,雷帕霉素能使OA软骨细胞自噬活动增强,并通过降低ROS的表达从而抑制细胞凋亡。这些研究结果之间的差异提示,某些外界因素能够调节自噬对细胞生存活性的影响。Iglewski等[13]报道,自噬对细胞生存的影响取决于细胞外刺激的类型。当细胞暴露于DNA损伤试剂,内质网应激,放射性环境时,自噬活动的增强有利于细胞生存[14-16],而细胞处于低氧、砒霜等治疗条件下,自噬活动的增强则促进细胞凋亡[17,18]。因此,雷帕霉素调控自噬活性与OA软骨细胞退变之间的具体机制仍需进一步深入研究。
综上所述,通过不同浓度的雷帕霉素干预正常软骨细胞及中、晚期OA软骨细胞后发现,雷帕霉素可以上调自噬相关因子的表达,抑制软骨细胞凋亡,促进细胞生存,其中正常软骨细胞及中期OA软骨细胞对雷帕霉素诱导的自噬活动具有良好的反应性,而晚期OA软骨细胞对雷帕霉素诱导的自噬活动反应较差。
[1]Glyn-Jones S,Palmer AJ,Agricola R,et al.Osteoarthritis. Lancet,2015,386(9991):376-387.
[2]HunterDJ,FelsonDT.Osteoarthritis.BMJ,2006,332(7542): 639-642.
[3]Mizushima N.Physiological functions of autophagy.Curr Top Microbiol Immunol,2009,335:71-84.
[4]Caramés B,Taniguchi N,Otsuki S,et al.Autophagy is a protective mechanism in normal cartilage,and its aging-related loss is linked with cell death and osteoarthritis.Arthritis Rheum,2010,62(3):791-801.
[5]Takayama K,Kawakami Y,Kobayashi M,et al.Local intraarticular injection of rapamycin delays articular cartilage degeneration in a murine model of osteoarthritis.Arthritis Res Ther,2014,16(6):482.
[6]Pan T,Rawal P,Wu Y,et al.Rapamycin protects against rotenone-induced apoptosis through autophagy induction. Neuroscience,2009,164(2):541-551.
[7]Shigemitsu K,Tsujishita Y,Hara K,et al.Regulation of translational effectors by amino acid and mammalian target of rapamycin signaling pathways.Possible involvement of autophagy in cultured hepatoma cells.J Biol Chem,1999, 274(2):1058-1065.
[8]Xiao T,Guan X,Nie L,et al.Rapamycin promotes podocyte autophagy and ameliorates renal injury in diabetic mice.Mol Cell Biochem,2014,394(1-2):145-154.
[9]Caramés B,Taniguchi N,Seino D,et al.Mechanical injury suppresses autophagy regulators and pharmacologic activation of autophagy results in chondroprotection.Arthritis Rheum,2012,64(4):1182-1192.
[10]Sasaki H,Takayama K,Matsushita T,et al.Autophagy modulates osteoarthritis-related gene expression in human chondrocytes.Arthritis Rheum,2012,64(6):1920-1928.
[11]Matsuzaki T,Matsushita T,Tabata Y,et al.Intra-articular administration of gelatin hydrogels incorporating rapamycinmicelles reduces the development of experimental osteoarthritis in a murine model.Biomaterials,2014,35(37):9904-9911.
[12]Chang J,Wang W,Zhang H,et al.The dual role of autophagy in chondrocyte responses in the pathogenesis of articular cartilage degeneration in osteoarthritis.Int J Mol Med, 2013,32(6):1311-1318.
[13]Iglewski M,Hill JA,Lavandero S,et al.Mitochondrial fission and autophagy in the normal and diseased heart.Curr Hypertens Rep,2010,12(6):418-425.
[14]Katayama M,Kawaguchi T,Berger MS,et al.DNA damaging agent-induced autophagy produces a cytoprotective adenosine triphosphate surge in malignant glioma cells.Cell Death Differ,2007,14(3):548-558.
[15]Lomonaco SL,Finniss S,Xiang C,et al.The induction of autophagy by gamma-radiation contributes to the radioresistance of glioma stem cells.Int J Cancer,2009,125(3):717-722.
[16]Ogata M,Hino S,Saito A,et al.Autophagy is activated for cell survival after endoplasmic reticulum stress.Mol Cell Biol,2006,26(24):9220-9231.
[17]Azad MB,Chen Y,Henson ES,et al.Hypoxia induces autophagic cell death in apoptosis-competent cells through a mechanism involving BNIP3.Autophagy,2008,4(2):195-204.
[18]Kanzawa T,Kondo Y,Ito H,et al.Induction of autophagic cell death in malignant glioma cells by arsenic trioxide. Cancer Res,2003,63(9):2103-2108.
Research on the mechanism of Rapamycin regulating autophagy in the degenerativee process of osteoarthritis chondrocytee
WANG Hao,CAO Fei,SI Haibo,SHEN Bin*
(Department of Orthopedics,West China Hospital,West China Medical School,Sichuan University,Chengdu 610041,China)
【Absttrraactt】Background::Osteoarthritis is the result of chondrocytes degeneration.While autophagy is a cellular homeostasis mechanism that plays an essential role in preventing chondrocytes degeneration.Rapamycin as an autophagy inducer could upregulate autophagy activity and maintain cell homeostasis.Objecttiivee::To observe the changes of expression of autophagy related molecules(ULK1,Beclin1 and LC3)after regulation of mTOR signal pathway by Rapamycin.Methodss::Five normal cartilage samples and a total of 20 moderate and severe osteoarthritis cartilage samples with 10 of each were collected from amputation or knee arthroplasty surgery.Immunohistochemical techniques were used to detect the expression of autophagy-related proteins such as ULK1,Beclin1 and LC3 in cartilage.Knee cartilage cells were isolated and cultured in vitro for drug experiment.Osteoarthritis chondrocyte samples were divided into four groups:low,medium,high concentration Rapamycin groups and blank control group,treated with 1 μmol/L,5 μmol/L,10 μmol/L Rapamycin and the same volume of medium,respectively.PCR and Western-blot tests were performed to detect the mRNAand protein expression of autophagy related molecules(ULK1,Beclin1 and LC3).Resullttss::The results of immunohistochemistry showed that the expression of ULK1,Beclin1 and LC3 in the cartilage decreased significantly with the degradation of osteoarthritis.The results of PCR and Western-blot tests showed that in the normal chondrocyte,autophagy related molecules(ULK1,Beclin1 and LC3)were significant higher in low,medium and high concentration Rapamycin groups than those in blank control group,and were concentration-dependent on Rapamycin.The results of experiment on moderate osteoarthritis chondrocyte were similar to those of the normal chondrocyte,while the difference among groups was more significant.In the severe osteoarthritis chondrocyte,autophagy related molecules were higher in low,medium and high concentration Rapamycin groups than those in the blank control group,but no significant difference was found.Conclusiionss::Rapamycin can increase the expression of autophagy related molecules such as ULK1,LC3 and Beclin1.The autophagy activity is enhanced in the normal chondrocyte and the moderate osteoarthritis chondrocyte significantly by Rapamycin,but that in the severe osteoarthritis chondrocyte is little changed by Rapamycin.
Osteoarthritis;Autophagy;mTOR Signaling Pathway;Rapamycin
2095-9958(2017)06-0 248-06
10.3969/j.issn.2095-9958.2017.03-19
*通信作者:沈彬,E-mail:shenbin_1971@163.com
——雷帕霉素

