一种基于SYBR Green I实时荧光定量PCR的温州病毒检测方法的建立
张 优 吕 刚,2 陈锦龙 朱奇轩 尹飞飞,2
(1.海南医学院热带医学与检验医学院,海南 海口 571199; 2.海南医学院热带医学转化重点实验室,海南 海口 571199)
一种基于SYBR Green I实时荧光定量PCR的温州病毒检测方法的建立
张 优1吕 刚1,2陈锦龙1朱奇轩1尹飞飞1,2
(1.海南医学院热带医学与检验医学院,海南 海口 571199; 2.海南医学院热带医学转化重点实验室,海南 海口 571199)
目的 建立一种温州病毒(Wenzhou virus, WENV)的SYBR GreenI实时荧光PCR检测方法。 方法 分析WENV保守区域并设计特异引物,以特异扩增产物构建的阳性重组质粒为标准品,建立SYBR Green I实时荧光定量PCR反应的扩增曲线和溶解曲线,获得标准曲线。 结果 建立的WENV的荧光定量PCR标准曲线在1×101~1×108拷贝/μl的浓度时呈现良好线性关系,其扩增相关系数为0.999,熔解曲线只出现1个特异峰,无引物二聚体,检测下限可达10拷贝。利用WENV的样本对本检测方法进行验证,结果良好,组内变异系数为1.47%。 讨论 本实验建立的SYBR Green I实时荧光定量PCR检测方法灵敏度高、特异性好,可用于WENV的诊断及病原的定量分析。
WENV;实时荧光PCR;检测
温州病毒(wenzhou virus, WENV),属于沙粒病毒科(arenaviridae),是一种有包膜、单链线状RNA病毒,以啮齿目动物为主要宿主的重要的人畜共患病原体[1-2]。近年来也有报道在蝙蝠和蛇[3-4]体内检测到沙粒病毒。沙粒病毒可以引起人类淋巴细胞脉络丛脑膜炎和以拉沙热为代表的人类病毒性出血疾病等严重的人类疾病[5-9]。沙拉热病毒是西非发热疾病的重要病原体,拉沙病毒可以引起人类病毒性出血疾病,致死率高,是西非发热性疾病的重要病原体,急性期病死率为15%~20%;特别是孕妇感染后预后较差,易导致流产、畸胎与死胎[10-11]。WENV作为一种新发病原是我国报道首例新型的沙粒病毒,于2014年首次在我国浙江省褐家鼠和黄胸鼠体内检测出来,也是亚洲大陆近80年发现的首例新沙粒病毒[2]。沙粒病毒的检测的方法有:细胞分离培养、免疫学抗原抗体检测技术和RT-PCR核酸检测[12]。细胞学检测和免疫学检测的特异性有一定局限性[13];而RT-PCR具有检测速度快、灵敏度高且特异性好等优点,适用于大量样本的高通量检测,能够在病毒感染早期进行有效检测的特点。目前国内外尚未见有针对WENV的有效检测方法。本研究选取了WENV最为保守的RNA依赖性RNA聚合酶(RNA-dependent RNA polymerase, RdRP),建立了基于SYBR Green I实时荧光定量PCR检测WENV的方法,为WENV感染的诊断及流行病学调查提供了技术支持和参考。
1 材料与方法
1.1材料 含WENV的RdRP基因的重组质粒WENV-ZT由作者构建并保存;离心机,德国Eppendorf公司产品;Rotor-Gene Q荧光定量PCR仪,德国QIAGEN公司产品;Nano Drop紫外分光光度计(2000型),美国Thermo Scientific公司产品;凝胶成像系统。QIAamp Viral RNA Mini Kit与dNTPs,德国QIAGEN公司产品;Random Primers、Ribolock RNase Inhibitor和M-MLV Reverse Transcriptase,美国Thermo Scientific公司产品;ZTOPO-Vecotr,北京庄盟国际生物基因科技有限公司;Taq PCR MasterMix (TIANGEN) SuperReal PreMix Plus,离心柱型DNA凝胶回收与纯化试剂盒和质粒提取试剂盒,天根生化科技(北京)有限公司产品。
1.2方法
1.2.1引物设计与合成 用 BIOEDIT软件对Genbank上所有的WENV核苷酸序列进行比对,分析确定其保守区域。根据基因序列(KM 386661.1),用Primer Premier 5.0设计一对特异性引物,上游引物WENV-F:5’AAGGGTGTTAGGCTTGTCG 3’,下游引物WENV-R:5’CAGGCTTAGAAATCAGACG 3’,由北京六合华大基因科技有限公司合成,预期扩增片段大小为232bp。
1.2.2质粒标准品的制备
1.2.2.1病毒RNA的提取 室温下,称取感染WENV的家鼠的肝组织0.2 g,加入300 μl病毒保存液进行组织破碎,获得肝匀浆液。将获得肝匀浆液经过外源消化核酸,使用QIAamp Viral RNA Mini Kit,按说明书手工操作,提取核酸的样本量为140μl,提取核酸洗脱液体积为60μl收集RNA溶液,-80 ℃保藏备用。
1.2.2.2cDNA的逆转录合成 cDNA的逆转录合成:5×MLV-RT buffer 4 μl,MLV RT(50umol/l)1ul,,Random primer1μl,dNTPs(10mM each)1 μl,RNasin 1 μl,RNA template 12 μl,混匀后短暂离心,37 ℃孵育60 min;90 ℃孵育10 min灭活MLV-RT和RNasin。合成的cDNA 保存于-80℃备用。
1.2.2.3WENV标准品的制备 以cDNA为模板进行PCR反应, 反应体系为25 μl:2×Taq Master Mix 25 μl,正、反向引物各1 μl,cDNA 2μl ,灭菌双蒸水21 μl。PCR反应条件为:95 ℃ 5 min;30个循环95 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s;72 ℃ 10 min;16 ℃保温。取扩增产物5μl于0.8%琼脂糖凝胶中电泳,观察结果。
紫外灯下切取目的片段DNA,经试剂盒回收纯化后,与ZTOPO vector按照摩尔比1∶3的比例连接,转化DH5α感受态细胞。在含氨苄青霉素的培养板上37 ℃培养16 h,挑取单个菌落,进行PCR鉴定和Sanger测序验证。
1.2.3荧光定量PCR检测方法的建立
1.2.3.1荧光定量PCR反应条件的优化 为了优化荧光定量PCR的退火温度,对荧光定量PCR的循环条件进行三步法摸索,并将退火温度从55 ℃依次递增至60 ℃,递增步长为1 ℃。
1.2.3.2荧光定量PCR敏感性试验及标准曲线的建立 用紫外分光光度计测定其核酸浓度,计算拷贝/μl,作为荧光定量PCR的标准品。将质粒标准品进行10倍浓度梯度稀释,获得浓度为1.0×102~1.0×108拷贝/μl的质粒标准品,按1.2.3.1中优化后的条件进行PCR反应,观察该方法的敏感性,标准曲线由Rotor Gene荧光定量PCR仪自动生成,其中X轴代表每个浓度标准品模板中所含病毒起始含量以10为底的对数,Y轴代表各个梯度质粒标准品扩增达到阈值所需的循环数。
1.2.3.3荧光定量PCR的初步应用 对感染WENV的啮齿动物的肝组织样本进行检验,加入200ul无血清细胞培养液后,提取RNA并进行逆转录后进行荧光定量PCR检测。用已建立的SYBR GreenⅠ实时荧光定量PCR方法检测样本中WENV的含量。
2 结 果
2.1靶基因的扩增 利用本实验设计的引物进行PCR扩增,获得约232bp的目的片段,与预期结果相符(图1)。该片段回收纯化后与ZTOPO vector连接,重组质粒命名为WENV-ZT ,对该质粒进行测序,测序结果经BLAST分析表明,扩增的目的片段与WENVRNA依赖性RNA聚合酶(RdRP)序列(KM 386661.1 )的一致性为95%,并且与 NCBI数据库中其他WENV的RdRP基因序列比对,同源性大于94%,说明对该毒株进行检测对其他WENV具有参考意义。

M.D2000 DNA分子质量标准;1.阴性对照;2.特异性扩增产物。
图1 RdRP基因PCR扩增结果
2.2敏感性试验及标准曲线的建立 本实验获得的重组质粒的浓度为108ng/μl,经计算其拷贝数约为4.7×1010拷贝/μl,对该质粒进行10倍梯度稀释,获得1.0×102~1.0×108拷贝/μl的质粒作为检测的模板,按照优化的最佳反应条件:2×SuperReal Premix Plus 25 μl,上、下游引物各1 μl,模板2 μl,灭菌双蒸水21 μl,总体积50 μl;最佳反应条件为:95 ℃15 min;95 ℃15 s,58 ℃20 s,72 ℃20 s,40个循环进行SYBR GreenⅠ实时荧光定量PCR反应,从图2可以看出,本研究建立的荧光定量PCR方法的检测灵敏度达到1.0×102拷贝/μl。在1.0×102~1.0×108拷贝/μl范围内线性关系良好,经Rotoe Gene荧光定量PCR仪(Qiagen)软件自动分析得到了荧光定量 PCR方法的标准曲线(图3),相关系数R2=0.999。

图2 标准品10倍梯度稀释的SYBR Green I 荧光PCR扩增曲线

图 3 SYBR Green I Real-time quantitative PCR 的标准曲线
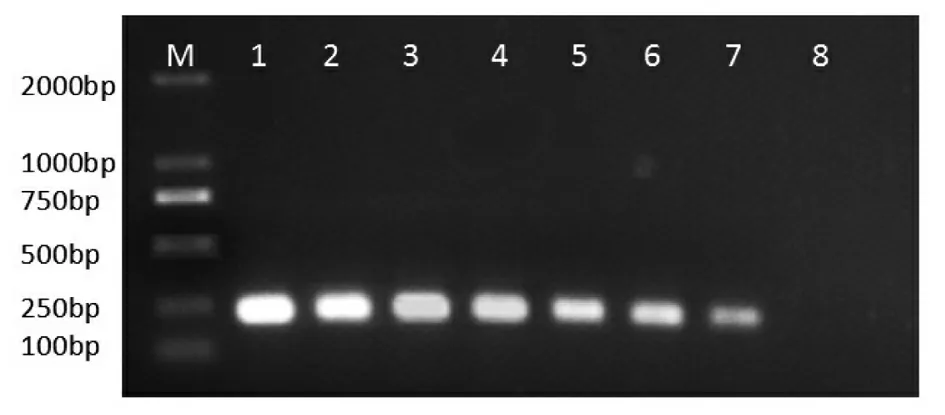
M.D2000 DNA分子质量标准;1.108拷贝/μl;2.107拷贝/μl;3.106拷贝/μl;4.105拷贝/μl;5.104拷贝/μl;6.103拷贝/μl;7.102拷贝/μl;8.阴性对照。
图4 RdRP基因SYBR Green I PCR扩增结果
2.3熔解曲线的分析 对熔解曲线分析表明,本方法在熔解温度Tm=(82±0.5)℃时出现特异性峰,表明该反应特异性良好(图4)。

图5 标准品熔点曲线分析结果
2.4疑似WENV感染的家鼠肝组织中病毒含量的检测 用本项目建立的SYBR GreenⅠ实时荧光定量PCR方法对海口疑似WENV感染的家鼠肝组织中WENV含量进行检测,进行重复3次的批内试验。三次重复实验的溶解曲线只有一个特异峰,特异性良好;反应循环值(Ct)分别为:11.67、11.66、11.32,平均值(Ct Mean)为11.55,标准差(STD)为0.1626,变异系数(CV)为1.47%,结果显示重复性良好。
3 讨 论
沙粒病毒是淋巴细胞性脉络丛脑膜炎、拉撒热、阿根廷出血热和玻利维亚出血热等严重人类疾病的病原体,主要分布在欧美和非洲地区,亚洲地区报道较少[14-15]。拉沙病毒(Lassa virus, LASV)主要分布在西非,据统计每年非洲地区的沙拉热感染人数30万至50万人,5 000人死亡[16]。呼宁病毒(Junin virus, JUNV)、马秋博病毒(Machupo virus, MACV)、瓜纳瑞托病毒(Guanarito virus, GTOV)主要分布在南美洲地区,易引起可觉察的出血性疾病或神经系统疾病,往往与心血管疾病、胃肠道疾病、肾病以及神经系统疾病密切相关,病死率15%~ 30%[17-18]。目前在亚洲大陆发现的沙粒病毒仅有淋巴细胞性脉络丛脑膜炎病毒(lymphocytic choriomeningitis virus, LCMV)和WENV:LCMV可致人脑炎,患病后致死率低(<1%)[19];WENV于2014年首次在中国浙江啮齿动物体内发现,其系统发育进化关系显示与已知的沙粒病毒亲缘关系远,是一种新的沙粒病毒,是自20世纪30年代以来在欧亚大陆上发现的第二种沙粒病毒[2]。2016年在东南亚地区啮齿动物也报道了WENV变种的流行,在柬埔寨发现WENV感染人后可以引起发热、头痛、流涕等一系类沙粒病毒感染的症状,并预测WENV的致病性可能与LASV和LCMV相似[13]。进一步证实了WENV在亚洲地区广泛存在流行的可能,潜在的感染性和致病性使其引起新发传染病的风险加剧。
沙粒病毒的诊断金标准是细胞培养,但样本处理前期不当容易造成病毒失活、病毒滴度低,这些情况往往导致不能成功分离病毒,大大限制了细胞分离技术在WENV病毒诊断检测上的应用[13]。血清学方法也用于沙粒病毒的检测,但各病毒成员之间的交叉反应会影响检测结果的特异性,仍需要进一步优化[20-21]。RT-PCR核酸检测技术,具有快速、特异性好、灵敏度高等优点,而且扩增结果通过序列分析甚至能够获得其病毒在系统发育进化上的位置,有助于发现新病毒[22]。WENV基因组是由包膜和分节段的单链 RNA组成,病毒基因组包含有两个区域:S段编码核壳蛋白(NP)和包膜糖蛋白(GP),L段编码病毒和锌结合蛋白(ZP)[21]。目前,国内外尚未报道建立针对WENV的有效检测方法。
本研究建立了基于SYBR GreenⅠ的WENV实时荧光定量PCR快速检测技术。为了避免漏检试验选择了最为保守的RNA依赖性RNA聚合酶(RdRP)基因作为检测靶基因,引物设计阶段注意其AT和GC含量比,确保PCR的扩增效率和特异性。本试验以8个梯度稀释的标准品质粒进行荧光定量PCR扩增,结果显示均可出现典型S型扩增曲线。重复性试验结果表明,每个重复误差不到0.5个循环,变异系数为1.47%,说明该检测方法具有良好的可重复性。
综上,本研究建立的WENV荧光定量PCR检测方法,将为我国WENV的检测提供快速有效的手段,进而为更好的防控WENV的发生与流行奠定基础。
[1] Jay MT,Glaser C,Fulhorst CF.The arenaviruses[J].J AmVet Med Assoc,2005,227(6):904-915.
[2] Li K,Lin XD,Wang W,et al.Isolation and characterization of a novel arenavirus harbored by Rodents and Shrews in Zhejiang province,China[J].J Virol,2014,476:37-42.
[3] Bodewes R,Kik MJ,Raj VS,et al.Detection of novel divergent arenavirus in boid snakes with inclusion body disease in the netherland[J].J Gen Virol,2013.94:1206-1210.
[4] Hetzel U,Sironen T,Laurinmki P, et al. Isolation, Identification, and Characterization of Novel Arenaviruses, the Etiological Agents of Boid Inclusion Body Disease[J].J Virol,2013,87:10918-10935.
[5] Gonzalez JP,Emonet S,Lamballerie X,et al.Arenaviruses[J].Curr Top Microbiol Immunol,2007,315:253-288.
[6] Bowen MD,Peters CJ,Nichol ST.Phylogenetic analysis of the Arenaviridae: patterns of virus evolution and evidence for cospeciation between arenaviruses and their rodent hosts[J]. Mol Phylogenet Evol,1997,8(3):301-316.
[7] Charrel RN,Lamballerie X.Arenaviruses other than Lassavirus[J].Antiviral Res,2003,57(1):89-100.
[8] Salazar BJ,Dragoo JW,Bowen MD,et al.Natural nidality in Bolivian hemorrhagic fever and the systematics of the reservoir species[J].Infect Genet Evol,2002,1(3):191-199.
[9] Demby AH,Inapogui A,Kargbo K,et al.Lassa fever in Guinea: II. Distribution and prevalence of Lassa virus infection in small mammals[J].Vector Borne Zoonotic Dis,2001,1(4):283-297.
[10] McCormick JB,Fisher-Hoch SP.Lassa fever[J]. Curr TopMicrobiol Immunol,2002,262:75-109.
[11] Guerrant RL,Walker DH,Weller PF,et al.Tropical infectious diseases: principles, pathogens and practice[M].Philadephia:Charchill Livingstone,1999.1180-1188.
[12] 陈昭斌.拉沙热病毒及其检测技术[J].中国卫生检验杂志,2006,16(2):254-256.
[13] Blasdell KR,Duong V, Eloit M,et al.Evidence of human infection by a new mammarenavirus endemic to Southeastern Asia[J].Elife,2016,9:5.
[14] Delgado S,Erickson BR,Agudo R,et al.Chapare virus,a newly discovered arenavirus isolated from a fatal hemorrhagic fever case in Bolivia[J].PLoS One,2008,4(4):1-6.
[15] Palacios G,Druce J,Du L,et al.A new arenavirusin a cluster offatal transplant-associated diseases[J].N Engl Med,2008,358(10):991-999.
[16] Ogbu O,Ajuluchukwu E,Uneke CJ.Lassa fever in West African sub-region:an overview[J].J Vector Borne Dis,2007, 44(1): 1-11.
[17] Fulhorst CF,Bowen MD,Salas RA,et al.Natural rodent host associations of Guanarito and pirital virusesin central Venezuela[J],Am J Trop Med Hyg,1999,61(2):325-330.
[18] Armstrong LR,Dembry LM,Rainey PM,et al.Management of a Sabia virus-infected patient in a US hospital[J].Infect Control Hosp Epidemiol,1999,20(3):176-182.
[19] Mandell GL,Bennett JE,Dolin R,et al.Mandell, Douglas and Bennett's principles and practice of infectious diseases[M].Philadelphia: Churchill Livingstone,2005:1855-1862.
[20] Bausch DG,Rollin PE,Demby AH,et al.Diagnosisand clinical virology of Lassa fever as evaluated by enzyme-linked immunosorbent assay, indirect fluorescent-antibody test, and virusisolation[J].J Clin Microbiol,2000,38(7):2670-2677.
[21] Takimoto K,Taharaguchi M,Morikawa S,et al.Detection of the antibody to lymphocytic choriomeningitis virus in sera of laboratory rodents infected with viruses of laboratory and newly isolated strains by ELISA using purified recombinant nucleoprotein[J].Exp Anim,2008,57(4):357-365.
[21] Methods for trapping and sampling small mammals for virologictesting[EB/OL].[2004-12-05].www.Cdc.gov/ncidod/dvrd/spb/mnpages/ rodentmanual.htm.
[22] Jay MT,Glaser C,Fulhorst CF.The arenaviruses[J].J Am Vet Med Assoc,2005,227(6):904-915.
Establishment of SYBR GreenⅠreal-time PCR for detecting Wenzhou virus
ZHANG You1LV Gang1,2CHEN Jin-long1ZHU Qi-xuan1YIN Fei-fei1,2
(1.College of Tropical Medicine and Laboratory Medicine, Hainan Medical University, Haikou 571199,China; 2. Key Laboratoy of Translation Medicine Tropical Diseases, Hainan Medical University, Ministry of Education, Haikou 571199,China)
Objective: To establish SYBR GreenⅠreal-time PCR method for Wenzhou virus (WENV).Methods:The conserved fragments ofRNA-dependentRNApolymerase(rdrp) gene of WENV were analyzed. Primers were designed based on the conserved regions. The recombinant plasmid was used to establish melting and standard curves of SYBR GreenⅠreal-time PCR.Results:The generated standard curve had a wide dynamic range from 1×101to 108copies/μl, with a linear correlation of R2=0.999. The melting curve analysis using SYBR GreenⅠshowed that only one specific melting peak was observed and no primer-dimers represented. The detection limit of the method was 10 copies/reaction and intra-assay variation was 1.47%. Conclusion:The established SYBR GreenⅠreal-time PCR method has high sensitivity and strong specificity, which is suitable for rapid detection of Wenzhou virus.
Wenzhou virus;real-time PCR;detection
国家自然科学基金课题(31460017,81672072);海南省重点研发计划项目(ZDYF2017091);海南省高等学校科学研究专项项目(Hnky2017ZD-16, Hnkyzx2014-08)。
张优(1992—),女,湖南浏阳人,研究生,研究方向:病原生物学。
尹飞飞(1981—),女,内蒙古赤峰人,副研究员,博士,E-mail:yinfeifeiff@163.com。
R446.5
:A
:1004-7115(2017)09-0961-04
10.3969/j.issn.1004-7115.2017.09.001
2017-06-02)
*

