肠黏膜上皮组织紧密连接的生物学功能和作用机理
陈 意 李方方 张 勇,* 黄铁军
(1.沈阳农业大学畜牧兽医学院,沈阳110866;2.乐达(广州)香味剂有限公司,广州510530)
肠黏膜上皮组织紧密连接的生物学功能和作用机理
陈 意1李方方1张 勇1,2*黄铁军2
(1.沈阳农业大学畜牧兽医学院,沈阳110866;2.乐达(广州)香味剂有限公司,广州510530)
紧密连接(TJ)是肠黏膜上皮细胞间的主要连接方式,对维持黏膜上皮细胞极性及调节肠屏障的通透性发挥着重要的作用。TJ在黏膜上皮细胞间形成限制溶质和物质运动的细胞屏障。总的来说,TJ的结构可以概括为跨膜屏障蛋白与周围的脚手架蛋白组成的间隔。在这个复杂的网络中有许多相关的信号蛋白,影响屏障和更广泛的细胞功能。本文从TJ在肠黏膜上皮中的生物学功能、分子调控机制及当前研究现状等作综合阐述。
肠黏膜上皮细胞;紧密连接;黏膜屏障;作用机理
黏膜是肠道上皮重要的一道屏障,它是由肠黏膜上皮细胞(intestinal epithelial cell,IEC)连接构成,并调控着物质的跨上皮运输,如单糖、氨基酸、核苷酸、维生素及激素。肠道黏膜上皮细胞间有多种连接方式,如紧密连接(tight junction,TJ)、缝隙连接(gap junction,GJ)、黏附连接(adherence junction,AJ)以及桥粒(desmosome)等。其中TJ是细胞间最重要的连接方式,TJ在黏膜上皮细胞间形成限制溶质和物质运动的细胞屏障。目前许多蛋白已被确定为TJ的组件,了解它们的组织机构和相互作用对于理解屏障的生物学作用是至关重要的。屏障的结构可以概括为间隔与跨膜屏障[密封蛋白(claudin)[1]、闭合蛋白(occludin)[2]、连接黏附分子(JAM)[3]等]与周围的脚手架蛋白[外周蛋白1(ZO-1)、丝状肌动蛋白结合蛋白(afadin)[4]等]组成的一类蛋白复合体。在这个复杂的网络中有许多相关的信号蛋白,影响屏障和更广泛的细胞功能。黏膜上皮细胞间转运需要细胞旁的密封结构以便跨层细胞离子和溶质的定向运输。这种密封结构是由TJ形成的,TJ是在相邻细胞之间最顶端交界处由一系列细胞接触形成的横向连接。TJ结构如图1所示。
1 TJ的生物学特征
1.1蛋白种类
肠黏膜上皮细胞分为黏液层、顶面、基底外侧面,TJ是在上皮细胞和内皮细胞连接复合体的最顶端结构,由众多蛋白及其连接物从质膜的顶面到基底外侧面之间形成屏障结构和细胞旁路间隙。研究表明,TJ中含有众多蛋白,构成多分子TJ复合物蛋白可以分为3组:1)TJ整合蛋白(occludin、claudin),它连接顶端细胞间隙并形成调节渗透性屏障;2)TJ斑块蛋白[上皮细胞钙黏蛋白(E-cadherin)、ZO-1、JAM-1],其中多数表达盘状同源区域(PDZ)结构域作为整合TJ蛋白和肌动蛋白(actin)细胞骨架之间的连接,并且作为衔接细胞信号相关的胞浆分子的接头蛋白;3)其他蛋白[联蛋白(catenins)、扣带蛋白(cingulin)、肌动蛋白等],包括调节蛋白、肿瘤抑制剂以及转录和转录后因子,它们直接或间接地与TJ斑块蛋白相互作用,以协调这样的多种功能,如调节细胞外溶质渗透性、细胞增殖、细胞极性和肿瘤抑制。
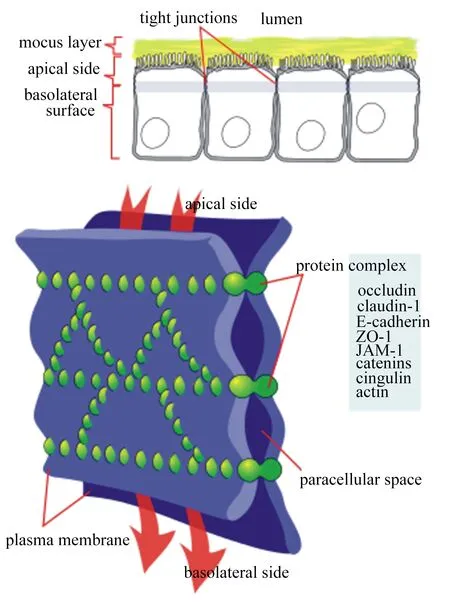
tight junctions:紧密连接;lumen:腔道;mucus layer:黏液层;apical side:顶面;basolateral surface:基底外侧面;protein complex:蛋白复合体;occludin:闭合蛋白1;claudin-1:密封蛋白1;E-cadherin:上皮细胞钙黏蛋白;ZO-1:外周蛋白1 zonula occludens-1;JAM-1:连接黏附分子1 junctional adhesion molecule 1;catenins:链蛋白;cingulin:扣带蛋白;actin:肌动蛋白;paracellular space:细胞旁路间隙;plasma membrane:质膜;basolateral side:基底面。
图1TJ的蛋白结构
Fig.1 Protein structure of TJ[5]
1.2主要蛋白结构
TJ作为一个屏障通过旁细胞途径调节离子和小分子的通道(屏障功能)和限制膜脂质和蛋白质在顶面和基底面之间的横向扩散,以维持细胞的极性(栅栏功能)。组成TJ的众多蛋白中整合蛋白最重要,主要包括occuldin和claudin。occuldin是约65 ku的四跨膜蛋白,形成由短胞质环分开的2个细胞外环,并且氨基端和羧基端结构域都在胞质区域内(图2)。羧基端结构域富含丝氨酸、苏氨酸和酪氨酸残基,是许多蛋白质和酪氨酸激酶的靶标。2个细胞外环具有不寻常的氨基酸组成,包括高含量(61%)的酪氨酸和甘氨酸残基的第1环,而在酪氨酸残基(18%)第2环中富集。在任一环中存在非常少的带电荷的氨基酸,并且在中性pH下,它们被预测为不具有净电荷。根据数据库搜索和基因组克隆研究结果,已鉴定出claudin家族成员有24个,经预测其基因编码22~24 ku的蛋白,其中claudin和occuldin没有任何同源序列,但和occuldin相似的是claudin具有相对短的胞质氨基和羧基端侧翼的53个氨基酸的第1胞外环和长度为24个氨基酸的第2个更短的环的4层蛋白(图2)。
ZO蛋白家族作为TJ重要的支架蛋白,包括ZO-1[6-7]、ZO-2和ZO-3[8]。这3个多模块蛋白属于膜相关鸟苷酸激酶(membrane-associated guanylate kinase-like,MAGUK)家族结构上均含有氨基端PDZ结构域中央Src同源结构域3(Src homology 3,SH3)和鸟苷酸激酶(guanylate kinase-like,GUK)域以及1个富含脯氨酸的结构域[9]。这些蛋白-蛋白相互作用结构域通过与TJ跨膜蛋白和纤维型肌动蛋白胞浆尾部形成稳定结构,这对链的装配具有关键作用。除了脚手架功能以外,ZO蛋白具有调控作用,对肌动球蛋白调节因子、信号蛋白和转录因子以及细胞极性有调节作用[10]。此外,在细胞融合性低或连接重构的条件下,一些ZO蛋白可以在TJ和细胞核之间穿梭[11]。因此,这些功能使ZO蛋白作为细胞外对TJ的动态冲击变化的机械感受器协调对像细胞极化、连接细胞装配、细胞增殖和细胞分化的基本细胞连接装配的过程。
连接黏附分子(junctional adhesion molecules,JAMs)是一类糖蛋白,属于免疫球蛋白超家族(immunoglobulin superfamily,IgSF),由2个胞外类免疫球蛋白样结构域(v-c2型免疫球蛋白结构域)[12],1个跨膜区和1个可变的胞质尾部(图2)。JAM的家庭是由4个密切相关的蛋白(JAM-1[13-14]、JAM-2[15-16]、JAM-3[17-18]和JAM-4[19])组成,它们在氨基酸水平上显示出高达35%的同一性并且在C末端[19]共享一个长度可变(40~50个残基)的短细胞内结构域,该结构域含有Ⅱ类PDZ结合基序。由于Ⅰ类和Ⅱ类PDZ结合基序与支架蛋白与肌动蛋白细胞骨架和信号通路的相互作用,JAM和相关蛋白定位于不同细胞质蛋白负责不同的功能联系。
claudin和claudin-1是不共享序列同源性的4层蛋白。claudin的第1胞外环富含酪氨酸和甘氨酸残基,并且2个环带电荷氨基酸残基均较少。相比之下,claudin-1的2个细胞外环的氨基酸组成变化显著,因此产生了宽范围的等电点。JAM-1跨膜浆膜1次,并具有2个胞外免疫球蛋白样的结
构域,其中第1氨基末端环与其相邻细胞上的同源配偶体相互作用。
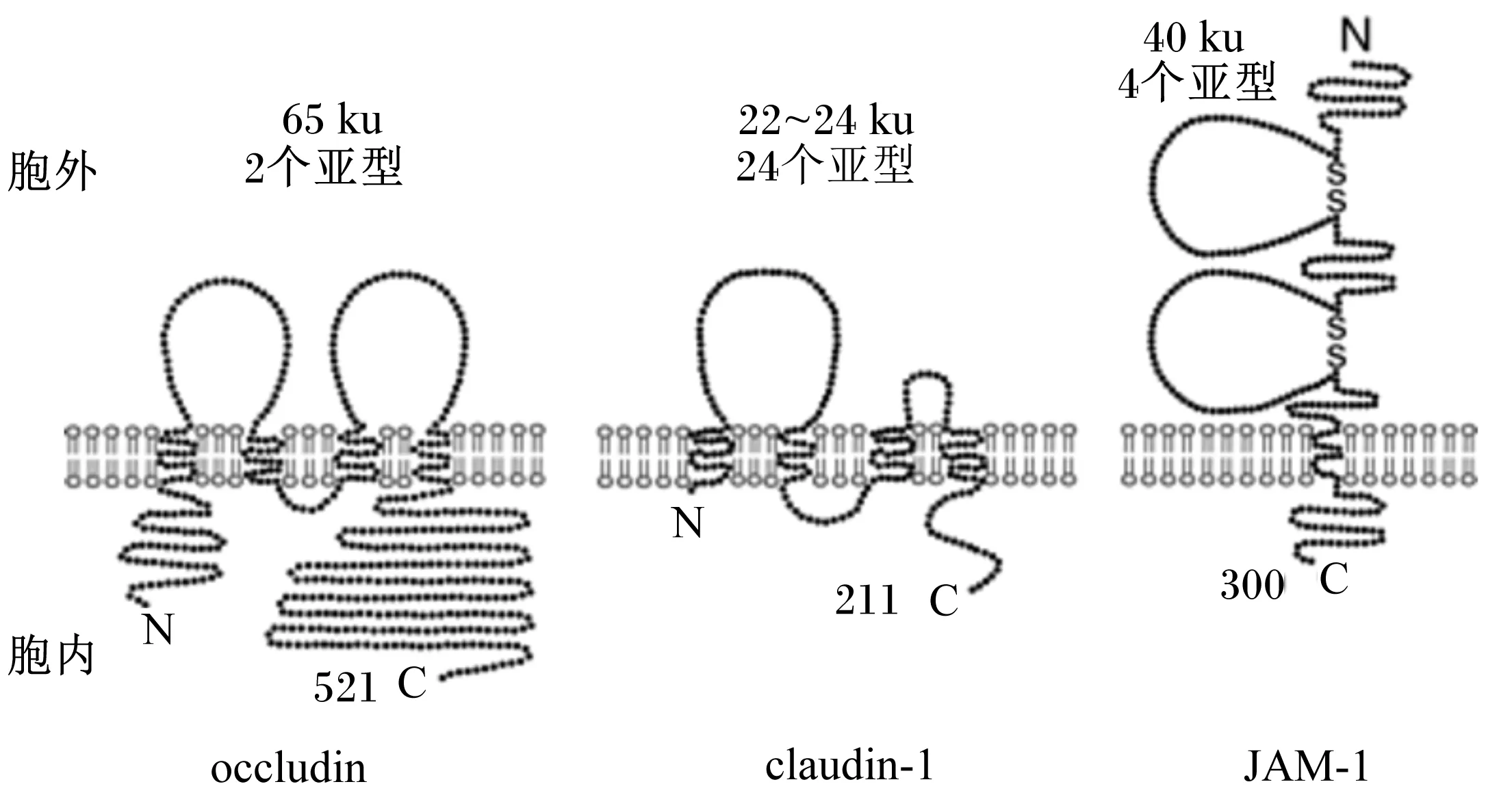
图2 occludin、claudin-1、JAM-1的蛋白结构
2 TJ中主要蛋白的作用
黏膜上皮在不同流体和溶质组成的细胞区室之间形成具有选择性的屏障,基本上通过2个途径控制调节:1)跨细胞途径,由能量依赖性转运蛋白和不对称分布在顶端的通道控制;2)细胞旁通路,其中整合的TJ蛋白跨越顶端细胞间隙,并调节离子和小的不带电荷的溶质通过细胞旁空间进行被动扩散[20]。TJ除了在细胞旁通路中作为调节的屏障,还在质膜平面中起到栅栏的作用,其中包括有助于维持整合膜蛋白和脂质的不对称分布。
2.1claudin参与离子选择性孔隙的形成
最近使用细胞膜非渗透聚乙二醇低聚物的研究表明,在肠细胞单层的TJ内存在限制性孔,半径为0.43~0.45 nm[21]。尽管这一数据表明TJ阻挡层对小的不带电的溶质是可渗透的,但是TJ中的孔能够区分相似电荷的离子,并且它们的渗透性取决于离子浓度和环境pH[22-23]。除了少数例外,大多数黏膜上皮中的TJ是阳离子选择性的。然而,TJ的离子渗透性(TER)和溶质渗透性在不同组织中甚至在相同组织的细胞中变化很大[24-25]。在TJ的2个胞外结构域中仅存在2种同种型的claudin和少量带电残基,表明claudin不可能直接作用于TJ中离子选择性孔的形成。相比之下,claudin的量和形式有所不同,细胞外环具有宽范围的等电点,一个或多个claudin的胞外结构域中的带电荷的氨基酸侧链可以在给定的TJ形成选择性孔隙。有试验表明,TJ蛋白的胞外结构域足以在旁细胞途径中形成离子选择性孔[26]。然而,表达claudin-4胞外结构域对claudin-2的电生理效应大于过表达天然claudin-4,表明其他结构域,包括羧基终端可能在调节离子选择性中发挥作用的可能性。
在与介质、pH和温度的变化相关联的最小化扰动的条件下对处于稳态的汇合单层进行研究,发现了TJ共享离子通道的生物物理性质,包括尺寸和电荷选择性,对离子浓度和pH的依赖性,以及离子竞争的存在。这些观察结果表明[27],特异性密蛋白似乎决定TJ中孔隙的离子选择性。
2.2occludin在TJ中的作用
occludin在TJ中的作用及其对TJ中的离子孔的功能和/或调节的贡献(如果有的话)是不清楚的。claudin在考克斯班尼犬肾(Madin-Darby canine kidney,MDCK)细胞中的过表达增加TER,但矛盾的是,增加甘露醇的跨上皮通量。在表达前列腺素受体的MDCK细胞中前列腺素与前列腺素受体结合再与G蛋白偶联,激活Ras同源基因家族成员A(Ras homolog gene family, member A,RhoA)-GTP酶(GTPase)后观察到类似的功能变化,而Ras相关的C3肉毒底物1(ras-related C3 botulinum toxin substrate 1,Rac1)或RhoA-GTPase的过表达导致TJ结构和功能的破坏。值得注意的是,最近鉴定的TJ相关的Ras同源基因家族(Ras homolog gene family,Rho)-GTPase特异性鸟嘌呤核苷酸交换因子(GEF/H1)的过表达增加了亲水性溶质的细胞旁通透性,而不影响TER。然而,没有检查GEF/H1活性对claudin磷酸化状态和在TJ中的功能的影响。在内皮细胞中检查了p160ROCK(RhoA的关键效应子之一)可能调节claudin磷酸化和TJ通透性的可能性。有试验观察表明claudin可能是受体启动的信号的目标,并且claudin磷酸化可以独立于细胞骨架活性调节TJ通透性。有试验观察表明,occludin可能行动协调细胞骨架的活动与各种信号通路,维护上皮细胞表型所必需的。
3 肠黏膜上皮细胞TJ的调控机制
当肠黏膜上皮的TJ的结构变异、减少或缺失,会导致肠黏膜上皮的间隙扩大,通透性也就会增加[28],使得一些细菌、内毒素可通过细胞间隙进入体循环,进而引起某些肠道炎症性疾病,如炎症性肠病。目前,有关这些TJ的调控机制尚不完全清楚,但是通过下列这些途径调控是基本的共识。
3.1磷脂酶C(phospholipaseC,PLC)依赖性信号通路
当肠道上皮黏膜受到外源性刺激或内源性刺激,肠道黏膜上皮细胞就会通过G蛋白的介导,从而激活PLC,PLC将4,5-二磷酸磷脂酰肌醇(phosphatidyl-inositol 4, 5-biophosphate,PIP2)分解成1,2-二脂酰甘油(1, 2-diacyl-glycerol,DAG)和三磷酸肌醇(inositol 1, 4, 5-trisphosphate,IP3),进而激活蛋白激酶C同工酶、钙调素依赖性激酶和肌球蛋白轻链激酶(myosin light chain kinase,MLCK);PLC活性改变,诱导周围连接肌动蛋白-肌球蛋白环的收缩,该环收缩移位会使得肠上皮的TJ结构松弛进而改变其功能[29],使得肠黏膜上皮的通透性改变。乙醇和中链脂肪酸也可通过上述机制分解周围连接肌动蛋白-肌球蛋白环,进而改变肠黏膜上皮的通透性。
3.2钙离子(Ca2+)-E-cadherin信号途径
E-cadherin作用在于调节细胞外Ca2+浓度进而调节TJ。E-cadherin在胞外部分形成5个含Ca2+结合部位的结构域。研究表明,当细胞外Ca2+浓度减小时,可以激活MLCK,从而使得肠黏膜上皮细胞的通透性增加。试验表明,Ca2+鳌合剂[如乙二胺四乙酸(EDTA)]能增加肠黏膜上皮细胞TJ的通透性,其机制可能是EDTA消耗细胞外Ca2+,导致E-cadherin所需Ca2+减少[30],TJ蛋白(occludin和ZO-1)分解,细胞旁路通透性增高。
3.3酪氨酸激酶-磷酸酶信号通路
G蛋白α12(Gα12)属异三聚体G蛋白家族,通过SH3结构域结合到ZO-1,Gα12活化能增强MDCK细胞旁路通透性。Meyer等[31]研究发现,在MDCK细胞表现出Gα12活性时,Src自磷酸化活性增高;同时β链蛋白酪氨酸磷酸化也升高,共聚焦显微镜下显示TJ蛋白被破坏,ZO-1和钠、钾ATP酶(Na+,K+-ATPase)的正常分布发生改变、细胞极性消失,而肌动蛋白应激纤维增高。酪氨酸激酶抑制剂金雀异黄素和Src特异性抑制剂PP-2能逆转上述改变,并可阻止细胞旁路通透性的升高。因此,Gα12可部分通过Sac酪氨酸激酶通路调控上皮细胞的TJ。
3.4Rho-GTPase途径
Rho-GTPase属于G蛋白酶,分子质量为20~30 ku,可以通过调节Rho的活性进而调节TJ的装配。研究发现,当Rho-GTPase激活Rho的活性后,会导致ZO-1和occludin在TJ处沉积,进而维持TJ的功能;当Rho的活性被Rho-GTPase抑制后则ZO-1和claudin在TJ处定位降低。研究发现当Rho活性抑制的同时敲除ATP,在转染细胞中TJ成分会大量的丢失[32]。
4 影响TJ的因素
4.1理化因素
有试验在不同功率密度的微波辐射下研究大鼠血脑屏障通透性、脑皮质和海马体中JAM-1表达的变化情况,结果表明,微波辐射会导致大鼠脑组织JAM-1表达水平降低,大鼠血脑屏障通透性增高;也有研究表明,在大鼠脑微血管内皮细胞培养试验中的氧糖剥夺/再给氧糖过程可破坏内皮细胞间TJ[19]。
4.2营养因素
4.2.1 脂肪酸
在目前的研究中,最佳膳食α-亚麻酸/亚油酸(ALA/LNA)能增加小肠黏膜claudin-3、claudin-b、claudin-c、claudin和ZO-1表达水平,而降低claudin-15a在小肠黏膜的表达水平,表明最佳膳食ALA/LNA加强了鱼肠道的TJ。有趣的是,在饲粮ALA/LNA为1.03的草鱼肠道中claudin-12表达水平提高,这可能与钙的吸收有关。Claassen等[33]研究表明,二十碳五烯酸以及它的同分异构体γ-亚麻酸(GLA,n-6)可以刺激大鼠肠钙吸收。同时,增强钙的吸收有助于调节claudin-12在小鼠肠黏膜上皮细胞的表达。这些数据表明,膳食中ALA/LNA为1.03时claudin-12表达水平的增加可能由于吸收钙的刺激,这需要进一步的研究。MLCK在调节小鼠TJ起着至关重要的作用。目前的研究表明,MLCK转录丰度明显减少的比例为1.03。进一步的相关分析表明,claudin-3、claudin-b、claudin-c、claudin和ZO-1与MLCK呈负相关,而claudin-15a与MLCK mRNA丰度呈正相关。
4.2.2 蛋白质
血红蛋白可引起内皮细胞间TJ破坏及通透性增加,进而导致内皮屏障功能障碍。血红蛋白可引起细胞内磷酸化肌球蛋白轻链(phosphorylated myosin light chain,p-MLC)表达水平增加,进而导致细胞内纤维型肌动蛋白大量形成、并诱导细胞间TJ蛋白ZO-1表达水平下降,这一变化可能是内皮细胞间TJ破坏的重要病理生理机制之一。
胰高血糖素样肽-2(glucagon-like peptide-2,GLP-2)是一种促肠生长激素,在离体的断奶仔猪肠组织块中进行GLP-2梯度试验,即在肠组织块中添加不同浓度的GLP-2培养72 h,试验结果表明适宜浓度的GLP-2促进了ZO-1、occludin、claudin-1的表达。
肠毒素分子质量为35 ku,它是一种由产气荚膜梭菌产生的能够使人类食物中毒的蛋白。该蛋白的羧基端特异性结合到claudin-3和claudin-4[34],而氨基端在质膜中形成孔。为了特异性与TJ蛋白结合并避免对质膜的损伤,肠毒素的羧基端转染claudin-1、claudin-2、claudin-3、claudin-4的L-细胞,或汇合表达claudin-1和claudin-4的MDCKⅠ细胞。在L-细胞转染子中,肠毒素片段选择性地结合到claudin-3和claudin-4而不是claudin-1或claudin-2。值得注意的是,在MDCKⅠ细胞中,肠毒素片段与肠黏蛋白肽结合4 h内,TJ开始分解,TER下降,细胞旁通量增加。然而,这些研究尚不清楚肠毒素与claudin-4的相互作用是否导致了现有TJ链中蛋白的解聚。或者,因为TJ的破坏仅在将肠毒素加入到基底外侧表面时才发生,所以可以想象,肠毒素与膜中的claudin-4单体的相互作用阻止了它们结合到TJ链中,从而导致TJ的破坏。
CagA是幽门螺杆菌产生的一种蛋白。当幽门螺杆菌黏附于上皮细胞的顶端连接复合物时,CagA从细菌转位到上皮细胞中[35]。值得注意的是,CagA似乎将幽门螺杆菌靶向细胞间连接处,其中肠毒素在细菌附着部位与ZO-1和JAM-1相互作用。在这种相互作用之后,TJ屏障功能被破坏,细胞形状被显着改变[36]。尽管导致幽门螺旋杆菌感染TJ破坏的机制尚不清楚,ZO-1和JAM-1的扰动有可能导致重要信号分子的定位和功能异常。如果异常,这种相互作用的临床后果可能是胃溃疡或胃癌。
5 小 结
TJ是肠黏膜上皮细胞间最重要的连接方式之一,与蛋白质、脂肪酸等营养因子的结合影响了TJ中蛋白的活性,起到调节肠道上皮物质转运及通透性的作用。但是TJ调控的分子机制尚未完全清楚。因此,深入开展TJ蛋白的基因表达调控方面的研究,对深入探讨动物肠道以及组织屏障的调控机理有重要意义。
[1] FURUSE M,FUJITA K,HIIRAIG T,et al.Claudin-1 and claudin-2:novel integral membrane proteins localizing at tight junctions with no sequence similarity to occludin[J].The Journal of Cell Biology,2001,141(7):1539-1550.
[2] MATSUDA M,KUBO A,FURUSE M,et al.A peculiar internalization of claudins,tight junction-specific adhesion molecules,during the intercellular movement of epithelial cells[J].The Journal of Cell Biology,2004,117:1247-1257.
[3] YEAMAN C,GRINDSTAFF K K,NELSON W J.New perspectives on mechanisms involved in generating epithelial cell Polarity[J].Physiology Review,2005,79(1):73-98.
[4] CITI S,DENISENKO N.Phosphorylation of the tight junction protein cingulin and the effects of protein kinase inhibitors and activators in MDCK epithelial cells[J].Journal of Cell Science,2005,108:2917-2926.
[5] TSUKITA S,FURUSE M.Occludin and claudins in tight-junction strands:leading or supporting Players?[J].Trends in Cell Biology,1999,9(7):268-273.
[6] STEVENSON B R,SILICIANO J D,MOOSEKER M S,et al.Identification of ZO-1:a high molecular weight polypeptide associated with the tight junction (zonula occludens) in a variety of epithelia[J].The Journal of Cell Biology,2005,103(3):755-766.
[7] GUMBINER B,LOWENKOPF T,APATIRA D.Identification of a 160-kDa polypeptide that binds to the tight junction protein ZO-1[J].Proceedings of the National Academy of Sciences of the United States of America,2005,88(8):3460-3464.
[8] HASKINS J,GU L J,WITTCHEN E S,et al.ZO-3,a novel member of the MAGUK protein family found at the tight junction interacts with ZO-1 and occludin[J].The Journal of Cell Biology,2005,141:199-208.
[10] BAUER H,ZWEIMUELLER-MAYER J,STEINBACHER P,et al.The dual role of zonula occludens (ZO) proteins[J].Journal of Biomedicine and Biotechnology,2010,2010:402593.
[11] LOPEZ-BAYGHEN E,JARAMILLOY BE,HUERTA M,et al.TJ proteins that make round trips to the nucleus[M]//GONZALEZ-MARISCAL L.Tight junctions.[S.l.]:Springer,2006: 76-100.
[12] WILLIAMS A F,BARCLAY A N.The immunoglobulin superfamily-domains for cell surface recognition[J].Annual Review of Immunology,2005,6(1):381-405.
[13] MALERGUE F,GALLAND F,MARTIN F,et al.A novel immunoglobulin superfamily junctional molecule expressed by antigen presenting cells,endothelial cells and platelets[J].Molecular Immunology,2005,35(17):1111-1119.
[15] CUNNINGHAM S A,ARRATE M P,RODRIGUEZ J M,et al.A novel protein with homology to the junctional adhesion molecule.Characterization of leukocyte interactions[J].The Journal of Biology Chemistry,2000,275:34750-34756.
[16] PALMERI D,VAN ZANTE A,HUANG C C,et al.Vascular endothelial junction-associated molecule,a novel member of the immunoglobulin superfamily,is localized to intercellular boundaries of endothelial cells[J].The Journal of Biology Chemistry,2000,275(25):19139-19145.
[17] ARRATE M P,RODRIGUEZ J M,TRAN T M,et al.Cloning of human junctional adhesion molecule 3 (JAM3) and its identification as the JAM2 counter-receptor[J].The Journal of Biology Chemistry,2001,276(49):45826-45832.
[18] AURRAND-LIONS M,DUNCAN L,BALLESTREM C,et al.JAM-2,a novel immunoglobulin superfamily molecule,expressed by endothelial and lymphatic cells[J].The Journal of Biology Chemistry,2001,276(4):2733-2741.
[19] HIRABAYASHI S,TAJIMA M,YAO I,et al.JAM-4,a junctional cell adhesion molecule interacting with a tight junction protein,MAGI-1[J].Molecular and Cellular Biology,2003,23:4267-4282.
[20] MADARA J L.Intestinal absorptive cell tight junctions are linked to cytoskeleton[J].American Journal of Physiology:Cell Physiology,2005,253(1):C171-C175.
[21] WATSON C J,ROWLAND M,WARHURST G.Functional modeling of tight junctions in intestinal cell monolayers using polyethylene glycol oligomers[J].American Journal of Physiology:Cell Physiology,2001,281(2):388-397.
[22] TANG V W,GOODENOUGH D A.Paracellular ion channel at the tight junction[J].Biophysical Journal,2003,84(3):1660-1673.
[23] YU A S L,ENCK A H,LENCER W I,et al.Claudin-8 expression in Madin-Darby canine kidney cells augments the paracellular barrier to cation permeation[J].The Journal of Biology Chemistry,2003,278(19):17350-17359.
[24] ENCK A H,BERGER U V,YU A S L.Claudin-2 is selectively expressed in proximal nephron in mouse kidney[J].American Journal of Physiology:Renal Physiology,2001,281(5):F966-F974.
[25] KIUCHI-SAISHIN Y,GOTOH S,FURUSE M,et al.Differential expression patterns of claudins,tight junction membrane proteins in mouse nephron segments[J].Journal of the American Society of Nephrology,2002,13(4):875-886.
[26] COLEGIO O R,VAN ITALLIE C M,RAHNER C,et al.Claudin extracellular domains determine paracellular charge selectivity and resistance but not tight junction fibril architecture[J].American Journal of Physiology:Cell Physiology,2003,284(6):C1346-C1354.
[27] FURUSE M,FURUSE K,SASAKI H,et al.Conversion of zonulae occludentes from tight to leaky strand type by introducing claudin-2 into Madin-Darby canine kidney Ⅰ cells[J].The Journal of Biology,2001,153(2):263-272.
[28] HOLLANDER D,VADHEIM C M,BRETTHOLZ E,et al.Increased intestinal permeability in patients with Crohn’s disease and their relatives.A possible etiologic factor[J].Annals of Internal Medicine,2005,105(6):883-885.
[29] YAMAGUCHI Y,DALLE-MOLLE E,HARDISON W G.VasoPressin and A23187 stimulate phosphorylaiton of myosin light chain-1 in isolated rat hepatocytes[J].American Journal of Physiology:Gastrointestinal and Liver Physiology,2005,261(2):G312-G319.
[30] BEHLENS J,VAKAET L,FRIIS R,et al.Loss of epithelial differentiation and gain of invasiveness correlates with tyrosine phosphorylation of the E-cadherin/beta-catenin complex in cells transformed with a temperature-sensitivev-SRCgene[J].The Journal of Biology,2005,120(3):757-766.
[31] MEYER T N,HUNT J,SCHWESINGER C,et al.Gα12regulates epithelial cell junctions through Src tyrosine kinases[J].American Journal of Physiology:Cell Physiology,2003,285(5):C1281-C1293.
[32] GOPALAKRISHNAN S,RAMAN N,ATKINSON S J,et al.Rho GTPase signaling regulates tight junction assembly and Protects tight junctions during ATP depletion[J].American Journal of Physiology:Cell Physiology,2005,275(3):C798-C809.
[33] CLAASSEN N,COETZER H,STEINMANN C M L,et al.The effect of different n-6 n-3 essential fatty acid ratios on calcium balance and bone in rats[J].Prostaglandins,Leukotrienes and Essential Fatty Acids,1995,53(1):13-19.
[34] FUJITA K,KATAHIRA J,HORIGUCHI Y,et al.Clostridiumperfringensenterotoxin binds to the second extracellular loop of claudin-3,a tight junction integral membrane protein[J].FEBS Letters,2000,476(3):258-261.
[35] ODENBREIT S,PÜLS J,SEDLMAIER B,et al.Translocation ofHelicobacterpyloriCagA into gastric epithelial cells by type Ⅳ secretion[J].Science,2000,287(5457):1497-1500.
[36] AMIEVA M R,VOGELMANN R,COVACCI A,et al.Disruption of the epithelial apical-junctional complex byHelicobacterpyloriCagA[J].Science,2005,300(5624):1430-1434.
*Corresponding author, professor, E-mail: syndzhy@126.com
(责任编辑 王智航)
Biological Function and Mechanism of Tight Junction of Intestinal Mucosal Epithelium
CHEN Yi1LI Fangfang1ZHANG Yong1,2*HUANG Tiejun2
(1. College of Veterinary and Animal Science, Shenyang Agricultural university, Shenyang 110866, China; 2. Lucta (Guangzhou) Flavours Co., Ltd., Guangzhou 510530, China)
Tight junction is the main connection between intestinal epithelial cells, which plays an important role in maintenance of epithelial cell polarity and regulation of the permeability of the intestinal barrier. Tight junction creates an intercellular barrier limiting paracellular movement of solutes and materials across epithelia. In general, the architecture can be conceptualized into compartments with the transmembrane barrier proteins linked to peripheral scaffolding proteins. Within the complex network, tight junction is associated with many signaling proteins that affect the barrier and broader cell functions. This review was about biological function, molecular mechanisms and current research status of tight junction in intestinal mucosal epithelium.[ChineseJournalofAnimalNutrition,2017,29(9):3068-3074]
intestinal mucosal epithelial cell; tight junction; intestinal barrier; mechanism
10.3969/j.issn.1006-267x.2017.09.007
2017-02-23
陈 意(1993—),男,安徽合肥人,硕士研究生,从事分子营养学与饲料资源开发利用研究。E-mail: 15940519094@163.com
*通信作者:张 勇,教授,硕士生导师,E-mail: syndzhy@126.com
S852.2
:A
:1006-267X(2017)09-3068-07

