α-酮戊二酸和大蒜素对生长猪生长发育及养分表观消化率的影响
刘少娟 陈家顺 康保聚 蒋 谦 何流琴 吴 飞 黄 牛 李 欢 印遇龙* 姚 康*
(1.中国科学院亚热带农业生态研究所,中国科学院亚热带农业生态过程重点实验室,湖南省畜禽健康养殖工程技术中心,农业部中南动物营养与饲料科学观测实验站,长沙410125;2.中国科学院大学,北京100049;3.湖南农业大学动物科学技术学院,长沙410128)
α-酮戊二酸和大蒜素对生长猪生长发育及养分表观消化率的影响
刘少娟1,2陈家顺1,3康保聚3蒋 谦1,2何流琴1,2吴 飞1,2黄 牛3李 欢3印遇龙1,2*姚 康1,3*
(1.中国科学院亚热带农业生态研究所,中国科学院亚热带农业生态过程重点实验室,湖南省畜禽健康养殖工程技术中心,农业部中南动物营养与饲料科学观测实验站,长沙410125;2.中国科学院大学,北京100049;3.湖南农业大学动物科学技术学院,长沙410128)
本试验旨在研究α-酮戊二酸(AKG)和大蒜素对生长猪生长性能、养分表观消化率、血清生化指标以及肠道形态结构的影响。选用40头初始平均体重为(30.64±1.35) kg的健康三元(杜×长×大)杂交生长猪,按体重相近、性别比例相同原则随机分为5组,每组8个重复,每个重复1头猪。5组试验猪分别饲喂无抗基础饲粮(对照组)、无抗基础饲粮+25 mg/kg抗生素(Ⅰ组)、无抗基础饲粮+1%AKG(Ⅱ组)、无抗基础饲粮+0.5%大蒜素(Ⅲ组)、无抗基础饲粮+1%AKG+0.5%大蒜素(Ⅳ组)。预试期7 d,正试期21 d。结果表明:1)与对照组相比,Ⅰ组和Ⅳ组生长猪的平均日增重分别提高了10.80%和9.91%,但差异不显著(P>0.05)。2)与对照组相比,Ⅱ组钙的表观消化率显著提高(P<0.05),Ⅳ组粗蛋白质、钙和磷的表观消化率显著提高(P<0.05),且Ⅳ组较Ⅰ组显著提高了磷的表观消化率(P<0.05)。3)与对照组相比,Ⅱ组血清免疫球蛋白G(IgG)含量显著提高(P<0.05);Ⅲ组血清甘油三酯(TG)含量显著降低(P<0.05);Ⅳ组血清总胆固醇(TCHO)和TG含量显著降低(P<0.05),血清碱性磷酸酶(AKP)、谷草转氨酶(AST)和谷丙转氨酶(ALT)活性及血清免疫球蛋白A(IgA)、IgG含量显著提高(P<0.05)。与Ⅰ组相比,Ⅳ组血清TCHO和TG含量有降低趋势(P>0.05),血清AST和ALT活性显著提高(P<0.05)。4)与对照组相比,Ⅳ组回肠绒毛高度及空肠和回肠的绒毛高度/隐窝深度值显著提高(P<0.05)。5)与对照组相比,Ⅳ组回肠中杯状细胞和淋巴细胞数目显著增加(P<0.05)。综上,无抗饲粮中联合添加1%AKG和0.5%大蒜素可通过改善肠道形态结构,提高对粗蛋白质、钙和磷等养分的消化吸收能力,促进肠道健康,进而改善生长猪的生长性能。
α-酮戊二酸;生长猪;大蒜素;生长性能;养分表观消化率;血清生化指标;肠道形态结构
抗生素作为饲料添加剂已被广泛应用于畜禽养殖生产中,然而,随着抗生素滥用产生的细菌抗药性、药物残留和环境污染等问题,尤其是近几年来食品安全事件频发,引起了国内外政府和广大消费者对抗生素的高度关注。寻找抗生素的替代品将成为解决抗生素滥用问题的一条有效途径。大蒜素(allicin)是从百合科葱属植物大蒜的鳞茎中提取的生物活性物质,有研究表明其可作为抗生素的替代物应用于动物生产中,具有抗菌消炎、抗癌、抗肿瘤、降血脂、提高机体免疫力等[1-4]多种生物学功能。α-酮戊二酸(α-ketoglutarate,AKG)是三羧酸循环中重要的中间物质,也是谷氨酰胺和谷氨酸的前体物质,其良好的稳定性及其改善动物生长性能、促进肠道发育、调节能量代谢、提高免疫力和抗氧化等[5-7]特性引起了研究者的广泛关注。王金泉等[8]在断奶仔猪饲粮中添加中草药和AKG,结果发现中草药结合AKG可改善断奶仔猪的生长性能和消化吸收功能。AKG和大蒜素因其特殊生物学活性和营养作用,可能对动物的生长性能、免疫功能、肠道发育等方面具有一定的促进作用[9-12]。但目前关于饲粮单一添加AKG和大蒜素或其联合使用对生长猪生长性能、血清生化指标及肠道发育等方面的研究较少。因此,本试验旨在研究无抗饲粮中添加AKG和大蒜素对生长猪生长发育及养分表观消化率的影响,以期为AKG和大蒜素在生长猪无抗饲料中的科学应用提供理论依据。
1 材料与方法
1.1试验材料
AKG购自武汉远成共创科技有限公司,有效成分含量为99.5%;大蒜素购自河南开封牧博生物科技有限公司,有效成分含量≥25%;抗生素为金霉素,市售产品,饲粮中按25 mg/kg添加。
1.2试验饲粮
试验饲粮选用普通玉米作为主要能量来源、豆粕作为主要蛋白质来源,参考NRC(2012)30~60 kg猪营养需要配制,基础饲粮组成及营养水平见表1。各种饲粮原料粉碎后逐级混匀,制成粉状料,储存于通风干燥处备用。
1.3试验动物和设计
试验选用40头初始平均体重为(30.64±1.35) kg的健康三元(杜×长×大)杂交生长猪,按体重相近、性别比例相同原则随机分为5组,每组8个重复,每个重复1头。5组试验猪分别饲喂无抗基础饲粮(对照组)、无抗基础饲粮+25 mg/kg抗生素(Ⅰ组)、无抗基础饲粮+1%AKG(Ⅱ组)、无抗基础饲粮+0.5%大蒜素(Ⅲ组)、无抗基础饲粮+1%AKG+0.5%大蒜素(Ⅳ组)。预试期7 d,正试期21 d。
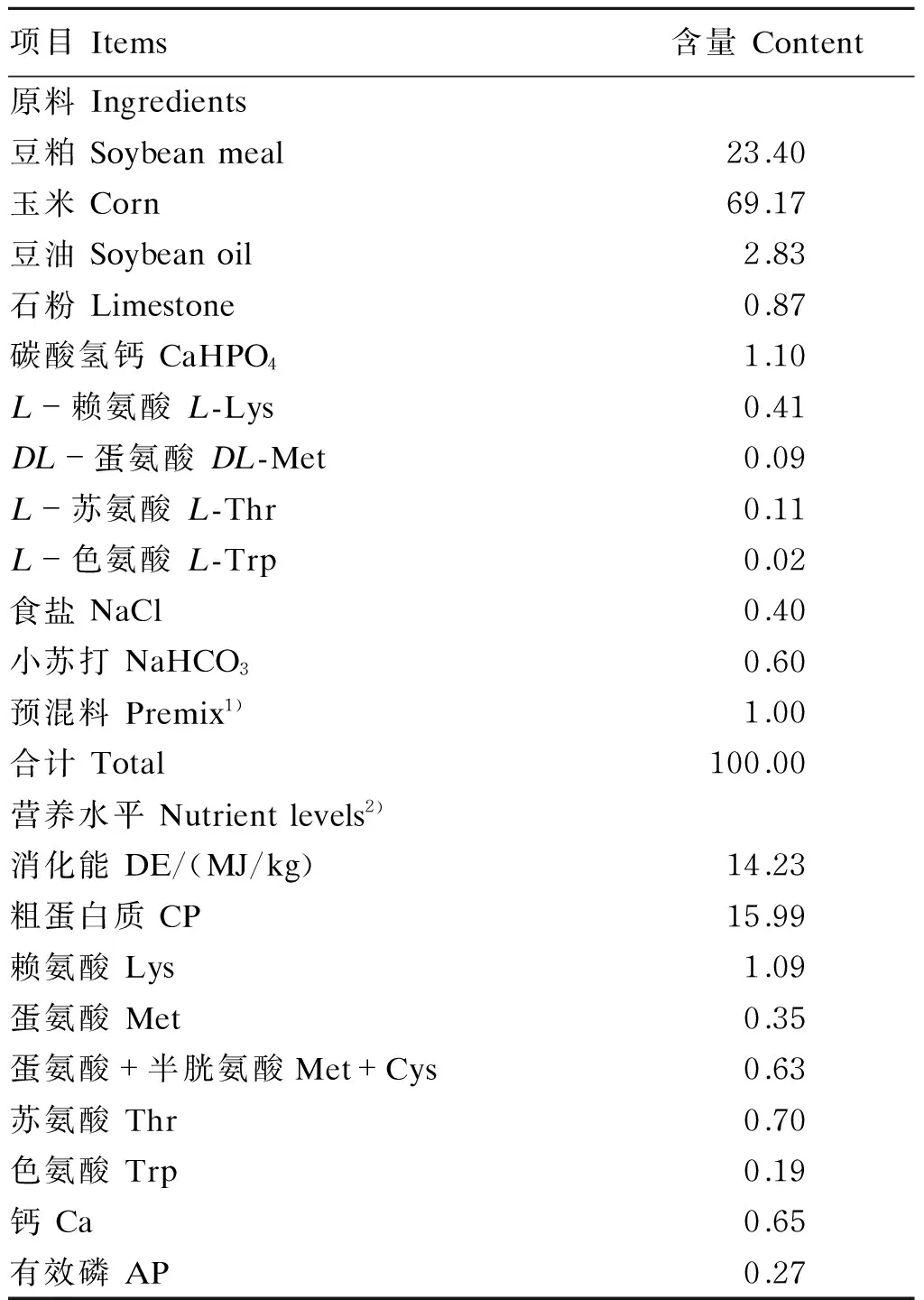
表1 基础饲粮组成及营养水平(风干基础)
1)预混料为每千克饲粮提供The premix provided the following per kg of diet:VA 4 000 IU,VD3400 IU,VE 50 IU,VK 1 mg,VB11.5 mg,VB24 mg,VB62 mg,VB120.02 mg,VC 300 mg,烟酸 nicotinic acid 23 mg,D-泛酸D-pantothenic acid 15 mg,生物素 biotin 0.08 mg,叶酸 folic acid 1.3 mg,氯化胆碱 choline chloride (50%) 600 mg,耐高温植酸酶 high temperature resistant phytase 150 mg,抗氧化剂 antioxidant 800 mg,防霉剂 mildew preventive 500 mg,沸石粉 zeolite powder 7 442 mg,Cu 15 mg,Mn 30 mg,Fe 100 mg,Zn 50 mg,I 0.3 mg,Se 0.3 mg。
2)消化能为计算值,其余为实测值。DE was a calculated value, while the others were measured values.
1.4饲养管理
本试验在中国科学院亚热带农业生态研究所动物实验楼内进行,生长猪采用单笼饲养,每天08:30和16:30进行喂料,自由采食和饮水。试验期间每天早上记录给料量和剩料量,以便准确记录每头猪的实际采食量,掌握猪群的采食及健康情况,定期进行猪舍内清扫和消毒,保持猪舍干净卫生。
1.5测定指标及方法
1.5.1 生长性能
试验的第1天和最后1天早上08:00分别对猪只进行空腹称重,记为初重和末重,据此来计算平均日增重(ADG)。每天记录猪只实际采食量,试验结束后结算总耗料量,计算平均日采食量(ADFI)和料重比(F/G)。各指标计算公式如下:
ADFI=总耗料量/(试验天数×试验猪数);ADG=(试验末平均体重-试验初平均体重)/(试验天数×试验猪数);F/G=ADFI/ADG。
1.5.2 养分表观消化率
试验结束前,连续5 d以不完全收粪法采集生长猪的新鲜粪便,称重并按每15 g鲜粪加10%稀硫酸10 mL混合均匀后置于-80 ℃冰箱贮存备用。测定前先将粪样在105 ℃烘箱烘至恒重,粉碎成粉末状。按4 mol/L盐酸不溶灰分法测定粪样和饲粮中粗蛋白质、粗灰分、能量、钙和磷含量。按照国家标准方法测定粗蛋白质(GB/T 6432—1994)、粗灰分(GB/T 6438—2007)、钙(GB/T 6436—2002)和总磷(GB/T 6437—2002)等常规营养成分含量,能量则采用GR-3500型氧弹式热量计进行测量。养分表观消化率计算公式如下:
养分表观消化率(%)=100×[1-(A/B)×(C/D)]。
式中:A为粪中某养分含量;B为饲粮中该养分含量;C为饲粮中酸不溶灰分含量;D为粪中酸不溶灰分含量。
1.5.3 血清生化指标
于试验的最后1天08:00对每头猪进行空腹前腔静脉无菌采血10 mL,3 000 r/min离心10 min分离制备血清,-80 ℃保存待测。血清中甘油三酯(TG)、高密度脂蛋白(HDL)、低密度脂蛋白(LDL)、总胆固醇(TCHO)、尿素氮(UN)、总蛋白(TP)、白蛋白(ALB)、免疫球蛋白(Ig)A、IgM和IgG含量及碱性磷酸酶(AKP)、谷草转氨酶(AST)、谷丙转氨酶(ALT)活性的检测采用南京建成生物工程研究所试剂盒测定,具体操作步骤见说明书。
1.5.4 肠道形态结构
试验结束后,空腹屠宰试验猪,迅速打开腹腔之后取出肠道,分离出空肠、回肠的肠道中段,磷酸盐缓冲液冲洗掉附着的内容物之后,浸入4%多聚甲醛固定24 h后,石蜡包埋并进行切片。通过苏木精-伊红(HE)及过碘酸希夫(PAS)染色后,光镜下观察小肠的黏膜结构及上皮内淋巴细胞和杯状细胞的形态及分布。每段小肠取5张切片,每张切片选2~5个视野,应用Moditec照相处理软件拍照,取每根肠管横切面,每张照片测量5根小肠绒毛高度(以肠腺绒毛连接处到绒毛顶端为准)、最深隐窝深度(以肠腺绒毛连接处到肠腺基部为准),并统计观察5根最长且排列整齐的绒毛每100个肠黏膜上皮柱状细胞间淋巴细胞、杯状细胞数量。
1.6数据处理与统计分析
试验结果用平均值±标准误表示,采用SPSS 20.0进行单因素方差分析,模型显著时采用Duncan氏多重比较检验。P<0.05作为差异显著的判断标准,P<0.01作为差异极显著的判断标准,0.05≤P<0.10作为具有差异显著趋势的判断标准。
2 结果与分析
2.1饲粮添加AKG和大蒜素对生长猪生长性能的影响
由表2可见,与对照组相比,Ⅰ组和Ⅳ组的ADG均有提高趋势,分别提高了10.80%(P=0.059)和9.91%(P=0.067);各试验组的F/G都有所降低,但无显著性差异(P>0.05)。各组的ADG、ADFI和F/G之间均无显著性差异(P>0.05)。
2.2饲粮添加AKG和大蒜素对生长猪养分表观消化率的影响
由表3可见,与对照组相比,Ⅳ组粗蛋白质、钙和磷的表观消化率分别显著提高了5.45%、5.20%和4.26%(P<0.05),粗灰分的表观消化率有提高的趋势(P=0.065);Ⅱ组钙的表观消化率显著提高了4.24%(P<0.05),粗蛋白质的表观消化率有提高的趋势(P=0.052),磷的表观消化率提高了3.43%(P>0.05)。与Ⅰ组相比,Ⅳ组磷的表观消化率显著提高(P<0.05)。其他各组间各养分表观消化率没有显著性差异(P>0.05)。
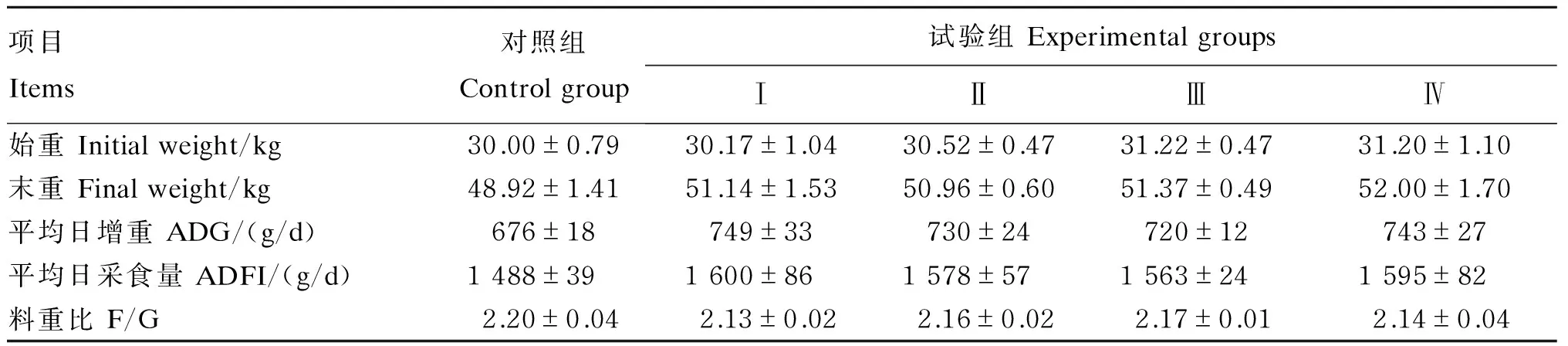
表2 饲粮添加AKG和大蒜素对生长猪生长性能的影响
同行数据肩注不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同小写字母或无字母表示差异不显著(P>0.05)。下表同。
In the same row, values with different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean extremely significant difference (P<0.01), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.

表3 饲粮添加AKG和大蒜素对生长猪养分表观消化率的影响
2.3饲粮添加AKG和大蒜素对生长猪血清生化指标的影响
由表4可见,与对照组相比,Ⅳ组血清TG和TCHO含量显著降低(P<0.05),AKP、ALT、AST活性及IgA、IgG含量显著提高(P<0.05),ALB含量有提高的趋势(P=0.060);Ⅱ组血清IgG含量显著提高(P<0.05);Ⅲ组血清TG含量显著降低(P<0.05),TCHO含量有降低的趋势(P=0.066)。与Ⅰ组相比,Ⅳ组血清TCHO(P=0.068)和TG(P=0.063)含量有降低的趋势,AST和ALT活性显著提高(P<0.05),IgG含量有提高的趋势(P=0.057)。各组间其他血清生化指标均无显著性差异(P>0.05)。
2.4饲粮添加AKG和大蒜素对生长猪肠道形态结构的影响
由表5可见,与对照组相比,Ⅳ组空肠和回肠的绒毛高度/隐窝深度(V/C)值显著提高(P<0.05),回肠绒毛高度显著提高(P<0.05),回肠隐窝深度有降低趋势(P=0.052),空肠绒毛高度有提高趋势(P=0.059)。Ⅳ组空肠(P=0.058)和回肠(P=0.052)V/C值较Ⅰ组有提高的趋势,其他组间无显著性差异(P>0.05)。
2.5饲粮添加AKG和大蒜素对生长猪肠道杯状细胞和淋巴细胞数目的影响
由表6可见,与对照组相比,Ⅳ组回肠杯状细胞和淋巴细胞数目显著增加(P<0.05),空肠淋巴细胞数目有增加趋势(P=0.056);Ⅱ组回肠淋巴细胞数目有增加趋势(P=0.057)。与Ⅰ组相比,Ⅳ组回肠淋巴细胞数目有增加趋势(P=0.066),其他各试验组间均无显著性差异(P>0.05)。
3 讨 论
3.1AKG和大蒜素对生长猪生长性能的影响
众所周知,抗生素是由微生物(包括细菌、真菌、放线菌属)或高等动植物在生活过程中所产生的具有抗病原体或其他活性的一类次级代谢产物,能干扰其他生活细胞发育功能的化学物质,近年来被广泛应用于畜禽养殖和临床医学中,其最主要的作用是提高动物机体免疫力进而促进动物生长发育。本试验中,与对照组相比,抗生素组生长猪ADG提高了10.80%,料重比降低了3.18%,说明抗生素对生长猪的生长具有一定促进作用。AKG是谷氨酰胺的前体物质,具有良好的稳定性,其在改善动物生长性能方面发挥着非常重要的作用。胡泉舟[10]在25日龄断奶仔猪饲粮中添加AKG可提高其生长性能,其中添加1%AKG可提高ADG达9%,效果最佳。余亲平等[13]在肉鸡饲粮中添加AKG,结果表明添加0.7%AKG可显著提高肉鸡2周龄时体重及1~2周龄的ADG。许多研究报道从中草药中提取的大蒜素对动物生长发育有促进作用。刘超良[11]研究表明在饲粮中添加大蒜素可提高断奶仔猪ADG达14.4%,降低料重比达16.8%,说明大蒜素有提高断奶仔猪生长性能的作用。涂兴强[14]研究表明,饲粮中添加大蒜素能够显著提高65~110 kg阶段育肥猪ADG,降低F/G,且以150和300 mg/kg为宜。以上结果从本研究中进一步得到证实,笔者发现无抗饲粮中添加1%AKG联合0.5%大蒜素较对照组ADG有提高的趋势,且与抗生素组无显著差异。究其原因可能是:1)AKG作为谷氨酰胺前体物质,和谷氨酰胺一样可为肠上皮细胞和免疫细胞供能和补充氮源,同时降低肠道谷氨酰胺的分解,为胃肠道细胞代谢提供能量,保障肠道屏障功能的完整性和正常的吸收功能[15-16];2)大蒜素中的二烯丙基三硫醚能抑制胃液中亚硝酸盐还原菌的生长,对胃肠道有保护作用,进而促进生长猪的生长[17]。
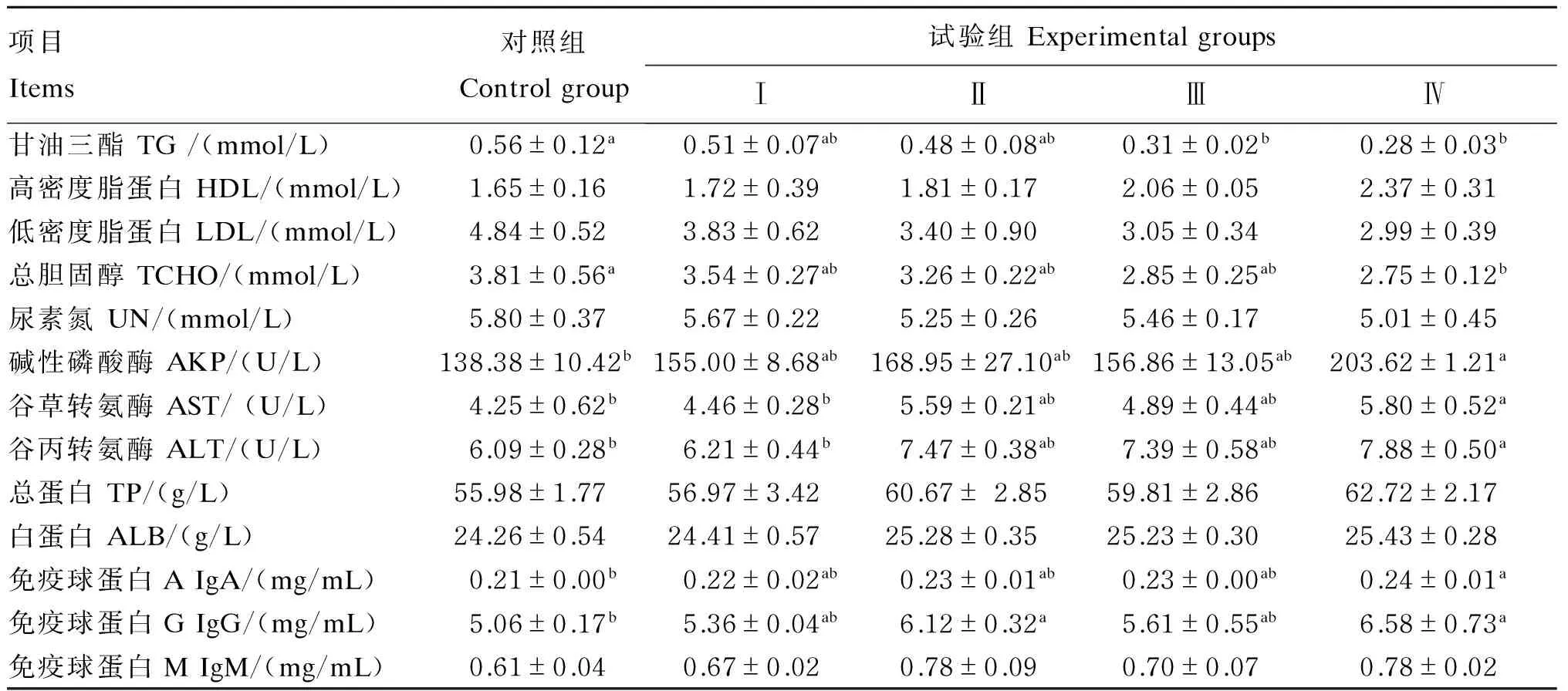
表4 饲粮添加AKG和大蒜素对生长猪血清生化指标的影响
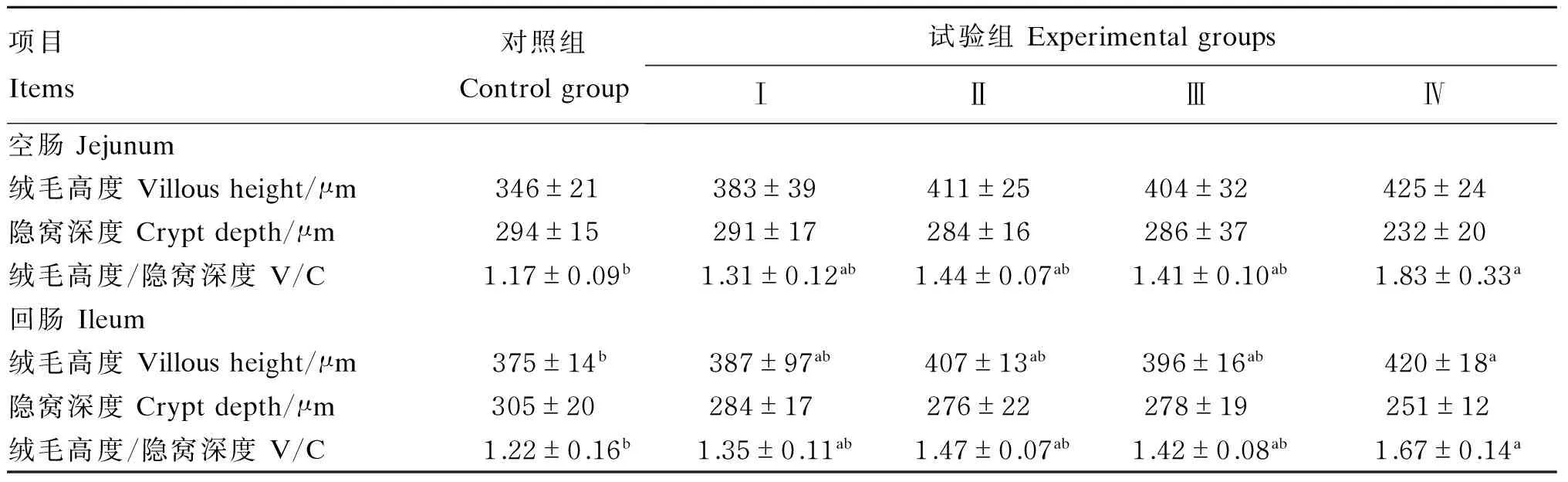
表5 饲粮添加AKG和大蒜素对生长猪肠道形态结构的影响
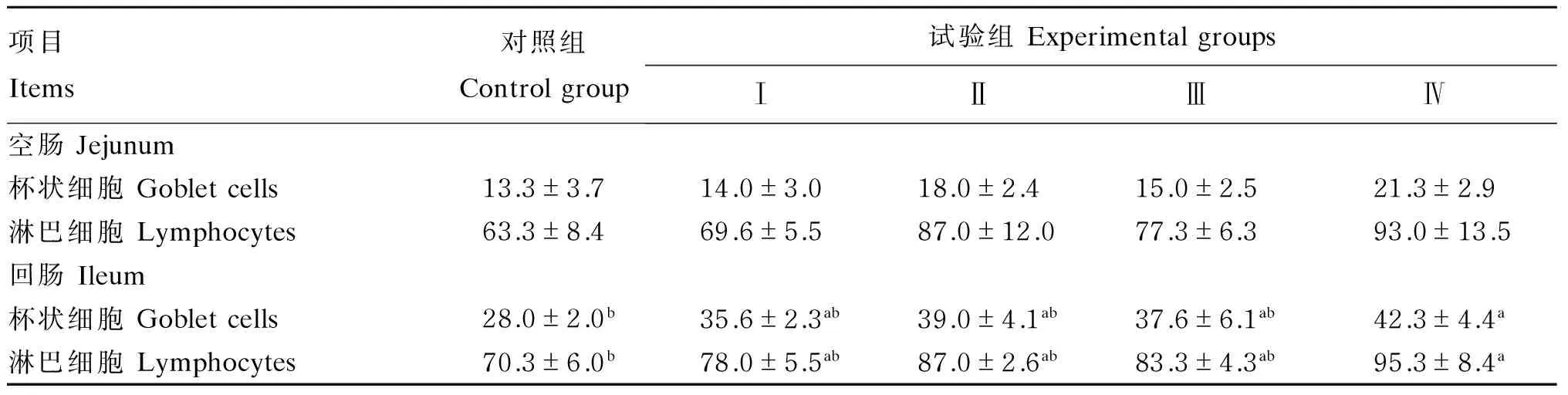
表6 饲粮添加AKG和大蒜素对生长猪肠道杯状细胞和淋巴细胞数目的影响
3.2AKG和大蒜素对生长猪养分表观消化率的影响
养分表观消化率是衡量动物对饲料消化吸收能力的重要指标,动物的消化吸收能力越强,越有利于动物的生长。付晓辉等[18]在断奶仔猪饲粮中添加中草药和AKG能提高断奶仔猪的消化吸收功能。刘超良[11]研究发现,大蒜素能提高断奶仔猪对钙、磷等营养物质表观消化率。本试验中,与对照组相比,饲粮中添加1%AKG和0.5%大蒜素能显著提高粗蛋白质、钙和磷的表观消化率,这与上述研究结果相一致。一方面可能是因为AKG与大蒜素间具有相互协同作用,能更好地促进生长猪的消化吸收能力;另一方面可能是由于AKG可以促进肠道黏膜生长,从而增加营养物质与肠道的接触面积,进而增加了肠道吸收面积,促进营养物质的消化吸收[8]。另外,大蒜素独特的气味能改善饲粮的适口性,促进动物采食、增强胃液分泌、胃肠蠕动,从而促进营养物质的消化吸收[19]。
3.3AKG和大蒜素对生长猪血清生化指标的影响
动物的血清生化指标是反映机体新陈代谢状况的一项重要指标,在一定程度上可以根据相关指标的变化来推断出某一组织或器官的功能状况。血清ALT和AST是体内参与转氨基作用的重要酶,常分布于肝细胞和其他组织内,其活性可反映蛋白质和脂类代谢效率以及肝脏和心脏器官功能状况,在排除肝脏组织受损情况下,血清ALT和AST的活性增强可反映蛋白质合成和分解代谢的增强[20]。AKP是具有遗传标记的同工酶,其活性的高低除了能反映动物的生长速度和生长性能外,还能反映骨组织生长、钙磷代谢、脂肪代谢状况,当AKP活性升高时,骨质生长旺盛、钙磷沉积增加[21]。位莹莹等[22]研究表明在松浦镜鲤饲料中添加AKG可显著提高血清ALT和AST活性,促进松浦镜鲤肝脏氨基酸代谢,提高蛋白质利用率,促进蛋白质合成;魏玉强等[23]研究也证实了AKG可提高鱼体蛋白质代谢水平。本试验中,与对照组相比,1%AKG+0.5%大蒜素能显著提高血清AKP、ALT和AST活性,1%AKG有提高血清AST和ALT活性的趋势;而与抗生素相比,1%AKG+0.5%大蒜素显著提高血清AST和ALT活性,1%AKG有提高血清AST活性的趋势,这表明无抗饲粮中添加1%AKG和0.5%大蒜素能提高机体内蛋白质合成和脂肪代谢效率。这可能与AKG可促进机体蛋白质合成和抑制蛋白质降解等功能有关[24]。
血清TCHO和TG的含量能反映肝功能状况,与动物体内脂肪沉积有关,当TCHO和TG含量降低,表明机体脂肪代谢增强,有抗脂肪肝的作用[25]。本研究中,无抗饲粮中添加1%AKG+0.5%大蒜素可显著降低血清TCHO和TG含量,而单一地添加0.5%大蒜素只能显著降低血清TG含量,对血清TCHO含量有降低趋势。这表明AKG和大蒜素都有增强机体脂肪代谢、减少脂肪沉积的作用[24,26-27],且二者联合添加的效果比添加抗生素或单独添加AKG和大蒜素的效果好。
血清TP含量反映了机体对蛋白质的吸收情况和体液免疫的关系,主要包括ALB和球蛋白,可间接反映机体的抗病能力,当血清中IgA、IgG和IgM含量升高,表明机体免疫功能增强[28]。本试验中,无抗饲粮中添加1%AKG+0.5%大蒜素显著提高血清IgA和IgG的含量,有提高血清ALB含量的趋势,而单独添加1%AKG则显著提高血清IgG含量。这表明AKG和大蒜素可增强机体免疫能力及肝脏蛋白质合成能力[9,12]。
3.4AKG和大蒜素对生长猪肠道形态结构的影响
小肠是动物机体营养物质消化、吸收和转运的主要部位,而肠道黏膜结构的完整是机体养分消化吸收和动物正常生长的生理基础。肠道绒毛高度与隐窝深度反映了肠道的功能状况,绒毛高度反映了肠道吸收能力,当绒毛高度降低时,养分吸收能力下降,而隐窝深度反映了肠道黏膜细胞的更新速度,当隐窝深度变浅,表明细胞更新速度提高,分泌功能增强[29]。胡泉舟[10]研究表明,在饲粮中添加1%AKG可显著降低仔猪小肠隐窝深度、提高V/C值,可在一定程度上改善仔猪的小肠组织学形态,提高小肠吸收功能。陈迪等[30]研究发现,AKG显著提高杂交鲟后肠绒毛高度,可在一定程度上促进肠道发育。本试验中,无抗饲粮中添加1%AKG+0.5%大蒜素可显著提高空肠和回肠V/C值及回肠绒毛高度。同时,1%AKG+0.5%大蒜素组空肠和回肠V/C值较抗生素组高。这可能是因为AKG是三羧循环的中间体,在三羧循环的过程中可转化为谷氨酸和谷氨酰胺,为胃肠道细胞供能以及补充氮源,从而促进胃肠道细胞增殖和肠道黏膜修复,维持胃肠道健康,促进肠道发育[31]。
3.5AKG和大蒜素对生长猪肠道杯状细胞和淋巴细胞数目的影响
肠道淋巴细胞和杯状细胞等免疫细胞是肠道屏障发挥作用的主要组成部分,在保护肠道免受有害微生物的黏附和入侵中起到第一道防线的作用[32]。杯状细胞是肠道上皮中的黏液分泌细胞,具有分泌黏液的功能,对维持肠道黏膜的完整和稳定具有重要作用,并参与感染、炎症性肠病、坏死性肠炎等多种肠道疾病的发生发展[33]。小肠黏膜上皮内淋巴细胞是肠道相关淋巴组织中的一个特殊组分,是机体免疫系统中和外来抗原以及微生物最先接触的免疫细胞,同时也是最先发生免疫反应的细胞,其数量可反映小肠局部黏膜免疫屏障的完整及免疫防御功能的完善程度[34]。有研究表明,AKG和谷氨酰胺一样可通过雷帕霉素靶蛋白(mTOR)信号通路调控黏膜蛋白质的合成,为胃肠道上皮细胞和免疫细胞供能,促进胃肠道细胞增殖,保障肠道吸收及结构功能的完整性[16]。另外,张玉仙等[35]在小鼠饲粮中添加不同浓度的大蒜素溶液,发现添加1%大蒜素溶液可显著增加小鼠肠道杯状细胞数量,使杯状细胞分泌黏液的能力增强,进而使得小肠黏膜免疫屏障的作用发挥得更好。本试验结果发现无抗饲粮中添加1%AKG+0.5%大蒜素能显著增加回肠中杯状细胞和淋巴细胞数目,同时单独添加1%AKG同样也有增加回肠淋巴细胞数目的趋势。另外,回肠中,无抗饲粮中添加1%AKG+0.5%大蒜素较抗生素具有较高的淋巴细胞数,其结果与上面所述报道结果相符,这说明1%AKG和0.5%大蒜素联合添加可起到增强两者效果的作用。
4 结 论
无抗饲粮中联合添加1%AKG和0.5%大蒜素可通过改善肠道形态结构,促进肠道对粗蛋白质、钙和磷等养分的消化吸收,增强机体免疫抗病能力,促进肠道健康,进而改善生长猪生长性能。
[1] ARDITTI F D,RABINKOV A,MIRON T,et al.Apoptotic killing of B-chronic lymphocytic leukemia tumor cells by allicin generatedinsituusing a rituximab-alliinase conjugate[J].Molecular Cancer Therapeutics,2005,4(2):325-331.
[2] CUTLER R R,WILSON P.Antibacterial activity of a new,stable,aqueous extract of allicin against methicillin-resistantStaphylococcusaureus[J].British Journal of Biomedical Science,2004,61(2):71-74.
[3] GARDNER C D,CHATTERJEE L M,CARLSON J J.The effect of a garlic preparation on plasma lipid levels in moderately hypercholesterolemic adults[J].Atherosclerosis,2001,154(1):213-220.
[4] VIMAL V,DEVAKI T.Hepatoprotective effect of allicin on tissue defense system in galactosamine/endotoxin challenged rats[J].Journal of Ethnopharmacology,2004,90(1):151-154.
[5] 付大波,王友炜,侯永清,等.α-酮戊二酸对脂多糖刺激断奶仔猪肌肉能量代谢的影响[J].中国农业科学,2011,44(4):814-822.
[6] 刘坚,侯永清,丁斌鹰,等.α-酮戊二酸对脂多糖应激仔猪肠黏膜能量代谢的影响[J].动物营养学报,2009,21(6):892-896.
[7] 刘坚,侯永清,丁斌鹰,等.α-酮戊二酸对脂多糖应激断奶仔猪空肠黏膜蛋白合成和抗氧化能力的影响[J].中国畜牧杂志,2010,46(11):35-38.
[8] 王金泉,项方献,姚刚.中草药结合AKG对断奶仔猪生长及消化吸收功能的影响[J].西北农林科技大学学报:自然科学版,2011,39(5):27-31.
[9] 王友炜.α-酮戊二酸对脂多糖刺激仔猪生长性能、肠道功能和血浆指标的影响[D].硕士学位论文.武汉:武汉工业学院,2010.
[10] 胡泉舟.α-酮戊二酸对断奶仔猪生长性能和肠道功能的影响[D].硕士学位论文.武汉:武汉工业学院,2008.
[11] 刘超良.日粮中添加大蒜素对断奶仔猪生长的影响[D].硕士学位论文.长沙:湖南农业大学,2008.
[12] 张金枝,刘建新,华卫东,等.大蒜和大蒜素对仔猪生产性能和血液生化指标的影响研究[J].家畜生态学报,2008,29(4):56-60.
[13] 余亲平,陈雁群,谢金蝉,等.日粮添加α-酮戊二酸对肉仔鸡生长性能及组织器官发育的影响[J].中国畜牧兽医,2010,37(10):10-14.
[14] 涂兴强.糖萜素、大蒜素在生长育肥猪中的应用研究[D].硕士学位论文.南宁:广西大学,2013.
[15] CHEN L X,LI P, WANG J J,et al.Catabolism of nutritionally essential amino acids in developing porcine enterocytes[J].Amino Acids,2009,37(1):143-152.
[16] JONES C,PALMER T E A,GRIFFITHS R.Randomized clinical outcome study of critically ill patients given glutamine-supplemented enteral nutrition[J].Nutrition,1999,15(2):108-115.
[17] 程志斌,葛长荣,苏子峰.大蒜素的研究与应用[J].饲料博览,2001(12):38-40.
[18] 付晓辉,项方献,罗金生,等.中草药结合α-酮戊二酸作为饲料添加剂对断奶仔猪消化吸收功能的影响[J].黑龙江畜牧兽医,2011(7):71-72.
[19] 占今舜,张彬,赵越.大蒜素在动物生产中的应用[J].中国饲料,2012(18):38-41.
[20] 尹清强,李小飞,常娟,等.微生态制剂对哺乳和断奶仔猪生产性能的影响及作用机理研究[J].动物营养学报,2011,23(4):622-630.
[21] 唐晓玲,刘振湘,张石蕊,等.糖萜素对早期断奶仔猪血液生化指标及免疫机能的影响研究[J].湖南环境生物职业技术学院学报,2005,11(3):239-243.
[22] 位莹莹,徐奇友,李晋南,等.不同蛋白质水平饲料中添加α-酮戊二酸对松浦镜鲤生长性能、体成分和血清生化指标的影响[J].动物营养学报,2013,25(12):2958-2965.
[23] 魏玉强,徐奇友,位莹莹,等.不同蛋白源饲料中添加α-酮戊二酸对松浦镜鲤肌肉成分、血清氨基酸和生化指标的影响[J].东北农业大学学报,2015,46(1):94-100.
[24] YAO K,YIN Y L,LI X L,et al.Alpha-ketoglutarate inhibits glutamine degradation and enhances protein synthesis in intestinal porcine epithelial cells[J].Amino Acids,2012,42(6):2491-2500.
[25] 刁慧,郑萍,余冰,等.苯甲酸对断奶仔猪生长性能、血清生化指标、养分消化率和空肠食糜消化酶活性的影响[J].动物营养学报,2013,25(4):768-777.
[26] 张庭廷,童希琼,刘锡云.大蒜素降血脂作用及其机理研究[J].中国实验方剂学杂志,2007,13(2):32-35.
[27] RADZKI R P,BIENKO M,PIERZYNOWSKI S G.Effect of dietary alpha-ketoglutarate on blood lipid profile during hypercholesterolaemia in rats[J].Scandinavian Journal of Clinical & Laboratory Investigation,2009,69(2):175-180.
[28] 胡新旭,周映华,刘惠知,等.无抗发酵饲料对断奶仔猪生长性能、肠道菌群、血液生化指标和免疫性能的影响[J].动物营养学报,2013,25(12):2989-2997.
[29] 姚浪群,萨仁娜,佟建明,等.安普霉素对仔猪肠道微生物及肠壁组织结构的影响[J].畜牧兽医学报,2003,34(3):250-257.
[30] 陈迪,王连生,徐奇友.α-酮戊二酸对杂交鲟肠道形态、消化酶活力和抗氧化能力的影响[J].大连海洋大学学报,2015,35(4):363-368.
[31] 王蕾,吴信,付大波.α-酮戊二酸对动物肠道黏膜作用的研究进展[J].黑龙江畜牧兽医,2010(11):36-37.
[32] 石玉祥,闫金坤,王雪敏,等.中药提取物对应激小鼠肠道上皮内淋巴细胞和杯状细胞数量及IL-2水平的影响[J].中国兽医科学,2011,41(1):85-88.
[33] 董文逍,曹海龙,王邦茂.杯状细胞在肠道疾病发病中作用的研究进展[J].国际消化病杂志,2015,35(4):244-246,269.
[34] XU R J,WANG F,ZHANG S H.Postnatal adaptation of the gastrointestinal tract in neonatal pigs:a possible role of milk-borne growth factors[J].Livestock Production Science,2000,66(2):95-107.
[35] 张玉仙,王文利,陈耀星,等.大蒜溶液对小鼠小肠黏膜结构、上皮内淋巴细胞和杯状细胞的影响[J].北京农业职业学院学报,2008,22(1):33-37.
*Corresponding authors: YIN Yulong, academician, E-mail: yinyulong@isa.ac.cn; YAO Kang, professor, E-mail: yaokang@isa.ac.cn
(责任编辑 田艳明)
Effects of Dietary α-Ketoglutarate and Allicin on Growing Development and Nutrient Apparent Digestibility of Growing PigsLIU Shaojuan1,2CHEN Jiashun1,3KANG Baoju3JIANG Qian1,2HE Liuqin1,2WU Fei1,2HUANG Niu3LI Huan3YIN Yulong1,2*YAO Kang1,3*
(1. Key Lab Agro-Ecology Processing Subtropical Region, Institute of Subtropical Agriculture, Chinese Academy of Sciences, Hunan Engineering & Research Center of Healthy Breeding Livestock & Poultry, Scientific Observational and Experimental Station of Animal Nutrition and Feed Science in South-Central, Ministry of Agriculture, Changsha 410125, China; 2. University of Chinese Academy of Sciences, Beijing 100049, China; 3. College of Animal Science and Technology, Hunan Agricultural University, Changsha 410128, China)
This experiment was conducted to study the effects of dietary α-ketoglutarate (AKG) and allicin on growth performance, nutrient apparent digestibility, serum biochemical parameters and intestinal morphologic structure of growing pigs. Forty healthy crossbred (Duroc×Landrace×Large White) growing pigs with (30.64±1.35) kg were randomly divided into 5 groups with 8 replicates per group and 1 pig per replicate by similar body weight and gender ratio. Pigs in control group were fed a basal diet (without antibiotics), while pigs in the experimental groups were fed the basal diet supplemented with either 25 mg/kg antibiotics (group Ⅰ), or 1.0 % AKG (group Ⅱ), or 0.5 % allicin (group Ⅲ), or 1.0 % AKG combined with 0.5 % allicin (group Ⅳ). The experiment lasted for 21 days after 7 days for pre-feeding. The results showed as follows: 1) compared with control group, the average daily gain of pigs in groups Ⅰ and Ⅳ was respectively improved by 10.80% and 9.91% without significant difference (P>0.05). 2) Compared with control group, the calcium (Ca) apparent digestibility in group Ⅱ was significantly improved (P<0.05), the apparent digestibility of crude protein (CP), Ca and phosphorus (P) in group Ⅳ was significantly increased (P<0.05). Compared with group Ⅰ, the P apparent digestibility in group Ⅳ was significantly increased (P<0.05). 3) Compared with control group, pigs in group Ⅱ had significantly improved serum immunoglobulin G (IgG) content (P<0.05), and the serum triglyceride content in group Ⅲ was significantly decreased (P<0.05); pigs in group Ⅳ had significantly lower serum contents of total cholesterol (TCHO) and TG (P<0.05), but had significantly higher serum activities of alkaline phosphatase (AKP), glutamic-oxalacetic transaminase (AST) and alanine aminotransferase (ALT) (P<0.05), and significantly higher serum contents of immunoglobulin A (IgA) and IgG (P<0.05). Compared with group Ⅰ, the serum contents of TCHO and TG in group Ⅳ were tend to be decreased (P>0.05), while the serum activities of AST and ALT in group Ⅳ were significantly increased (P<0.05). 4) Compared with control group, the villous height of ileum and the ratio of the villous height to crypt depth of ileum and jejunum in group Ⅳ were significantly improved (P<0.05). 5) Compared with control group, the amounts of goblet cells and lymphocytes in the ileum of group Ⅳ were increased significantly (P<0.05). The results suggest that dietary supplementation with 1.0 % AKG and 0.5% allicin can ameliorate intestinal morphologic structure, increase the ability of nutrient digestibility and absorption such as CP, Ca and P, and promote intestinal health, thus improve growth performance of growing pigs.[ChineseJournalofAnimalNutrition,2017,29(9):3193-3201]
α-ketoglutarate; growing pigs; allicin; growth performance; nutrient apparent digestibility; serum biochemical parameters; intestinal morphologic structure
10.3969/j.issn.1006-267x.2017.09.022
2017-02-16
中科院百人计划项目(Y451022111);国家自然科学基金面上项目(31472107);湖南省“湖湘青年科技创新人才”项目(2015RS4053);湖南省“湖南省杰出青年基金”项目(2016JJ1015);中国科学院亚热带农业生态过程重点实验室开放基金项目(ISA2016101)
刘少娟(1991—),女,湖南邵阳人,硕士研究生,从事单胃动物营养与饲料研究。E-mail: 2431866181@qq.com
*通信作者:印遇龙,院士,博士生导师,E-mail: yinyulong@isa.ac.cn;姚 康,研究员,博士生导师,E-mail: yaokang@isa.ac.cn
S816.7;S828
:A
:1006-267X(2017)09-3193-09

