硒对脂多糖诱导的奶牛乳腺上皮细胞氧化损伤的保护作用
郭咏梅 张博綦 闫素梅 史彬林 郭晓宇
(内蒙古农业大学动物科学学院,呼和浩特010018)
硒对脂多糖诱导的奶牛乳腺上皮细胞氧化损伤的保护作用
郭咏梅 张博綦 闫素梅*史彬林 郭晓宇
(内蒙古农业大学动物科学学院,呼和浩特010018)
本试验旨在研究硒(Se)对脂多糖(LPS)诱导的奶牛乳腺上皮细胞(BMEC)氧化损伤的保护作用及其机制。将贴壁生长的第3代BMEC随机分为8组,每组6个重复,每个重复1个培养孔。对照(CON)组采用基础培养液,不添加Se和LPS,培养30 h;LPS组和6个Se保护组在基础培养液中分别添加不同水平的Se(0、10、20、50、100、150和200 nmol/L),培养24 h后,加入1 μg/mL LPS作为外源刺激作用6 h。结果表明:1)与CON组相比,LPS组BMEC的相对增殖率显著下降(P<0.05),谷胱甘肽过氧化物酶(GPx)、硫氧还蛋白还原酶(TrxR)、总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)活性和总抗氧化能力(T-AOC)均显著下降(P<0.05),GPx1和TrxR1的基因和蛋白表达量、硒蛋白P(SelP)含量也显著下调(P<0.05);而LPS组的一氧化氮(NO)含量,诱导型一氧化氮合酶(iNOS)活性及其基因和蛋白表达量,炎症因子肿瘤坏死因子-α(TNF-α)、白介素-1(IL-1)和白介素-6(IL-6)含量及其基因表达量,活性氧(ROS)活性,丙二醛(MDA)含量均显著升高(P<0.05),丝裂原活化蛋白激酶(MAPK)信号通路相关因子p38丝裂原活化蛋白激酶(p38MAPK)、c-Jun氨基端激酶(JNK)、细胞外信号调节激酶1/2(ERK1/2)的基因表达量呈相似变化。2)与LPS组相比,Se保护组随Se添加水平的增加,相对增殖率,T-SOD、CAT、GPx、TrxR活性,T-AOC,GPx1、TrxR1基因和蛋白表达量均呈先升高后下降趋势;而NO含量,iNOS活性及其基因和蛋白表达量,炎症因子TNF-α、IL-1、IL-6含量及其基因表达量,MAPK信号通路相关因子ERK1/2、JNK、p38MAPK的基因表达量,ROS活性,MDA含量呈先降低后升高的趋势;以20~100 nmol/L Se保护效果较好,综合来看50 nmol/L Se保护效果最好。结果提示,Se可提高BMEC的抗氧化功能,对LPS引起的细胞氧化损伤具有保护作用,其机制是Se增强TrxR活性从而抑制MAPK信号通路的激活,最终减少NO的大量释放,但过高水平的Se会对细胞造成损伤。培养液中20~100 nmol/L Se的保护作用较好,尤其以50 nmol/L Se效果最好。
硒代蛋氨酸;脂多糖;奶牛乳腺上皮细胞;氧化损伤;保护作用
奶牛乳腺上皮细胞(bovine mammary epithelial cell,BMEC)是乳成分合成与分泌的重要场所,其生物合成能力决定了奶牛乳腺的产奶潜力[1]。泌乳期的BMEC由于高代谢率引起的大量氧自由基蓄积,这是诱发细胞氧化损伤及抗氧化机能降低进而引起乳房炎等代谢性疾病和乳品质降低的重要原因之一[2]。微量元素硒(Se)主要通过合成硒蛋白发挥其生物学功能,对奶牛的抗氧化功能和免疫功能具有显著促进效果[3]。一些研究也指出,在Se推荐需要量的基础上,适当提高饲粮Se水平可进一步提高抗氧化功能[4],但关于其影响机制尚不完全清楚。因此,深入研究Se对乳腺氧化应激损伤的缓解作用及其机理,为在生产中科学补加Se、保证奶牛乳腺健康和改善乳品质具有重要的理论与实际意义。
一氧化氮(NO)是由诱导型一氧化氮合酶(inducible nitric oxide synthase,iNOS)催化L-精氨酸经多步氧化还原反应生成的气体信号分子。研究证实,NO具有双向调节功能。一方面,适量的NO参与机体多种生理活动,并且具有抗菌及抗肿瘤作用,保护动物免受外界环境的感染[5];另一方面,过量的NO还会导致活性氮的产生、细胞信号通路的阻断,诱导机体发生氧化应激及炎症反应[6]。一些研究指出,硒代蛋氨酸可下调鼠软骨细胞中可诱导iNOS和环氧合酶-2产生的白介素-1β(IL-1β)基因的表达,进而抑制NO和前列腺素E2的大量产生[7]。Ferret等[8]的研究指出,硫氧还蛋白(thioredoxin,Trx)体系可保护人单核巨噬细胞免受NO引起的损伤,细胞对NO损伤作用的易感性与硫氧还蛋白还原酶(thioredoxin reductase,TrxR)和Trx的基因表达量呈负相关。Obata等[9]指出p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)信号通路的激活能促进单核巨噬细胞产生肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素-1(IL-1)、白介素-6(IL-6)等多种细胞因子的基因表达;引起细胞内iNOS基因的表达量增加,产生大量NO。细胞凋亡信号激酶-1(apoptosis signal-regulating kinase-1,ASK-1)是MAPK信号通路的上游激动剂,还原型Trx转变为氧化形式时,ASK-1被激活,从而激活MAPK信号通路[10]。体内和体外研究结果得出,Se可以增加奶牛血液和BMEC的TrxR活性,改善其抗氧化功能,减缓氧化损伤[3,11]。这些研究提示,Se对BMEC氧化损伤的保护作用机制可能通过增强硒蛋白TrxR活性调节MAPK信号通路来影响细胞因子白介素(IL)的产生,进而调节NO的生成,但相关研究甚少,确切机理需要进一步探讨。脂多糖(lipopolysaccharide,LPS)诱发的奶牛乳腺炎模型被国际公认是研究乳房炎的主要病理模型[12]。本课题组利用LPS为应激源,诱导BMEC产生大量的NO,已成功建立了细胞的氧化应激模型[13]。鉴此,本试验以LPS诱导BMEC氧化应激,主要从TrxR活性和MAPK信号通路与NO的关系的角度,研究不同水平Se对细胞损伤的预保护作用及其可能机理,为提高奶牛乳腺组织抗氧化功能、科学补加Se和保障乳腺健康提供理论依据。
1 材料与方法
1.1BMEC的培养
BMEC采用胶原酶消化法获得。于内蒙古自治区呼和浩特市北亚清真冷库挑选3头健康的奶牛,采集乳腺组织,剪去外层组织,取数块深层组织依次经含有3×双抗的磷酸盐缓冲液(PBS)清洗3遍、75%酒精清洗1遍、含有1×双抗的PBS清洗3遍。在深层剪取约1 mm3大小的组织块于5 mL离心管中,充分剪碎后加入等体积的0.5%胶原酶Ⅱ,置于CO2恒温培养箱(HF240,HealFORS,37 ℃和5% CO2)中消化1 h。将消化液用80目的细胞滤网过滤,收集滤液于15 mL的离心管中,离心后弃上清。所得沉淀用PBS重新悬浮离心,弃去上清,所得沉淀用培养液重新悬浮细胞后接种于25 cm2的培养瓶中,置于CO2恒温培养箱中培养。待原代细胞的贴壁率达到80%~90%时,进行细胞纯化及传代。将分离纯化后的BMEC经荧光免疫细胞染色法鉴定后,连续培养到第3代,将其分别接种于试验设计要求的细胞培养器皿中,加入完全培养液在37 ℃、5%CO2条件下培养细胞,当细胞贴壁率达到80%~90%时,弃去旧培养液,加入新的不含胎牛血清的培养液饥饿培养24 h之后,按照试验设计进行后续试验。
1.2试验设计
LPS(L4391)和硒代蛋氨酸(Se源,纯度≥98%,S3132)均购自Sigma公司。
以LPS诱导BMEC氧化损伤,建立氧化损伤模型,LPS作用时间及作用浓度参照高瑞峰[12]的研究结果确定。将贴壁生长的第3代BMEC随机分为8组,每组6个重复,每个重复1个培养孔。对照(CON)组采用基础培养液,不添加Se和LPS,培养30 h;LPS组利用基础培养液培养24 h后,加入1 μg/mL的LPS作用6 h;不同水平Se保护组分别在基础培养液中添加10(LSe10组)、20(LSe20组)、50(LSe50组)、100(LSe100组)、150(LSe150组)及200 nmol/L的Se(LSe200组),培养24 h后,加入1 μg/mL的LPS作用6 h。基础培养液中蛋氨酸的浓度为115 588.99 nmol/L,因此硒代蛋氨酸的补加对基础培养液蛋氨酸浓度的影响很小。
1.3测定指标与方法
1.3.1 相对增殖率
BMEC相对增殖率采用噻唑蓝(MTT)法测定。将第3代BMEC悬液接种于96孔培养板中,按照试验设计培养,向各培养孔中加入20 μL的MTT(5 mg/mL),培养4 h后,弃去上清液,甩板并拍干液体,再向每孔加入100 μL二甲基亚砜,使用全自动酶标仪(Synergy 4,BioTek)振荡10 min后,检测各孔490 nm吸光度值(OD490 nm)。
相对增殖率(%)=(试验组OD490 nm/CON组OD490 nm)×100。
1.3.2 抗氧化功能及炎症因子
将第3代BMEC悬液接种于60 mm细胞培养皿中,按照设计要求培养30 h后,收集细胞培养液于1.5 mL Eppendorf管中15 455×g离心10 min,收集上清液用于抗氧化功能、炎症因子含量的测定。总抗氧化能力(T-AOC)采用钼酸铵显色法测定,总超氧化物歧化酶(T-SOD)活性采用黄嘌呤氧化酶法测定,过氧化氢酶(CAT)活性采用比色法测定,iNOS活性及硒蛋白P(SelP)、NO、IL-1、IL-6、TNF-α的含量均采用酶联免疫吸附测定法测定,具体操作按照试剂盒说明书进行,试剂盒购自美国R&D公司。
将上述弃去细胞培养液后的细胞培养皿置于冰上,加入1 mL PBS清洗2遍,加入1 mL动物细胞裂解液于冰上裂解30 min,用细胞刮板刮取贴壁细胞,收集于1.5 mL Eppendorf离心管中,4 ℃、15 455×g离心10 min,收集上清液用于细胞内的抗氧化功能的测定。其中,谷胱甘肽过氧化物酶(GPx)活性采用二硫代二硝基苯甲酸法测定,丙二醛(MDA)含量采用硫代巴比妥酸法测定,操作均按照试剂盒说明书进行,试剂盒购自南京建成生物研究所。活性氧(ROS)及TrxR活性均采用酶联免疫吸附测定法测定,具体操作按照试剂盒说明书进行,试剂盒购自美国R&D公司。细胞内的GPx活性、MDA含量换算为总蛋白质基础,总蛋白质含量采用二喹啉甲酸(BCA)法测定,试剂盒购自北京碧云天公司。
1.3.3 细胞内基因的相对表达量
以β-肌动蛋白(β-actin)作为内标基因,采用实时荧光定量PCR技术测定细胞中GPx1、GPx4、SelP、TrxR1、iNOS、IL-1、IL-6、TNF-α、p38MAPK、c-Jun氨基端激酶(c-Jun N terminal kinase,JNK)、细胞外信号调节激酶1/2(extracellular signal-regulated kinas 1/2,ERK1/2)的基因表达量。
1.3.4 细胞内蛋白表达量
以β-actin作为内参蛋白,采用Western Blot法测定BMEC内GPx1、TrxR1和iNOS的蛋白表达量,每个处理3个重复。主要操作步骤:将30 μg蛋白样品与5×上样缓冲液以4∶1的体积比混合,于干煮仪变性5 min后,用上样针将样品加到点样孔内。蛋白样品分别依次经浓缩胶(80 V、30 min)、分离胶(120 V、90 min)电泳分离,之后进行转膜(100 V、50 min)。转膜完成后,用Tris缓冲液(TBST)洗涤膜3次,每次5 min,室温封闭1 h,然后用TBST洗涤膜1次,每次5 min。将膜分别在4 ℃条件下过夜进行一抗[兔抗β-actin多克隆抗体(20536-1-AP,Proteintech,1∶2 000稀释)、兔抗GPx1多克隆抗体(ab22604,Abcam,1∶1 000稀释)、兔抗TrxR1多克隆抗体(ab16840,Abcam,1∶500稀释)和兔抗iNOS多克隆抗体(NBP1-97471,Novus Biological,1∶1 000稀释)孵育,次日进行二抗孵育,与辣根过氧化物酶(HPR)标记的山羊抗兔二抗(04-15-06,KPL,1∶1 000稀释)室温孵育1 h。用ECL超敏发光试剂盒进行显色,并在凝胶成像仪(ImageQuant RT ECL,GE)上照相。用ImageJ软件对图像进行灰度值分析,并计算目的蛋白表达量,计算公式如下:
目的蛋白表达量=目的蛋白灰度值/内参蛋白灰度值。
1.4试验数据处理与分析
试验数据经采用SAS 9.0统计软件中的方差分析(ANOVA)程序进行显著性分析,P<0.05表示差异显著,0.05≤P<0.10表示差异趋于显著。
2 结 果
2.1细胞形态、相对增殖率、抗氧化功能及炎症因子含量
如表1及图1所示,与CON组相比,LPS组的细胞形态发生了改变,细胞界限不清,细胞形态明显固缩,相对增殖率显著下降(P<0.05),较CON组降低23.57%;抗氧化指标T-SOD、CAT、GPx、TrxR活性,T-AOC,SelP含量均显著降低(P<0.05),而ROS和iNOS活性,NO、MDA及炎症因子TNF-α、IL-1和IL-6含量呈相反变化规律,显著升高(P<0.05)。
与LPS组相比,Se保护组中的LSe20、LSe50、LSe100和LSe150组的细胞形态固缩情况有所缓解,相对增殖率显著升高(P<0.05),LSe50组为Se保护组中最高,且显著高于其他各试验组(P<0.05),LSe10、LSe200组无显著变化(P>0.05);LSe20、LSe50、LSe100组的T-AOC、CAT和TrxR活性均显著高于LPS组(P<0.05),且LSe50组为Se保护组中最高,但LSe10、LSe150、LSe200组与LPS组无显著差异(P>0.05)。LSe50、LSe100、LSe150组的GPx活性显著高于LPS组(P<0.05),以LSe100组为Se保护组中最高;但LSe10、LSe20、LSe200组与LPS组无显著差异(P>0.05)。所有的Se保护组T-SOD活性均高于LPS组,以LSe50组为Se保护组中最高。LSe50组的SelP活性显著高于LPS组(P<0.05),其余各Se保护组均与LPS组差异不显著(P>0.05)。所有Se保护组的MDA含量及ROS活性均显著低于LPS组(P<0.05),且以LSe50组最低;NO含量与iNOS活性也呈相似变化规律,但NO含量以LSe100组最低,iNOS活性以LSe50组最低,LSe200组的NO含量与iNOS活性均与LPS组无显著差异(P<0.05)。LSe50、LSe100组TNF-α及IL-1含量及LSe20、LSe50组的IL-6含量均显著低于LPS组(P<0.05),其他Se保护组与LPS组均无显著差异(P>0.05)。

图1 Se对LPS诱导氧化损伤的BMEC形态的影响
2.2抗氧化酶和炎症因子的基因和蛋白表达量
如表2和图2所示,与CON组相比,LPS组的GPx1和TrxR1基因和蛋白表达量均显著降低(P<0.05),而iNOS基因和蛋白表达量、炎症因子(TNF-α、IL-1和IL-6)及MAPK信号通路相关因子(p38MAPK、JNK、ERK1/2)基因表达量呈相反变化规律,均显著升高(P<0.05)。
与LPS组相比,LSe20、LSe50、LSe100组的GPx1和TrxR1基因表达量,LSe50、LSe100、LSe150、LSe200组的SelP基因表达量均显著升高(P<0.05),LSe50组的TrxR1、SelP基因表达量为Se保护组中最高。Se保护组GPx1和TrxR1的蛋白表达量均显著高于LPS组(P<0.05),最高值也出现在LSe50组。与LPS组相比,LSe20、LSe50、LSe100组的IL-1基因表达量及iNOS基因和蛋白表达量均显著降低(P<0.05),LSe50组为Se保护组中最低,LSe200组IL-1和iNOS基因表达量反而显著升高(P<0.05)。所有Se保护组的TNF-α基因表达量均显著低于LPS组(P<0.05),LSe50组Se保护组中最低。MAPK信号通路相关的基因表达量与上述炎症因子呈现相似的变化趋势,与LPS组相比,p38MAPK(LSe20、LSe50、LSe100、LSe150组)与ERK1/2(LSe20、LSe50、LSe100组)的基因表达量均显著降低(P<0.05),且以LSe50组为Se保护组中最低。所有Se保护组的JNK基因表达量均显著低于LPS组(P<0.05),以LSe100组为其组中最低。
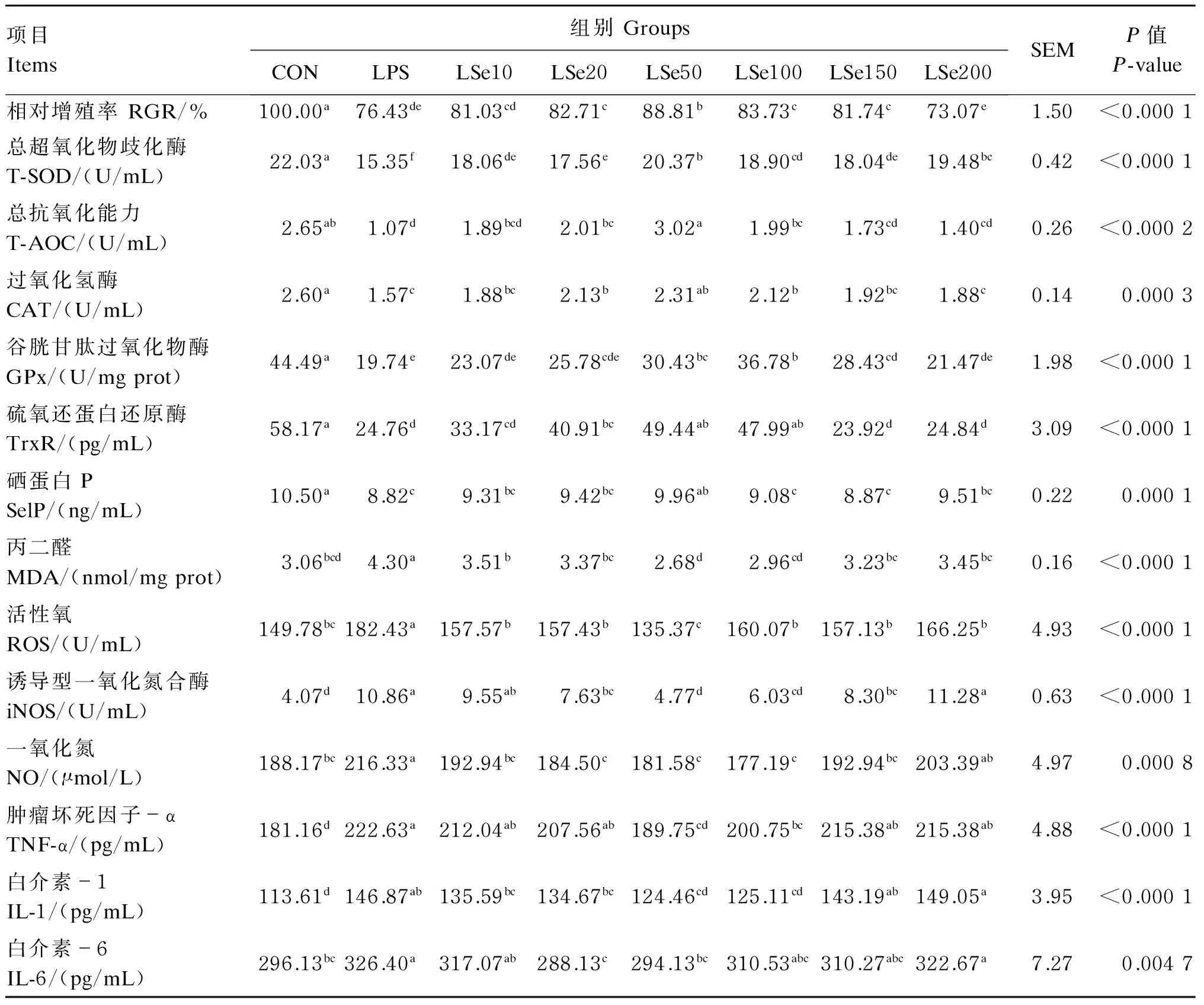
表1 Se对LPS诱导氧化损伤的BMEC相对增殖率、抗氧化功能及炎症因子含量的影响
同行数据肩标相同或无字母表示差异不显著(P>0.05),不同字母表示差异显著(P<0.05)。下表同。
Values in the same row with the same or no letter superscripts mean no significant difference (P>0.05), while with different letter superscripts mean significant difference (P<0.05). The same as below.
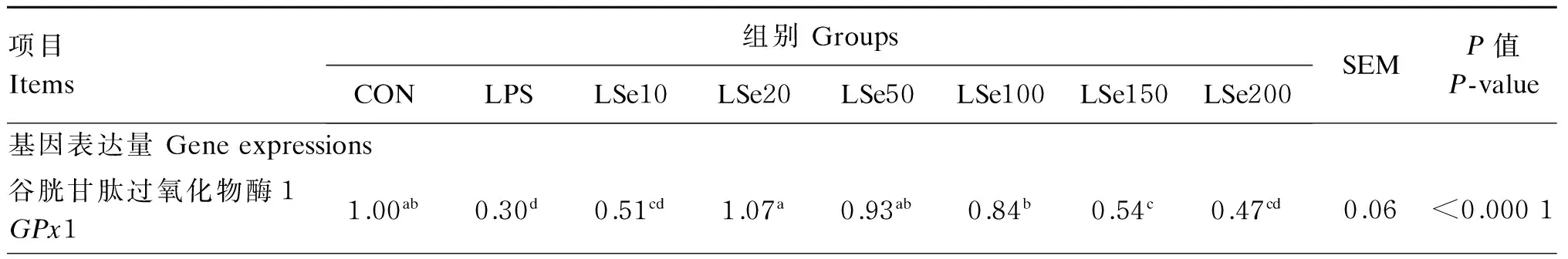
表2 Se对LPS诱导氧化损伤的BMEC抗氧化酶和炎症因子基因及蛋白表达量的影响

续表2项目Items组别GroupsCONLPSLSe10LSe20LSe50LSe100LSe150LSe200SEMP值P-value基因表达量Geneexpressions谷胱甘肽过氧化物酶4GPx41.001.211.291.491.481.331.461.240.120.1393硫氧还蛋白还原酶1TrxR11.00a0.23f0.38cde0.40cd0.71b0.47c0.34def0.27ef0.03<0.0001硒蛋白PSelP1.00de0.59e0.93de1.37cde3.57a2.92ab2.57abc2.13bcd0.35<0.0001白介素-1IL-11.00f14.12b13.65b10.09cd6.57e7.78de12.69bc17.31a0.90<0.0001白介素-6IL-61.00c2.15a2.04a2.08a1.16bc1.96ab2.22a2.43a0.250.0059肿瘤坏死因子-αTNF-α1.00e19.16a13.18bc11.06c7.33d12.34bc13.03bc15.06b0.78<0.0001诱导型一氧化氮合酶iNOS1.00f2.33b2.02bc1.71cd1.20ef1.49de2.06bc2.94a0.12<0.0001p38丝裂原活化蛋白激酶p38MAPK1.00a1.89b1.49ab1.35a1.08a1.23a1.21a1.49ab0.150.0146c-Jun氨基端激酶JNK1.00d3.57a2.14b1.84bc1.48bcd1.05d1.21cd1.83bc0.23<0.0001细胞外信号调节激酶1/2ERK1/21.00d2.34a1.76abc1.35cd1.19cd1.56bcd2.10ab2.32a0.180.0002蛋白表达量Proteinexpressions硫氧还蛋白还原酶1TrxR10.904c0.444f0.750d0.901c1.031a0.954b0.912c0.718e0.008<0.0001谷胱甘肽过氧化物酶1GPx10.618b0.356d0.439c0.622b0.907a0.622b0.593b0.407c0.013<0.0001诱导型一氧化氮合酶iNOS0.787cd0.936a0.928a0.810c0.682e0.768d0.848b0.928a0.008<0.0001
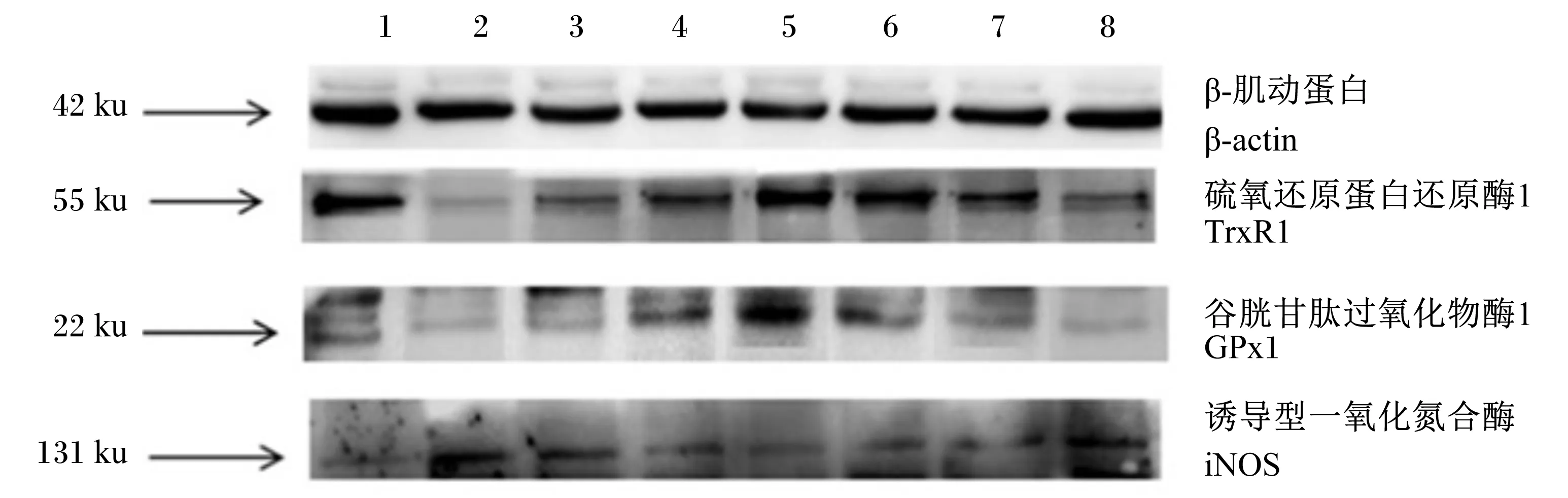
1:CON组 CON group;2:LPS组 LPS group;3:LSe10组 LSe10 group;4:LSe20组 LSe20 group;5:LSe50组 LSe50 group;6;LSe100组 LSe100 group;7:LSe150组 LSe150 group;8:LSe200组 LSe200 group。
图2Se对LPS诱导氧化损伤的BMEC抗氧化酶蛋白表达量的影响
Fig.2 Effects of of Se on expressions of proteins of antioxidant enzymes in BMEC oxidative damaged by LPS
3 讨 论
3.1LPS诱导BMEC引起的氧化损伤
细胞相对增殖率、抗氧化酶活性及炎症因子含量是反映细胞氧化应激状态的主要指标。正常情况下,体内的抗氧化酶会清除多余的自由基,使其维持在生理水平,参与机体的信号转导[14]。但当细胞遭受LPS等外源性刺激时,会产生大量的自由基并集聚[15];自由基的过量产生会直接损伤DNA、蛋白质和细胞器,促进细胞凋亡,启动炎症介质产生[16]。本试验用LPS诱导细胞后,与CON组相比,LPS组的相对增殖率降低了23.57%,T-SOD、GPx、TrxR、CAT等抗氧化酶活性显著下降,而炎症因子TNF-α、IL-1和IL-6的含量及其基因表达量,MDA含量,自由基ROS活性,NO含量,iNOS活性及其基因和蛋白的表达量显著升高,说明LPS诱导BMEC发生了氧化损伤。研究报道,LPS经Toll样受体4受体蛋白识别将信号传入胞浆,引起MAPK信号通路的激活,而p38通路活化可使细胞内iNOS基因的表达量增加,产生大量NO,过高含量的NO导致活性氮的产生、细胞信号通路的阻断及全身性不可控制的炎症发生,从而造成机体组织损伤[17]。MAPK信号通路的激活能诱导NF-κB通路活化,活化的NF-κB促使炎症因子的大量生产,进而引起NO的大量释放,NO的过量释放反过来又诱导ERK1/2、p38MAPK和JNK活化并刺激NF-κB的进一步活化,形成恶性循环,最终导致炎症反应,造成机体损伤[18-19]。可见,LPS对细胞诱导的氧化损伤是通过MAPK信号通路的激活引起炎症因子的产生,进而诱导iNOS基因的过度表达和NO的过量产生。本研究发现,LPS组的细胞炎症因子含量及其相关基因和蛋白表达量增加的同时,MAPK信号通路被激活,相关因子p38MAPK、JNK及ERK1/2的基因表达量显著升高,进一步验证了LPS对BMEC诱导的氧化损伤与其NO的过量产生有关。
3.2Se对LPS诱导的氧化损伤的保护作用及其机制
本研究结果显示,与LPS组相比,Se保护组降低了TrxR、GPx等抗氧化酶活性,TrxR1、GPx1基因和蛋白的表达量,降低了MDA含量、ROS活性、NO含量、iNOS的基因和蛋白表达量,并下调了炎症因子的含量及基因表达量,说明Se可以提高细胞的抗氧化功能,对LPS诱导引起的BMEC氧化损伤具有保护效果。Se作为体内抗氧化酶如TrxR、GPx的组成成分,通过清除体内的自由基而发挥抗氧化性损伤的作用,可防止生物大分子发生氧化应激反应。因此Se对BMEC氧化损伤的保护机制与硒蛋白活性的增强有关。过量NO的产生是引起细胞产生损伤的主要原因之一。Zhao等[20]的研究指出,Se的缺乏引起雏鸡的胰腺组织中TrxR的基因表达量显著降低,iNOS的基因表达量及NO含量显著升高。研究发现,促炎症因子IL-1β可诱导细胞内的iNOS活性升高和其基因及蛋白表达量增加,进而促进NO的大量合成,导致炎症加重[21]。小鼠巨噬细胞的相关研究结果指出,Se是通过降低炎症因子的基因及蛋白表达量[22],减少了炎症因子的释放,实现了其对细胞氧化应激的保护作用,提高了细胞的抗氧化及抑炎功能。本研究以BMEC为对象的研究得出了类似的结果,Se保护组降低了炎症因子TNF-α、IL-1和IL-6含量及其基因表达量,结合抗氧化功能、自由基含量和细胞活性的变化结果说明,Se对BMEC氧化损伤的保护作用与其降低了炎症因子的基因和蛋白表达量,引起iNOS的活性降低,进而减少了NO的大量生成有关。
在炎症反应中,细胞因子IL-1β、IL-6和TNF-α基因表达量增加与信号通路MAPK信号转导的增强有关,Se可能通过调节硒蛋白的表达抑制MAPK等信号途径参与细胞信号转导调控,下调炎症相关基因的表达并促进重建免疫稳态而使机体恢复健康[23]。MAPK家族包括p38MAPK、JNK和ERK,它们分别可被上游相应的激酶活化,其中ASK-1是MAPK家族的重要成员,是MAPK信号通路的上游激动剂,还原型Trx结合在ASK-1的N端区域,起抑制其活性的作用,当Trx由于TrxR活性降低转变为氧化形式时,ASK-1被激活,从而激活MAPK信号通路中的JNK和p38MAPK[10]。巨噬细胞体外培养研究表明,LPS可诱导MAPK信号通路的活化,增加ROS和NO的产生,而加Se显著降低了LPS诱导的H2O2的生成以及p38的活化[21],降低了NO等促炎因子的产生[24]。柳晨[24]利用转染Trx基因的小鼠神经嵴母瘤细胞建立了NO毒性模型,研究了Trx基因的表达与NO的关系,研究发现Trx可以保护小鼠神经嵴母瘤细胞免受NO诱导的损伤,其原因可能是Trx的S-亚基能绑定NO,减少NO含量,清除氧自由基,提高细胞抗氧化水平[25]。本课题组的前期研究指出,Se的补加可显著增强奶牛血液中的TrxR活性,促进奶牛的抗氧化功能[3]。本研究结果得出,Se保护组的TrxR活性及TrxR1基因和蛋白表达量上调,而MAPK信号通路相关因子的基因表达量下调,提示BMEC受到LPS损伤后,Se可能是通过上调硒蛋白TrxR1的基因和蛋白表达量,增加了TrxR活性,抑制了MAPK信号通路的活化,进而通过抑制IL-1的产生,降低iNOS活性,减少NO的释放,从而对BMEC氧化损伤起到保护作用。然而,本研究并未对TrxR1基因行沉默和过表达,需要进一步验证。
适宜水平的Se可以促进细胞增殖,增强抗氧化功能及免疫功能[11];而高水平的Se则抑制细胞增殖,并且减弱机体抗氧化功能及免疫功能,甚至导致机体病理性损伤[26]。本研究也得出Se对BMEC氧化应激的保护作用与其水平有关,10 nmol/L的Se对BMEC无显著保护作用,20~100 nmol/L的Se保护作用较好,尤其50 nmol/LSe的保护效果最好。然而,随着Se水平进一步增加,保护作用逐渐减弱,尤其是200 nmol/L的Se不仅没有保护效果,反而引起细胞发生损伤。这可能是由于Se能代替含硫化合物中的硫原子,对多种酶和含硫氨基酸有抑制作用,同时抑制体内的抗氧化过程而产生毒害[27]。Se的毒性也可能是正常金属元素和微量元素紊乱导致的结果。这种紊乱反过来又可能影响生物体内代谢途径和级联反应,并伴随着炎症反应的发生,最终导致氧化应激[28]。虽然Se对机体有保护作用,但其毒性范围较小,毒性剂量大概在营养需要的3~5倍[29]。因此,合理控制Se的添加水平是Se发挥抗氧化及抑炎作用的前提。
4 结 论
① Se可提高BMEC的抗氧化功能,对LPS引起的细胞氧化损伤具有保护作用,其机制是Se增强TrxR活性从而抑制MAPK信号通路的激活,最终减少NO的大量释放,但过高水平的Se会对细胞造成损伤。
② 培养液中20~100 nmol/L Se的保护作用较好,尤其以50 nmol/L Se效果最好。
[1] 胡菡,王加启,李发弟,等.高温诱导体外培养奶牛乳腺上皮细胞的应激响应[J].农业生物技术学报,2011,19(2):287-293.
[2] 郭咏梅,张博綦,石惠宇,等.二乙烯三胺/一氧化氮聚合物诱导的奶牛乳腺上皮细胞损伤模型的建立[J].动物营养学报,2016,28(8):2378-2384.
[3] GONG J,NI L L,WANG D F,et al.Effect of dietary organic selenium on milk selenium concentration and antioxidant and immune status in midlactation dairy cows[J].Livestock Science,2014,170:84-90.
[4] JUNIPER D T,PHIPPS R H,GIVENS D I,et al.Tolerance of ruminant animals to high dose in-feed administration of a selenium-enriched yeast[J].Journal of Animal Science,2008,86(1):197-204.
[5] MACMICKING J,XIE Q W,NATHAN C.Nitric oxide and macrophage function[J].Annual Review of Immunology,1997,15:323-350.
[6] SANG J R,JIANG M Y, LIN F,et al.Nitric oxide reduces hydrogen peroxide accumulation involved in water stress-induced subcellular anti-oxidant defense in maize plants[J].Journal of Integrative Plant Biology,2008,50(2):231-243.
[7] CHENG A W M,STABLER T V,BOLOGNESI M,et al.Selenomethionine inhibitsIL-1β inducible nitric oxide synthase (iNOS) and cyclooxygenase 2 (COX2) expression in primary human chondrocytes[J].Osteoarthritis and Cartilage,2011,19(1):118-125.
[8] FERRET P J,SOUM E,NEGRE O,et al.Protective effect of thioredoxin upon NO-mediated cell injury in THP1 monocytic human cells[J].Biochemical Journal,2000,346(3):759-765.
[9] OBATA T,BROWN GE,YAFFE M B.MAP kinase pathways activated by stress:the p38 MAPK pathway[J].Critical Care Medicine,2000,28(4S):N67-N77.
[10] SOGA M,MATSUZAWA A,IOCHIJO H.Oxidative stress-induced diseases via the ASK1 signaling pathway[J].International Journal of Cell Biology,2012,2012:439587.
[11] 弓剑.硒对奶牛乳腺抗氧化功能的影响及其机理研究[D].博士学位论文.呼和浩特:内蒙古农业大学,2014.
[12] 高瑞峰.绿原酸抗乳腺炎作用及机制研究[D].博士学位论文.长春:吉林大学,2014.
[13] SHI H Y,GUO Y M,LIU Y,et al.Theinvitroeffect of lipopolysaccharide on proliferation,inflammatory factors and antioxidant enzyme activity in bovine mammary epithelial cells[J].Animal Nutrition,2016,2(2):99-104.
[14] 梁馨予,张婷,周永,等.杨梅素减轻高糖诱导的血管内皮细胞氧化应激损伤[J].第三军医大学学报,2013,35(21):2301-2305.
[15] MO C F,WANG L,ZHANG J,et al.The crosstalk between Nrf2 and AMPK signal pathways is important for the anti-inflammatory effect of berberine in LPS-stimulated macrophages and endotoxin-shocked mice[J].Antioxidants & Redox Signaling,2014,20(4):574-588.
[16] KUNZ A,DIRNAGL U,MERGENTHALER P.Acute pathophysiological processes after ischaemic and traumatic brain injury[J].Best Practice & Research Clinical Anaesthesiology,2010,24(4):495-509.
[17] BRUBAKER S W,BONHAM K S,ZANONI I,et al.Innate immune pattern recognition:a cell biological perspective[J].Annual Review of Immunolgy,2015,33(1):257-290.
[19] DRABAREK B,DYMKOWSKA D,SZCZEPANOWSKA J,et al.TNF-α affects energy metabolism and stimulates biogenesis of mitochondria in EA.hy926 endothelial cells[J].The International Journal of Biochemistry & Cell Biology,2012,44(9):1390-1397.
[20] ZHAO X,YAO H D,FAN R F,et al.Selenium deficiency influences nitric oxide and selenoproteins in pancreas of chickens[J].Biological Trace Element Research,2014,161(3):341-349.
[21] 黄建花,何英,赖国旗.川芎嗪对IL-1β诱导的兔原代软骨细胞iNOS表达和NO合成的影响[J].第三军医大学学报,2012,34(16):1642-1645.
[22] KIM S H,JOHNSON V J,SHIN T Y,et al.Selenium attenuates lipopolysaccharide-induced oxidative stress responses through modulation of p38 MAPK and NF-κB signaling pathways[J].Experimental Biology and Medicine,2004,229(2):203-213.
[23] SALMAN S,KHOL-PARISINI A,SCHAFFT H,et al.The Role of dietary selenium in bovine mammary gland health and immune function[J].Animal Health Research Review,2009,10(1):21-34.
[24] 柳晨.基于TRX转基因细胞抗氧化应激损伤作用中对NO水平的调节作用研究[D].硕士学位论文.大连:大连医科大学,2013.
[25] MURATA M,AKAO M,O’ROURKE B,et al.Mitochondrial ATP-sensitive potassium channels attenuate matrix Ca2+overload during simulated ischemia and reperfusion:possible mechanism of cardioprotection[J].Circulation Research,2001,89(10):891-898.
[26] WANG Y C,JIANG L,LI Y F,et al.Effect of different selenium supplementation levels on oxidative stress,cytokines,and immunotoxicity in chicken thymus[J].Biological Trace Element Research,2016,172(2):488-495.
[27] 王丽鑫,胡晓蓉,谭智勇,等.生物体内汞与硒的相互作用[J].重庆环境科学,2012,24(2):73-75.
[28] HAUSER-DAVIS R A,SILVA J A N,ROCHA R C C,et al.Acute selenium selenite exposure effects on oxidative stress biomarkers and essential metals and trace-elements in the model organism zebrafish (Daniorerio)[J].Journal of Trace Elements in Medicine and Biology,2016,33:68-72.
[29] TUZEN M,PEKINER O Z.Ultrasound-assisted ionic liquid dispersive liquid-liquid microextraction combined with graphite furnace atomic absorption spectrometric for selenium speciation in foods and beverages[J].Food Chemistry,2015,188:619-624.
*Corresponding author, professor, E-mail: yansmimau@163.com
(责任编辑 王智航)
Protective Effects of Selenium on Bovine Mammary Epithelial Cells Oxidative Damaged by Lipopolysaccharide
GUO Yongmei ZHANG Boqi YAN Sumei*SHI Binlin GUO Xiaoyu
(College of Animal Science, Inner Mongolia Agricultural University, Hohhot 010018, China)
This experiment was conducted to investigate the protective effects of selenium (Se) on bovine mammary epithelial cells (BMECs) oxidative damaged by lipopolysaccharide (LPS) and the mechanism. The third-generation attachment cultured BMECs were randomly divided into 8 groups with 6 replicates per group and 1 culture pore per replicate. BMECs in control (CON) group were cultured in a basal medium without Se and LPS for 30 h. BMECs in LPS group and Se protection groups were exposed in Se with different concentrations (0, 10, 20, 50, 100, 150 and 200 nmol/L) for 24 h, and then treated with LPS (1 μg/mL) for 6 h. The results showed as follows: 1) compared with CON group, the relative proliferation rate in LPS group was significantly decreased (P<0.05), the activities of glutathione peroxidase (GPx), thioredoxin reductase (TrxR), superoxide dismutase (T-SOD) and catalase (CAT), and total antioxidant capacity (T-AOC) in LPS group were significantly decreased (P<0.05), and expressions of genes and proteins ofGPx1 andTrxR1 and selenoprotein P (SelP) content in LPS group was significantly decreased (P<0.05); however, nitric oxide (NO) content, activity, gene and protein expressions of inducible nitric oxide synthase (iNOS), contents and gene expressions of inflammatory factors [tumor necrosis factor-alpha (TNF-α), interleukin-1 (IL-1) and interleukin-6 (IL-6)], active oxygen (ROS) activity, and malondialdehyde (MDA) content in LPS group were significantly increased (P<0.05), and gene expressions of factors related to the mitogen-activated protein kinase (MAPK) signaling pathway [p38 mitogen-activated protein kinase (p38MAPK), c-Jun N terminal kinase (JNK) and extracellular signal-regulated kinas 1/2 (ERK1/2)] in LPS group showed the same tendency. 2) Compared with LPS group, with the increase of Se supplemental level in Se protection groups, relative proliferation rate, activities of T-SOD, CAT, GPx and TrxR, T-AOC, gene and protein expressions ofGPx1 andTrxR1 were increased first and then decreased; while NO content, activity, gene and protein expressions of iNOS, contents and gene expressions of inflammatory factors (TNF-α,IL-1 andIL-6), gene expressions of factors related to MAPK signal pathway [ERK1/2,JNKandp38MAPK], ROS activity, and MDA content showed the opposite trend; Se at 20 to 100nmol/L showed better protection effects, and in general Se at 50nmol/L showed the best protection effects. The results indicate that Se improves the antioxidant function of BMECs, and protects cells from oxidative damage induced by LPS mainly by increasing TrxR activity, inhibiting the activation of MAPK signaling pathway, and then decreasing NO content, however, high level of Se can cause damage to cells. Se at 20 to 100 nmol/L in culture medium has a better protection effect, and Se at 50 nmol/L has the best effect.[ChineseJournalofAnimalNutrition,2017,29(9):3375-3384]
selenomethionine; lipopolysaccharide; bovine mammary epithelial cell; oxidative damage; protective effect
10.3969/j.issn.1006-267x.2017.09.043
2017-02-27
国家自然科学基金(31560650)
郭咏梅(1989—),女,内蒙古呼和浩特人,博士研究生,从事动物矿物质与维生素营养的研究。E-mail: ymguo2015@163.com
*通信作者:闫素梅,教授,博士生导师,E-mail: yansmimau@163.com
S823
:A
:1006-267X(2017)09-3375-10

