秋刀鱼内脏磷脂的化学特性研究
张 静, 陶宁萍, 朱清澄, 花传祥
(1.上海海洋大学食品学院,上海 201306; 2.上海海洋大学海洋科学学院,国家海洋渔业工程研究中心,海洋渔业资源可持续开发教育部重点实验室, 上海 201306)
秋刀鱼内脏磷脂的化学特性研究
张 静1, 陶宁萍1, 朱清澄2, 花传祥2
(1.上海海洋大学食品学院,上海 201306; 2.上海海洋大学海洋科学学院,国家海洋渔业工程研究中心,海洋渔业资源可持续开发教育部重点实验室, 上海 201306)
采用超临界二氧化碳(SC-CO2)与有机溶剂提取两种方法对秋刀鱼内脏中的磷脂进行提取,研究了两种方法提取的磷脂及SC-CO2提取所得磷脂中的磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)的脂肪酸组成及含量,并对SC-CO2提取磷脂的酸值、过氧化值等理化指标进行检测分析。结果表明:SC-CO2法的提取率(23.90±1.10)%(干重)高于有机溶剂法的提取率(20.81±1.25)%(干重),但两者无显著差异(P>0.05);SC-CO2法所得磷脂的脂肪酸总量高于有机溶剂法的,其中二十碳五烯酸(EPA)的含量分别为8.80%和8.95%,二十二碳六烯酸(DHA)的含量分别为43.20%和43.82%;PC、PE的脂肪酸组成之间无显著差异(P>0.05);磷脂酸值(KOH)为(21.52±0.57)mg/g,过氧化值为(2.06±0.12)mmol/kg,均符合JECFA标准Lecithin (Phosphalipides, Phospholipids; INS No.322 (ⅰ))的规定。
秋刀鱼内脏;磷脂;超临界二氧化碳;脂肪酸
秋刀鱼(CololabisSaira)是一种冷水性海洋生物,广泛分布于西北太平洋及其沿海海域, 是日本、俄罗斯、韩国、中国等国家重要的捕捞品种之一[1-2]。鱼类产品加工的过程中,通常会产生大量的鱼头、鱼骨、鱼皮、内脏等下脚料,总质量占鱼体重的40%~50%,这些下脚料含有丰富的钙、蛋白质资源以及油脂资源等[3-4]。本研究中,秋刀鱼内脏占鱼体重的(10±0.98)%,经前期工作发现,其内脏中含有(25.14±2.01)%的粗脂肪,并且磷脂含量高达(7.58±1.33)%。海洋动物磷脂含有EPA 和DHA等丰富的不饱和脂肪酸,具有预防心脑血管疾病,延缓大脑的衰老和抑制肿瘤细胞生长等功能,有利于高血脂、脂肪肝等疾病的治疗和人体正常的发育。作为一种混合物,海洋磷脂中主要含有磷脂酰胆碱(PC)、磷脂酰乙醇胺(PE)、磷脂酰丝氨酸(PI)等组分[5-7]。
本研究以秋刀鱼内脏为原料,分别利用超临界二氧化碳提取法(SC-CO2)和有机溶剂法对其中的磷脂进行提取,利用气相色谱定性定量分析两种提取方法所得磷脂中的脂肪酸成分,对结果进行比较;利用硅胶柱层析分离SC-CO2法所得磷脂中的PC及PE,利用气相色谱-质谱进一步分析PC以及PE中的脂肪酸成分;并对SC-CO2法提取的磷脂进行理化指标分析,对照Lecithin (Phosphalipides, Phospholipids; INS No.322 (ⅰ))标准进行品质评价,以期为后续进一步研究海洋磷脂的功能特性提供参考。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
秋刀鱼30尾,体重(107.63±11.31)g,体长(27.38±1.12)cm,均为西北太平洋捕捞,原料冷冻鱼经解冻,取内脏剁碎,30 g每包分装,然后冻藏贮存在-20℃条件下。
食品级CO2(纯度大于99.99%)、N2购自上海利旦气体,37种脂肪酸甲酯标准品、十九烷酸甲酯及C19∶0标准品购自上海安谱实验科技股份有限公司,正己烷分别选用色谱纯和分析纯,乙醇、氢氧化钠、二氯甲烷等均为分析纯,默克硅胶粉末。
1.1.2 仪器与设备
Speed SFE-2超临界提取仪,美国Applied Separations公司;R250B旋转蒸发仪;DZKW-4电子恒温水浴锅;TDL-40B型低速离心机;TRACE GC ULTRA气相色谱仪,美国Thermo Fisher公司;Agilent 6890N-5975C气相-质谱联用仪,美国安捷伦科技有限公司。
1.2 实验方法
1.2.1 磷脂提取
1.2.1.1 有机溶剂法提取
将分装的内脏置于真空冷冻干燥机48 h,除去其中的水分,得到粉末状干燥样品。按料液比1∶8加入正己烷在40℃条件下放置4 h,进行中性脂脱除,2 000 r/min离心15 min,收集残渣。按料液比1∶10 在残渣中加入无水乙醇在40℃条件下放置3 h提取磷脂,重复此步骤2次,收集所得乙醇提取物,旋转蒸发掉乙醇溶剂,所得产物为磷脂粗提取物。将所得磷脂粗提取物溶于正己烷,加入3倍体积丙酮,并在4℃条件下缓慢搅拌,置于-20℃冰箱15 min,然后2 000 r/min离心15 min,弃上清液,所得即为秋刀鱼内脏磷脂。
1.2.1.2 SC-CO2法提取
称取10 g左右经冷冻干燥处理的样品填入50 mL提取釜内,检查设备的气密性,设定提取温度、出口阀温度为55℃,打开CO2、N2贮气罐阀门,设定提取压力45 MPa,打开出口阀,进行中性脂脱除,4 h后中性脂脱除完毕,将提取温度、出口阀温度设定为50℃,打开夹带剂系统,设置无水乙醇流速为2 mL/min,同时调节N2压力稳定在45 MPa,动态提取3 h,旋转蒸发掉乙醇溶剂,所得残渣即为秋刀鱼内脏磷脂。
1.2.1.3 硅胶柱层析分离PC和PE[8]
取12 g硅胶粉末放入玻璃柱中进行装柱,用正己烷-二氯甲烷溶液(体积比2∶3)对柱子进行活化。取0.3 g上述SC-CO2提取所得的磷脂放入活化好的硅胶柱中,分别用二氯甲烷-甲醇溶液(体积比1∶1)洗脱PE,用二氯甲烷-甲醇溶液(体积比1∶20)洗脱PC。收集洗脱液后旋转蒸发掉其中的有机溶剂,得PC和PE。
1.2.2 脂肪酸组成及含量分析
利用37种脂肪酸甲酯标准品保留时间对照法定性,内标法定量,结果以“平均值±标准差”(n=3)的形式表示。
1.2.2.1 脂肪酸甲酯标准品及内标溶液配制
在25 mg 37种脂肪酸甲酯标准品中添加1 mg十九烷酸甲酯及2.6 mL正己烷混匀,配制成10 mg/mL标准品储备液。称取50 mg C19∶0标准品于5 mL容量瓶,加入正己烷至刻度处,混匀,制成10 mg/mL内标储备液。
1.2.2.2 甲酯化
分别取0.1 g上述步骤所得样品于平底烧瓶内,加入5 mL 0.5 mol/L氢氧化钠-甲醇溶液和100 μL 10 mg/mL内标储备液,接入冷凝回流装置,通入冷凝水,100℃水浴中煮沸冷凝回流10 min左右,每隔30~60 s摇晃1次烧瓶,直至烧瓶内油滴消失;加入3 mL三氟化硼甲醇溶液,100℃煮沸冷凝回流3 min;再加入2 mL色谱级正己烷,100℃煮沸冷凝回流2 min;然后将烧瓶从水浴中取出,待冷凝管中无液滴滴下时取下冷凝回流装置,加入10 mL饱和NaCl溶液,充分振摇,取上清液,过0.20 μm有机相滤膜保存在气相进样瓶中。
1.2.2.3 气相色谱条件
色谱柱为Agilent SP-2560毛细管柱(100 m×0.25 mm×0.2 μm);检测器为FID;升温程序为起始温度70℃,以50℃/min升至140℃,保持1 min,4℃/min升至180℃,保持1 min,3℃/min升至225℃,保持30 min;汽化室温度250℃;载气N2;柱流速1 mL/min;分流比45∶1;进样量1 μL。
1.2.2.4 气相色谱-质谱条件
色谱条件:HP-88毛细管色谱柱(60 m×250 μm×0.2 μm);进样口温度250℃;升温程序为起始温度70℃,以10℃/min升至210℃,然后以5℃/min升至220℃,再以5℃/min升至235℃,保持9 min;载气为高纯氦气。
质谱条件:EI离子源;电子能量70 eV;离子源温度200℃;进样量1 μL;溶剂延迟时间11 min。
1.2.3 理化指标的测定
酸值参照AOAC 969.17进行测定,过氧化值参照AOAC 965.33进行测定,碘值参照AOAC 993.20进行测定,不皂化物参照AOAC 975.13进行测定[9]。游离脂肪酸参照Berrdez等[10]的方法进行测定。
2 结果与分析
2.1 SC-CO2法和有机溶剂法提取磷脂的脂肪酸组成分析
利用SC-CO2法和有机溶剂法提取磷脂,提取率分别达(23.90±1.10)%(干重)和(20.81±1.25)%(干重),SC-CO2法较有机溶剂法提取率高,但两者并无显著性差异(P>0.05)。对两种提取方法得到的磷脂进行定性定量分析,结果如表1所示。
从表1可以看出,两种提取方法所得磷脂脂肪酸种类一致,都为13种脂肪酸,SC-CO2法所得脂肪酸总量较有机溶剂提取法的高。两种提取方法所得磷脂脂肪酸中SFA、MUFA和PUFA分别为5种、4种和4种,分别占脂肪酸总量的39.51%和38.05%、6.88%和7.57%、53.61%和54.37%。SC-CO2法所得磷脂中EPA占脂肪酸总量的8.80%,DHA占脂肪酸总量的43.20%,有机溶剂提取法所得磷脂中EPA占脂肪酸总量的8.95%,DHA占脂肪酸总量的43.82%。将两种结果进行显著性差异分析比较,结果显示无显著性差异(P>0.05)。推测其原因在于两种方法本质上都是利用无水乙醇作为提取剂,提取所得产物性质较为相似。但由于SC-CO2法提取率较有机溶剂提取法的高,并且提取时间大幅缩短,所得产物脂肪酸总量较高,之后的研究都选用了SC-CO2提取法所得磷脂。

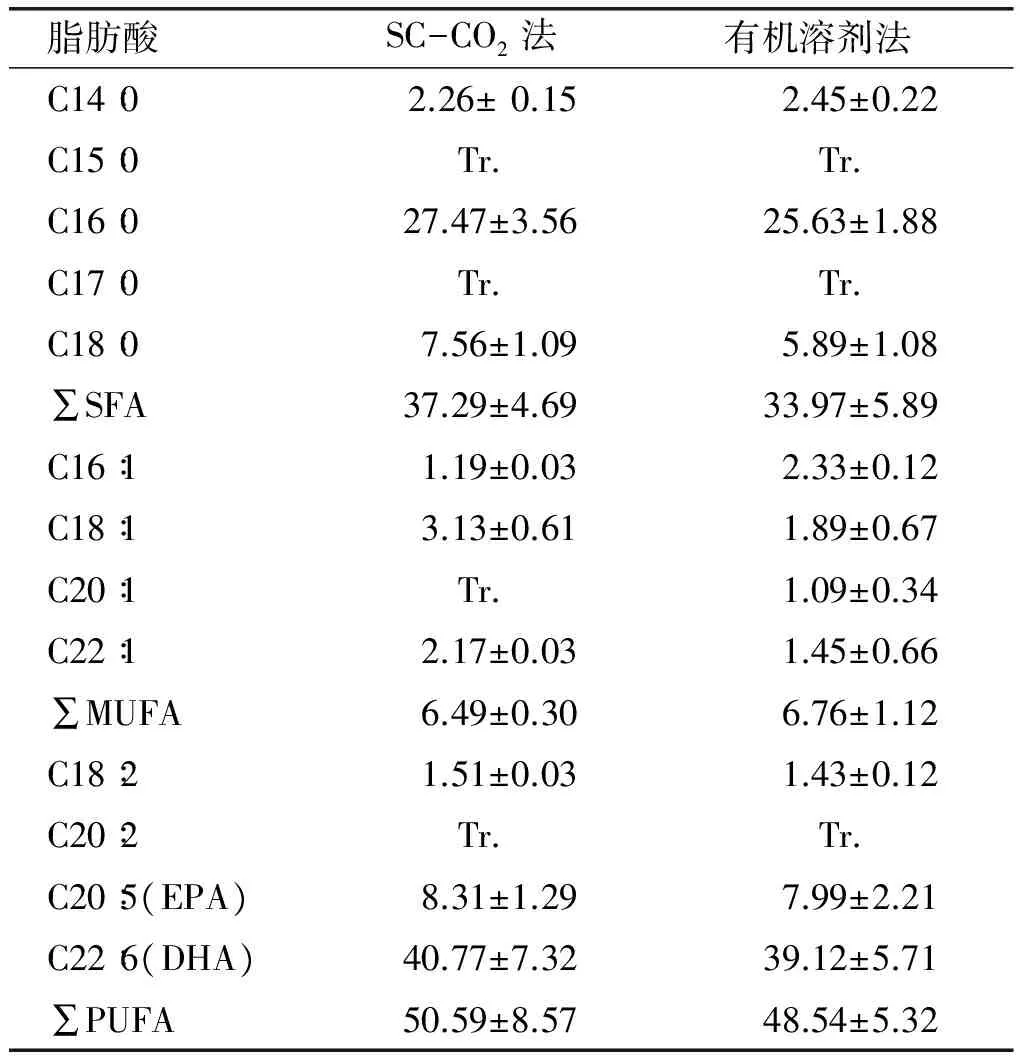
表1 两种方法提取得到秋刀鱼内脏磷脂脂肪酸组成及含量 mg/g
注:SFA为饱和脂肪酸;MUFA为单不饱和脂肪酸;PUFA为多不饱和脂肪酸;Tr.为痕量。下同。
2.2 磷脂中PC和PE组分脂肪酸组成分析
研究室前期的检测结果表明,秋刀鱼内脏磷脂中PC、PE的总量占PC、PE、PI、PS、LPC、LPE几种磷脂组分的64.33%,为秋刀鱼内脏磷脂的重要组成部分。因此,为研究PC、PE对总磷脂脂肪酸的贡献与影响情况,本研究中对PC、PE两种组分进行分离并鉴定其脂肪酸组成。表2中列出SC-CO2法提取的秋刀鱼内脏磷脂再经柱层析分离得PC、PE的脂肪酸组成分析结果。

表2 秋刀鱼内脏磷脂中PC、PE脂肪酸组成及含量 mg/g
注:N.D.为未检出。下同。
从表2可以看出,C16∶0是PC、PE主要的饱和脂肪酸,C20∶1和C22∶1是PC、PE主要的单不饱和脂肪酸,这与研究室之前研究结果秋刀鱼内脏甘油三酯中的脂肪酸组成类似。
PC、PE中DHA和EPA的含量分别占总脂肪酸含量的8.88%和2.89%、7.12%和3.11%,两者脂肪酸组成较为相近,无显著性差异(P>0.05)。楼乔明等[14]通过硅胶柱层析分离得到皱纹盘鲍内脏磷脂中的PC、PE组分,研究其脂肪酸组成,发现从PC、PE中分别检测出0.18%(PC)的DHA以及10.43%和6.53%的EPA。Uddin等[15]从鱿鱼内脏中提取磷脂并通过薄层层析分离得到其中的PC,PE,对其脂肪酸进行研究,发现从PC、PE中分别检测到22.70%和17.60%的DHA以及13.10%和16.40%的EPA。经比较可以看出,秋刀鱼内脏磷脂中的PC、PE组分可以作为良好的DHA和EPA来源。
2.3 磷脂理化指标分析
本研究对于磷脂的理化指标主要检测了酸值、过氧化值、碘值、不皂化物含量和游离脂肪酸,结果如表3所示。
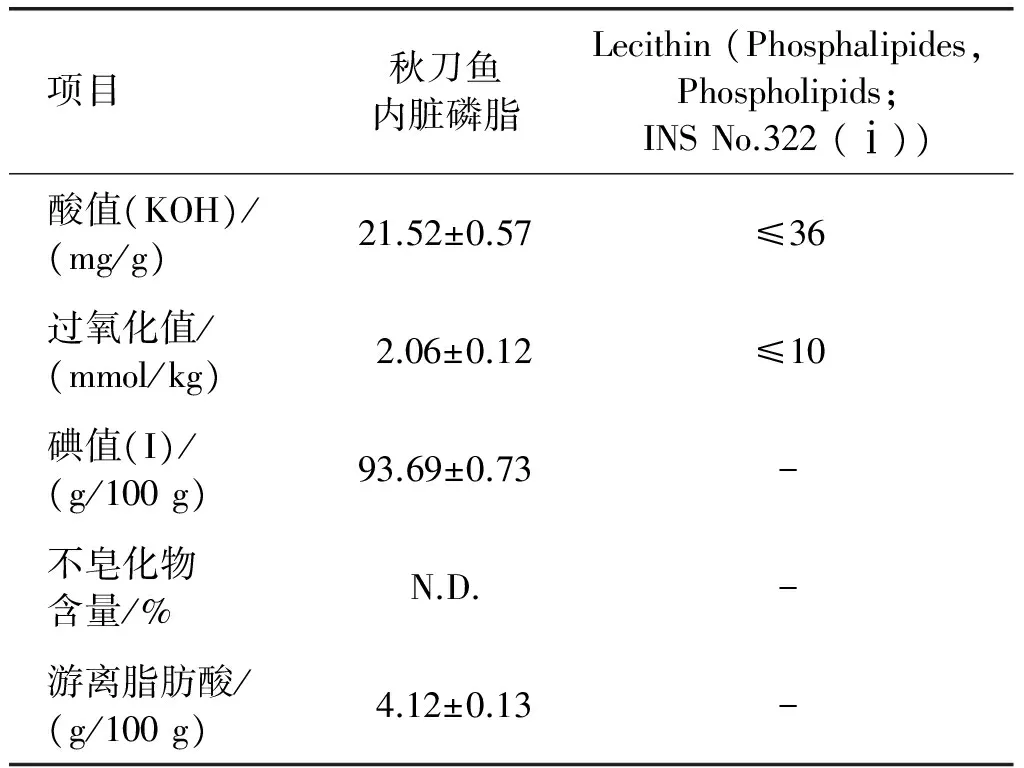
表3 秋刀鱼内脏磷脂理化指标
注:“-”表示标准中无该项。
从表3可以看出,利用SC-CO2法提取的秋刀鱼内脏磷脂的游离脂肪酸含量低,不皂化物未检出,酸值和过氧化值检测结果均符合JECFA标准Lecithin (Phosphalipides, Phospholipids; INS No.322 (ⅰ))的规定。
3 结 论
秋刀鱼内脏所含脂质成分丰富,其中磷脂含量较高。通过对SC-CO2法和有机溶剂法提取所得磷脂的分析比较,SC-CO2法的提取率及脂肪酸总量较有机溶剂法的高,提取时间短;秋刀鱼内脏磷脂中脂肪酸种类丰富,其中EPA和DHA含量较高,尤其是DHA含量占总脂肪酸的40%以上,可以视为良好的DHA及EPA来源;将SC-CO2法得到磷脂中的PC和PE两种组分分离并进一步进行脂肪酸组成分析,两者无显著差异,最主要的脂肪酸都为单不饱和脂肪酸,且DHA和EPA含量丰富;SC-CO2法所得磷脂的酸值、过氧化值均符合JECFA标准Lecithin (Phosphalipides, Phospholipids; INS No.322 (ⅰ))的规定,品质良好。
[1] 叶彬清,陶宁萍,王锡昌,等. 秋刀鱼营养成分分析、贮藏加工及副产物综合利用研究进展[J]. 食品工业科技,2013(22):367-370,374.
[2] 罗海波,陈伟,王锦富,等. 秋刀鱼营养价值及其开发利用研究进展[J]. 水产科学,2016(2):179-184.
[3] 叶彬清,王锡昌,陶宁萍,等. 鱼类副产物利用研究进展[J]. 食品研究与开发,2014(21):15-19.
[4] AKKASIT J, SOOTTAWAT B, WONNOP V, et al. Isolation and characterization of acid and pepsin-solubilised collagens from the skin of Brownstripe red snapper(Lutjanusvitta) [J]. Food Chem, 2005,93(3):475-484.
[5] 赵静,姜国良,田丹. 常见海产动物磷脂研究进展[J]. 食品工业,2011(10):86-89.
[6] 闫媛媛,张康逸,黄健花,等. 磷脂分离、纯化和检测方法的研究进展[J]. 中国油脂,2012,37(5):61-65.
[7] 林洪,吕青, KHALID J,等. 贻贝等六种软体动物磷脂的比较[J].水产学报,2000,24(2):175-179.
[8] HIROAKI S. Identification of noveln-4 series polyunsaturated fatty acids in a deep-sea calm[J].J Chromatogr A, 2007,1163: 247-259.
[9] AOAC.Official methods of analysis of official analytical chemists[M].15th ed. Washington DC: Association of Official Analytical Chemists, 1995.
[11] 王兰,岳荣岩,卢杰,等. 太平洋磷虾脂肪酸的气相色谱-质谱法分析[J]. 现代食品科技,2012(10):1407-1410.
[12] 张丽,殷燕. 金枪鱼脑中磷脂及脂肪酸组成分析[J]. 现代食品,2016(10):91-93.
[13] 卢航, 里慧, 赵景华,等. 利用高效液相色谱-蒸发光检测器法分析鮰鱼脑中磷脂组成[J]. 食品科学, 2015,36(24):177-180.
[14] 楼乔明,杨文鸽,张进杰,等.皱纹盘鲍内脏脂质及其脂肪酸组成分析[J]. 中国食品学报,2013(5):216-222.
[15] UDDIN M, KISHIMURA H, CHUN B S. Isolation and characterization of lecithin from squid (Todarodespacificus)viscera deoiled by supercritical carbon dioxide extraction[J]. J Food Sci, 2011,76(2): 350-354.
ChemicalcharacterizationofPacificsaury(CololabisSaira)visceralecithin
ZHANG Jing1, TAO Ningping1, ZHU Qingcheng2, HUA Chuanxiang2
(1.College of Food Science and Technology, Shanghai Ocean University, Shanghai 201306, China;2.Key Laboratory of Sustainable Exploitation of Oceanic Fisheries Resources, Ministry of Education,National Engineering Research Centre for Oceanic Fisheries, College of Marine Sciences,Shanghai Ocean University, Shanghai 201306, China)
The lecithin in Pacific saury (CololabisSaira) viscera was extracted by supercritical carbon dioxide (SC-CO2) and organic solvent method. Fatty acid compositions and contents of lecithin extracted by the two methods and its phosphatidylcholine (PC) and phosphatidylethanolamine (PE) in lecithin extracted by SC-CO2were determined. Meanwhile, the acid value and peroxide value of Pacific saury viscera lecithin extracted by SC-CO2were detected. The results showed that the extraction rate of Pacific saury viscera lecithin of SC-CO2((23.90±1.10)%, dry basis) was higher than that of organic solvent method ((20.81±1.25)%, dry basis), but they had no significant difference(P>0.05). The total fatty acid content of lecithin obtained by SC-CO2was higher than that of lecithin obtained by organic solvent method. EPA contents in lecithin obtained by SC-CO2and organic solvent method were 8.80% and 8.95%, respectively. DHA contents in lecithin obtained by SC-CO2and organic solvent method were 43.20% and 43.82%, respectively. The fatty acid compositions of PC and PE had no significant difference(P>0.05). The acid value and peroxide value of Pacific saury viscera lecithin were (21.52±0.57)mgKOH/g and (2.06±0.12)mmol/kg, respectively, which met the standard of JECFA Lecithin (Phos-phalipides, Phospholipids; INS No.322 (ⅰ)).
Pacific saury viscera; lecithin; SC-CO2; fatty acid
2016-10-12;
:2017-03-16
国家重点研发计划专项(2016YFD0400202-8);江苏省国家长江珍稀鱼类工程技术研究中心培育点项目(BM2013012)
张 静(1990),女,硕士研究生,研究方向为食品营养与品质评价(E-mail)1185686189@qq.com。
TS254.9;TS225.4
:A
1003-7969(2017)08-0028-05
油脂化学

