QuEChERS-液质联用法测定菜籽油中7种芳氧苯氧丙酸酯类除草剂残留
郭松年,李 玺,房俊房,赵丽莉,徐 驰,成 霈
(西安市产品质量监督检验院,西安710065)
油脂安全
QuEChERS-液质联用法测定菜籽油中7种芳氧苯氧丙酸酯类除草剂残留
郭松年,李 玺,房俊房,赵丽莉,徐 驰,成 霈
(西安市产品质量监督检验院,西安710065)
建立了分散固相萃取(QuEChERS)净化方法结合液质联用(HPLC-MS/MS)检测技术同时测定菜籽油中7种芳氧苯氧丙酸酯类除草剂的方法。结果表明:最优检测条件为采用90%乙腈水溶液提取2次, Supel QuE Z-Sep+分散固相萃取净化,色谱柱为sunshell C18柱(2.6 μm×2.1 mm×100 mm),以乙腈和0.025%乙酸水溶液进行梯度洗脱,MRM模式。在最优检测条件下,除精恶唑禾草灵外6种除草剂线性范围0~100(50)μg/L,相关系数R大于0.999 5,定量限在0.25~2.5 μg/kg之间,回收率在78.3%~95.1%之间,相对标准偏差在0.9%~6.5%之间。方法具有基质效应低、处理简单、准确快速、重复性好的优点,适用于实验室高通量快速检测菜籽油样品。
菜籽油;分散固相萃取;高效液相色谱质谱联用;芳氧苯氧丙酸酯类除草剂
精氟吡甲禾灵、氟吡乙禾灵、喔草酯、精吡氟禾草灵、炔草酯、精喹禾灵、精恶唑禾草灵7种除草剂是我国油料作物使用最多的芳氧苯氧丙酸酯类除草剂[1-2]。我国食品安全标准GB 2763—2014规定了植物油中氟吡甲禾灵的最大限量为1.0 mg/kg,精喹禾灵的最大限量为0.1 mg/kg,而对其他此类除草剂残留限量未做规定。
分散固相萃取(QuEChERS)净化技术从2003年首次被发表于AOAC 期刊后[3], 已被广泛地应用在新鲜果蔬、干燥果蔬、谷物等植物来源样品的农药多残留分析[4]。近年来,采用QuEChERS处理含油量较高的植物样品或植物油测定农药残留的技术发展很快,徐娟等[5]采用乙腈提取、 低温冷冻及C18+乙二胺-N-丙基硅烷(PSA)分散固相萃取净化、LC-MS/MS 测定植物油中 104 种农药残留;王连珠等[6]采用1%乙酸的甲醇溶液提取, Z-Sep+/C18 分散固相萃取净化、LC-MS/MS 测定棕榈原油中敌草快等 6 种农药残留;Tomasz等[7]采用乙腈提取、氧化锆键合硅胶分散固相萃取净化,HPLC-DAD测定21种不同农药残留,而植物油中精氟吡甲禾灵、氟吡乙禾灵、喔草酯等芳氧苯氧丙酸酯类除草剂残留的同时测定方法至今未见报道。
本研究选用适用于处理高脂肪含量样品的碳十八键合锆胶(Z-Sep+)为分散固相萃取剂,以常用7种芳氧苯氧丙酸酯类除草剂为研究对象,与高效液相色谱-串联质谱(HPLC-MS/MS)联用,建立菜籽油中多种农药残留的检测方法,为实验室高通量检测农药残留提供新的方法。
1 材料与方法
1.1 实验材料
1.1.1 原料与试剂
甲醇、乙腈、甲酸、乙酸、甲酸铵、乙酸铵为色谱纯,其他试剂均为分析纯;精氟吡甲禾灵、氟吡乙禾灵、喔草酯、精吡氟禾草灵、炔草酯、精喹禾灵、精恶唑禾草灵(纯度大于98%,德国Dr.Ehrenstorfer GmbH公司)。菜籽油,购于西安市某超市及农贸市场,其中一级菜籽油4种,二级菜籽油6种,四级菜籽油10种,阴性菜籽油样品由最后确定的实验方法选定,为四级菜籽油。
1.1.2 仪器与设备
Supel QuE Z-Sep+分散固相萃取管(美国Supelco公司);API3200三重四级杆串联质谱仪(美国AB公司),配电喷雾离子源;HPLC-20AD高效液相色谱系统(日本岛津公司);Analyst1.6工作站(美国AB公司);Milli-Q高纯水发生器(美国Millipore公司);KH5200超声波清洗器;Anke GL-20G高速离心机;涡旋振荡器(德国IKA公司)。
1.2 实验方法
1.2.1 样品处理
称取2. 00 g均质试样于10 mL具塞离心管中,加入5.0 mL 90%乙腈水溶液,涡旋3 min,4 000 r/min 离心5 min,吸取上清液;按上述方法再提取1次,合并2次提取液,-18℃冷冻2 h,室温解冻后,4 000 r/min离心5 min,取上层溶液1.0 mL加入Z-Sep+分散固相萃取管,涡旋1 min,10 000 r/min离心5 min,取0.5 mL净化液至玻璃小管中,再加0.5 mL水混匀,经0.22 μm微孔膜过滤后供HPLC-MS/MS分析。
1.2.2 HPLC-MS/MS 分析条件
色谱条件:sunshell C18色谱柱(2.6 μm×2.1 mm×100 mm);柱温38℃;进样体积10 μL;流速0.25 mL/min;流动相,A为0.025%乙酸,B为乙腈,梯度条件为56%B(0 min),56%B(13 min),96%B(13.5 min),56%B(16.5 min),56%B(20.0 min)。
质谱条件:离子源为电喷雾源;正离子模式扫描;喷雾电压5 500 V;辅助气温度650℃;碰撞气设置Medium。
1.2.3 标准溶液配制及基质效应评估方法
分别称取7种除草剂标准品,以乙腈配制成400~750 mg/L的标准储备液,分别吸取一定量的标准储备液,用乙腈配制成10 mg/L的加标用母液;将标准储备液以50%乙腈水溶液分别逐级稀释为0.5~1 mg/L的单一标准溶液作为质谱调谐用标液;分别吸取一定量的标准储备液用50%乙腈水溶液配制成1 mg/L混合标准储备液,此混合标准储备液可以使用3个月,将混合标准储备液以50%乙腈水溶液逐级稀释为0、1、10、50、100 μg/L的标准溶液,此标准溶液可以使用2周。
分别以下列方法建立标准曲线并按如下公式计算基准效应:
(1)由标准溶液建立的标准曲线,分别以0、1、10、50、100 μg/L的标准溶液上机建立标准曲线(SCC)。
(2)基质匹配标准曲线,以1.2.1方法处理阴性样品,将步骤中“再加0.5 mL水混匀”改为“再加0.5 mL 标准溶液”,分别配制成质量浓度为0、1、10、50、100 μg/L的基质匹配标准溶液,上机测定,建立基质匹配标准曲线(MCC)。
1.2.4 回收率测定样品配制
吸取10 mg/L的加标用母液适量,放入烧杯中,38℃下氮气吹干,加入阴性样品,定量为100 μg/kg的加标母液,搅拌5 min,再用阴性样品定量成不同含量的加标样品。
2 结果与讨论
2.1 质谱参数选择
将质量浓度为0.5~1 mg/L的调谐用标液用针泵进样器注入质谱,采用ESI+模式,由全扫描模式分别确定各待测农药的母离子,然后用产物离子扫描方式,对选定的母离子进行扫描,调整相应参数,确定子离子;对选定的子离子在MRM模式下分别优化DP、EP、CE 和CXP等参数,使被测离子灵敏度最高,目标物优化的质谱参数见表1。样品测定采用MRM模式。
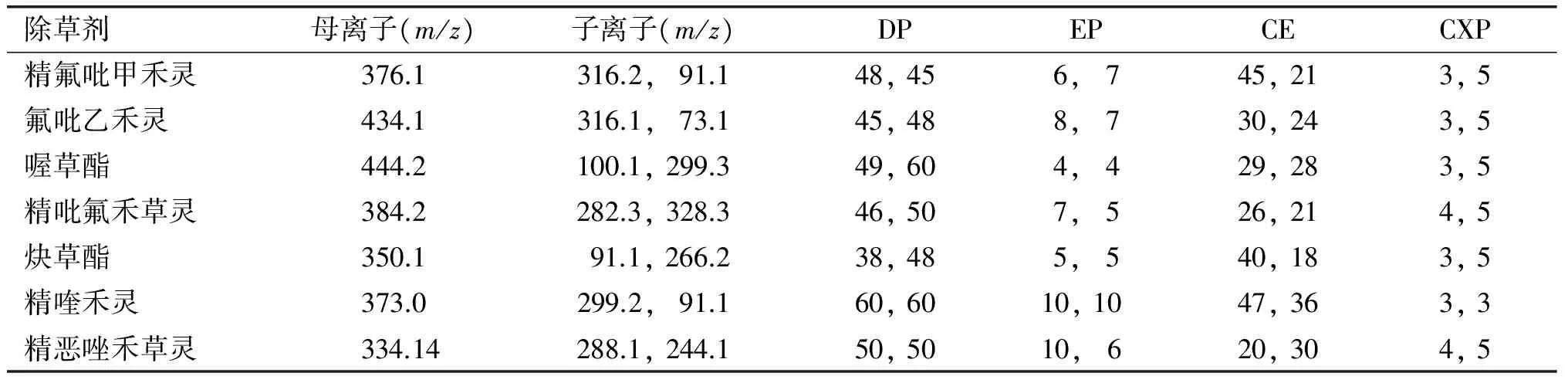
表1 7种除草剂的质谱参数
2.2 色谱条件的优化
分别采用①MG Capcell pak 5 μm×3.0 mm×150 mm、②BEH 2.1 mm×1.7 μm×100 mm、③sunshell C18 2.6 μm×2.1 mm×100 mm、④IF 2 μm ×2.0 mm×100 mm色谱柱测定标准混合溶液,改变流动相比例等色谱条件,结果①④都不能很好地将所有待测物分开,②柱压太高,在0.25 mL/min流速下接近色谱系统的临界压力极限,且分离效果有待继续优化,③的分离效果较好,其采用了核壳技术,具有分离速度快、柱效高,能使普通HPLC仪器达到UPLC的分离效果。分别采用乙腈-水和甲醇-水作为流动相对标准溶液进行洗脱,分别改变色谱条件,结果显示,采用甲醇-水洗脱时间大于40 min,并且分离效果不好,而采用乙腈-水作为流动相洗脱时能在20 min内较好地对待测物质进行分离。流动相中加入少量甲酸或乙酸可降低色谱柱残余硅羟基的活性,对于碱性化合物有较好的峰形,而且在正离子电离模式下加入甲酸或乙酸有利于目标化合物离子化,从而提高化合物响应值;本实验中尝试加入不同体积分数的甲酸、乙酸、甲酸铵、乙酸铵,结果加入0.025%乙酸能有效改善峰形,各待测物质分离充分,并且能有效地提高精恶唑禾草灵的响应值。在最优色谱质谱条件下各待测物质的色谱图如图1所示,各待测物质基本达到了基线分离,更有利于对分析物的定性和定量。

注:1.精恶唑禾草灵;2.炔草酯;3.精喹禾灵;4.精氟吡甲禾灵;5.精吡氟禾草灵;6.氟吡乙禾灵;7.喔草酯。
图17种除草剂的分离效果图
2.3 提取方法的优化
2.3.1 提取液的选择
对植物样品中农药残留测定常用的萃取溶剂有乙腈、甲醇、丙酮、乙酸乙酯、正己烷等[8],而用于植物油等脂肪含量高的农药残留测定最常使用的提取液为甲醇和乙腈。本实验分别采用甲醇、乙腈、甲醇-乙腈(体积比1∶1)等对加标菜籽油进行提取,在20 μg/kg添加水平下7种除草剂的回收率见表2。
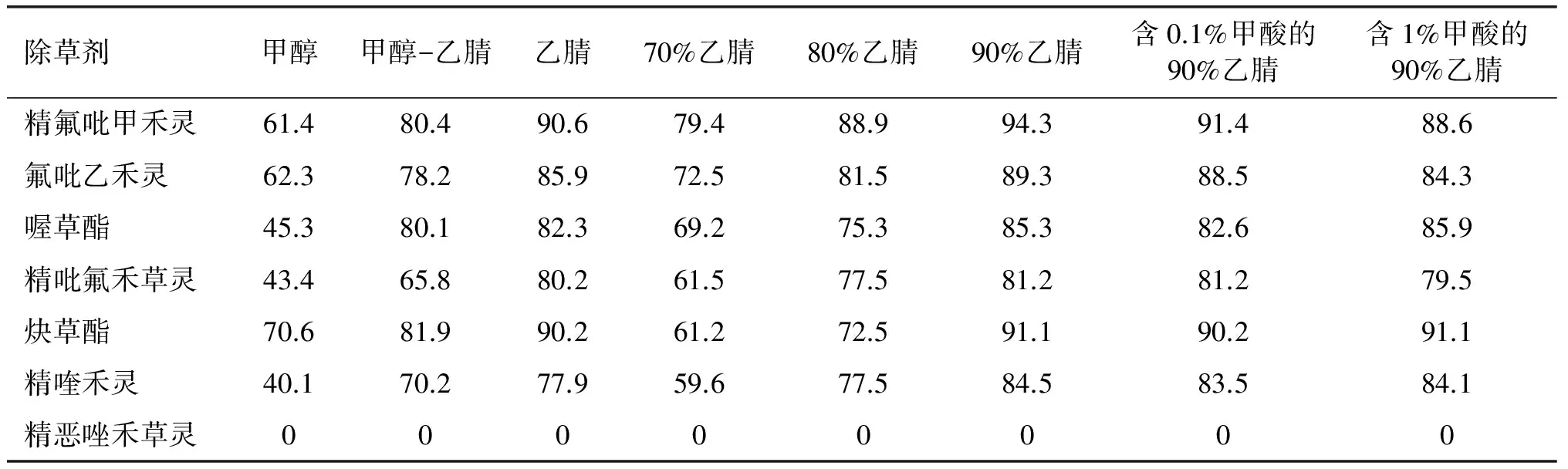
表2 20 μg/kg添加水平下7种除草剂的回收率比较 %
由表2可知,采用乙腈时各除草剂的回收率比甲醇和甲醇-乙腈(体积比1∶1)提取的回收率明显增高。在此基础上分别采用不同体积分数乙腈水溶液进行提取,采用90%乙腈水溶液的回收率最高。乙腈中加入适量的水后,其极性增大,油脂中的极性接近乙腈的非极性物质进入提取液减少,有利于后续净化处理。很多文献中提出在提取时加入适量的甲酸会提高回收率[9-11],常用的甲酸体积分数为0.1%或1%。本实验结果表明,加入0.1%甲酸各种除草剂的回收率基本都下降,加入1%甲酸后喔草酯和炔草酯回收率基本不变外,其他除草剂的回收率均不同程度降低。综上,选择90%乙腈水溶液作为本实验的提取溶剂。
为了能最大限度地减少油脂进入提取液,本实验采用冷冻方式除去部分提取液中的油脂,参考徐娟[5]、Bienvenida[12]等方法,在-18℃将提取液冷冻2 h除去油脂。
精恶唑禾草灵的回收率全部为零,经标准溶液以所用Supel QuE Z-Sep+分散固相萃取管直接实验,其对精恶唑禾草灵吸附完全和前处理其他因素无关,故此除草剂不能用该前处理方法,后续实验只研究其他6种除草剂。
2.3.2 提取次数的选择
取加标20 μg/kg菜籽油2.0 g,以90%乙腈水溶液分别提取1、2、3次,研究提取次数对回收率的影响,结果如图2所示。
由图2可知,提取2次后各除草剂回收率比提取1次均有较大的增加,提取3次时喔草酯和炔草酯比提取2次时回收率分别从78.3%和89.2%增加到83.6%和93.1%,分别增加5.3个百分点和3.9个百分点,其他除草剂回收率基本没有变化。综合考虑实验前处理的烦琐程度和回收率情况,本实验确定提取次数为2次。

注:1.精氟吡甲禾灵;2.氟吡乙禾灵;3.喔草酯;4.精吡氟禾草灵;5.炔草酯;6.精喹禾灵。
图2提取次数对回收率的影响
2.4 线性范围与基质效应
各除草剂标准溶液的线性范围、相关系数及菜籽油对各除草剂的基质效应见表3。
由表3可知,精吡氟禾草灵的线性范围为0~50 μg/L,其他除草剂在0~100 μg/L范围内线性良好,各标准曲线的相关系数均大于0.999 5。在食品液质联用分析中,乳粉、蔬菜,茶叶、肉、油脂等基质复杂样品常会对质谱离子化效率产生影响,使测定结果和标准溶液测定值发生偏离,一般情况下减小,这种现象叫基质效应。当基质效应小于20%时为弱基质效应,可忽略不计,基质效应范围在20%~50%时为中等基质效应,当基质效应大于50%时,为强基质效应,中等、强基质效应时一般采用基质加标的方法进行补偿。本研究中菜籽油对各除草剂的基质效应测定结果见表3。由表3可知, 6种除草剂的基质效应范围为1.9%~9.9%,属于弱基质效应,完全可以忽略不计。
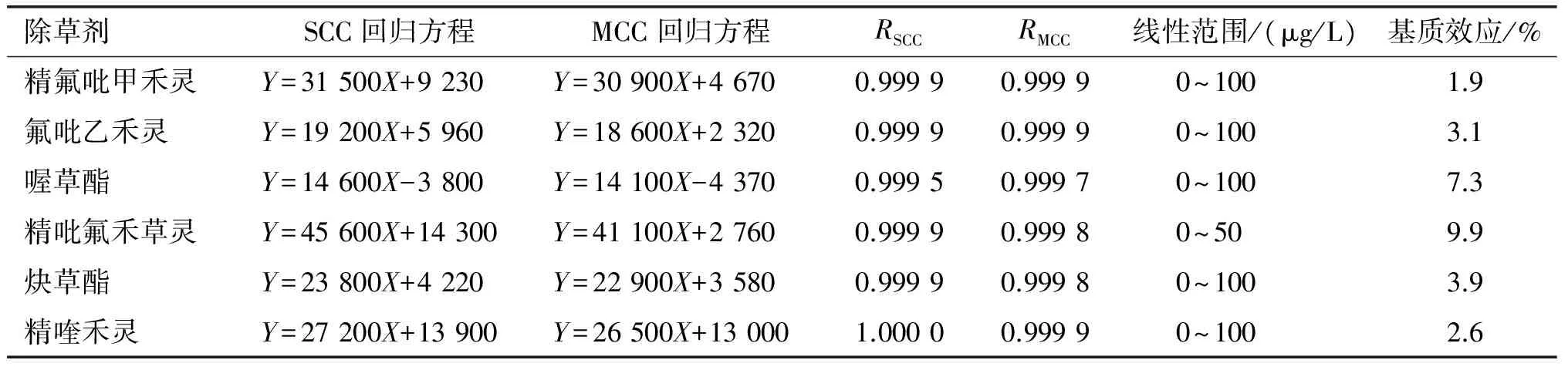
表3 线性范围和基质效应
注:Y,峰面积;X,质量浓度。
2.5 检出限、定量限、回收率与相对标准偏差
以10 μg/kg加标四级菜籽油为样品进行处理,上机测定其信噪比,分别以3倍和10倍信噪比考察方法的检出限、定量限。以四级菜籽油分别配制含量为20、50、100 μg/kg的6种除草剂的混合加标样品,进行回收率和相对标准偏差测定,结果见表4。
由表4可知,各除草剂的检出限在0.08~0.76 μg/kg之间,定量限在0.25~2.50 μg/kg之间。实验测试了进样量20 μL的情况,线性依旧良好,根据测定需要,检出限和定量限还可以减小一半。6种除草剂的回收率在78.3%~95.1%之间,相对标准偏差在0.9%~6.5%之间,符合GB/T 27404—2008的要求。

表4 方法检出限、定量限、回收率和相对标准偏差(RSD)(n=6)
2.6 实际样品测试
将20种菜籽油按实验确定的方法进行检测,20种样品均未检测出6种除草剂,而精氟吡甲禾灵等芳氧苯氧丙酸酯类除草剂在我国油菜的种植中广泛使用,说明芳氧苯氧丙酸酯类除草剂很少被油菜籽吸收,此类除草剂对油菜籽相对安全。
3 结 论
本研究通过对色谱分离技术和前处理方法进行优化,建立了分散固相萃取(QuEChERS)净化结合液质联用(HPLC-MS/MS)检测技术同时测定菜籽油中7种芳氧苯氧丙酸酯类除草剂的方法。采用90%乙腈水溶液提取2次, Supel QuE Z-Sep+分散固相萃取净化,液相色谱-电喷雾正离子电离-三重四级杆串联质谱测定,该方法具有基质效应低、处理简单、准确快速、重复性好的优点,适用于实验室高通量快速检测菜籽油样品,亦可用于其他常用食用油的日常检测工作。
[1] 赵增运,徐星,沈伟健,等. 固相萃取气相色谱串联质谱法测定食品中8种芳氧苯氧丙酸酯类除草剂的残留量 [J].质谱学报,2010,31(5):306-312.
[2] 刘博宏,叶非. 芳氧苯氧丙酸酯类除草剂的应用进展 [J].农药科学管理, 2011,32(2):20-25.
[3] ANASTASSIADES M, LEHOTAY S J, STAJNBAHER D, et al. Fast and easy multiresidue method employing acetonitrileextraction/partitioning and ‘dispersive solid phase extraction’ for the determination of pesticide residues in produce[J]. J Aoac Int,2003,86(2):412-431.
[4] 林逸柔,邱群惠,方嘉佑,等. QuEChERS 与串联质谱于蔬果中农药多重残留分析之应用[J].长庚科技学刊,2015, 22(7):89-98.
[5] 徐娟,王岚,黄华军,等. 低温冷冻及分散固相萃取净化-超高效液相色谱-串联质谱法测定植物油中104 种农药残留[J].色谱,2015,33(3):242-249.
[6] 王连珠,李晓莲,方恩华,等. QuEChERS -液相色谱-串联质谱法测定棕榈原油中敌草快等 6 种农药残留 [J].色谱,2016,34(7):686-691.
[7] TOMASZ T,TOMASZ R. Application of HPLC-DAD after SPE/QuEChERS with ZrO2-based sorbent in d-SPE clean-up step for pesticide analysis in edible oils[J]. Food Chem,2016,190(1):71-79.
[8] GONZALEZ C M A, SOCAS R B, HERRERA H A V,et al. Evolution and applications of the QuEChERS method [J].Trends Anal Chem,2015,71(91):169-185.
[9] GONZALEZ C M A,LEHOTAY S J,HERNANDEZ B J,et al. Use of ammonium formate in QuEChERS for highthroughput analysis of pesticides in food by fast, low-pressure gas chromatography and liquid chromatography tandem mass spectrometry[J].J Chromatogr A,2014,1358 (5):75-84.
[10] GONZALEZ C M A, HERNANDEZ B S J, BORGES M T M,et al. Determination of pesticides and their metabolites in processed cereal samples[J]. Food Addit Contam, 2011,29(1):104-116.
[11] CHUNG S W C,CHAN B T P. Validation and use of a fast sample preparation method and liquid chromatography-tandem mass spectrometry in analysis of ultra-trace levels of 98 organophosphorus pesticide and carbamate residues in a total diet study involving diversified food types[J].J Chromatogr A ,2010,1217(2):4815-4824.
[12] BIENVENIDA G L,JUAN F G,ANTONIO M D. Sample treatment and determination of pesticide residues in fatty vegetable matrices: a review[J].Talanta,2009,79(2):109-128.
DeterminationofsevenaryloxyphenoxypropionateherbicidesresiduesinrapeseedoilbyQuEChERS-liquidchromatography/tandemmassspectrometry
GUO Songnian,LI Xi,FANG Junfang,ZHAO Lili, XU Chi, CHENG Pei
(Xi’an Supervision & Inspection Institute of Product Quality,Xi’an 710065,China)
A QuEChERS- liquid chromatography/tandem mass spectrometry to determine seven aryloxyphenoxypropionate herbicides in rapeseed oil was developed. The results showed that the optimal detection conditions were obtained as follows:samples extracted by 90% acetonitrile water solution for twice, extractive purified by Supel QuE Z-Sep and dispersive solid-phase extraction, chromatography column sunshell C18(2.6 μm×2.1 mm×100 mm); mobile phase acetonitrile and 0.025% acetic acid water solution, gradient elution, MRM method. Under the optimal detection conditions, except for fenoxaprop-ethyl, the calibration curve was linear in the range of 0-100(50) μg/L andR>0.999 5, and the limit of quantitation was in the range of 0.25-2.5 μg/kg. The recovery rate and relative standard deviation were in the range of 78.3%-95.1% and 0.9%-6.5%, respectively. The method had advantages of low matrix effect, easy sample handling, accuracy, rapidness, and good reproducibility, and could be used as a high throughput and rapid detection method for rapeseed oil in lab.
rapeseed oil;QuEChERS; HPLC-MS/MS; aryloxyphenoxypropionate herbicides
2017-03-10;
:2017-05-30
国家质量监督检验检疫总局科技计划项目(2014QK133)
郭松年(1971),男,高级工程师,博士,主要从事食品仪器分析工作(E-mail)271535565@qq.com。
TS227; O658
:A
1003-7969(2017)08-0071-05

