温度对裂殖壶菌S31中FAS及PKS基因转录水平的影响
娄 菲,张 涛,刘睿杰,常 明,金青哲,王兴国
(江南大学 食品学院,食品科学与技术国家重点实验室,食品营养与安全协同创新中心,江苏 无锡 214122)
温度对裂殖壶菌S31中FAS及PKS基因转录水平的影响
娄 菲,张 涛,刘睿杰,常 明,金青哲,王兴国
(江南大学 食品学院,食品科学与技术国家重点实验室,食品营养与安全协同创新中心,江苏 无锡 214122)
以甘油为碳源,测定了摇瓶中裂殖壶菌S31进入脂质积累期后,温度对胞内油脂脂肪酸组成以及FAS和PKS基因转录水平的影响。结果表明:当裂殖壶菌进入脂质积累阶段后,提高发酵温度到30℃会减少藻油中DHA的含量,FAS基因的转录水平比PKS基因的更高;同时,降低发酵温度到20℃会提高裂殖壶菌S31藻油DHA的含量,PKS基因的转录水平显著高于FAS基因的。实验结果表明,温度对PKS和FAS基因的转录水平有显著的影响,从而决定裂殖壶菌S31中藻油脂肪酸组成的变化。
裂殖壶菌;DHA;FAS;PKS;转录调控
DHA(C22∶6)是一种重要的n-3系列多不饱和脂肪酸,被许多医学研究认定为必需营养成分[1-4]。很多破囊弧菌菌株可以积累大量的甘油三酯(50%~80%干菌质量),且其中多不饱和脂肪酸的比例尤其是DHA和DPA(C22∶5,n-6)非常高[5]。目前普遍认为破囊弧菌中存在两条多不饱和脂肪酸(PUFAs)的合成途径,其一是“标准”途径,在此途径中PUFAs是由C14∶0经一系列的延长酶和去饱和酶作用合成的[6]。这个过程需要氧分子的参与,因此又叫需氧DHA生物合成途径[7]。另一途径为PKS途径,它不需要氧分子的参与把双键加到已有的酰基链上,而是在脂肪酸合成的过程中直接引进的,因此又称为“厌氧”PKS途径[8]。
裂殖壶菌S31属于破囊弧菌的一种,可以产生超过40%的DHA和DPA[9]。有研究表明在裂殖壶菌S31体内厌氧PKS途径才是合成DHA和DPA的唯一途径[10]。作为PKS途径的补充,FAS途径则是负责其他饱和脂肪酸的合成。并且这两条途径存在竞争关系,因为两者有重合的反应,并且会竞争相同的底物如丙二酰辅酶A或者NADPH来合成相应的脂肪酸[11]。
温度作为发酵过程中的一个重要影响因素,已经被广泛应用以提高DHA含量[12]。低温会使藻油中多不饱和脂肪酸的含量增加,但低温同时会抑制细胞生长,降低发酵产量。因此,有人已经尝试两阶段温度控制发酵实验。当采用裂殖壶菌HX-308在30℃条件下发酵32 h然后转到20℃条件下发酵12 h,DHA的含量可以达到51.98%[13]。然而,对于其准确调控机制却知之甚少,这也阻碍了进一步利用该机制继续扩大藻油中DHA含量的相关研究。转录分析是了解基因表达调控机制的基础,能够为环境响应机制以及细胞应答机制提供更为深入的见解。因此,本文通过在不同发酵温度条件下对裂殖壶菌S31中FAS及PKS脂肪合成酶系的基因转录水平进行系统研究,阐明其调控脂肪酸合成的分子机制。
1 材料与方法
1.1 实验材料
裂殖壶菌S31,由美国标准菌库(ATCC)获得,并保存在ATCC790By+培养基中(人工海水中包含:5 g/L 葡萄糖,1.0 g/L酵母提取物及1.0 g/L胨)。
种子培养基:葡萄糖,30 g/L;氯化钠,0.3 g/L;酵母膏,5 g/L;硫酸钠,15 g/L;硫酸钾,1 g/L;谷氨酸钠,5 g/L;磷酸氢二钾,2 g/L;七水硫酸镁,3 g/L;磷酸二氢钾,3 g/L;氯化钙,0.02 g/L;维生素B1,0.005 g/L;维生素B6,0.002 g/L;维生素B12,0.005 g/L。
发酵培养基:甘油,100 g/L;酵母提取物,10 g/L;NaCl,0.3 g/L;硫酸钠,15 g/L;谷氨酸钠,15 g/L;硫酸钾,1 g/L;七水硫酸镁,4 g/L;磷酸二氢钾,0.1 g/L;氯化钙,0.05 g/L;维生素B1,0.008 g/L;维生素B6,0.002 g/L;维生素B12,0.008 g/L。
1.2 实验方法
1.2.1 摇瓶发酵培养
由于不同初始细胞数会严重影响之后的油脂合成及DHA含量[14],两组摇瓶均控制在25℃以使其达到相同的细胞数。当氮源耗尽进入油脂合成阶段时,将其中一组的发酵温度上调为30℃,另一组下调为20℃。当残余碳源含量低于15 g/L时,发酵停止。
细胞干重、总脂含量、脂肪酸组成、甘油质量浓度及氨基氮质量浓度的测定方法参考文献[15]。以上指标均重复测定3次,取平均值加标准偏差。
1.2.2 RNA提取及反转录
取5 g发酵液在4℃条件下6 000 r/min离心10 min。弃上清,迅速将下层细胞浸入液氮速冻1 min,然后转移到-80℃冰箱。总RNA采用SV总RNA提取试剂盒(Promega,USA)按说明书操作。残余的基因组DNA污染采用10单位的DNAse I(Takara,China)在37℃下30 min,然后在80℃下5 min 使DNAse失活的方法去除。用目标基因及参照基因引物,采用RNA-PCR的方法证明RNA样品不存在基因组DNA污染。RNA的反转录采用Tiangen反转录试剂盒按照说明书条件操作(Tiangen,China)。
1.2.3 实时荧光定量PCR(RT-qPCR)
目标基因及参照基因的mRNA水平通过RT-qPCR方法,采用SYBR Green染料法测定。RT-qPCR采用CFX-96 TM系统(Bio-Rad,USA)的96孔板。
基因的相对表达水平采用ΔΔCT法。计算方法如下:基因的表达水平是与参照基因β-actin 作比较的,ΔCT=CT(目标基因)-CT(β-actin)。对照组(25℃)的基因表达水平与调控组(30℃或20℃)作比较,ΔΔCT=ΔCT(调控组)-ΔCT(对照组)。相对表达水平表示为2-ΔΔCT。每个样品测定3次,取其平均值加标准偏差。
1.2.4 引物列表
PKS的3个亚基分别由3个基因编码而成,FAS是单一蛋白。引物序列如表1所示。

表1 PKS(PFA1,PFA2及PFA3),FAS及ACT基因引物序列
2 结果与讨论
2.1 温度调节后摇瓶内的菌体生长、脂质积累及脂肪酸组成
初始发酵温度控制在25℃条件下发酵72 h氮源耗尽,标志着菌体进入脂质积累阶段。然后将其中一组温度上调为30℃,另一组下调为20℃。当温度上调为30℃时,甘油及氨基氮的消耗速度均呈现增长趋势,如图1所示。

图1 温度上调为30℃发酵情况
由图1可知,当甘油质量浓度降低为13.2 g/L时,发酵停止,细胞干重达到20.6 g/L且总脂含量为40.99%。而对于温度下调组,温度下调后甘油及氨基氮的消耗速度均减慢,如图2所示。
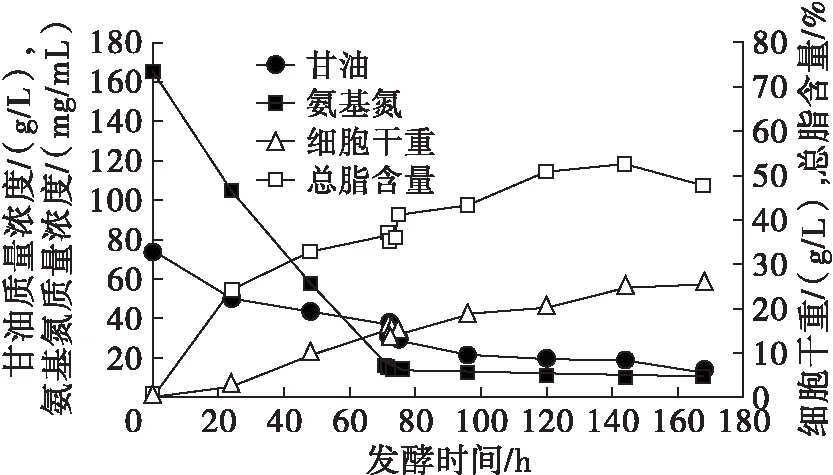
图2 温度下调为20℃发酵情况
由图2可知,当甘油质量浓度为12.4 g/L时发酵停止,细胞干重达到25.5 g/L且总脂含量达到47.72%。
调节温度后,细胞脂肪酸组成及含量也表现出相应的变化,见表2、表3。通常将PFAS定义为除DHA和DPA之外的其他脂肪酸。在本研究中,将PPKS定义为DHA和DPA之和。由表2可知,当采用30℃的发酵温度下,随着发酵时间的延长,PFAS升高而PPKS降低。由表3可知,在20℃的发酵温度下,随着发酵时间延长,PFAS下降而PPKS不断上升。
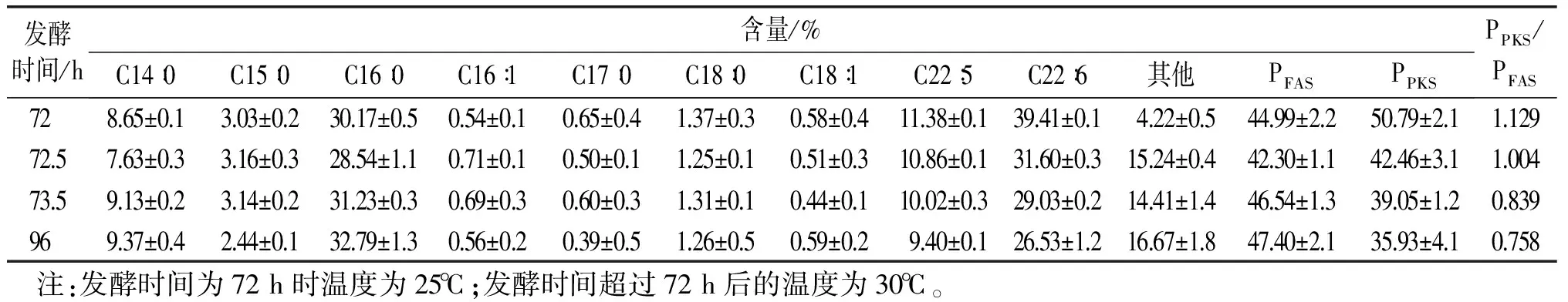
表2 温度上调为30℃组的脂肪酸组成及含量
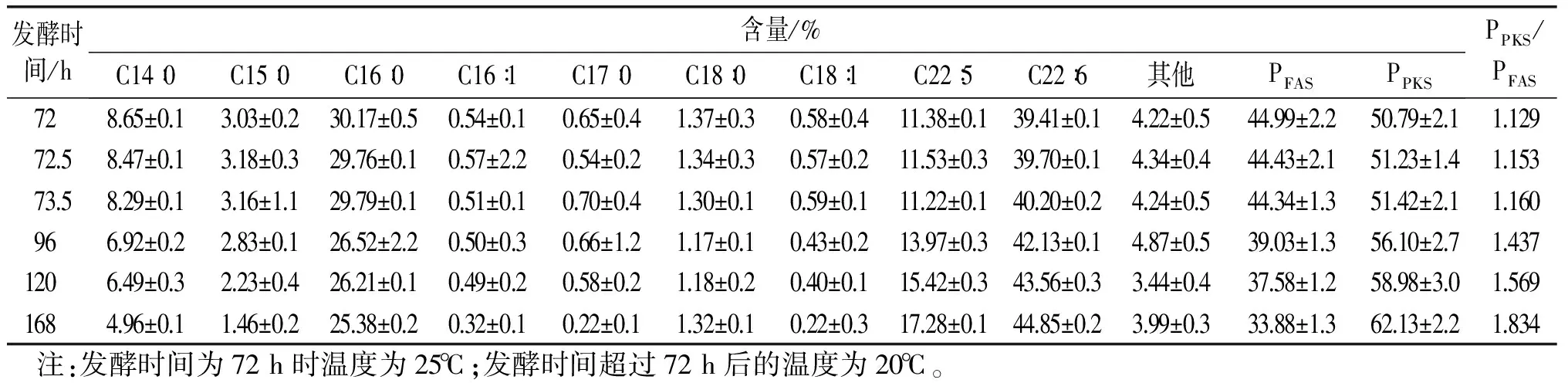
表3 温度下调为20℃组的脂肪酸组成及含量
2.2 摇瓶发酵温度调节后FAS及PKS基因的转录水平变化
目标基因的mRNA水平的变化是由RT-qPCR测定的。发酵72 h进入脂质积累阶段后调节温度,各基因的表达情况如图3、图4所示。
由图3可知,对于温度上调组(30℃),发酵时间为72.5 h时,FAS基因的转录水平降低为原来的32%,而PFA2和PFA3分别降低为原来的29%及32%;而在发酵时间为75 h时,FAS扩大为原来的3倍,而PFA1只有原来的80%。因此,在温度上调的过程中,FAS基因相比PKS基因更有优势。
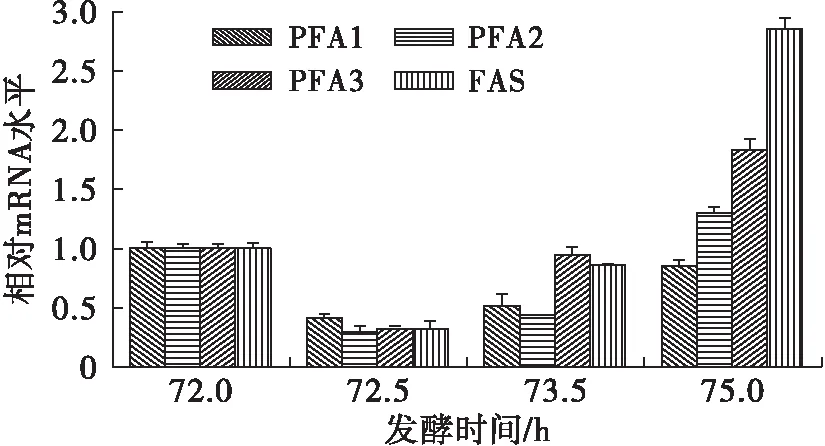
图3 温度上调为30℃后各基因表达情况
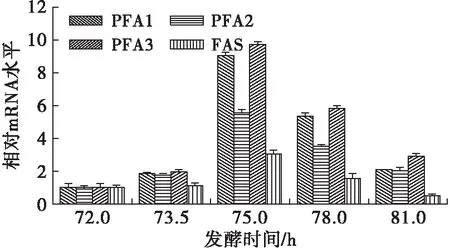
图4 温度下调为20℃后各基因表达情况
由图4可知,对于温度下调组(20℃),发酵时间为73.5 h时,PFA1、PFA2及PFA3的表达水平均增长为原来的2倍,而FAS基因的表达水平却没有表现出明显的变化;在发酵时间为75 h时,PFA1和PFA3分别迅速增长为原来的9倍及10倍,而FAS基因增长为原来的3倍;在发酵时间超过75 h后,所有目标基因的表达水平均有所下降,但PKS基因相对FAS基因仍具有明显优势。
在此过程中,PFA1、PFA2及PFA3表现出了不同的变化趋势,这或许可以解释为3个亚基在脂肪酸合成过程中起着不同的作用。可以肯定的是,3个亚基对于维持PKS基因的完整功能是不可或缺的。
3 结 论
通常来说,较低的发酵温度不利于菌体的生长,却会提高油脂中不饱和脂肪酸的含量,因此两阶段温度控制策略被广泛用来提高藻油中DHA的含量。本研究解释了改变发酵温度条件如何影响DHA含量,即其分子生物学调控机制。当发酵温度升高时,FAS基因比PKS基因更具优势;而当发酵温度降低时,PKS基因相比FAS基因更具优势。同时,脂肪酸组成的变化情况也与之相吻合。因此推测,裂殖壶菌S31通过调整脂肪酸组成来适应外部环境如温度的变化,而这一生物学过程至少部分是由FAS基因和PKS基因共同转录调控的。
除了温度之外,还有很多其他因素例如碳源、溶氧及金属离子等影响着DHA的生物合成,并且与FAS基因和PKS基因的表达水平有关。因此,后期可以进行更多这些因素与基因表达情况之间关系的研究。同时了解分子层面的调控机制之后,可以尝试采用基因工程手段使PKS基因过表达同时抑制FAS基因的表达或通过一定的手段使其不表达来进一步提高油脂中DHA的基因。
[1] 曹万新, 孟橘, 田玉霞. DHA 的生理功能及应用研究进展[J]. 中国油脂, 2011, 36(3): 1-4.
[2] CRAWFORD M A, CRAWFORD M A, COSTELOE K, et al. Are deficits of arachidonic and docosahexaenoic acids responsible for the neural and vascular complications of preterm babies?[J]. Am J Clin Nutr, 1997, 66(4): 1032S-1041S.
[3] HORROCKS L A, YEO Y K. Health benefits of docosahexaenoic acid (DHA)[J]. Pharmacol Res, 1999, 40(3): 211-225.
[4] UAUY R, HOFFMAN D R, PEIRANO P, et al. Essential fatty acids in visual and brain development[J]. Lipids, 2001, 36(9): 885-895.
[5] 孙冠男, 任路静, 瞿亮, 等. 裂殖壶菌单细胞油脂的组分特性分析[J]. 中国油脂, 2013, 38(6): 70-73.
[6] KANG D H, ANBU P, KIM W H, et al. Coexpression of Elo-like enzyme and Δ5, Δ4-desaturases derived fromThraustochytriumaureumATCC 34304 and the production of DHA and DPA inPichiapastoris[J]. Biotechnol Bioproc E, 2008, 13(4): 483-490.
[7] QIU X. Biosynthesis of docosahexaenoic acid (DHA, 22∶6-4, 7, 10, 13, 16, 19): two distinct pathways[J]. Prostag Leukotr ESS, 2003, 68(2): 181-186.
[8] METZ J G, ROESSLER P, FACCIOTTI D, et al. Production of polyunsaturated fatty acids by polyketide synthases in both prokaryotes and eukaryotes[J]. Science, 2001, 293(5528): 290-293.
[9] RATLEDGE C. Fatty acid biosynthesis in microorganisms being used for single cell oil production[J]. Biochimie, 2004, 86(11): 807-815.
[10] LIPPMEIER J C, CRAWFORD K S, OWEN C B, et al. Characterization of both polyunsaturated fatty acid biosynthetic pathways inSchizochytriumsp.[J]. Lipids, 2009, 44(7): 621-630.
[11] HAUVERMALE A, KUNER J, ROSENZWEIG B, et al. Fatty acid production inSchizochytriumsp.: involvement of a polyunsaturated fatty acid synthase and a type I fatty acid synthase[J]. Lipids, 2006, 41(8): 739-747.
[12] 王澍, 吕小义, 张静雯, 等. 不同碳氮源浓度和培养温度对裂殖壶菌产 DHA 的影响[J]. 中国油脂, 2015, 40(10): 74-77.
[13] ZENG Y, JI X J, LIAN M, et al. Development of a temperature shift strategy for efficient docosahexaenoic acid production by a marine fungoid protist,Schizochytriumsp. HX-308[J]. Appl Biochem Biotech, 2011, 164(3): 249-55.
[14] CHI Z, LIU Y, FREAR C, et al. Study of a two-stage growth of DHA-producing marine algaeSchizochytriumlimacinumSR21 with shifting dissolved oxygen level[J]. Appl Microbiol Biotechnol, 2009, 81(6): 1141-1148.
[15] CHANG G, GAO N, TIAN G, et al. Improvement of docosahexaenoic acid production on glycerol bySchizochytriumsp. S31 with constantly high oxygen transfer coefficient[J]. Bioresour Technol, 2013, 142: 400-406.
InfluenceoftemperatureonFASandPKSgenestranscriptionlevelsofSchizochytriumsp.S31
LOU Fei, ZHANG Tao, LIU Ruijie, CHANG Ming, JIN Qingzhe, WANG Xingguo
(Synergetic Innovation Center of Food Safety and Nutrition, State Key Laboratory of Food Science and Technology, School of Food Science and Technology, Jiangnan University, Wuxi 214122, Jiangsu, China)
Using glycerol as carbon source, the effects of temperature on the cellular oil fatty acid composition, FAS and PKS genes transcription levels were measured afterSchizochytriumsp. S31 entering lipid accumulation stage in shake flask. The results showed that after the cells entering lipid accumulation stage, when the fermentation temperature increased to 30℃, the DHA content in algal oil decreased, and the FAS gene transcriptional level was higher than that of PKS. When the fermentation temperature decreased to 20℃, the DHA content in algal oil increased and the PKS gene transcriptional level was significantly higher than that of FAS. All these datas showed that temperature had significant effects on PKS and FAS genes transcriptional levels, which determined the changes of fatty acid composition in algal oil ofSchizochytriumsp. S31.
Schizochytrium; DHA; FAS; PKS; transcriptional regulation
2016-10-17;
:2017-02-23
江苏省自然科学基金(BK20140156)
娄 菲(1991),女,在读硕士,研究方向为脂质科学与技术(E-mail)freya0427@aliyun.com。
常 明,副教授(E-mail)changming@aliyun.com。
Q936;Q812
:A
1003-7969(2017)08-0089-04
生物工程

