L-α-甘油磷脂酰胆碱的制备、纯化及检测研究进展
康世宗,张海臣,吴永辉,谷克仁,
(1.河南工业大学 化学化工学院,郑州 450001; 2.吉林工程职业学院,吉林 四平 136001; 3.广州倚德生物科技有限公司,广州 511340)
综合利用
L-α-甘油磷脂酰胆碱的制备、纯化及检测研究进展
康世宗1,张海臣2,吴永辉3,谷克仁1,2
(1.河南工业大学 化学化工学院,郑州 450001; 2.吉林工程职业学院,吉林 四平 136001; 3.广州倚德生物科技有限公司,广州 511340)
L-α-甘油磷脂酰胆碱(L-α-GPC) 是动物体内天然存在的水溶性磷脂代谢产物,是乙酰胆碱合成的胆碱源。甘油磷脂酰胆碱能够有效增强人体的记忆力和认知能力,预防和治疗多种疾病。然而国内L-α-GPC的制备、纯化和检测技术相对不够成熟,较难满足市场对高质量、高纯度L-α-GPC的需求。通过对国内外L-α-GPC的制备、纯化及检测方法进行综述,进一步为甘油磷脂酰胆碱以及相关产品开发技术提供支持。
L-α-甘油磷脂酰胆碱;制备;纯化;检测
L-α-甘油磷脂酰胆碱(L-α-GPC)又称甘油磷酸胆碱、甘磷酸胆碱,是动物体内天然存在的水溶性磷脂代谢产物,经口服后,能到达胆碱突触末梢并增加乙酰胆碱的合成和释放[1-2]。L-α-GPC不仅可以作为保健品,促进大脑中乙酰胆碱和磷脂酰胆碱的生物合成,提高人的记忆能力和认知能力,也能有效治疗老年痴呆类疾病如阿尔茨海默病,被医药界称为“大脑的防衰老营养素”[3-4]。L-α-GPC还可以保护肝脏,抵抗高脂蛋白的脂肪渗透,起到抗类风湿、抗高血脂和抗动脉硬化的作用。另外L-α-GPC在一定程度上能够增强人体肌肉力量,提高反应敏捷度[5]。
国外对L-α-GPC的研究始于20世纪三四十年代,国内对该产品的研究起步较晚,在质量、规模方面与国外产品相比均存在一定的差距。纯度较低的L-α-GPC中可能含有部分色素和非极性杂质,常温常压下性质不稳定,不仅药理作用弱,还有可能产生对人体有害的毒素[6-7]。国内药用L-α-GPC几乎全部依靠进口,95%以上的高纯度L-α-GPC价格非常昂贵[8-9]。因此,研究和开发高纯度L-α-GPC的生产工艺,扩大生产规模以满足市场对L-α-GPC的需求,具有重要意义。
1 L-α-GPC的制备方法
由于天然存在的L-α-GPC极少,直接从牛乳或者胰脏中提取比较困难,目前国内外制备L-α-GPC方法主要有化学醇(水)解法、非水相酶法、低沸点有机胺催化法和化学合成法[10],整体上可总结为催化水解法和化学合成法。
1.1 催化水解法
目前,磷脂酰胆碱(PC)催化水解的方法有非水相或水相中用生物酶、金属钠、甲醇钠、乙醇钠、有机胺等催化醇解。磷脂酰胆碱上两个脂肪酰基(见图1中虚线标注部分)被水解,断开1、2位上的酯键就可以得到甘油磷脂酰胆碱。甘油磷脂酰胆碱含有一个季铵盐正电荷和一个磷酸负电荷,其分子结构式如图2所示。
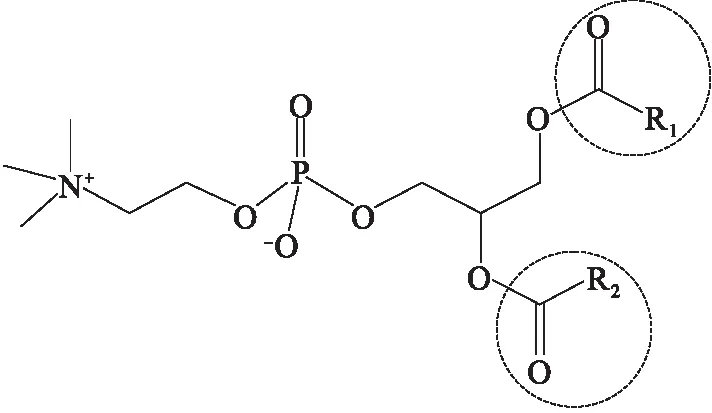
图1 磷脂酰胆碱分子式
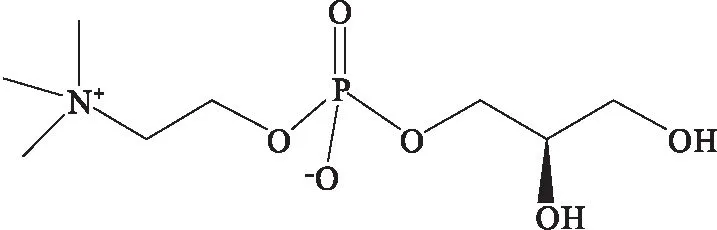
图2 L-α-GPC结构式
阮朝滨等[11]利用碱金属醇盐作为催化剂,产品为白色固体L-α-GPC结晶,收率达到72.2%。刘磊[12]以碱金属硅酸盐固体碱作为催化剂,在最佳反应条件下使大豆磷脂酰胆碱和甲醇发生酯交换反应制备L-α-GPC,收率达到95.1%。Li等[13-15]探索了丙胺、叔丁胺作为催化剂,磷脂酰胆碱的转化率均可达到98%以上;并对以氢氧化四丁基铵为催化剂的反应进行动力学分析,构建动力学模型,提出该反应可视为准一级反应,反应活化能为21.98 kJ/mol[16]。
相比其他催化剂,生物酶技术作为一种安全、绿色、高效的催化技术为L-α-GPC的工业化生产开辟一条全新的道路。磷脂酶A1(PLA1)是一类催化磷脂sn-1位酰基催化水解的酶族[17]。其作用机理为:第一步,PC的sn-1位的脂肪酸酰基被水解,生成sn-2-溶血磷脂酰胆碱(sn-2-LPC);第二步,经过自动酰基转移,sn-2-LPC转化为sn-1-LPC;第三步,磷脂酶A1再作用于sn-1-LPC中sn-1 的脂肪酸酰基得到L-α-GPC。
利用以上原理,Chang等[18]以磷脂酶A1催化水解大豆磷脂酰胆碱,抑制了第二步的酰基转移,得到纯度为83.7%的溶血磷脂酰胆碱(LPC),并且产物中没有检测到L-α-GPC。El等[19]利用紫外分光法连续准确地测定磷脂酶A1、A2的作用位点和催化机理,并介绍了抑制酰基转移的方法。Bang等[20]以大豆磷脂酰胆碱为原料,在正己烷-水(体积比5.8∶1)双相体系中利用磷脂酶A1水解制备L-α-GPC,优化了反应温度、反应时间、载酶量等工艺参数,然后利用乙醚萃取与硅胶柱色谱纯化后得到了99.3%的高纯度L-α-GPC,该研究表明相对于单水相的酶催化体系,正己烷-水双相体系中L-α-GPC产率更高。可见溶剂的不同或界面的疏水性质有所差异,水解产物的产率也不同。
常规的单一酶解法制备L-α-GPC用磷脂酶A1作催化,进行酰基的自动转移。张文喆等[21-22]以复合磷脂酶法(磷脂酶A1+磷脂酶A2)制备L-α-GPC。这种方法虽然未能提高得率,但缩短了反应时间,相对提高了生产效率。周雯君等[23]以磷脂酶A1和磷脂酶A2为复合酶,在水相及非均相微乳体系下分别酶解制备L-α-GPC,得到了最佳工艺条件。Blasi等[24]在微乳体系中,碱性条件下使用磷脂酶A1、A2通过酶解脱酰基反应制备L-α-GPC,转化率较高。
1.2 化学合成法
Puricelli[25]以D-亚异丙基甘油对甲苯磺酸酯为起始原料,与磷酸胆碱四甲基铵盐反应,一步制备L-α-GPC,收率达到75%。Song等[26]应用shapless环氧开环反应原理,用(R)-(+)缩合甘油与磷酸胆碱在异丙胺存在条件下通过亲核加成制备L-α-GPC。
李海林等[27]利用(R)-环氧氯丙烷与苄醇在强碱作用下缩合制备(S)-苄基缩水甘油醚,然后将(S)-苄基缩水甘油醚与氯化磷酸胆碱反应制得L-α-氯化甘油磷酸胆碱苄基醚;再将所得到的L-α-氯化甘油磷酸胆碱苄基醚通过Pd/C加氢反应脱去苄基保护基,最后纯化即得L-α-GPC。苏福男[28]利用一种氯化磷酰胆碱钙盐和(R)-(-)-3-氯-1,2-丙二醇为原料,通过膜分离除去氯化钠等杂质,最后经过离子交换树脂进行分离制备甘油磷脂酰胆碱,产品纯度可达到99.7%。艾海马等[29]以D-甘露糖醇为原料,经缩酮化、氧化、还原制得D-亚异丙基甘油,再与2-氯-2-氧-1,3,2-环氧磷戊烷进行酯化反应,然后用三甲胺进行氨化,最后水解除去丙叉基得目标化合物L-α-GPC,总收率从9.5%提高到38.6%(以D-甘露糖醇计)。
在以磷脂酰胆碱为原料利用合适的催化剂催化脱酰,再进行酰基转移制备L-α-GPC的工艺中,原料通常为磷脂酰胆碱,无毒无害,产物收率高。但是原料纯度要高,否则将会生成很多副产物,影响产品纯度并对后期的分离提纯造成困难,并且溶剂的回收耗能大,催化剂价格高。另外,水解过程中可能造成手性结构消旋,导致产品旋光度不合格。化学合成法制备L-α-GPC,产品纯度高,分离纯化容易,但是工艺复杂,操作条件苛刻,部分原料有毒,中间体不易得,对工业化生产造成一定影响。
2 L-α-GPC的分离纯化方法
2.1 传统方法
通过酯交换反应制备GPC工艺中,反应液中存在其他中性脂类以及脂肪酸甲酯等[30],同时由于原料中往往伴有磷脂酰乙醇胺(PE)、磷脂酰丝氨酸(PS)、磷脂酰肌醇(PI)等杂质,所以水解产物中也含有甘油磷脂酰乙醇胺(GPE)、甘油磷脂酰丝氨酸(GPS)、甘油磷脂酰肌醇(GPI),与目标产物GPC的极性相似,利用简单的溶剂萃取[31]很难去除这些杂质。早期分离方法主要有沉淀法、重结晶法、溶剂萃取法。这些方法在纯化GPC时存在自身的优缺点:溶剂萃取法利于工业化大规模生产,但很难制备出高纯度的GPC,萃取过程需要消耗大量有机溶剂,溶剂的回收也将产生很高的能耗;沉淀法主要利用氯化汞等可溶性汞盐进行分离杂质,重金属离子的引入和残留对医药级GPC的开发是不符合要求的;重结晶法是将含有水的液态粗GPC用乙醇等溶剂溶解后,蒸发结晶提纯GPC,在工业化规模生产方面满足不了要求。以上方法对产品纯度和旋光性都达不到市场需求,无法商业化生产,现已逐渐被淘汰。
2.2 柱色谱层析法
柱色谱层析法分为硅胶柱层析法、氧化铝柱层析法、离子交换树脂柱层析法,以及将两种填料进行联合层析法。离子交换树脂柱层析法操作简单,回收率高,可重复性使用,并能分离性质和结构相似的化学物质,如分离异构体,特别适用于L-α-GPG的纯化分离操作[32]。
Liu等[33]利用磷脂酶A1酶法水解,然后用离子交换树脂纯化和硅胶柱层析法制备纯度高达99.8%的L-α-GPC,最终收率高达78.4%。Zhang等[34]利用D001和D301-111阴离子交换树脂柱层析法纯化磷脂酶A1催化水解产物,利用活性炭进行脱色并去除小颗粒杂质,得到纯度高达98.8%的L-α-GPC。周丽等[35]采用以离子交换树脂为分离介质的柱层析法及活性炭脱色法,对粉末磷脂的醇解反应液进行分离纯化。通过筛选,确定了D001树脂为第一层析柱的分离介质,201×7树脂为第二层析柱的分离介质,然后利用D113柱对L-α-GPC粗溶液进一步纯化,最后经过旋转蒸发和真空干燥可得到纯度达97.1%的L-α-GPC,回收率为84.8%。
但离子交换树脂对L-α-GPC、GPE和LPC的分离度相对来说仍然不是很高,导致产品的回收率低,整个纯化周期长[36]。
3 L-α-GPC的分析检测方法
3.1 定性分析
对于油状的L-α-GPC,可利用传统的检测手段如红外光谱(IR)、核磁共振谱(1H-NMR,1H-1H COSY,13C-NMR,13C-DEPT,13C-1H HSQC,13C-1H HMBC,31P-NMR)、质谱(ESI+离子源,220℃)、LC-MS、旋光度测定、薄层色谱等技术对L-α-GPC进行定性表征[37]。另外,在利用磷脂酶A1催化水解PC过程当中,Ca2+是必需的辅酶因子[38-39],需要除去,原子吸收光谱可以作为辅助手段对产品中Ca2+含量进行监测[37],为L-α-GPC生产过程中杂质控制提供依据。
然而对于晶体状态的L-α-GPC很难利用以上方法进行表征。Oh等[40]公开了一种制备Ⅰ、Ⅱ晶型L-α-GPC晶体的方法,并利用差示扫描量热仪(DSC)进行表征,Ⅰ晶型L-α-GPC初始温度147℃并在150℃有吸收峰,Ⅱ晶型初始温度为62℃并在66℃处有吸收峰;利用X射线衍射法(XRD)对产品进行定性分析,Ⅰ晶型L-α-GPC在衍射角为(9.8±0.2)°、(12.0±0.2)°、(14.3±0.2)°、(15.8±0.2)°、(19.6±0.2)°处有特征峰,Ⅱ晶型在衍射角为(10.3±0.2)°、(12.2±0.2)°、(13.4±0.2)°、(14.8±0.2)°、(20.6±0.2)°处有特征峰,确证了两种晶型结构。由于晶体状态的L-α-GPC相比传统的油状L-α-GPC纯度更高,同时该晶体吸湿性低,存储期间具有良好的稳定性,所以更易保存。
赵成磊[41]以油状甘油磷酸胆碱为原料,将过氧化铝层析柱后的L-α-GPC油状物粗品通过两步结晶法制备L-α-GPC单晶纯品,用CuKα(λ=1.541 84×10-10m)光源收集(150±2)K温度下的X射线单晶衍射数据,在4.89°≤θ≤69.75°范围内收集4 137个衍射点,其中2 204个[R(int)=0.012 6]独立点。X射线单晶衍射结果表明该化合物为正交晶系,对L-α-GPC晶型进行了补充,为今后的L-α-GPC在制剂中晶型的选择提供了参考。
3.2 定量分析
高效液相色谱法是现今普遍采用的定性、定量分析L-α-GPC的方法。由于L-α-GPC在200~800 nm全波长范围内没有紫外吸收峰,不能用紫外检测器对其检测,所以可以用HPLC-ELSD对其定性或者定量分析[42-43],但是该方法使用的流动相一般含有水,对硅胶色谱柱的柱效有一定的损害作用,造成检测结果稳定性差,并且PC、LPC、L-α-GPC吸水性强,进一步增加结果的误差。核磁共振氢谱法可以解决此问题,不但避免了样品中水分对检测结果的干扰,还可以分别选取化学位移δ=4.40~4.50、4.14~4.16、3.76~3.83处的信号峰作为PC、LPC和L-α-GPC的特征性质子峰,并根据质子峰相对面积与物质的量的对应关系计算三者的相对含量[44],为PC两步水解过程中检测L-α-GPC产率提供了一种简单快速的方法。
刘丹等[45]建立了一种非水电位滴定测定L-α-GPC含量的方法,采用高氯酸标准溶液对L-α-GPC样品进行电位滴定,然后利用二级微商法找到点位突跃点,确定电位滴定终点消耗的高氯酸标准溶液体积[46],从而得出L-α-GPC含量,实验精密度较高,并且不受溶液浑浊度影响,可以作为定量分析L-α-GPC的新方法。
通常定性和定量分析L-α-GPC可将多种方法联用,以提高检测的准确性和可信度。
4 结束语
医药、食品、保健品等领域对磷脂及其改性产品L-α-GPC都具有很大的需求,并且在未来将有更大的市场。国内有关L-α-GPC的制备、纯化、检测技术不是十分成熟,所以研发适用于大规模生产L-α-GPC的新工艺,提高产品质量,探索简便、快速的检测方法具有重要意义。
[1] BROWNAWELL A M, CARMINES E L, MONTESANO F, et al. Safety assessment of AGPC as a food ingredient [J]. Food Chem Toxicol, 2011, 49(6):1303-1315.
[2] TAYEBATI S K, TOMASSONI D, DI S A, et al. Effect of choline-containing phospholipids on brain cholinergic transporters in the rat[J]. J Neurol Sci, 2011, 302(1/2):49-57.
[3] TAYEBATI S K, AMENTA F. Choline-containing phospholipids:relevance to brain functional pathways[J]. Clin Chem Lab Med, 2013, 51(3):513-521.
[4] RUI W, SHEN S, BURTON C, et al. Lipidomic profiling of tryptophan hydroxylase 2 knockout mice reveals novel lipid biomarkers associated with serotonin deficiency[J]. Anal Bioanal Chem, 2016, 408(11):2963-2973.
[5] PARKER A G, BYARS A, PURPURA M, et al. The effects ofalpha-glycerylphosphorylcholine, caffeine or placebo on markers of mood, cognitive function, power, speed, and agility[J]. J Int Soc Sport Wutr, 2015, 12(1):41.
[6] 高志荣, 赵艳艳, 张洪斌,等. 甘油磷酸胆碱的层析纯化及其稳定性研究[J]. 安徽医药, 2014, 18(2):242-246.
[7] TOKES T, TUBOLY E, VARGA G, et al. Protective effects ofL-alpha-glycerylphosphorylcholine on ischaemia-reperfusion-induced inflammatory reactions[J]. Eur J Nutr, 2015, 54(1):109-118.
[8] 大久保刚. Importance of the choline supply:the functionality ofα-GPC[J]. Bio Ind, 2012, 29(2):26-31.
[9] KOMATSU H, WESTERMAN J, SNOEK G, et al.L-α-glycerylphosphorylcholine inhibits the transfer function of phosphatidylinositol transfer proteinα[J]. Bioch Biophys Acta, 2003, 1635(2/3):67-74.
[10] LI H, ZHANG X, BAI W, et al. Study on the preparation ofL-α-glycerophosphocholine catalyzed by low boiling point organic amines[J]. React Kinet Mech Cat, 2013, 108(2):305-316.
[11] 阮朝滨, 侯善波, 李晓峰,等.L-α-甘油磷酰胆碱的合成方法:CN103193821A[P]. 2013-07-10.
[12] 刘磊. 碱金属硅酸盐固体碱催化磷脂酯交换反应制备甘油磷脂酰胆碱反应的研究[D]. 西安:西北大学, 2015.
[13] LI H, ZHANG X, BAI W, et al. Study on the preparation ofL-α-glycerophosphocholine catalyzed by low boiling point organic amines[J]. React Kinet Mech Cat, 2013, 108(2):305-316.
[14] LI H Y, ZHANG T T.L-α-glycerophosphocholine from natural lecithin via transesterification catalyzed by propylamine[J]. Adv Mat Res, 2014, 997:73-76.
[15] LI H Y, ZHANG X L, BAI W L, et al. Preparation ofL-α-glycerophosphocholine from natural lecithin catalyzed by tert-butylamine[J]. Adv Mat Res, 2013, 641-642(1):148-151.
[16] LI H Y, ZHANG X L, ZHANG J B, et al. PreparingL-α-glycerophosphocholine in a phase-transfer catalytic reaction:kinetic study[J]. Int J Chem Kinet, 2014, 46(3):169-175.
[17] 史永革, 陈斌斌, 谷克仁. 磷脂酶A1催化大豆粉末磷脂水解工艺研究[J]. 粮油食品科技, 2009, 17(5):21-23.
[18] CHANG W L, KIM B H, KIM I H, et al. Modeling and optimization of phospholipase A1-catalyzed hydrolysis of phosphatidylcholine using response surface methodology for lysophosphatidylcholine production[J]. Biotechnol Progr, 2014, 31(1):35-41.
[19] EL A M, SOULERE L, NOIRIEL A, et al. A continuous spectrophotometric assay that distinguishes between phospholipase A1 and A2 activities[J]. J Lipid Res, 2016, 57(8):1589-1597.
[20] BANG H J, KIM I H, KIM B H. Phospholipase A1-catalyzed hydrolysis of soy phosphatidylcholine to prepareL-α-glycerylphosphorylcholine in organic-aqueous media[J]. Food Chem, 2016, 190:201-206.
[21] 张文喆, 鹿保鑫, 王霞,等. 复合磷脂酶法制备甘油磷脂酰胆碱萃取液中脂肪酸甲酯化研究[J]. 农产品加工(月刊), 2015(1):7-11.
[22] 张文喆, 鹿保鑫. 复合磷脂酶水相体系酶法制备甘油磷脂酰胆碱的研究[J]. 中国油脂, 2015,40(6):57-61.
[23] 周雯君, 张文喆, 鹿保鑫. 复合磷脂酶微乳体系非均相酶法制备甘油磷脂酰胆碱的研究[J]. 中国油脂, 2016, 41(1):80-83.
[24] BLASI F, COSSIGNANI L, SIMONETTI M S, et al. Enzymatic deacylation of l,2-diacyl-sn-glycero-3-phosphocholines to sn-glycerol-3-phospho choline[J]. Enzyme Microb Technol, 2006, 39(7):1405-1408.
[25] PURICELLI L. Process for preparingL-alpha-glycerylphosphorylcholine:EP486100[P]. 1991-11-09.
[26] SONG Y S, SONG E S, KANG D S, et al. A process for preparation ofL-alphaglycerylphosphorylcholine:WO 2007145476A1[P]. 2007-12-21.
[27] 李海林, 王世运, 张建现,等. 一种L-α-甘油磷酸胆碱的制备方法: CN103304594A[P]. 2013-09-18.
[28] 苏福男. 甘油磷脂酰胆碱的制备方法:CN104844647A[P]. 2015-08-19.
[29] 艾海马, 张晓峰, 白福英,等.L-α-甘油磷酸胆碱合成工艺的改进[J]. 中国新药杂志, 2015(4):466-469.
[30] 谷克仁. 浓缩大豆磷脂的溶剂分提[J]. 中国油脂, 2002, 27(1):31-33.
[31] JONG M P, KATHLIA A, CASTRO D. Facile syntheses ofL-alphaglycerylphosphorylcholine[J]. Bull Kotean Chem Soc, 2010,31(9):2689.
[32] ZHANG Z F, LIU Y, LUO P, et al. Separation and purification of two flavone glucuronides from erigeron multiradiatus (Lindl.) benth with macroporous resins [J]. J Biomed Biotechnol, 2009: 875629-875637.
[33] LIU Y, ZHANG K, WANG X, et al. Method for preparing high purityL-αglycerylphosphorylcholine:US 8658401B2[P]. 2014-02-25.
[34] ZHANG K, WANG X, LIU Y. Purification ofL-alpha-glycerylphosphorylcholine from the enzyme reaction solutions by resin column chromatography[J]. J Oil Fat Ind, 2012, 89(6):1155-1163.
[35] 周丽, 王兴国, 张康逸,等. 甘油磷脂酰胆碱的分离纯化研究[J]. 食品与生物技术学报, 2012, 31(1):67-70.
[36] 张康逸. 水相体系酶法制备甘油磷脂酰胆碱及酰基转移机理研究[D]. 江苏 无锡:江南大学, 2012.
[37] 赵艳艳. 甘油磷酸胆碱的分离纯化、结构表征及其质量研究[D]. 合肥:合肥工业大学, 2012.
[38] SNIJDER H J, DIJKSTRA B W. Bacterial phospholipase a:structure and function of an integral membrane phospholipase [J]. Bioch Biophys Acta, 2000, 1488(1/2):91-101.
[39] DEKKER N. Outer-membrane phospholipase A:known structure,unknown biological function [J]. Mol Microbiol, 2000, 35(4):711-717.
[40] OH M K, KIM K N, SEO K H, et al. I-and II-type crystals ofL-α-glyceryl phosphoryl choline, and method for preparing same:US8981141[P]. 2015-03-17.
[41] 赵成磊. 甘油磷酸胆碱的结晶、结构解析及年产100吨原料药工艺设计[D]. 合肥: 合肥工业大学, 2014.
[42] 刘狄, 刘明, 冯宝民,等. 高效液相色谱-蒸发光散射法测定甘油磷脂酰胆碱[J]. 分析科学学报, 2014, 30(3):377-380.
[43] ZHANG K L. Preparation of highpurityL-alphaglycerylphosphorylcholine catalyzed by sodium methoxide in alcohol phase[J]. J Chin Cereals Oils Assoc, 2012, 27(2):36-41.
[44] 杜章斌, 滕英来, 汪勇,等. 核磁共振氢谱法测定卵磷脂、溶血磷脂和甘油磷脂酰胆碱含量[J]. 中国油脂, 2015, 40(3):83-86.
[45] 刘丹, 张康逸, 黄健花,等. 非水电位滴定法测定甘油磷脂酰胆碱[J]. 中国油脂, 2012, 37(3):82-84.
[46] BLACK S, LII J R F. Determination of carbonyl groups in pyrolysis bio-oils using potentiometric titration:review and comparison of methods[J]. Energ Fuel, 2016, 30(2):1071-1077.
Advanceinpreparation,purificationanddetectionofL-α-glycerylphosphorylcholine
KANG Shizong1, ZHANG Haichen2, WU Yonghui3, GU Keren1,2
(1.College of Chemistry and Chemical Engineering, Henan University of Technology, Zhengzhou 450001, China; 2.Jilin Engineering Vocational College, Siping 136001, Jilin, China; 3.Guangzhou Yide Biological Technology Co., Ltd., Guangzhou 511340, China)
L-α-glycerophosphorylcholine (L-α-GPC) is a type of water-soluble phospholipid metabolite, which naturally exists in the animal body, and it is also the choline source of preparing the acetylcholine. It can not only enhance the people’s memory and cognitive abilities, but also prevent and treat lots of diseases. It will be difficult to meet the market demand of high-quality and high-purityL-α-GPC without the mature technology of preparation, purification and detection. The methods of preparation, purification and detection ofL-α-GPC at home and abroad were summarized, in order to provide support to the development ofL-α-GPC and related products.
L-α-glycerophosphorylcholine; preparation; purification; detection
2016-11-17
康世宗(1991),男,硕士研究生,研究方向为天然产物开发(E-mail)18236920553@163.com。
谷克仁,教授(E-mail)gukeren988@163.com。
Q545;TQ645.9
:A
1003-7969(2017)08-0103-05

