青藤碱对肾缺血再灌注大鼠肾组织Fas/FasL蛋白表达水平影响的探讨
吕兴华,冷玉芳,杨艳妮,苏玉洁,王朋,郑贯峥
(兰州大学第一医院,甘肃兰州730000)
青藤碱对肾缺血再灌注大鼠肾组织Fas/FasL蛋白表达水平影响的探讨
吕兴华,冷玉芳*,杨艳妮,苏玉洁,王朋,郑贯峥
(兰州大学第一医院,甘肃兰州730000)
目的探讨青藤碱对肾缺血再灌注大鼠肾组织Fas、FasL蛋白表达水平的影响。方法选取健康雄性Wistar大鼠72只,体重180~220 g,随机分为假手术组(S组)、空白给药组(SS组)、肾缺血再灌注损伤模型组(I/R组)、青藤碱组(SIN组),每组18只。I/R组、SIN组游离双侧肾蒂,用无创动脉夹夹闭左肾肾蒂,使左肾缺血,45分钟后松开动脉夹再灌注,并即刻切除右肾,建立肾缺血再灌注损伤模型。S组、SS组仅游离双侧肾蒂,不夹闭左肾肾蒂。SIN组、SS组于缺血后15分钟(即再灌注前30分钟)向腹腔注射青藤碱注射液60mg/kg,I/R组、S组于同一时间向腹腔注射等量生理盐水。再灌注后6小时(T1)、12小时(T2)、24小时(T3)穿刺心脏采血,用全自动生化分析仪检测血清Cr、BUN浓度;摘除左肾,光镜下观察肾组织病理学变化,用免疫组化法检测肾组织Fas、FasL蛋白表达水平,用TUNEL法检测并计算肾小管上皮细胞凋亡率。结果S组与SS组大鼠在T1、T2、T3的血清Cr、BUN浓度,Fas、FasL蛋白表达水平,肾小管上皮细胞凋亡率比较,差异无统计学意义(P>0.05);与S组比较,I/R组、SIN组T1、T2、T3的血清Cr、BUN浓度升高(P<0.05),肾组织病理损伤加重,肾组织Fas、FasL蛋白表达水平升高(P<0.05),肾小管上皮细胞凋亡率升高(P<0.05);与I/R组比较,SIN组T1、T2、T3的血清Cr、BUN浓度降低(P<0.05),肾组织病理损伤减轻,肾组织Fas、FasL蛋白表达水平下降(P<0.05),肾小管上皮细胞凋亡率下降(P<0.05);与T2比较,I/R组和SIN组T3的Fas蛋白表达水平、细胞凋亡率升高(P<0.05)。结论青藤碱可显著降低大鼠肾I/R病理过程中Fas、FasL蛋白的表达水平,从而减少肾小管上皮细胞的凋亡,有助于减轻I/R时肾脏的损伤。
青藤碱;肾脏;缺血再灌注损伤;Fas蛋白;FasL蛋白
肾脏是机体的高灌注器官,对缺血缺氧十分敏感,休克、创伤、肾移植等均可导致肾缺血再灌注损伤(I/R)。研究发现,I/R的发生发展与凋亡、炎症、自由基生成等机制密切相关[1-2]。细胞凋亡受多种基因调控,是促进凋亡和抑制凋亡相互平衡的结果。而Fas/FasL被认为是参与细胞凋亡的重要因子[3-4]。研究发现,青藤碱(SIN)对大鼠I/R具有保护作用[5-6],但SIN能否通过抑制Fas/FasL的表达从而抑制肾小管上皮细胞的凋亡尚不清楚。本实验以大鼠肾I/R模型为基础,以青藤碱(SIN)作为干预手段,测定肾脏组织中Fas、FasL蛋白表达水平的变化,现介绍如下。
1 资料与方法
1.1 一般资料
选择健康雄性Wistar大鼠72只(由兰州大学医学院动物中心提供),体重180~220 g,饲养温度23℃~25℃,相对湿度55%~60%,自由进食水。采用随机数字表法分为假手术组(S组)、空白给药组(SS组)、肾缺血再灌注损伤模型组(I/R组)、青藤碱组(SIN组),每组18只。
1.2 方法
本研究参照Basile DP、姚爱军等[7-8]的实验方法制备大鼠肾缺血再灌注损伤模型。向I/R组及SIN组大鼠腹腔注射10%水合氯醛350mg/kg麻醉,俯卧位固定,备皮、消毒,于脊柱旁1.0 cm、肋缘下0.5 cm取约1.5 cm的切口,游离双侧肾蒂,用无创动脉夹夹闭左肾肾蒂,肾脏由红色变为暗褐色表示缺血成功,缺血45分钟后松开左肾动脉夹并立即切除右肾,左肾由暗褐色转为红色表示再灌注成功。S组及SS组大鼠仅游离双侧肾蒂,用生理盐水纱布覆盖切口,45分钟后切除右肾。4组切除右肾后均行碘伏消毒,逐层缝合切口,敷以青霉素粉预防感染。SIN组、SS组于缺血后15分钟(即再灌注前30分钟)向腹腔注射青藤碱注射液(规格:2 ml:50 mg;批号:1312417-019;湖南正清制药集团股份有限公司生产)60mg/kg,S组、I/R组于同一时间向腹腔注射等量生理盐水。
各组分别于再灌注6小时(T1)、12小时(T2)、24小时(T3)随机选取大鼠6只,向腹腔注射10%水合氯醛350mg/kg,麻醉后打开腹腔,穿刺心脏采血3~5m l,并摘除左肾。血标本3 000r/min离心10分钟,取上清液,用全自动生化分析仪(LX20,Beckman Coulter)测定血清肌酐(Cr)、尿素氮(BUN)浓度。肾脏标本用10%多聚甲醛溶液固定,石蜡包埋、切片(3μm)。随机选取每个肾脏标本的切片2张用于HE染色,光镜(×400,Olympus)下观察大鼠肾脏病理变化。
采用非生物素二步免疫组织化学法检测大鼠肾脏Fas、FasL蛋白表达水平。切片脱蜡至水,柠檬酸钠抗原修复,3%过氧化氢封闭内源性过氧化物酶,滴加Fas、FasL兔抗大鼠多克隆抗体(批号分别为:BA0484、BA0049,浓度分别为1∶400、1∶50,武汉博士德生物技术有限公司生产),4℃分别孵育16小时、18小时,滴加山羊抗兔二抗。DAB显色,苏木素复染、返蓝,脱水、二甲苯透明、树脂封片。光镜下观察胞浆出现棕黄色颗粒或胞核黄染表示阳性表达。每张切片随机选取6个视野,采用Image-Pro Plus 6.0图像分析处理软件(Media Cybernetics公司生产)测定Fas、FasL的积分光密度(IOD),取其平均值。
采用TUNEL检测试剂盒(Promega公司生产,美国)测定细胞凋亡情况。石蜡切片脱蜡至水,用蛋白酶K消化,于37℃湿盒中孵育30分钟,将Equilibration Buffer 98μl、Biotinylated Nucleotide Mix 1μl混合液覆盖于样本反应区域,于37℃湿盒中孵育60分钟。玻片放入20×SSC溶液的染色缸中终止反应,室温放置15分钟,滴加3%H2O2,30分钟后加入稀释的抗生物素蛋白链菌素辣根过氧化物酶溶液,室温反应30分钟,DAB显色,封片。在光学显微镜(×400,Olympus公司生产,日本)下观察、拍照,棕黄色为阳性。采用Image-Pro Plus 6.0图像分析处理软件计数凋亡细胞数和总细胞数,每个标本随机取5张切片,每张切片随机选取肾皮质部5个不同视野,取其平均值,计算细胞凋亡率(细胞凋亡率=凋亡细胞数÷总细胞数× 100%)。
1.3 统计学处理
采用SPSS 17.0统计学软件处理数据,计量资料以(x±s)表示,组间比较采用单因素方差分析,组内比较采用重复测量,P<0.05为差异有统计学意义。
2 结果
2.1 血清Cr、BUN浓度
S组与SS组大鼠T1、T2、T3的血清Cr、BUN浓度比较,差异无统计学意义(P>0.05);与S组比较,I/R组、SIN组大鼠T1、T2、T3的血清Cr、BUN浓度升高(P<0.05);与I/R组比较,SIN组大鼠T1、T2、T3的血清Cr、BUN浓度降低(P<0.05),见表1。
表1 各组大鼠不同时间点血清Cr、BUN浓度比较
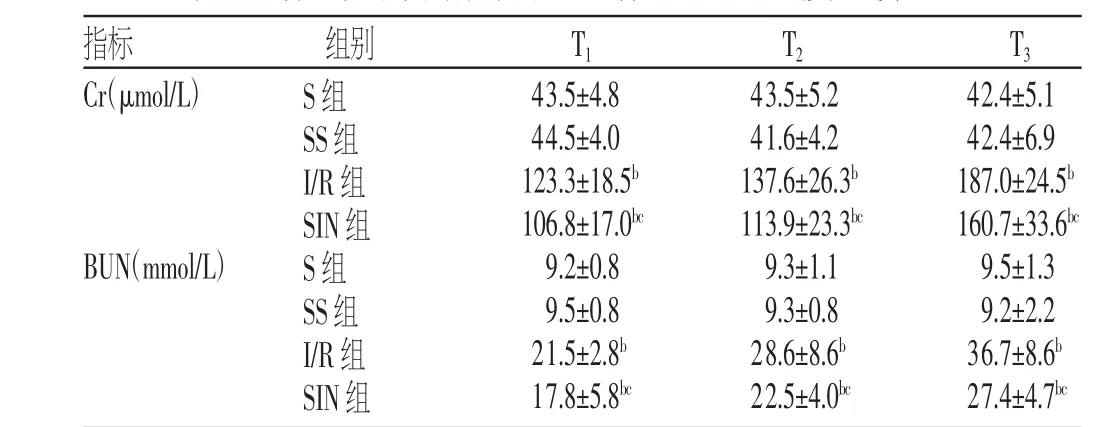
表1 各组大鼠不同时间点血清Cr、BUN浓度比较
注:与S组比较,bP<0.05;与I/R组比较,cP<0.05
42.4±5.1 42.4±6.9 187.0±24.5b160.7±33.6bc9.5±1.3 9.2±2.2 36.7±8.6b27.4±4.7bc指标Cr(μmol/L)组别T1T2T3BUN(mmol/L)S组SS组I/R组SIN组S组SS组I/R组SIN组43.5±4.8 44.5±4.0 123.3±18.5b106.8±17.0bc9.2±0.8 9.5±0.8 21.5±2.8b17.8±5.8bc43.5±5.2 41.6±4.2 137.6±26.3b113.9±23.3bc9.3±1.1 9.3±0.8 28.6±8.6b22.5±4.0bc
2.2 病理变化
S组、SS组大鼠T1、T2、T3仅见少许肾小管上皮细胞水肿、小管扩张,肾小球毛细血管轻度扩张充血。I/R组大鼠T1、T2、T3部分肾小球囊腔扩张,肾小管上皮细胞坏死脱落至管腔,管腔内可见蛋白管型,肾小管上皮细胞核固缩、浓染、碎裂,凋亡小体形成;胞浆变性,间质充血、水肿明显,并有散在炎性细胞浸润。SIN组大鼠T1、T2、T3肾小管上皮细胞坏死较I/R组轻,少许管腔可见蛋白管型,间质充血、水肿减轻,炎性细胞浸润减少。各组大鼠肾脏组织HE染色图片见图1。
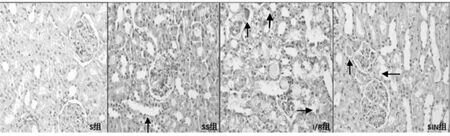
图1 各组大鼠肾脏组织HE染色图片
2.3 Fas、FasL蛋白表达水平
S组与SS组大鼠T1、T2、T3的Fas、FasL蛋白表达水平比较,差异无统计学意义(P>0.05);与S组比较,I/R组、SIN组大鼠T1、T2、T3的Fas、FasL蛋白表达水平升高(P<0.05);与I/R组比较,SIN组大鼠T1、T2、T3的Fas、FasL蛋白表达水平降低(P<0.05);I/R组和SIN组T3的Fas蛋白表达水平高于T2(P<0.05),见表2。各组大鼠肾脏Fas、FasL蛋白表达免疫组化图片见图2~3。
表2 各组大鼠肾脏不同时间点Fas、FasL蛋白表达水平比较
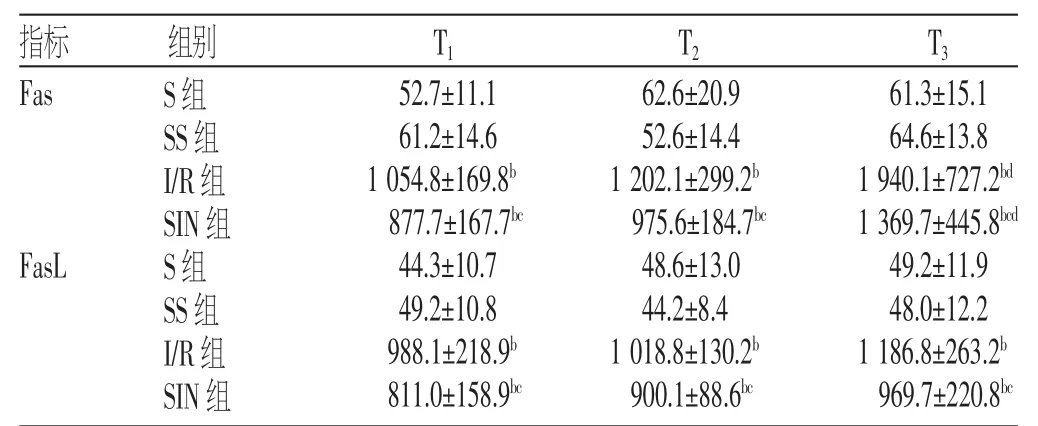
表2 各组大鼠肾脏不同时间点Fas、FasL蛋白表达水平比较
注:与S组比较,bP<0.05;与I/R组比较,cP<0.05;与T2比较,dP<0.05
61.3±15.1 64.6±13.8 1940.1±727.2bd1369.7±445.8bcd49.2±11.9 48.0±12.2 1186.8±263.2b969.7±220.8bc指标Fas T1T2T3FasL组别S组SS组I/R组SIN组S组SS组I/R组SIN组52.7±11.1 61.2±14.6 1 054.8±169.8b877.7±167.7bc44.3±10.7 49.2±10.8 988.1±218.9b811.0±158.9bc62.6±20.9 52.6±14.4 1202.1±299.2b975.6±184.7bc48.6±13.0 44.2±8.4 1018.8±130.2b900.1±88.6bc
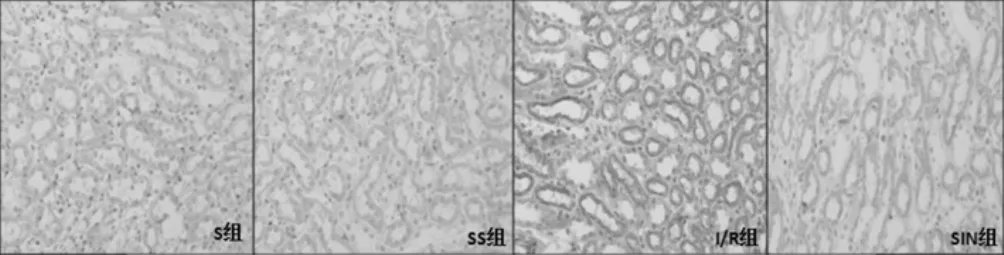
图2 各组大鼠肾脏Fas蛋白表达免疫组化图片
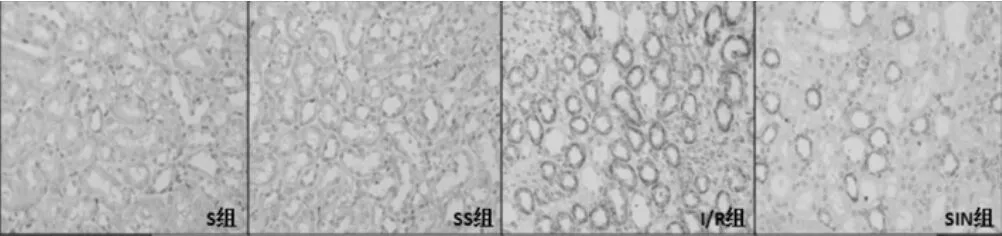
图3 各组大鼠肾脏FasL蛋白表达免疫组化图片
2.4 肾小管上皮细胞凋亡率
S组与SS组肾小管上皮细胞凋亡率比较,差异无统计学意义(P>0.05);与S组比较,I/R组和SIN组肾小管上皮细胞凋亡率升高(P<0.05);与I/R组比较,SIN组肾小管上皮细胞凋亡率降低(P<0.05);与T2比较,I/R组和SIN组T3的细胞凋亡率升高(P<0.05),见表3。各组大鼠肾小管上皮细胞凋亡情况见图4。
表3 各组大鼠不同时间点肾小管上皮细胞凋亡率的比较
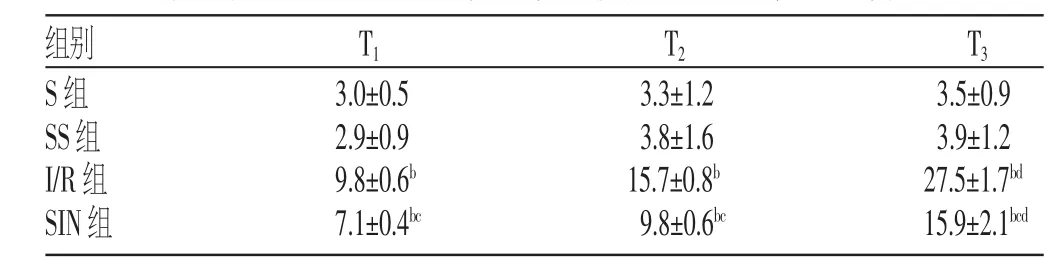
表3 各组大鼠不同时间点肾小管上皮细胞凋亡率的比较
注:与S组比较,bP<0.05;与I/R组比较,cP<0.05;与T2比较,dP<0.05
3.5±0.9 3.9±1.2 27.5±1.7bd15.9±2.1bcd组别S组SS组I/R组SIN组T1T2T33.0±0.5 2.9±0.9 9.8±0.6b7.1±0.4bc3.3±1.2 3.8±1.6 15.7±0.8b9.8±0.6bc
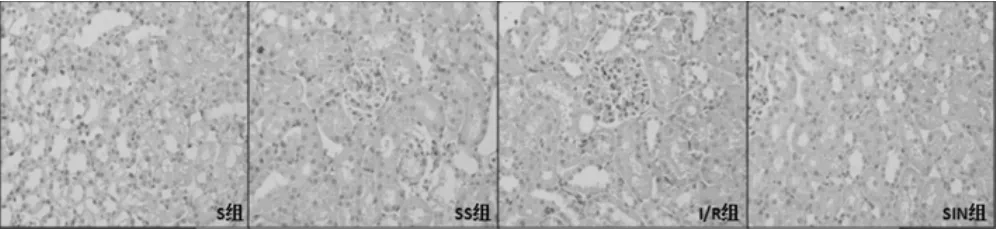
图4 各组大鼠肾小管上皮细胞凋亡情况
3 讨论
本研究采用左肾缺血期间保留右肾,左肾再灌注时即刻切除右肾以避免右肾代偿的方法制备大鼠肾缺血再灌注损伤模型。结果表明,I/R组大鼠在再灌注6小时、12小时、24小时的血清Cr、BUN浓度升高,病理损伤明显,说明肾缺血再灌注损伤模型制备成功。本研究参考文献[9]及预实验结果,选择肾缺血后15分钟(即再灌注前30分钟)向腹腔注射青藤碱60 mg/kg进行研究。
肾脏I/R的发生发展是一个极其复杂的病理生理过程,其发病机制涉及中性粒细胞浸润、氧化应激损伤、细胞凋亡、自由基生成等机制,并有众多炎性介质和免疫因子的参与[1-2]。Fas蛋白是神经生长因子受体(NGFR)和肿瘤坏死因子受体(TNFR)家族成员之一,属于Ⅰ型跨膜蛋白,膜外是富含丝氨酸的功能域,膜内是传递凋亡信号所必需的死亡结构域(DD),因此Fas又被称为死亡分子;FasL属于肿瘤坏死因子(TNF)家族,是一种分子量为40 KD的Ⅱ型跨膜蛋白[10]。Fas与其配体FasL结合形成同源三聚体,并与其他具有死亡结构域(DD)同源区的周围蛋白质结合形成死亡起始信号复合体(DISC),通过一系列途径激活内源性核酸内切酶,同时降解DNA损伤修复酶及细胞骨架调节蛋白[11],并激活Caspase酶联反应,使细胞骨架破坏、DNA断裂,致使细胞凋亡[12-14]。
青藤碱是从防己科植物毛青藤的干燥藤茎中提取的异喹啉类生物碱单体,具有免疫抑制、抗炎、镇痛等多种药理作用[5,15-16]。本实验以大鼠肾脏I/R为基础,以青藤碱为干预治疗措施,观察到以下情况:(1)用青藤碱处理后,与S组相比,SS组大鼠血清Cr及BUN浓度无明显变化(P>0.05),说明该剂量青藤碱对正常大鼠肾功能无明显影响;而SIN组大鼠T1、T2、T3的肾小管上皮细胞坏死较I/R组轻,少许管腔可见蛋白管型,间质充血、水肿减轻,炎性细胞浸润减少,说明青藤碱对大鼠肾脏具有保护作用。研究显示,青藤碱可通过调节肾小管上皮细胞Caspase-3、Bcl-2、Bax蛋白的表达,抑制肾小管上皮细胞凋亡[17]。(2)S组与SS组大鼠Fas、FasL蛋白表达水平比较,差异无统计学意义(P>0.05),而I/R组大鼠Fas、FasL蛋白表达水平与S组比较,明显增多(P<0.05),且I/R组再灌注24小时的Fas蛋白表达水平比再灌注12小时高(P<0.05),说明当肾脏组织发生缺血再灌注时,Fas、FasL蛋白表达水平明显升高,其参与了I/R的发生。(3)用青藤碱处理后,与I/R组相比,SIN组再灌注6小时、12小时、24小时大鼠Fas、FasL蛋白表达水平下降(P<0.05),肾小管上皮细胞凋亡率下降(P<0.05),说明青藤碱可抑制大鼠肾脏Fas、FasL蛋白的表达,减少死亡起始信号复合体(DISC)的合成,抑制了一系列细胞凋亡的激活途径,减轻肾小管上皮细胞的凋亡,从而对大鼠肾缺血再灌注损伤产生保护作用。有关青藤碱下调Fas、FasL蛋白表达水平的具体机制仍需进一步探索。
综上所述,青藤碱可通过抑制大鼠肾I/R过程中Fas、FasL蛋白的表达,从而降低肾小管上皮细胞的凋亡,减轻了I/R时肾脏的损伤。
[1]Rouschop KM,Roelofs JJ,Claessen N.Protection against renal ischemia reperfusion injury by CD44 disruption[J].JAm Soc Nephrol,2005,16(7):2034-2043.
[2]SrichaiM B,HaoC,Davis L,etal.Apoptosisof the thick ascending limb results in acute kidney injury[J].JAm Soc Nephrol,2008,19(8):1538.
[3]Liu CY,Fu R,Wang HQ,et al.Fas/FasL in the immune pathogenesis of severe aplastic anemia[J].GenetMol Res,2014(13):4083-4088.
[4]韩丽萍,李鸿珠,姜春明,等.精胺抑制模拟缺血-再灌注心肌细胞Fas /FasL的表达[J].中国病理生理杂志,2010(4):630-634.
[5]Zhao Z,Guan R,Song S.Sinomenine protects mice against ischemia reperfusion induced renal injury by attenuating inflammatory response and tubular cell apoptosis[J].Int JClin Exp Pathol,2013,6(9):1702-1712.
[6]王博,徐达,王锡智.青藤碱减轻小鼠肾脏缺血再灌注损伤[J].中华器官移植杂志,2011,32(2):73-77.
[7]Basile DP,Donohoe D,Cao X.Resistance to ischemic acute renal failure in the Brown Norway rat:a new model to study cytoprotection[J].Kidney Int,2004,65(6):2201-2211.
[8]姚爱军,冷玉芳.氯胺酮对大鼠肾脏缺血再灌注损伤的影响[J].中华麻醉学杂志,2009,29(10):927-931.
[9]彭小龙.青藤碱对大鼠急性肾缺血再灌注损伤保护作用的研究[D].衡阳:南华大学,2010.
[10]Zhao J,Duan S,Zhou J,et al.Mild hypothermia reduces expression of Fas/FasL and MMP-3 after cerebral ischemia-reperfusion in rats[J].Iran JBasic Med Sci,2014(17):454-459.
[11]Del Rio M,Imam A.The death domain of kidney ankyrin interacts with Fas and promotes Fas-mediated cell death in renal epithelia[J].JAm Soc Nephrol,2004,15(1):41-51.
[12]左耿,陶贵周.Fas/FasL系统与心肌缺血再灌注细胞凋亡[J].心血管病学进展,2011,32(2):282-287.
[13]Li SQ,Liang LJ.Hepatocyte apoptosis induced by hepatic ischemiareperfusion injury in cirrhotic rats[J].Hepatobiliary Pancreat Dis Int,2003,2(1):102-105.
[14]Niu FN,Zhang X,Hu XM,et al.Targeted mutation of Fas ligand gene attenuates brain inflammation in experimental stroke[J].Brain Behav Immun,2012(26):61-71.
[15]李乐,张彩玲,宋必卫.青藤碱的药理研究与临床应用[J].中药新药与临床药理,2006,17(4):310-313.
[16]Oh YC,Kang OH,Kim SB.Anti-inflammatory effect of sinomenine by inhibition of pro-inflammatorymediators in PMA plus A23187-stimulated HMC-1 Cells[J].Eur Rev Med Pharmacol Sci,2012,16(9):1184-1191.
[17]闫建涛.青藤碱对大鼠肾缺血再灌注损伤保护作用及可能机制探讨[D].衡阳:南华大学,2010.
(*通讯作者:冷玉芳)
G424.31
B
1671-1246(2017)18-0157-03

