一种新的免疫检查点分子
——TIM-3
陆思芸,林峰,吴炯
浙江理工大学生命科学学院,杭州 310018
一种新的免疫检查点分子
——TIM-3
陆思芸,林峰,吴炯
浙江理工大学生命科学学院,杭州 310018
近十年在T细胞活化增殖方面的新认识,导致了多种免疫检查点蛋白的产生,并以此用来上调或者下调T细胞的活性。继PD-1之后,越来越多的研究开始重视TIM-3在各种疾病中的作用,将其作为一种新的免疫检查点分子。综述了TIM-3在NK、DC、CD4和CD8等淋巴细胞中的表达情况,及其对免疫系统的影响。
免疫检查点 TIM-3;免疫细胞;细胞因子;T细胞耗竭现象

吴炯,博士,浙江理工大学特聘教授,国家“千人计划”专家。曾任Cell Application公司副总裁,Cell Signaling Technology(CST)公司首席科学家,McGill大学教授。2012年诺贝尔生理学或医学奖得主Yamanaka的获奖之作iPS就是利用吴博士团队开发的原代细胞产品制作而成。E-mail:jwu1867@hotmail.com
免疫检查点(immune checkpoint)是指存在于免疫系统中的一种(几种)抑制受体或一条(几条)抑制信号通路,其可以调控免疫反应的强度或持续时间的长短,防止对正常外周组织的损害[1]。然而,在肿瘤微环境中,这种抑制性的通路被利用和扩大,导致了T细胞的耗竭失能现象。如PD-1/PD-L1是最早被发现并研究的一条通路,利用单抗阻断其相互作用在黑色素瘤等多种肿瘤疾病中起到了非常好的治疗作用[2]。但是随着研究的进一步深入,PD-1抗体的耐药性开始显现,在耐药的动物模型中发现,阻断PD-1通路后,其T细胞相继表达了大量的T细胞免疫球蛋白黏蛋白分子3(TIM-3)[3]。TIM-3是表达在活化的CD4+T细胞表面重要的负调节因子,TIM-3/Galectin-9的结合,将抑制T细胞的活性,使T细胞呈现“耗竭现象”。封闭TIM-3分子,阻断TIM-3/Galectin-9结合的通路,既可能进一步打破T细胞的“耗竭现象”,也将打破PD-1现有的僵局。所以,越来越多的研究开始转向PD-1和TIM-3两种单抗的联合使用,这样,既可以保留PD-1单抗在肿瘤免疫治疗中强大的作用,又可以打破其耐药性的肿瘤免疫微环境,是一种很有希望的新型肿瘤免疫治疗方案。因此,TIM-3作为一种新型的免疫检查点分子,研制与其特异性结合的单抗,对实现肿瘤免疫治疗有着重要的研究价值和巨大的潜力。
1 TIM-3的结构及其配体
1.1 TIM-3的结构模型
T细胞免疫球蛋白和黏蛋白结构域家族(TIM)最初是由Mcintire等在克隆的哮喘小鼠模型中发现的[4]。其后,在人染色体5q33.2上也发现了TIM家族[5],分别是TIM-1、TIM-3和TIM-4。而且在活化的Th1细胞(辅助性T细胞1)表面也发现了特异性表达的TIM-3。所有TIM的N端都有一个IgV结构域,其后紧随一个黏蛋白域、一个跨膜域和一个胞质尾结构,如图1所示。
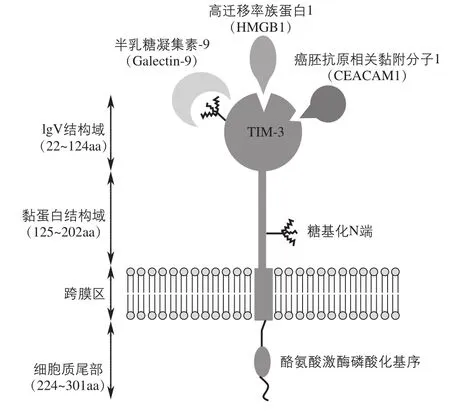
图1 TIM-3的结构及其配体
无论是小鼠还是人类,其IgV结构域都包含两个反向平行的β-片层。所有TIM的IgV结构域同其他免疫球蛋白结构域一样,包含6个保守的半胱氨酸残基,第1个和最后1个半胱氨酸残基桥接到β-片层。但特殊的是,在4个额外的半胱氨酸残基中有2个二硫键,使长的C'—C''循环向上折叠到β-片层,这种特有的结构域对于TIM-1、TIM-3、TIM-4和磷脂酰丝氨酸(phosphatidylserine,PS)结合是非常重要的[6]。
1.2 TIM-3的重要配体及其作用途径
Galectin-9、HMGB1和CEACAM1已被确认为TIM-3的3种重要配体。
Galectin-9结合在TIM-3的碳链端并且抑制Th1细胞的免疫作用[7]。TIM-3与Galectin-9结合后下调转录因子T细胞表达的T盒(T-box expressed in T cells,T-bet)水平[8]。此外Galectin-9还可以减少干扰素(IFN)和白介素12(IL-12)的产生[9]。人类TIM-3/Galectin-9通路的失调可引起自身慢性免疫性疾病,如多发性硬化症(MS)等。
在肿瘤免疫微环境中,HMGB1与肿瘤浸润的DCs(树突状细胞)上的TIM-3相互作用,通过阻断 Toll样受体3(TLR3)、TLR7、TLR9及细胞质中DNA和RNA相关的正常转运来抑制免疫反应,导致肿瘤的免疫逃逸,减弱DNA预防治疗及化疗的效果。
CEACAM1与TIM-3结合能抑制T细胞的活性,并且是慢性病毒感染或者肿瘤微环境中T细胞功能耗竭的一种标记[10]。大量的证据表明,TIM-3参与包括肿瘤在内的多种疾病的发生和发展,并对疾病的免疫调节起关键作用。
2 TIM-3在肿瘤中的信号途径
Anderson[11]的研究阐述了TIM-3在肿瘤中的作用,如图2所示。
图2(a)表明,在肿瘤微环境中功能障碍的CD8+T细胞表面有TIM-3的表达[12]。肿瘤细胞上的Gal-9与CD8+T细胞上的TIM-3结合后,将在TIM-3细胞质尾部的酪氨酸256和263处磷酸化,从TIM-3胞质尾部释放出人白细胞抗原B相关转录物3(Bat3)和无活性Lck(在酪氨酸505磷酸化,Ty505)。
同时TIM-3也大量存在于肿瘤组织内CD4+FoxP3+Treg细胞(调节性T细胞),并伴随着大量的IL-10、穿孔素和颗粒酶的分泌[8]。TIM-3+Treg细胞能有效抑制肿瘤组织中的免疫应答反应,并且可以作用于肿瘤内功能障碍的CD8+T细胞[13]。
除了T细胞,TIM-3还在骨髓来源的具有CD11b+和Gr-1+标志的抑制性细胞中表达[14]。TIM-3+T细胞会依赖Gal-9促进CD11b+和Gr-1+的骨髓来源的抑制细胞(MDSC)的增殖。MDSC会抑制肿瘤内的免疫应答反应。
TIM-3在肿瘤相关的树突状细胞(TADC)中特异性上调并且干扰TADC对坏死性肿瘤细胞释放的DNA的结合[11,15]。而TIM-3与HMGB1的结合既可以防止HMGB1与释放的DNA结合,同时也递送了晚期糖基化终产物受体(RAGE)和Toll样受体-2/4(TLR-2/4)[15]。HMGB1和TIM-3的结合,阻止了HMGB1的预警作用,也阻断了肿瘤组织中固有免疫反应的应答。基于对TIM-3在肿瘤中的通路研究,TIM-3将作为一个新的肿瘤治疗靶点进行研究。

图2 TIM-3在肿瘤中的作用途径
3 TIM-3在不同免疫细胞中的表达
TIM-3是免疫系统中多种细胞的受体,在调节先天免疫反应中起着重要作用。其中NK细胞是天然淋巴细胞中重要的组成之一,占外周血单核细胞数量的5%~20%。在抗病毒感染和肿瘤发生中都起着十分重要的作用。TIM-3最早是在活化的Th1细胞中被发现的,但不存在于Th2细胞中,这也使其成为最早区分Th1和Th2细胞的重要标志物[16]。进一步的研究表明,TIM-3不仅在NK细胞中表达,而且还是NK细胞成熟的标志,并能同时抑制细胞介导的细胞毒性作用[9]。
TIM-3作为一种负调节免疫分子,在DC、CD4+T、CD8+T和巨噬细胞中均有表达[17]。TIM-3在单核细胞和巨噬细胞中的表达与细胞凋亡和细胞吞噬作用有关。研究表明,离体CD8+T细胞中低表达TIM-3分子(TIM-3+CD8+T细胞约占离体CD8+T细胞总量的1%~2%)。虽然无法精确证明,但是RT-PCR等数据表明,CD4+T细胞中TIM-3的表达量略低于CD8+T细胞[16]。
TIM-3存在于人淋巴结中部分活化的CD4+T细胞中,但是从外周血中分离的CD4+T细胞并不表达TIM-3,需要CD3/CD28单抗联合作用的刺激下才能活化诱导TIM-3的表达[18]。而用CD3/CD28单抗激活过的CD4+T细胞,一小部分表达Gal-9分子,另一大部分表达TIM-3分子。且在T细胞的极化过程中,由于Th1和Th17细胞的TIM-3表达量是最高的,CD4+T细胞向Th1、Th2和Th17细胞的极化过程中也伴随着TIM-3表达量的变化。
4 TIM-3抗体阻断机制
最初对鼠科动物的研究表明,小鼠T细胞中的TIM-3与其配体Gal-9结合,导致Th1细胞的死亡和产生干扰素(IFN) 的T细胞的选择性凋亡。但是后来发现,人类TIM-3分子的作用机制不同于鼠科动物,用抗体阻断TIM-3分子后发现这并不能阻止细胞的死亡或者增强T细胞的增殖能力,而是增强所选因子在mRNA水平上的表达。为了进一步证明这个观点,在获得人脾脏细胞后,分选出TIM-3+CD4+T和TIM-3-CD4+T细胞,用CD3/CD28单抗激活48h,评估细胞因子产生的量。结果证明,TIM-3+CD4+T细胞对刺激并无反应,既不增殖也不产生细胞因子。因为,TIM-3+T细胞本身就处于被活化状态,进一步的活化刺激只会导致细胞呈现“耗竭现象”[16]。
TIM-3可调节T细胞功能耗竭并抑制其产生的免疫应答反应。用TIM-3抗体特异性地结合并封闭其免疫检查点后可以抑制TIM-3下游信号,阻断TIM-3/Galectin-9信号通路,逆转表达TIM-3的一些功能受损的细胞,如NK细胞等,恢复其抗肿瘤的能力,并调节CD4+T细胞向Th1、Th2和Th17细胞的极化。由此可见,封闭TIM-3途径有助于自身免疫性疾病的治疗。
5 T细胞的“耗竭现象”
在持续的慢性病毒感染的情况下,长时间的 T细胞激活产生了T细胞耗竭的独特现象。T细胞耗竭的特征表现在效应子功能的逐渐损失,最初是缺陷的细胞增生和具有较强功能的细胞凋亡,其次是减少IL-2和TNF-α等细胞因子的分泌,然后是IFN-γ和细胞毒性功能的丧失。据观察发现,表征耗尽的T细胞中有多种共抑制分子的表达,包括程序性死亡1(PD-1)、淋巴细胞激活基因-3(LAG-3)和TIM-3。T细胞耗竭是病毒本身逃避免疫监控的策略还是免疫系统限制T细胞过多避免交叉反应的发生,还尚未明了。
而这种T细胞的“耗竭现象”又并非是T细胞的凋亡,而是一种类似于细胞的“沉默表达”的现象。有趣的是,这种“耗竭现象”并非不可逆,是可以通过封闭免疫检查点PD-1/TIM-3等实现逆转的,并可以恢复T细胞原有的功能性。在肿瘤微环境中,肿瘤细胞或APC(抗原递呈细胞)的抑制性调节分子与T细胞结合,导致CD4+T和CD8+T细胞呈现“耗竭现象”以此来逃避人体免疫系统本身对肿瘤的杀伤作用[19]。而肿瘤免疫治疗的本质就是打破效应T细胞的无反应并阻断其细胞配体,允许效应细胞发挥肿瘤根除作用。
6 TIM-3/PD-1单抗在动物模型中的作用
耗竭的T细胞在抗原的刺激下并不反应,不增殖也不发挥效应子的功能,也不具有细胞毒性作用或者分泌细胞因子等功能。进一步研究证明,耗竭的T细胞的特征之一就是持续地表达PD-1,因此,PD-1被认定为慢性疾病中耗竭状态的T细胞的一种标记。此外,阻断PD-1/PD-L1的通路可以逆转T细胞的耗竭状态,发挥T细胞的效应功能,但阻断单一负调节分子只能部分恢复T细胞的效应功能,而同时封闭TIM-3和PD-1将可有效提高T细胞在免疫作用中的功能。
现已发现携带实体瘤的小鼠CD8+肿瘤浸润淋巴细胞(TILs)可表达TIM-3分子,且同时共表达PD-1,因此,共表达TIM-3+PD-1+TILs占TILs中的主要部分。而TIM-3+PD-1+TILs被认为是最严重的耗竭状态,因其无法增殖和分泌IL-2、TNF和IFN-γ等具有抗肿瘤作用的细胞因子。进一步研究表明,在控制肿瘤生长方面,TIM-3和PD-1多途径的靶向组合比单独靶向途径更有效。
研究发现,CT26结肠癌小鼠模型中,共表达TIM-3和PD-1的TILs约占50%,有趣的是,在所有TILs中,有TIM-3-PD-1+TILs或TIM-3-PD-1-TILs或TIM-3+PD-1+TILs,却没有TIM-3+PD-1-TILs细胞,Jones、Golden-Mason等认为联用TIM-3和PD-1/PD-L1(PDL1是PD-1分子的配体,封闭PD-1或PD-L1分子都可阻断PD-1/PD-L1通路)单抗阻断多条负调节通路,将是体内免疫系统抗肿瘤最有效的手段之一[20-21]。
在CT26荷瘤小鼠治疗过程中,已经表明,仅用TIM-3单抗并没有明显的抗肿瘤作用,但是仅用PD-L1单抗能延缓肿瘤的生长。联用TIM-3和PD-L1单抗组实验显示,该组具有显著的抗肿瘤作用,且同时具有延缓肿瘤生长的作用(图3)[22]。
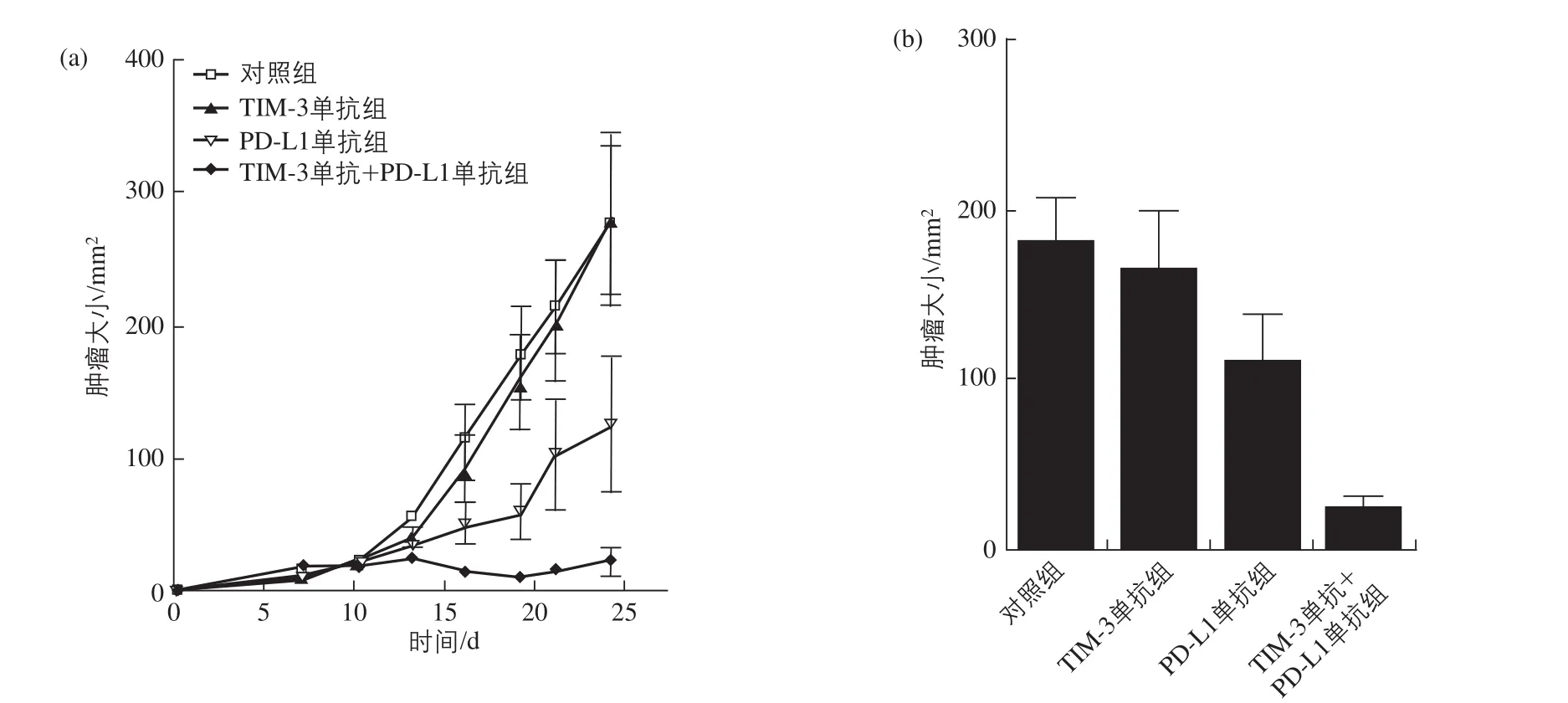
图3 CT26荷瘤小鼠治疗中瘤径大小变化
7 讨 论
近年来,关于TIM-3的研究进展迅速,对TIM-3在癌症和慢性感染中的免疫抑制微环境和T细胞耗竭的背景下进行了广泛而深入的研究。TIM-3的早期研究表明,其作用是阻止Th1和Th17细胞对自身抗原的反应和平衡Th1/Th2 细胞间的关系,这导致了自身免疫系统疾病的发生和发展。值得一提的是,NK细胞在体内存有肿瘤细胞或病毒感染等情况下不需要特异抗原的刺激,肿瘤细胞的表面结构可直接诱发NK 细胞的免疫反应。NK细胞在机体受到肿瘤攻击后反应迅速,可在数小时或一天内达到高峰。此外,NK细胞还可作用于CD4+T 细胞和CD8+CTL 细胞以强化获得性免疫力[23]。全面掌握这些作用途径,将有利于人类运用TIM-3抗体有针对性地治疗各种免疫系统相关的疾病,为自身免疫疾病和肿瘤免疫治疗开辟一条新的途径。
[1] 李春. 靶向免疫检查点的肿瘤免疫治疗现状与趋势[J]. 中国继续医学教育,2015,14:32-33.
[2] POSTOW M A,CALLAHAN M K,WOLCHOK J D. Immune checkpoint blockade in cancer therapy[J]. Journal of Clinical Oncology,2015,33(17):1974-1982.
[3] 董忠谊,钟文昭. 抗PD-1免疫治疗获得性耐药机制——新的免疫检查点 TIM3 激活 [J]. 循证医学,2016,16(3):135-135.
[4] MCINTIRE J J,UMETSU S E,AKBARI O,et al. Identification of Tapr(an airway hyperreactivity regulatory locus) and the linked Tim gene family[J]. Nature Immunology,2001,2(2):1109-1116.
[5] 张欢,吴斌. TIM-3在免疫调节中的临床应用价值[J]. 现代医学,2016,3:425-430.
[6] KOSTREWA D,BROCKHAUS M,D’ARCY A,et al. X-ray structure of junctional adhesion molecule:structural basis for homophilic adhesion via a novel dimerization motif[J]. Embo Journal,2001,20(16):4391-4398.
[7] ZHU C,ANDERSON A C,SCHUBART A,et al. The Tim-3 ligand galectin-9 negatively regulates T helper type 1 immunity[J]. Nature Immunology,2005,6(12):1245-1252.
[8] 辛燕,张峰波,马秀敏,等. Tim3/HMGB1在肿瘤免疫逃逸中的机制研究进展[J]. 细胞与分子免疫学杂志,2015,31(10):1437-1439.
[9] NDHLOVU L C,LOPEZ-VERGÈS S,BARBOUR J D,et al.Tim-3 marks human natural killer cell maturation and suppresses cell-mediated cytotoxicity[J]. Blood,2012,119(16):3734-3743.
[10] HUANG Y H,ZHU C,KONDO Y,et al. CEACAM1 regulates TIM-3-mediated tolerance and exhaustion[J]. Nature,2015,517(7534):386-390.
[11] ANDERSON A C. Tim-3:an emerging target in the cancer immunotherapy landscape[J]. Cancer Immunology Research,2014,2(5):393-398.
[12] 张胜桃,刘晓军,何培根,等. 人TIM-3的克隆表达及其单克隆抗体的制备[J]. 中华风湿病学杂志,2005,9(12):729-732.
[13] SAKUISHI K,NGIOW S F,SULLIVAN J M,et al. TIM3+FOXP3+regulatory T cells are tissue-speci fi c promoters of T-cell dysfunction in cancer[J]. Oncoimmunology,2013,2(4):e23849.
[14] DARDALHON V,ANDERSON A C,KARMAN J,et al. Tim-3/galectin-9 pathway:regulation of Th1 immunity through promotion of CD11b+Ly-6G+myeloid cells[J]. Immunol,2010,185(3):1383-1392.
[15] CHIBA S,BAGHDADI M,AKIBA H,et al. Tumor-in fi ltrating DCs suppress nucleic acid-mediated innate immune responses through interactions between the receptor TIM-3 and the alarmin HMGB1[J].Nature Immunology,2012,13(9):832-842.
[16] HASTINGS W D,ANDERSON D E,KASSAM N,et al. TIM-3 is expressed on activated human CD4+T cells and regulates Th1 and Th17 cytokines[J]. European Journal of Immunology,2009,39(9):2492-2501.
[17] DA S I,GALLOIS A,JIMENEZ-BARANDA S,et al. Reversal of NK-cell exhaustion in advanced melanoma by Tim-3 blockade[J].Cancer Immunology Research,2014,2(5):410-422.
[18] JU Y,SHANG X,LIU Z,et al. The Tim-3/galectin-9 pathway involves in the homeostasis of hepatic Tregs in a mouse model ofconcanavalin A-induced hepatitis[J]. Molecular Immunology,2014,58(1):85-91.
[19] NGIOW S F,TENG M W,SMYTH M J. Prospects for TIM3-targeted antitumor immunotherapy[J]. Cancer Research,2011,71(21):6567-6571.
[20] JONES R B,NDHLOVU L C,BARBOUR J D,et al. Tim-3 expression de fi nes a novel population of dysfunctional T cells with highly elevated frequencies in progressive HIV-1 infection[J]. Journal of Experimental Medicine,2008,205(12):2763-2779.
[21] GOLDENMASON L,PALMER B E,KASSAM N,et al. Negative immune regulator Tim-3 is over expressed on T Cells in hepatitis C virus infection and its blockade rescues dysfunctional CD4+and CD8+T cells[J]. Journal of Virology,2009,83(18):9122-9130.
[22] SAKUISHI K,APETOH L,SULLIVAN J M,et al. Targeting Tim-3 and PD-1 pathways to reverse T cell exhaustion and restore antitumor immunity[J]. Journal of Experimental Medicine,2010,207(10):2187-2194.
[23] 罗志刚,谢江波. CD3单抗、CD28/CpGODN共刺激活化的PBMC对膀胱癌细胞杀伤作用的研究[J]. 中南医学科学杂志,2004,32(1):31-34.
A novel immune checkpoint molecule:TIM-3
LU Siyun,LIN Feng,WU Jiong
Zhejiang Sci-Tech University, College of Life Sciences , Hangzhou 310018, China
Our new understanding of T cell activation and proliferation over the last decade has led to the production of immune checkpoint proteins and used to up-regulate or down-regulate T cell activity. After PD-1, more and more studies have focused on the role of TIM-3 in various diseases. This paper focused on TIM-3 expression in lymphocytes such as NK,Dendritic cells, CD4 and CD8 T cells, and how the expression is related to lymphocyte functions in the immune system.
immune checkpoint TIM-3; immune cells; cytokines; T cell exhaustion
10.3969/j.issn.1674-0319.2017.05.010
陆思芸,浙江理工大学生命科学学院硕士研究生。研究方向:肿瘤靶向治疗。E-mail:492715653@qq.com

