时间分辨后化学发光同时测定林可霉素和卡那霉素
闫瑞芳, 李 琴, 苗江欢, 章竹君
(1.新乡医学院基础医学院,河南新乡 453003;2.新乡医学院三全学院,河南新乡 453003;3.陕西师范大学化学与化工学院,陕西西安 710062)
林可霉素(Lincomycin)又名洁霉素,是一种林可胺类碱性抗生素,主要用于葡萄球菌、链球菌、肺炎链球菌引起的呼吸道感染、骨髓炎、关节和软组织感染、胆道感染和败血症,对某些厌氧菌感染也可应用[1]。但若使用不当可引起消化道反应、过敏反应、转氨酶升高、黄疸等,偶尔会有耳鸣、眩晕等不良反应。目前常见的测定林可霉素的方法有紫外分光光度法[2]、高效液相色谱法[3]、毛细管电泳[4]和化学发光分析法[5]。卡那霉素(Kanamicina)属于氨基糖苷类(AGs)抗生素,是由氨基环醇和氨基糖通过氧桥连接而成的苷类化合物,抗菌谱与庆大霉素相似,对金葡菌、绿脓杆菌、大肠杆菌及变形杆菌等均有效[6]。若使用不当可导致一定程度的耳、肾功能损害。常见的卡那霉素的检测方法有荧光法[7]、分光光度法[8]、方波伏安法[9]和高效液相色谱法[10]。临床上,林可霉素和卡那霉素可以同时使用,但是鉴于它们各自的副作用,因此必须加强其血药浓度的监测。目前,未见同时测定林可霉素和卡那霉素的相关报道。
1 实验部分
1.1 仪器和试剂
YN-FGⅠ型化学发光分析仪(河南农大迅捷测试技术有限公司);TU-1901紫外分光光度计(北京普析通用仪器有限公司);F-4600荧光分光光度计(日本,日立公司)。
卡那霉素标准溶液(1.0×10-3g/mL):准确称取硫酸卡那霉素标准品(中国药品生物制品检定所)50 mg,溶于水中,定容至50 mL,备用,使用时稀释到所需浓度。林可霉素标准溶液(1.0×10-4g/mL):准确称取盐酸林可霉素标准品(中国药品生物制品鉴定所)10 mg,溶于水中,定容至100 mL,备用,使用时稀释至所需的浓度。鲁米诺溶液(1.0×10-2mol/ L):准确称取1.77 g鲁米诺(陕西师范大学分析科学研究所合成),用10 mL 1.0 mol/L的NaOH溶液溶解,加水定容于1 000 mL容量瓶中,室温下放置7 d后使用。PMS溶液(8.0×10-3mol/L):准确称取PMS(K2SO4·KHSO4·2KHSO5,Alfa)0.3078 g,溶解定容至100 mL容量瓶中,现配现用。实验所需试剂除鲁米诺外均为分析纯,水为二次去离子水。
1.2 实验方法
测量前仪器先预热20 min。将2.0 mL 8.0×10-3mol/L PMS溶液和2.0 mL 2.5×10-5mol/L鲁米诺溶液混合后,直接加入测量池,然后将含有林可霉素和卡那霉素的标准溶液或样品溶液通过自动开关加入到测量池中,加入的同时,反应池与光电倍增管的连接开关已被打开。数据处理仪记录化学发光的动力学曲线。根据峰高和峰面积分别对林可霉素和卡那霉素进行定量测定。
2 结果与讨论
2.1 林可霉素和卡那霉素的后化学发光行为及反应动力学性质
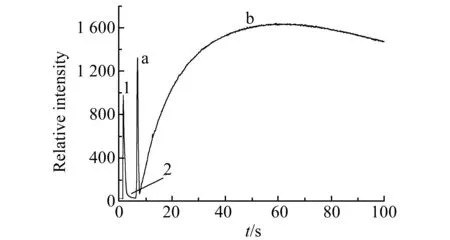
图1 化学发光强度-时间曲线Fig.1 The CL intensity-time curve1.2.0 mL 8.0×10-3 mol/L PMS solution was injected into 2.0 mL 2.5×10-5mol/L Luminol solution(in Na2CO3-NaHCO3, pH=11.25);2.the solution containing 8.0×10-6 g/mL kanamicina and 8.0×10-8 g/mL lincomycin was injected into the above reaction mixture(a.the optical signal of lincomycin reaction, b.the optical signal of kanamicina reaction).
如图1所示,PMS溶液加入到鲁米诺溶液中后立即发生化学反应(峰1),大约1 s后反应结束,化学发光信号衰减并逐渐回落到基线。此时,将含有林可霉素和卡那霉素的溶液加入到上述反应混合液中,又立即引发一快一慢的化学发光反应。林可霉素的化学发光反应(峰a)很快,大约0.8 s达到峰值,1.2 s后化学发光信号回到基线。而卡那霉素的化学发光反应(峰b)较慢,化学发光信号大约54.8 s后达到峰值,该化学发光反应持续10 min才回到基线。把含有林可霉素和卡那霉素的溶液单独加入到PMS溶液或鲁米诺溶液中均无化学发光信号产生。在同样条件下,用空白溶液代替含有林可霉素和卡那霉素的溶液进行实验,却未检测到化学发光信号。
林可霉素和卡那霉素的浓度比在一定范围内,他们的化学发光反应各自独立进行,互不干扰,其动力学曲线呈现出随时间分开的两个独立的发光峰。根据峰高和峰面积分别对溶液中林可霉素和卡那霉素进行定量。为减小误差,我们仅选择一定区间范围的峰面积进行积分定量分析,如30~80 s。
2.2 实验条件的优化
2.2.1鲁米诺溶液浓度的影响鲁米诺溶液的浓度对化学发光信号的影响较大。在5.0×10-6~2.5×10-4mol/L范围内,考察了鲁米诺溶液的浓度对测定结果的影响。结果表明,当鲁米诺溶液的浓度为2.5×10-5mol/L时,化学发光信号强度最大,故选用鲁米诺溶液的浓度为2.5×10-5mol/L。
2.2.2PMS溶液浓度的影响在6.0×10-4~6.0×10-2mol/L范围内,考察了PMS溶液的浓度对测定结果的影响。当PMS溶液浓度为8.0×10-3mol/L时,化学发光信号强度最大,故选用PMS溶液的浓度为8.0×10-3mol/L。
2.2.3缓冲介质及其pH值的影响研究了不同缓冲介质对化学发光强度的影响。如NaOH、Na2CO3、Na2CO3-NaHCO3、NaHCO3-NaOH、Na2B4O7、NaH2PO4-NaOH等,结果发现,当缓冲介质为NaHCO3-NaOH时,化学发光信号强度最大。故选择缓冲介质为NaHCO3-NaOH。用NaHCO3-NaOH缓冲溶液配制鲁米诺工作液。在pH值10.5~12.0的范围内考察缓冲溶液pH对化学发光信号的影响,结果表明当缓冲溶液的pH值为11.25时最合适,此时,可得到最大的化学发光信号。
2.3 分析性能
在最佳实验条件下,根据1.2节的操作步骤,考察了林可霉素和卡那霉素浓度与其后化学发光强度的关系。结果表明,林可霉素和卡那霉素浓度分别在4.0×10-9~8.0×10-7g/mL和4.0×10-7~8.0×10-5g/mL范围内与其后化学发光强度呈良好的线性关系。林可霉素、卡那霉素的线性回归方程分别为:y=0.2701c+1.670(r=0.9924),y=0.0545c+1.9094(r=0.9942)。对浓度为8.0×10-8g/mL的林可霉素溶液11次平行测定的相对标准偏差(RSD)为4.6%,对浓度为8.0×10-6g/mL的卡那霉素溶液11次平行测定的RSD为3.3%。按照IUPAC建议,该方法测定林可霉素和卡那霉素两种物质的检出限分别为1.0×10-9g/mL和1.0×10-7g/mL。
2.4 本方法与其他分析方法的比较
与文献报道的测定林可霉素和卡那霉素的方法其他相比,本方法测定卡那霉素的线性范围和灵敏度相当,但测定林可霉素的灵敏度要高,检出限低,见表1。

表1 本方法与文献报道分析方法的比较
2.5 干扰实验
在选定的实验条件下,用8.0×10-6g/mL卡那霉素和8.0×10-8g/mL林可霉素进行干扰试验,允许相对误差在±5%。结果表明,血液样品经高速离心后,样品中蛋白质的干扰可以忽略不计。血清中的其他物质如盐、脂质、氨基酸等对同时测定卡那霉素和林可霉素无干扰。对于样品来说,主要的干扰来自抗坏血酸和一些重金属离子,如:Co2+、Fe2+、Fe3+、Mn2+、Ni2+、Cu2+。重金属离子的干扰可以通过EDTA 掩蔽后消除。溶液稀释40倍后,不干扰测定。
2.6 样品分析
取0.5~1.0 mL健康人体血浆样品(陕西师范大学校医院),加入一定量林可霉素和卡那霉素的标准混合溶液,混匀,4 ℃、10 000 r/min超滤膜过滤离心10 min,以除去蛋白质。取无蛋白的上清液50 μL 稀释40倍,按照1.2所述的操作方法测定林可霉素和卡那霉素的含量,以未加林可霉素和卡那霉素的去蛋白血清同倍稀释溶液做空白。测定结果列于表2。
2.7 化学发光机理探讨
在改装的970-CRT荧光分光光度计上分别绘制了PMS -鲁米诺化学发光反应,以及含有林可霉素和卡那霉素溶液在PMS -鲁米诺体系中引发的后化学发光反应的化学发光光谱(图2)。从图中可以看出,两个化学发光反应的最大发射波长均为425 nm,这说明后化学发光反应与PMS -鲁米诺化学发光反应有相同的发光体。众所周知,鲁米诺化学发光反应的发光体是激发态的3-氨基邻苯二甲酸根离子(3-AP*)。从而可以确定所研究的后化学发光反应的发光体是3-AP*。
表2 人血清样品中林可霉素和卡那霉素的测定结果(n=3)
在TU-1901紫外-可见分光光度计上分别扫描了(林可霉素+卡那霉素)溶液(a)、PMS -(林可霉素+卡那霉素)混合溶液(b)的紫外-可见吸收光谱(图3)。(林可霉素+卡那霉素)溶液的紫外-可见吸收光谱在波长198 nm处有吸收峰。结果表明,在b的紫外-可见吸收光谱图上,(林可霉素+卡那霉素)在波长198 nm处的特征吸收峰消失了。
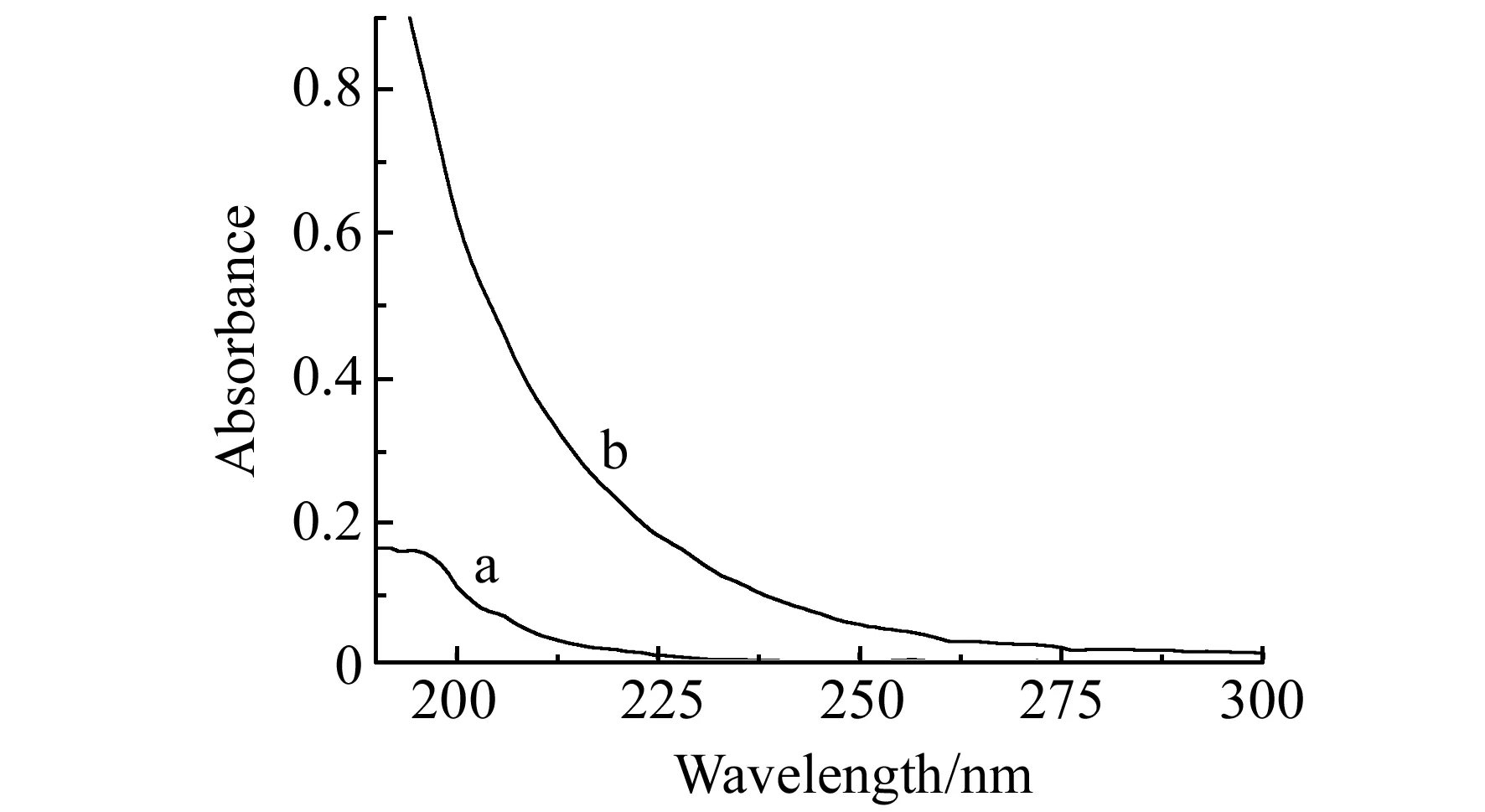
图3 紫外吸收光谱Fig.3 UV-Vis spectraa.the mixed solution of kanamicina(8.0×10-6 g/mL) and lincomycin(8.0×10-8 g/mL);b.PMS -the solution containing kanamicina(8.0×10-6 g/mL) and lincomycin(8.0×10-8 g/mL).
根据以上结果,我们推测含有林可霉素和卡那霉素的溶液在PMS -鲁米诺体系中后化学反应的机理可能是:碱性条件下,PMS氧化鲁米诺,生成3-AP*,3-AP*回到基态时,产生化学发光。回到基态的3-AP存留于反应后的溶液之中,可以吸收能量再次被激发。当含有林可霉素和卡那霉素溶液加入到此反应后的溶液之中时,PMS氧化(林可霉素+卡那霉素)并释放出一定的能量,溶液中存留的3-AP吸收了该反应释放的能量而再次被激发。激发态3-AP回到基态时产生了后化学发光。
此机理可以简单地表示如下:



3 结论
在PMS -鲁米诺体系中,林可霉素的化学发光反应较快,而卡那霉素的化学发光反应较慢,基于林可霉素和卡那霉素的化学发光反应动力学性质不同,建立了同时测定林可霉素和卡那霉素的时间分辨后化学发光的新的分析方法。该方法与以前报道的方法相比,具有很好的选择性和灵敏度。

