超高效液相色谱飞行时间质谱联用分析苗药头花蓼醇提物及水提物化学成分
周雯 张丽艳 谢立敏 丘利芳 王静蓉 马四补 姜志宏 唐静雯
[摘要]该研究应用超高效液相色谱飞行时间质谱联用对苗药头花蓼醇提物与水提物的化学成分进行分析与鉴定。采用 Waters ACQUITY UPLC BEH C18色谱柱(21 mm×100 mm,17 μm);以010%甲酸水溶液(A) 010%甲酸乙腈溶液(B)为流动相梯度洗脱;流速为035 mL·min-1;ESIMS检测采用负离子模式。根据精确相对分子质量,结合数据库匹配进行结构鉴定。结果显示醇提物及水提物皆以黄酮类﹑多酚类及木脂素类成分为主,但醇提物与水提物化学成分具有明显差异,具体为:醇提物中的可水解类鞣质成分明显减少,鞣花酸的缺失,花青素类化合物的新增等。该研究为阐明头花蓼醇提物与水提物中的药效物质基础提供了重要依据。而且可以为基于“有效组分” 的中药新药研制提供基础。
[关键词]头花蓼; 提取物; 超高效液相色谱飞行时间质谱; 化学成分
Analysis of alcohol extract and water extract of
Polygonum capitatum by UPLCQTOFMS
ZHOU Wen1, ZHANG Liyan1*, XIE Limin2, QIU Lifang2, WANG Jingrong2, MA Sibu1,
JIANG Zhihong2, TANG Jingwen3
(1. School of Pharmacy, Guiyang College of Traditional Chinese Medicine, Guiyang 550002, China;
2. State Key Laboratory of Quality of Traditional Chinese Medicine, Macao University of Science and Technology, Macau 999078, China;
3. Guizhou Weimen Pharmaceutical Co, Ltd, Guiyang 550004, China)
[Abstract]In this study, we used Ultra Performance Liquid ChromatographyTimeofFlight Mass Spectrometry(UPLCTOFMS)to identify the chemical constituents in both ethanol and water extract of Polygonum capitatum A Waters ACQUITY UPLC BEH C18 column(21 mm×100 mm,17 μm) was used for separation The mobile phase was consisted of(A) 010% formic acid in water and(B)010% formic acid in acetonitrile, and the flow rate was 035 mL·min-1 ESI source in negative ion mode was used for MS detection Structural identification was carried out according to the accurate mass and matching with database The results showed that flavonoids, polyphenols and lignans were the main components in both extracts However, the chemical compositions of both extracts were different, eg there are less hydrolyzable tannins, loss of ellagic acid and more anthocyanins in ethanol extract In a conclusion, this study provides an important scientific basis for identifying the active ingredients in P capitatum, which also help to reveal the pharmacological effect of P capitatum.
[Key words]Polygonum capitatum; extract; UPLCTOFMS; chemical composition
頭花蓼为蓼科植物头花蓼Polygonum capitatum BuchHamex DDon的干燥全草或地上部分,收载于《贵州省中药材、民族药材质量标准》2003年版[1]。是贵州别具特色的苗药。具清热利湿、解毒止痛、活血散瘀、利尿通淋之功效,民间常用其治疗泌尿系统感染、血尿、湿疹、肾盂肾炎、膀胱炎、尿路结石等症[2]。目前,已有其化学成分研究报道,但不同提取方法化学成分的差异比较尚未见报道。超高效液相色谱串联飞行时间质谱(UPLCTOFMS)分析技术,具有分离快速、灵敏度高、可提供精确分子量等优点,并可以根据裂解规律对化学成分进行解析,已成为中药活性成分研究的最有效的分析手段之一[3]。基于此,本研究采用超高效液相色谱飞行时间质谱(UPLCTOFMS)方法,以头花蓼醇提物及水提物为研究对象,利用一级﹑二级质谱数据,鉴定头花蓼醇提物及水提物中的化学成分。从化学的角度阐明头花蓼不同提取方法所得的化学成分的差异,为该药的药效物质基础提供科学依据。endprint
1材料
超高效液相色谱飞行时间质谱联用仪[美国Waters公司Acquity超高效液相色谱系统、高压二元梯度泵、恒温自动进样器、柱温箱、二极管阵列检测器、电喷雾接口、四极杆飞行时间质谱仪(QTOFMS, Bruker公司)、Hystar工作站﹔美国Agilent公司1290 Infinity液相色谱系统、6550 iFunnel四极杆飞行时间质谱仪、MassHunter工作站]。TGL16G离心机(上海安亭科学仪器厂)、超声处理器(100HZ,北京创新德超电子研究所)。
头花蓼醇提取物和水提取物样品均由贵州威门药业股份有限公司提供(样品编号分别为10246和10246)。头花蓼醇提物制备:取头花蓼药材,分别加7倍量70%乙醇回流提取2次,每次15 h,滤过,合并滤液,回收乙醇并浓缩至相对密度为120~125(60 ℃测)的稠膏,减压干燥、粉碎成细粉,即得。头花蓼水提物制备:取头花蓼药材,加水煎煮2次(第一次加8倍量水,第二次加6倍量水),每次15 h,煎液滤过,滤液合并,浓缩至适量,滤过,喷雾干燥,即得。头花蓼药材由贵州威门药业股份有限公司贵州施秉头花蓼GAP 种植基地提供,由贵阳中医学院魏升华教授鉴定为蓼科植物头花蓼P capitatum的干燥全草。对照品quercitrin(槲皮苷), gallic acid(没食子酸), ellagic acid(鞣花酸)购自中国食品药品检定研究院。甲醇、乙腈、甲酸为色谱纯(ACS公司),MilliQ水由Millipak20 Filter Unit处理,其他试剂均为分析纯。
2方法
21色谱条件液相色谱条件:色谱柱为Waters ACQUITY UPLC BEH C18色谱柱(21 mm×100 mm, 17 μm);以01%甲酸水溶液为流动相(A),01 %甲酸乙腈溶液为流动相(B),梯度洗脱为0~05 min,5% B;05~20 min,5%~185% B;20~28 min,185%~100% B;28~30 min;100%B;30~301 min,100%~5% B;301~32 min,5% B, 流速035 mL·min-1;自动进样2 μL;柱温40 ℃。
22质谱条件利用Bruker QTOF采集一级质谱数据:ESI离子源,离子源温度180 ℃,毛细管电压4 500 eV;负离子检测模式;喷雾压力25 bar;干燥氮气流速80 L·min-1;扫描范围100~2 000。利用Agilent QTOF采集二级质谱数据ESI离子源,离子源温度250 ℃,干燥氮气流速13 L·min-1,鞘气(氮气)温度300 ℃,鞘气流速11 L·min-1;负离子检测模式;扫描范围m/z 100~2 000,碰撞能量10~40 eV。
23供试品的制备称取适量头花蓼醇提取物粉末,加入70 %甲醇使浓度达5 g·L-1,超声处理使尽量溶解,混悬液稀释10倍,摇匀,过滤,备用。
称取适量头花蓼水提取物粉末,加入水使浓度为5 g·L-1,超声处理使完全溶解,用甲醇稀释1倍,摇匀,滤过,续滤液过022 μm微孔滤膜,备用。
24数据库的建立与数据分析通过检索数据库Dictionary of Natural Products中头花蓼的化学成分以及关于头花蓼化学成分研究的相关文献[47],首先建立头花蓼化学成分数据库,其中包括各化学成分的化学分子式﹑相对分子质量等信息。再根据一级质谱所提供的精确相对分子质量﹑同位素丰度和同位素间距等信息与数据库中的化学成分进行匹配,并进一步利用二级质谱数据,根据所得的碎片信息来对各色谱峰进行鉴定。同时利用与对照品比对出峰时间﹑精确分子量和二级碎片来确认部分色谱峰。
3结果
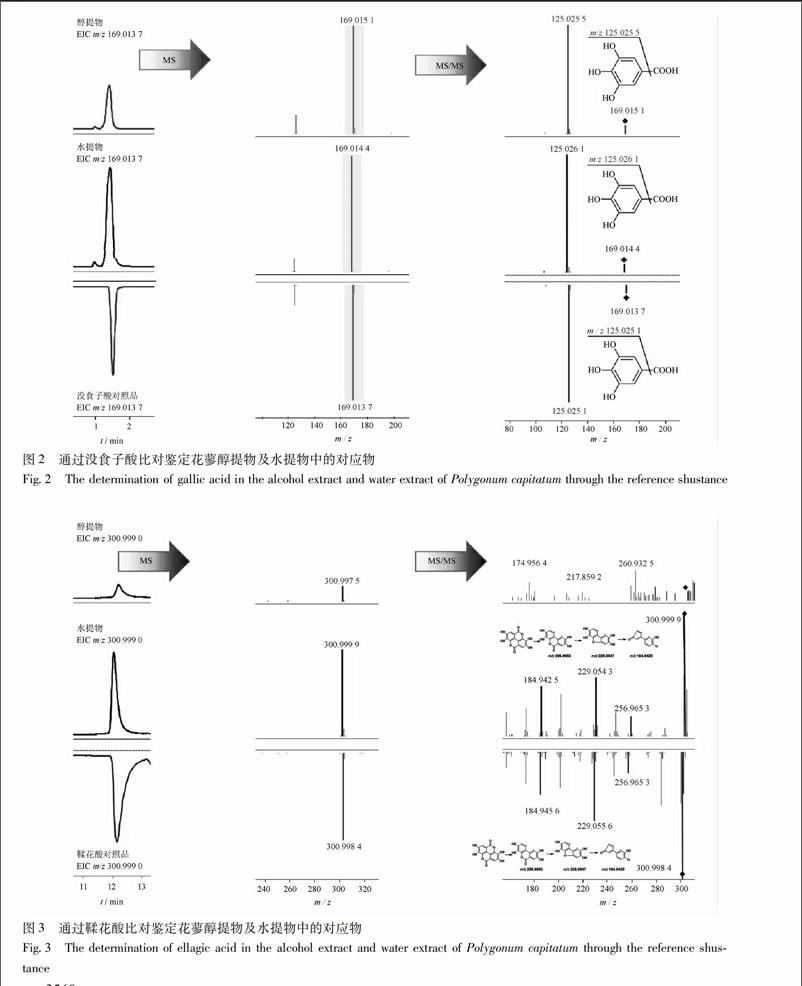
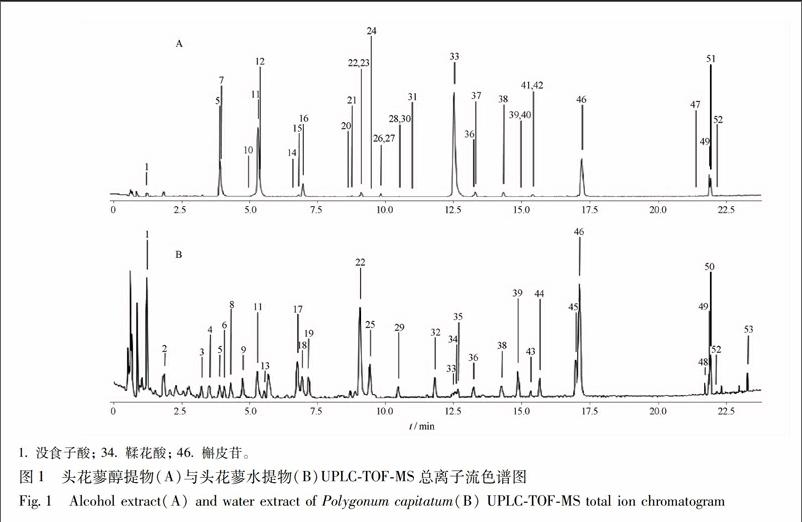
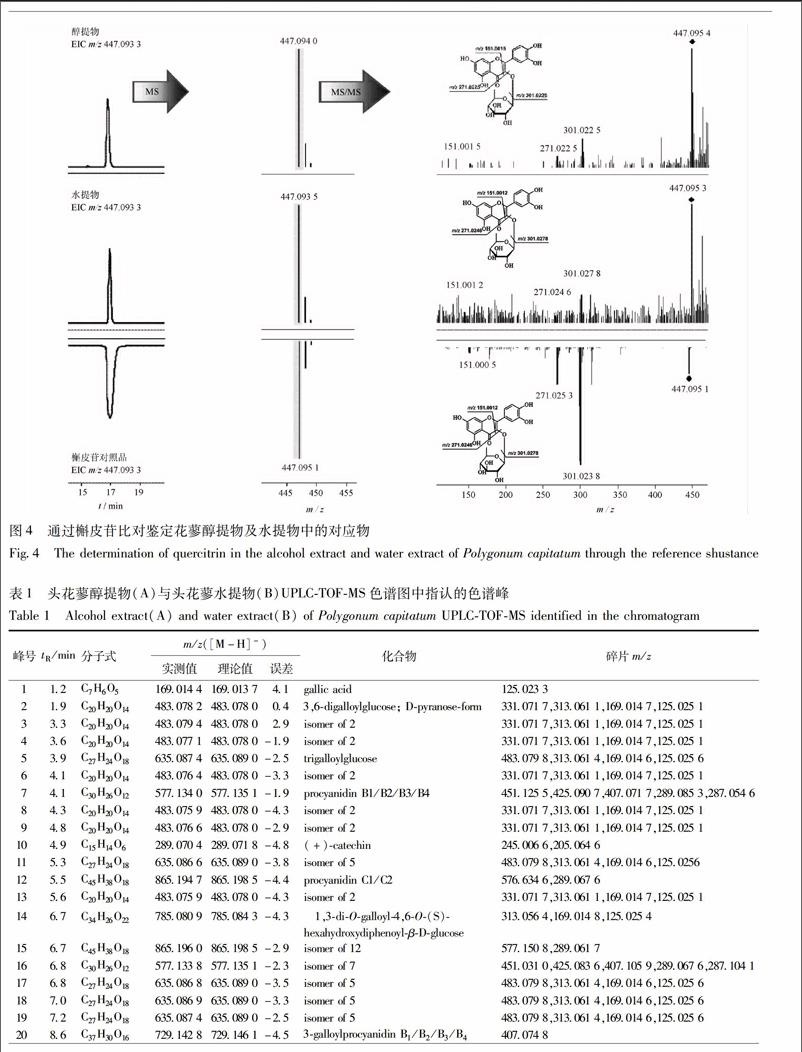
31头花蓼醇提物与水提物的化学成分鉴定按21及22项色谱及质谱条件进行检测,头花蓼醇提物所得的总离子流色谱图见图1A,头花蓼水提物所得的总离子流色谱图见图1B。对各色谱峰的鉴定,首先利用一级质谱分析,获得各色谱峰的精确分子量﹑同位素丰度和同位素间距等讯息,再与本课题组建立的头花蓼数据库中的化学成分进行匹配,获得初步的鉴定结果。接着,进一步利用二级质谱数据进行验证。以头花蓼醇提物总离子流色谱图中的主要色谱峰(峰33)作为例子,根据一级质谱,该色谱的质荷比m/z 937092 2,根据其同位素丰度和同位素间距推测为单电荷离子。经检索头花蓼的数据库,发现化学成分davidiin(化学分子式为C41H30O26,理论m/z 937095 3)的相对分子质量与其匹配,误差为-33,因此初步确定该峰为davidiin。二级质谱显示3个主要碎片:m/z 785085 3[M-C6H5O3CO-H]-,741092 9[M-C6H5O3CO-CO2-H]-, 589081 7[M-2C6H5O3CO-CO2-H]-。最后鉴定峰33为davidiin。此外,比对样品与对照品出峰时间﹑精确相对分子质量和二级碎片。,没食子酸对照品的出峰时间为12 min,其精确相对分子质量为m/z 169013 7,二级碎片主要为m/z 125025 1,见图2。而峰1(同时出现于醇提物及水提物中)的出峰时间为12 min,其精确相对分子质量為m/z 169015 1(醇提物),169014 4(水提物),二级碎片主要为m/z 125025 5(醇提物),125026 1(水提物)﹔其出峰时间﹑精确相对分子质量和二级碎片均与没食子酸对照品非常匹配,因此确定峰1为gallic acid(没食子酸)。以同样方法,确定峰34为ellagic acid(鞣花酸),见图3,峰46为quercitrin(槲皮苷),见图4。采用上述分析手段,最后于头花蓼醇提物及水提物中共鉴定出53个化合物,其鉴定结果见表1。头花蓼醇提物及水提物中的成分以黄酮类和多酚类成分为主,包括:①黄酮及黄酮苷类化合物(其中以黄酮为苷元,单糖或双糖苷,部分还有没食子酰基);②多酚类成分,包括没食子可水解鞣质,儿茶素及其聚合体;③木脂素及其苷类化合物等。endprint
32头花蓼醇提物与水提物的化学成分对比分析头花蓼醇提物与水提物的成分具有明显的差异,见图1。两者只有11个共有成分,分别为峰1(gallic acid,没食子酸),峰5,11,22(trigalloylglucose,三没食子酰葡萄糖或异构体),峰33(davidiin),峰36,38(quercetin3OβDglucopyranoside,槲皮素3OβD葡萄糖苷或异构体),峰39(nudiposide),峰46(quercitrin,槲皮苷),峰49(2″Ogalloyl quercetin),峰52(6acetyl3′,6′diferuloylsucrose)。当中,没食子酸﹑三没食子酰葡萄糖﹑nudiposid于水提物的含量明显高于醇提物﹔反之,davidiin醇提物的含量则明显高于水提物。
有21个成分只存在于醇提物中,分别为峰7,16,28(procyanidin B1/B2/B3/B4,原花青素或异构体),峰10[(+)catechin,儿茶素],峰12,15,27(procyanidin C1/C2,原花青素或异构体),峰14(1,3diOgalloyl4,6O(S)hexahydroxydiphenoylβDglucose),峰20,23,30(3galloylprocyanidin B1/B2/B3 /B4,没食子酰前矢车菊素或异构体),峰21(trigalloylglucose,三没食子酰葡萄糖或异构体),峰24,31,40,42(granatin B/carpinusin或异构体),峰26(diOgalloylHHDPβDglucose),峰37[(-)epicatechin3Ogallate,表儿茶素3O没食子酸酯],峰41(2″Ogalloyl hirsutrin),峰47(3,3′digalloylprocyanidin B2),峰51(viviparum B)。
有21个成分只存在于水提物中,分别为:峰2~4,6,8,9,13(3,6digalloylglucose; Dpyranoseform,3,6二没食子酰基葡萄糖或异构体),峰17~19,25,29,32(trigalloylglucose,三没食子酰葡萄糖或异构体),峰34(ellagic acid,鞣花酸),峰35[(+)lyoniresinol2αOβglucopyranoside],峰43(2″Ogalloyl hirsutrin),峰44,45(schizandriside),峰48(helonioside A),峰50(2″Ogalloyl quercetin),峰53(3,8diOmethylellagic acid)。
总括而言,花青素类化合物只存在于醇提物中,而水解鞣质类化合物(二没食子酰葡萄糖﹑三没食子酰葡萄糖)﹑槲皮素类化合物和鞣花酸等于水提物中的含量则明显高于醇提物。由此可见,使用不用溶剂提取头花蓼对其所得的提取物中的化学成分具有重要的影响。
4讨论
本研究对头花蓼以不同方法提取后所得的化学成分进行分析比较,发现头花蓼醇提物与水提物中的化学成分皆以黄酮类和多酚类成分为主。包括:①黄酮及黄酮苷类化合物以黄酮为苷元,单糖或双糖苷,部分连有没食子酰基;②多酚類成分,包括没食子可水解鞣质,儿茶素及其聚合体;③木脂素及其苷类化合物等,这些化合物很有可能是头花蓼的活性成分。
头花蓼醇提与水提物所含的化学成分具有显著的差异,两者只有11个共有成分。当中花青素类化合物,如原花青素B1~B4只存在于醇提物中,这可能是因为这类化合物在水煎煮过程中发生了进一步的聚合或氧化反应,但有关这方面的解释还有待进一步研究。水解鞣质类化合物﹑槲皮素类化合物和鞣花酸等于水提物中的含量则明显高于醇提物,这可能与不同化学物的溶解度有关。贵州威门药业股份有限公司生产的发热淋清颗粒为水提制剂,这些化学成分是否其发挥药效的物质基础还有待进一步研究。
头花蓼有较好的体外抗氧化活性,其甲醇提取物具有很强的清除DPPH自由基、ABTS自由基及还原Fe3+的能力,总抗氧化能力远远超过BHT的作用,头花蓼具有较好的抗氧化作用,其强弱程度取决于提取溶剂[8]。而水提是其制剂热淋清颗粒的提取方法,其具清热解毒、利尿通淋的功效,用于湿热蕴结、小便黄赤、淋漓涩痛之证和尿路感染、肾盂肾炎见上述症候者[9]。本文为阐明头花蓼醇提物与水提物中的药效物质基础的提供了重要依据。
[参考文献]
[1]贵州省食品药品监督管理局. 贵州省中药材民族药材质量标准[M]. 贵阳:贵州科技出版社,2003:147.
[2]江苏新医学院. 中药大辞典 [M]. 上海:上海人民出版社, 1977.
[3]胡峻,张权,齐梦蝶,等. 基于UPLCQTOFMS技术的川西吊石苣苔中化学成分分析[J]. 中国中药杂志, 2016,41(9):1658.
[4]陈旭冰,刘晓宇,陈光勇, 等. 头花蓼化学成分研究[J]. 安徽农业科学, 2011, 39(23):14025.
[5]赵焕新,白虹,李巍,等. 头花蓼化学成分研究[J]. 天然产物研究与开发, 2011(23):262.
[6]李勇军,骆宏丰,王永林, 等. 头花蓼黄酮类化学成分的研究[J]. 中国药学杂, 2000,35(5):300.
[7]Liao S G, Zhang L J, Sun Fa, et al. Identification and characterisation of phenolics in Polygonum capitatum by ultrahighperformance liquid chromatography with photodiode array chromatography with photodiode array detection and tandem mass spectrometry[J]. Phytochem Anal, 2013(6):556.
[8]闫杏莲,李昌勤,刘瑜新,等. 头花蓼抗氧化活性研究[J]. 中国药房, 2010(39):3659.
[9]史蕙 RPHPLC法测定热淋清片中没食子酸的含量[J]. 中国药房, 2011(32):3052.
[责任编辑丁广治]endprint

