吉马酮改善H2O2诱导的脐静脉血管内皮细胞氧化应激损伤的作用
陈琼芳 王钢 唐丽清++俞献文
[摘要]該文主要研究吉马酮对过氧化氢(H2O2)诱导的脐静脉血管内皮细胞(HUVECs)氧化损伤的保护作用并探讨其可能的作用机制。使用500 μmol·L-1H2O2诱导脐静脉内皮细胞3 h,从而建立氧化损伤模型,再用不同浓度吉马酮(20,40,100,150,200 μmol·L-1)保护24 h。利用MTT法检测吉马酮对H2O2损伤HUVECs细胞活力的影响;ELISA法检测PGI2,TXB2,ET1,tPA,PAI1,TNFα和IL6;硝酸还原酶法检测NO;比色法检测NOS及GSHPx;再分别采用TBA法、WST1法和微量酶标法检测MDA,SOD和LDH的含量等;Hoechst 33258荧光染色法观察细胞凋亡情况;RTPCR检测细胞中Bax,Bcl2,Caspase3 mRNA表达。结果表明500 μmol·L-1H2O2作用3 h细胞损伤率达到52%,而在20~200 μmol·L-1随着吉马酮浓度的增大被损伤细胞活性不断增强。与正常组比较,H2O2损伤使PGI2,NO,TNOS,tPA,SOD,GSHPx和Bcl2 mRNA降低,使PAI1,ET1,IL6,TNFα,TXB2,LDH,MDA,Bax mRNA和Caspase3 mRNA增加;与模型组比较,吉马酮(200,100,50 μmol·L-1)使PGI2,NO,TNOS,tPA,SOD,GSHPx和Bcl2 mRNA增加,使PAI1,ET1,IL6,TNFα,TXB2,LDH,MDA,Bax mRNA和Caspase3 mRNA减少。Hoechst 33258荧光染色与正常组比较,模型组细胞膜与细胞核呈浓缩致密的强蓝色荧光,细胞数量明显减少;与模型组比较,给药组的蓝色荧光强度降低等。以上研究结果表明,吉马酮可能通过抗氧化及抑制细胞凋亡等作用,从而改善H2O2诱导的脐静脉血管内皮细胞氧化应激损伤的作用。
[关键词]吉马酮; H2O2; 脐静脉内皮细胞; 氧化应激; 保护作用
Effect of germacrone in alleviating HUVECs damaged by
H2O2induced oxidative stress
CHEN Qiongfang1, WANG Gang1, TANG Liqing1, YU Xianwen1, LI Zhaofei2, YANG Xiufen1*
(1. Department of Pharmacology, School of Pharmacy, Guangxi University of Chinese Medicine, Nanning 530001, China;
2. Shaanxi Second People′s Hospital, Xi′an 710000, China)
[Abstract]This study focuses on the protective effect of germacrone on human umbilical vein endothelial cells(HUVECs) damaged by H2O2induced oxidative stress and its possible mechanisms. The oxidative damage model was established by using 500 μmol·L-1 H2O2 to treat HUVECs for 3 hours, and then protected with different concentrations of germacrone for 24 hours. The effect of germacrone on cell viability of HUVECs damaged by H2O2 was detected by MTT. The contents of PGI2, TXB2, ET1, tPA, PAI1, TNFα and IL6 were detected by ELISA. The content of NO was detected by using nitrate reductase method. Colorimetry was used to detect NOS and GSHPx. The contents of MDA, SOD and LDH were detected by TBA, WST1 and microplate respectively. Apoptosis was observed by Hoechst 33258 fluorescent staining. The mRNA expressions of Bax, Bcl2 and Caspase3 in cells were detected by RTPCR. The results showed that the cell damage rate was 52% after treated with 500 μmol·L1 H2O2 for 3 hours. The cell activity was increasing with the rise of germacrone concentration within the range of 20200 mol·L-1. Compared with normal group, the contents of PGI2, NO, TNOS, tPA, SOD, GSHPx and Bcl2 mRNA expressions were lower after damaged with H2O2. The contents of PAI1, ET1, IL6, TNFα, TXB2, LDH, MDA, Bax mRNA and Caspase3 mRNA expressions were increased. Compared with model group, the contents of PGI2, NO, TNOS, tPA, SOD, GSHPx and Bcl2 mRNA expressions were increased after treated with germacrone. The contents of PAI1, ET1, IL6, TNFα, TXB2, LDH, MDA, Bax mRNA and Caspase3 mRNA expressions were lower after treated with germacrone. According to Hoechst 33258 fluorescence staining, compared with normal group, the cell membrane and the nucleus showed strong dense blue fluorescence, and the number of cells significantly decreased in model group. Compared with model group, blue fluorescence intensity decreased in drug group. The above findings demonstrate that germacrone may improve the effect on HUVECs damaged by H2O2induced oxidative stress by resisting oxidation and inhibiting cell apoptosis.endprint
[Key words]germacrone; H2O2; human umbilical vein endothelial cell(HUVEC); oxidative stress; protective effect
血管内皮细胞与血管生理学的血管舒张、再生、炎症和屏障功能等许多方面密切相关,同样内皮细胞损伤也是导致动脉粥样硬化和高血压等疾病的重要因素之一[1],其中氧化应激引起的血管内皮细胞氧化应激损伤是引起血管内皮功能障碍的重要因素[2]。因此,保护和改善血管内皮细胞的功能是预防和治疗疾病的重要手段,从而利用天然药用植物有效成分预防血管内皮细胞的损伤来研究治疗心血管疾病形成热潮。
氧化应激是由潜在的活性氧生成与清除活性之间不平衡而导致的代谢状态[3]。氧化应激损伤还可导致中性粒细胞炎性浸润,蛋白酶分泌增加,产生大量氧化中间产物,及机体存在的一些抗氧化酶的变化,主要包括超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSHPx)、过氧化氢酶(CAT)等。因此认为其是导致衰老和疾病的一个比较重要的因素。本研究通过过氧化氢(H2O2)损伤HUVECs 细胞从而建立氧化应激体外模型,用于探讨吉马酮对HUVECs细胞氧化应激损伤的保护作用和机制,为吉马酮的进一步研究和开发提供有益的依据。
1材料
11药物及配置吉马酮(纯度≥98%,购自中国科学院成都生物研究所,Lot No MUST15012414)。吉马酮的配制:精密称取吉马酮,加入DMSO吹打数次使其溶解完全(DMSO的质量分数为01%),再加入DMEM/F12培养液充分混匀,再经025 μm微孔滤膜过滤除菌,即得。
12试剂30%H2O2(成都市科龙化工试剂厂);DMEM/F12细胞培养液(Hyclone,Lot No AAL209346);四季青胎牛血清(浙江天杭生物科技有限公司);1×PBS(Gibco,Lot No 8116251);025%胰蛋白酶EDTA消化液(Gibco,Lot No 1665735);MTT(Sigma,Lot No M2128);DMSO(Sigma,Lot No 520C031);4%多聚甲醛(Solarbio,Lot No 20160711);Hoechst 33258染色液(生物工程,E6073010005);NO试剂盒、TNOS试剂盒、LDH测试盒、GSHPx测试盒、SOD测定试剂盒和微量MDA测试盒(南京建成生物工程研究所);PGI2,TXB2,ET1,tPA,PAI1,TNFα和IL6酶联免疫试剂盒(武汉华美生物工程有限公司);DEPC水(生物工程上海有限公司,Lot No C612BA0013);RNAiso plus(TAKARA);异丙醇、无水乙醇和氯仿(AR,成都市新都区木兰镇工业开发区);RevertAid First Strand cDNA Synthesis Kit(Thermo,Lot No 00310953);Taq MasterMix(康为,Lot No 00461511);内参GAPDH(生物工程购买);引物(宝生物公司合成)。
13仪器细胞培养箱(Sanyo,MCO18AIC);TECAN全波长酶标仪(Infinite M200PRO);高速多用离心机(Thermo Fisher);电热恒温鼓风干燥箱(上海鸿都电子科技有限公司,DHG9140A);倒置荧光显微镜(Leica,DMI3000B);通用电泳仪(PowerPac Universal);低温离心机(Eppenderf,Centrifuge 5430R);PCR仪(BIO RAO T100TMThermal Cycler);凝胶成像仪(BIORAD)。
2方法
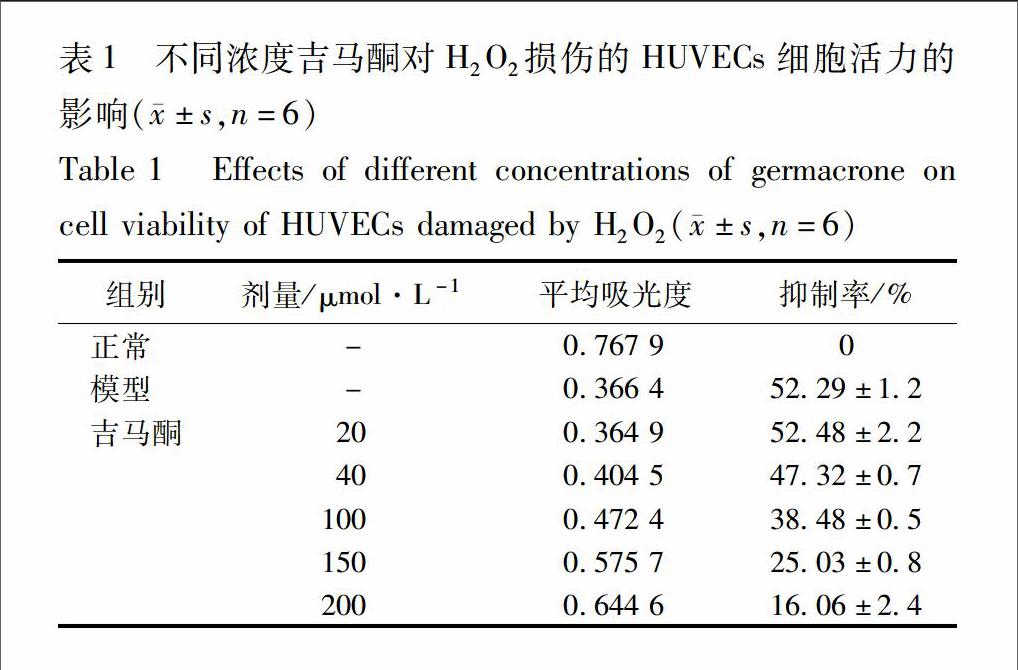
21氧化损伤模型的建立及MTT比色法检测吉马酮对H2O2损伤HUVECs活性的影响参考相关文献[45],消化离心制备细胞悬液,细胞计数,稀释使细胞浓度为5×104个/mL待用,96孔板每孔加入150 μL细胞悬液(每孔约75×103个细胞),贴壁24 h,吸出培养液,1×PBS洗涤2遍,每孔加入150 μL的500 μmol·L-1 H2O2孵育3 h,即得H2O2氧化损伤模型。吸出损伤液,1×PBS洗涤2遍,正常组与模型组分别加入150 μL培养液,给药组分别加入150 μL含不同浓度吉马酮(分别为20,40,100,150,200 μmol·L-1)的培养液,置入培养箱中培养24 h,再采用MTT法在490 nm检测A。每组設计6个复孔,实验重复3遍。抑制率=[(A正常值-A空白组)-(A模型组-A空白组)]/(A正常值-A空白组)×100%。
22实验分组及细胞培养上清液和细胞裂解液的制备实验分为正常组、模型组(500 μmol·L-1H2O2)、吉马酮高剂量组(200 μmol·L-1 )、吉马酮中剂量组(100 μmol·L-1 )、吉马酮低剂量组(50 μmol·L-1),n=6。消化离心制备细胞悬液,计数,稀释使细胞浓度为2×105 个/mL待用,6孔板每孔加入2 mL细胞悬液(每孔约4×105个细胞),贴壁24 h,造模方法与给药同21中所述,孵育24 h后取细胞培养液高速离心取上清,即得细胞培养上清液,分装,-20 ℃保持,待用。
将上述处理后的细胞放置在冰上,用4~5 mL冰1×PBS洗涤2遍,加入2 mL 1×PBS用细胞刮刷把细胞从瓶底刮下,吸入离心管,重复2次,尽量在冰上进行操作。1 000 r·min-1离心3 min,去除上清液,加1×PBS(pH 74左右)将细胞稀释至1×108个/mL,-20 ℃过夜,反复冻融3次破坏细胞膜后,于4 ℃,12 000 r·min-1离心15 min取上清液,即得细胞裂解液,分装,-20 ℃保持,待用。
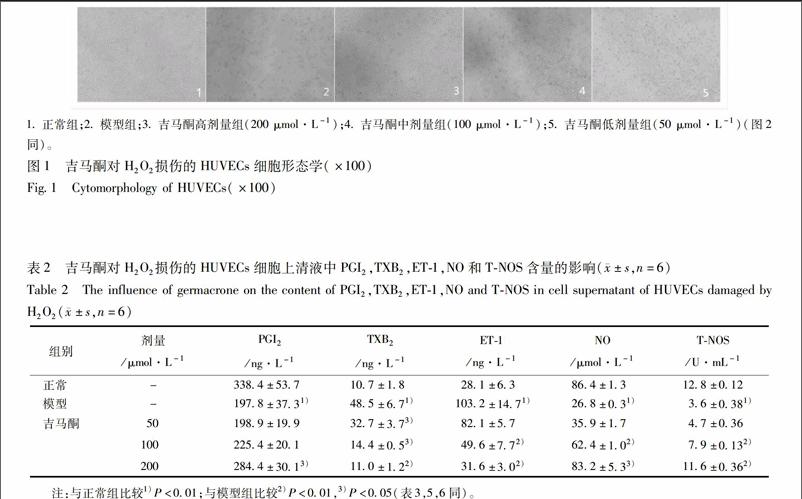
23利用Hoechst 33258荧光染色法观察吉马酮对H2O2诱导HUVECs细胞的凋亡情况的影响参考相关文献[6],消化离心制备细胞悬浮液,计数,稀释使细胞浓度为1×105个/mL待用,24孔板每孔加入1 mL细胞悬液(每孔约1×105个细胞),贴壁24 h,造模方法同21中所述,设对照组(正常组和模型组)与给药组,对照组加入正常培养液、给药组不同浓度吉马酮(200,100,50 μmol·L-1)孵育24 h。弃上清液,1×PBS洗涤2次,2 min 1次;再加每孔1 mL 4%多聚甲醛固定30 min;1×PBS洗涤3次,2 min 1次;每孔加05 mL稀释10倍的Hoechst染色液避光染色20 min;在激发波长350 nm、发射波长460 nm的荧光显微镜下观察并拍照。严格按照细胞凋亡荧光Hoechst 33258 检测试剂盒说明书操作流程进行。endprint
24RTPCR检测细胞中Bax,Bcl2,Caspase3 mRNA表达实验分组及细胞处理同21与22,再提取RNA:每孔加入RNAiso plus 1 mL,吹打使细胞溶解,吸入15 mL无酶EP管中;再加300 μL氯仿,振荡混匀,12 000 r·min-1 4 ℃低温离心10 min,取上清液;加入等量异丙醇,混匀,-20 ℃静置30 min,12 000 r·min-1 4 ℃低温离心10 min,弃上清液;分别加入750 μL无水乙醇和250 μL DEPC水,12 000 r·min-1 4 ℃低温离心10 min,弃上清液;晾干,约10 min,然后加入20 μL DEPC水,混匀,检测RNA浓度。再把所有组稀释至02 g·L-1。最后分别严格按照试剂盒说明逆转录和扩增等。
引物:Bax 上游:GACGAACTGGACAGTAACATGGA,下游:GCAAAGTAGAAAAGGGCGACA,产物长度149 bp,退火温度61 ℃;Bcl2 上游: ACTTCGCCGAGATGTCCAG,下游:ACCCCACCGAACTCAAAGAA,产物长度136 bp,退火温度61 ℃;Caspase3 上游:AAGGCAGAGCCATGGACCAC,下游:CTGGCAGCATCATCCACACATAC,产物长度81 bp,退火温度64 ℃。
25数据统计RTPCR图像采用Image J软件分析,数据利用统计学软件SPSS 220进行统计分析,实验数据均以±s表示,各组间计量资料比较采用单因素方差分析(ANOVA),组间数据多重比较采用LSD法,并结合Dunnett′s T3检验,以P<005为有统计学意义。
3结果
31吉马酮对H2O2损伤的HUVECs活性的影响设正常组的抑制率为0,则与正常组比较500 μmol·L-1H2O2组抑制率达50%以上,而H2O2损伤后用吉马酮保护24 h,发现在较低濃度时影响不大,而随着浓度的增大细胞的损伤程度减轻,见表1。形态学结果见图1,与正常组比较,模型组细胞数目明显减少,且细胞形态变圆;与模型组比较,给药组的细胞明显增加,并有一定的剂量差异。
1正常组;2模型组;3吉马酮高剂量组(200 μmol·L-1);4吉马酮中剂量组(100 μmol·L-1);5吉马酮低剂量组(50 μmol·L-1)(图2同)。
32吉马酮对H2O2损伤的HUVECs细胞上清液中PGI2,TXB2,ET1,NO和TNOS含量的影响模型组与正常组比较,细胞培养上清液中PGI2和总一氧化氮合酶(TNOS)含量减少(P<005),且NO释放量也显著减少(P<001);而细胞培养液中TXB2和ET1的含量显著增加(P<001)。与模型组比较,只有吉马酮高剂量组使PGI2含量增加(P<005),而吉马酮中剂量和高剂量组增加不明显没有统计学意义;200,100 μmol·L-1吉马酮细胞培养上清液中TNOS的含量显著增加(P<001),NO的含量增加(P<005);200,100,50 μmol·L-1吉马酮都可以使TXB2含量减少(P<005),且高剂量变化明显;200,100 μmol·L-1吉马酮组细胞中的ET1含量显著减少(P<001),而50 μmol·L-1组则无统计学意义,见表2。
33吉马酮对H2O2损伤的HUVECs细胞裂解液中tPA和PAI1的影响与正常组比较,H2O2诱导后使tPA显著减少(P<001),使PAI1显著增加(P<001),tPA/PAI1的比值减少;与模型组比较,200,100 μmol·L-1吉马酮组使tPA显著增加(P<001),而50 μmol·L-1吉马酮组几乎没有变化,200,100 μmol·L-1吉马酮可抑制细胞中PAI1的生成(P<005),而低剂量组无统计学意义,见表3。
34吉马酮对H2O2损伤的HUVECs细胞上清液中MDA,SOD,LDH和GSHPx的影响与正常组比较,H2O2损伤的HUVECs细胞释放MDA和LDH的量明显增加(P<005,P<001),细胞培养上清液中SOD和GSHPx的含量减少(P<005);与模型组比较,200,100 μmol·L-1吉马酮组显著抑制MDA 和LDH(P<001),200 μmol·L-1吉马酮使细胞培养液中SOD及GSHPx增加(P<005),吉马酮中剂量和低剂量组中SOD及GSHPx的含量变化不明显,无统计学意义,见表4。
35吉马酮对H2O2损伤的HUVECs细胞裂解液中IL6和TNFα变化的影响与正常组比较,H2O2损伤的HUVECs细胞裂解液中IL6和TNFα的含量显著性增加(P<001)。与模型组比较,200,100 μmol·L-1吉马酮使H2O2损伤的HUVECs细胞裂解液中IL6的含量显著性减少(P<001),同时细胞裂解液中TNFα的含量也明显减少(P<001),而50 μmol·L-1吉马酮组几乎无变化,并无统计学意义,见表5。
36Hoechst 33258荧光染色观察不同浓度吉马酮对H2O2诱导HUVECs细胞的凋亡情况的影响细胞主要表现为细胞核浓缩及细胞核碎裂等典型改变。荧光显微镜观察可见Hoechst 33258荧光染色,对照组细胞呈均匀微弱的荧光,500 μmol·L-1H2O2作用HUVECs细胞后,细胞的体积、形态及细胞内的结构均发生了明显的变化,细胞膜与细胞核呈浓缩致密的强蓝色荧光,显微镜下可见大量的细胞碎片,并且细胞的死亡数量增加,细胞的数量明显减少。再用不同浓度吉马酮(200,100,50 μmol·L-1)培养24 h后,与模型组比较,细胞的数量明显增加,细胞蓝色荧光强度减弱,而且凋亡细胞的数量随着药物浓度的升高而减少,见图2。
37不同浓度吉马酮对H2O2诱导HUVECs细胞中Bax,Bcl2,Caspase3 mRNA表达情况的影响与正常组比较,H2O2诱导细胞后使HUVECs细胞中Bax mRNA和Caspase3 mRNA的表达增加,而Bcl2 mRNA的表达减少;与模型组比较,HUVECs细胞中Bax mRNA和Caspase3 mRNA的表达减少,而Bcl2 mRNA的表达增加,见表6,图3。因此可知,一定剂量的吉马酮具有改善H2O2所致HUVECs细胞氧化损伤所致细胞凋亡的能力。endprint
4小结与讨论
血管内皮细胞功能非常复杂,是血液与组织间进行物质交换的屏障,其不但可以调节血小板的功能、激活促凝因子、清除活化后凝血因子和纤溶过程,还可以通过产生血管活性物质从而调节血管张力[7],其结构和功能损伤与许多疾病的发生和发展密切相关[8],导致血管内皮细胞损伤的因素很多,其中氧化应激是造成血管内皮损伤的主要原因之一。H2O2是体内常见的活性氧,可促进自由基生成,如生物体内的H2O2没有及时清除则可透过细胞膜,会造成脂质过氧化而导致细胞氧化应激损伤。氧化应激水平的提高不仅可以导致细胞损伤、甚至可致死细胞,氧化损伤还是一些神经退行性疾病、艾滋病和脑病重要的发病机制[9]。因此抑制血管内皮细胞氧化应激损伤对一些血管性病变的防治具有重要意义[10]。
血管内皮细胞的代谢与增殖情况可以提高其活性程度来反映[11],利用MTT测定结果可以反映细胞的活性程度[12]。本实验通过建立H2O2损伤HUVECs细胞模型,从而模拟体内氧化应激损伤,再利用吉马酮对H2O2损伤HUVECs细胞的相关作用进行研究。MTT 法检测发现,吉马酮能够增强H2O2损伤所致HUVECs细胞的细胞活力,在显微镜下观察可知,与正常组比较,模型组细胞数目明显减少,且细胞形态变圆;与模型组比较,给药组的细胞数量明显增加,并且在高剂量时细胞的数量最多。
MDA是氧自由基的攻击细胞膜发生脂质过氧化反应的产物,其含量可以反映氧自由基的水平及脂质过氧化的程度,MDA还可与核酸或蛋白质发生交联现象,而发生损伤,MDA不仅是细胞损伤的代谢产物,而且是导致细胞损伤的原因之一[13]。LDH是内皮细胞损伤后的代谢产物,它的活力强弱可以用来反映细胞的损伤程度。因此,本实验通过测定LDH和MDA含量来反映内皮细胞损伤的情况和程度。由实验结果可知,H2O2损伤后HUVECs细胞培养液中LDH和MDA含量增加,加入吉马酮培养24 h后发现,HUVECs细胞培养液中LDH和MDA含量明显减少,由此可知吉马酮可能具有增强细胞抗氧化及抑制脂质的过氧化作用。SOD和GSHPx等属于内源性抗氧化酶,能够清除氧自由基,从而保护细胞,当细胞氧化应激损伤没有特别严重时还可对其进行修复[14]。为研究吉马酮的抗氧化作用,本实验检测了吉马酮对H2O2损伤的HUVECs细胞SOD和GSHPx的释放影响。试验结果说明,吉马酮保护培养24 h后细胞培养液中SOD和GSHPx活性明显增强,则吉马酮具有缓解BMECs细胞损伤的作用,从而保持其完整性。
血管内皮细胞是合成前列环素(PGI2)的主要场所,PGI2可以舒张血管平滑肌、扩张血管,同NO都具有抑制血小板聚集;血栓素(TXA2)具有血小板凝聚和血管收缩作用,其与PGI2两者动态平衡以维持血管收缩功能及血小板聚集作用,而TXA2生物半衰期非常之短,迅速转化为无活性的血栓素B2(TXB2),因此常检测TXB2的含量[15]。本实验结果表明,H2O2诱导使HUVECs 细胞培养上清液中PGI2的含量降低,而TXB2的生成量显著增加,TNOS的含量减少,NO的含量也相随减少;吉马酮在较大剂量时可致损伤后HUVECs细胞PGI2的分泌量增加,TXB2的生成减少,细胞培养上清液中TNOS和NO的含量也增加。从而维持血管收缩功能及血小板聚集作用。ET1是如今以来作用最强的血管收缩物。而PAI1和tPA主要由VEC合成和分泌,分别纤溶酶原激活抑制物和纤溶酶原的激活物。本实验结果显示,吉马酮可以明显减少H2O2诱导的HUVECs细胞培养上清液中ET1含量增加;H2O2诱导的HUVECs细胞裂解液中tPA含量显著性降低,PAI1含量显著增加,可见H2O2可导致HUVECs细胞纤溶功能出现异常,加入吉马酮可明显抑制细胞产生PAI1,促进tPA的生成,改善tPA/PAI1,从而保护HUVECs细胞和使其纤溶功能恢复正常。
临床上诊断炎症反应的常用指标是炎症因子的含量:肿瘤坏死因子α(TNFα) 是体内非常重要的一种炎症细胞因子,在炎症过程中发挥着重要的作用,其含量水平可以反映H2O2损伤HUVECs细胞的炎症损伤程度;IL6为另外一种主要的炎症因子,其自身不仅能够介导炎症的发生,还能够促进TNFα的生成[16]。本实验结果显示,H2O2损伤后HUVECs细胞中IL6和TNFα的含量显著增加;加入吉马酮保护24 h后,HUVECs细胞中IL6和TNFα的生成量的以缓解。以上结果可以看出,吉马酮可以抑制H2O2损伤后HUVECs细胞中IL6和TNFα的生成,从而缓解H2O2损伤导致的HUVECs细胞的炎症。
细胞凋亡是一种有多种基因调控的细胞程序性死亡的过程,主要表现为细胞核浓缩及细胞核碎裂等典型改变。其中Bcl2基因家族发挥重要作用,基因Bcl2和Bax都属于Bcl2基因家族,Bcl2基因抑制细胞凋亡、Bax基因促细胞凋亡,二者相互作用、共同协调细胞凋亡过程,Bcl2不但可以通过控制细胞信号的传导来保护细胞生存,其还可以和Bax蛋白结合,从而抑制细胞凋亡。因此Bcl2/Bax越小,细胞凋亡情况越严重[17]。细胞凋亡途径有细胞表面死亡受体途径和线粒体引发途径2种,2种途径都能激活处于细胞凋亡途径下游的Caspase3及其他下游的Caspase效应子,激活的Caspase3能裂解大量底物使细胞凋亡[18]。本实验通过Hoechst 33258荧光染色观察后可知,H2O2作用HUVECs细胞后,细胞的体积、形态及细胞内的结构均发生了明显的变化,细胞膜与细胞核呈浓缩致密的强蓝色荧光,显微镜下可见大量的细胞核碎片,并且细胞的死亡数量增加,细胞的数量明显减少。再用吉马酮培养24 h后,细胞的数量明显增加,细胞蓝色荧光强度减弱,细胞碎片也减少,而且凋亡细胞的数量随着药物浓度的升高而减少。再利用RTPCR法檢测可知,H2O2诱导HUVECs细胞后使HUVECs细胞中Bax mRNA和Caspase3 mRNA的表达增加,而Bcl2 mRNA的表达减少;吉马酮保护培养24 h后HUVECs细胞中各相关基因的生成趋于正常。endprint
综上所述,吉马酮对H2O2诱导损伤的HUVECs细胞的保护作用及机制可能与以下作用相关:①吉马酮可以改善细胞的形态和生长、增殖率;②吉马酮可以缓解H2O2诱导损伤HUVECs细胞后LDH和MDA含量释放,且可增加SOD和GSHPX活性,而提高抗氧化能力,清除自由基对HUVECs细胞的损害;③增加血管活性物质PGI2和NO等生成,减少血管收缩物TXB2和ET1的生成;④抑制炎症因子的释放;⑤抑制细胞凋亡,维持细胞的结构和功能。
[参考文献]
[1]Ross R The pathogenesis of atherosclerosisan update [J]. New Engl J Med, 1986, 314(8):488.
[2]边金铎,邓同乐,许健丹参素对H2O2诱导的内皮细胞氧化损伤的保护作用研究[J]. 上海中医药大学学报, 2012(3):61.
[3]Ienco E C, Logerfo A, Carlesi C, et al. Oxidative stress treatment for clinical trials in neurodegenerative diseases [J]. J Alzheimers Dis, 2011, 24 Suppl 2(1):111.
[4]Wang Y K, Huang Z Q Protective effects of icariin on human umbilical vein endothelial cell injury induced by H2O2 in vitro[J]. Vasc Pharmacol, 2005, 43(4):198.
[5]李钊飞,曹小雨,陈琼芳,等灯盏花素对过氧化氢致人脐静脉内皮细胞损伤的保护作用[J]. 时珍国医国药, 2016(7):1566.
[6]张俊峰,刘加军,陆敏强,等冬凌草甲素抑制人肝癌BEL7402细胞生长及诱导细胞凋亡的机制研究[J]. 中草药, 2006, 37(10):1519.
[7]赵凤鸣,方泰惠,王明艳,等大黄酸对过氧化氢诱导损伤的血管内皮细胞的保护作用[J]. 中药药理与临床, 2011(2):47.
[8]王维蓉,林蓉,彭宁,等丹参酮ⅡA对过氧化氢损伤人血管内皮细胞的保护作用[J]. 中药材, 2006, 29(1):49.
[9]刘红亮,胡磊,王靖凯,等槲皮素对H2O2损伤PC12细胞的保护效果与机制[J]. 中国药理学通报, 2014, 30(3):373.
[10]Ramos J W The regulation of extracellular signalregulated kinase (ERK) in mammalian cells[J]. Int J Biochem Cell Biol, 2008, 40(12):2717.
[11]Mosmann T Rapid colorimetric assay for cellur growth and survival:application to proliferation and cytotoxlcity assay[J]. J Immunol Methods,1983,65(2):58.
[12]王世博,邱景富,白群华,等黄芪甲苷对H2O2致PC12细胞氧化应激损伤的保护作用[J]. 中国药理学通报, 2011, 27(11):1606.
[13]刘青青,郭红,王少峡,等脑缺血损伤机制的研究进展[J]. 中华中医药学刊,2012,30(6):1229.
[14]Cerqueira M D, El R S Oxidative stress in neurodegenerative diseases: mechanisms and therapeutic perspectives[J]. Oxid Med Cellul Long, 2011, 2011:467180.
[15]陈琼芳,李钊飞,王钢,等吉马酮对缺氧缺糖损伤BMECs细胞抗凝和纤溶功能的影响[J]. 中药药理与临床, 2016(4):46.
[16]李荣,李俊,胡成穆,等橙皮苷对大鼠佐剂性关节炎的治疗作用及机制[J]. 中国药理学通报, 2008, 24(4):496.
[17]孟剑锋地黄多糖对H2O2诱导乳鼠心肌细胞损伤的保护作用及其机制研究[J]. 中药药理与临床, 2016(1):93.
[18]張俊峰,刘加军,陆敏强,等冬凌草甲素抑制人肝癌BEL7402细胞生长及诱导细胞凋亡的机制研究[J]. 中草药, 2006, 37(10):1519.
[责任编辑张宁宁]endprint

