1株Cr(Ⅵ)抗性菌株的筛选鉴定及去除Cr(Ⅵ)特性
张杰 张丽丽 李媛媛
摘要:从东北林业大学林场土壤中筛选分离出1株六价铬[Cr(Ⅵ)]抗性菌株ng 05,经形态、生理生化分析及16S rDNA序列比对研究其分类;同时研究反应温度、溶液pH值以及Cr(Ⅵ)初始质量浓度对该菌去除Cr(Ⅵ)效果的影响,进而确定最佳去除条件;此外,利用傅氏转换红外线光谱分析仪(FTIR)研究菌株去除的机制。结果表明,该菌株为芽孢杆菌属;最佳反应温度为35 ℃,溶液pH值为9,Cr(Ⅵ)初始质量浓度为5 mg/L,在此条件下可以达到很好的去除效果,菌株ng 05对Cr(Ⅵ)的去除效率高达99%以上;对比反应前后的红外光谱图可知,菌体表面的羟基作为电子供体将Cr(Ⅵ)还原为Cr(Ⅲ),氨基、羧基、C—H与Cr(Ⅲ)在菌体表面形成络合物。
关键词:Cr(Ⅵ);芽孢杆菌;抗性菌株;分离筛选;生物去除;机制研究
中图分类号: X172文献标志码:
文章编号:1002-1302(2017)16-0268-04
[HJ14mm]
收稿日期:2016-11-28
基金项目:国家自然科学基金国家基础科学人才培养基金(编号:J1210053);国家自然科学基金(编号:31300573)。
作者简介:张杰(1972—),女,黑龙江哈尔滨人,博士,副教授,主要从事环境微生物方面研究。E-mail:zhangjie1972@nefueducn。
通信作者:张国财,博士,教授,主要从事环境微生物和森林保护方面研究。E-mail:zhang640308@126com。[HJ]
六价铬[Cr(Ⅵ)]主要来源于制革、木材防腐、矿石精炼、金属电镀和色素沉淀等行业,随着工业废水的不断排放,使水体、土壤遭到严重的污染。Cr(Ⅵ)毒性强烈,极易经皮肤、呼吸道、消化道以及黏膜侵入人体,损害肝肾等器官,从而严重危害人的身体健康[3],而Cr(Ⅲ)毒性约为Cr(Ⅵ)的1%[4-5]。传统上去除Cr(Ⅵ)的方法包括电渗析、化学沉淀、吸附、反渗透以及离子交换等,但这些方法成本较昂贵,且处理过程中会造成二次污染的问题。生物法以处理成本低、操作简单、不易引起二次污染[8]等优点成为去除含Cr(Ⅵ)废水研究的热点之一。瞿建国等筛选出1株抗铬的脱硫弧菌2-S-8,在营养液中加入75 mg/L Cr(Ⅵ),让该菌在其中生长,结果表明,Cr(Ⅵ)的去除率达到100%[9];朱玲玲等分离得到1株葡萄球菌(Staphylococcus) Y 73,让其生长在Cr(Ⅵ)浓度为1 000 mg/L的培养液中,可以还原83%的Cr(Ⅵ)[10];Mutter等仔细研究了处于对数增长期的假丝酵母活菌对Cr(Ⅵ)的去除作用,并且研究培养基对Cr(Ⅵ)的去除效果表明,产朊假丝酵母(Candidautilis)对Cr(Ⅵ)的吸附量为7 mg/g,且培养基对Cr(Ⅵ)有还原作用[11-12]。以上研究工作主要偏重于利用培养基中的碳源作电子供体去除Cr(Ⅵ),但在生物去除过程中,培养基中的碳源不仅会造成二次污染,而且具有成本高、用量需严格控制等弊端。目前,关于不添加培养基的纯菌通过自身生理活动直接去除Cr(Ⅵ)的报道较少,因此本研究拟筛选分离出1株Cr(Ⅵ)抗性菌株,在不添加培养基的条件下,考察环境因子对该菌株去除Cr(Ⅵ)效果的影响,并对其机制作进一步分析和探讨,以期为Cr(Ⅵ)生物治理的工业应用提供有益的数据。
1材料与方法
11试验材料
本试验从东北林业大学林场距地面深20 cm处取土壤样品,放入无菌封口袋内,置于4 ℃冰箱内备用。
基础培养基:10 g胰蛋白胨,05 g酵母提取物,10 g氯化钠,100 mL水,调节pH值为70。
12试验方法
121菌株的分离纯化和筛选本试验称取5 g采集的土样,量取5 mL无菌水溶解,搅拌后制成悬浮液。配制好LB培养液,用移液枪吸取1 mL悬液加入150 mL培养液中,用振荡培养箱于150 r/min富集培养18 h后,对菌体进行驯化培养,筛出可以抗铬的菌株。先将菌接种于含5 mg/L重铬酸钾的培养液中,驯化48 h,逐渐提高重铬酸钾的浓度;再将驯化的菌接入含10、15、20、25、30 mg/L重铬酸钾培养液中。然后用接种环蘸取少量菌液,在无菌平板表面进行划线,可在表面得到单菌落,進而获得能在含20 mg/L重铬酸钾培养基上存活的菌株,4 ℃保存。
122菌株形态和生理生化鉴定肉眼观察记录菌落形态,对菌株ng 05进行鉴别染色,利用革兰氏染色法,观测其大小、排列及形态;采用细菌微量生化反应管对菌株进行硝酸盐还原反应、伏普(V-P)反应、甲基红试验、苯丙氨酸脱氨酶试验、明胶液化、靛基质试验和西蒙氏枸橼酸盐利用[13-14]等生理生化特征的测定。
123菌株16S rDNA序列比对提取菌株ng 05的基因组DNA,利用细菌通用引物27 F、1 492 R进行PCR扩增。扩增反应条件:94 ℃ 5 min;94 ℃ 1 min,56 ℃ 1 min,72 ℃ 100 s,30次循环;4 ℃终止。PCR产物直接进行碱基序列测定。利用NCBI的BLAST进行碱基序列比对,使用MEGA 40软件构建系统进化树。
124菌株去除Cr(Ⅵ)的影响因素使用LB液体培养基对菌株ng 05培养24 h(D600 nm=16~17)后,5 000 r/min离心10 min,菌体用生理盐水洗涤3次,将纯菌接入含 5 mg/L Cr(Ⅵ)模拟废水中,调整各菌体在废水中浓度并使其一致,设置3个重复,振荡培养24 h,每6 h取样3 mL,测定上清液中剩余Cr(Ⅵ)浓度。本试验选择温度、pH值、初始 Cr(Ⅵ) 浓度等因素研究菌体去除Cr(Ⅵ)效果。试验设计如下:pH值5、6、7、8、9、10;反应温度20、25、30、35、40、45 ℃;Cr(Ⅵ) 浓度5、15、25、35、45、55、65 mg/L。
125红外光谱试验(傅氏转换红外线光谱分析仪,简称FTIR)将处理后的菌体制成样品,在红外吸收光谱仪上进行检测并记录其光谱。
13测定方法
Cr(Ⅵ)利用紫外-可见分光光度计,以二苯碳酰二肼分光光度法测定[15]。
2结果与分析
21菌株ng 05鉴定结果
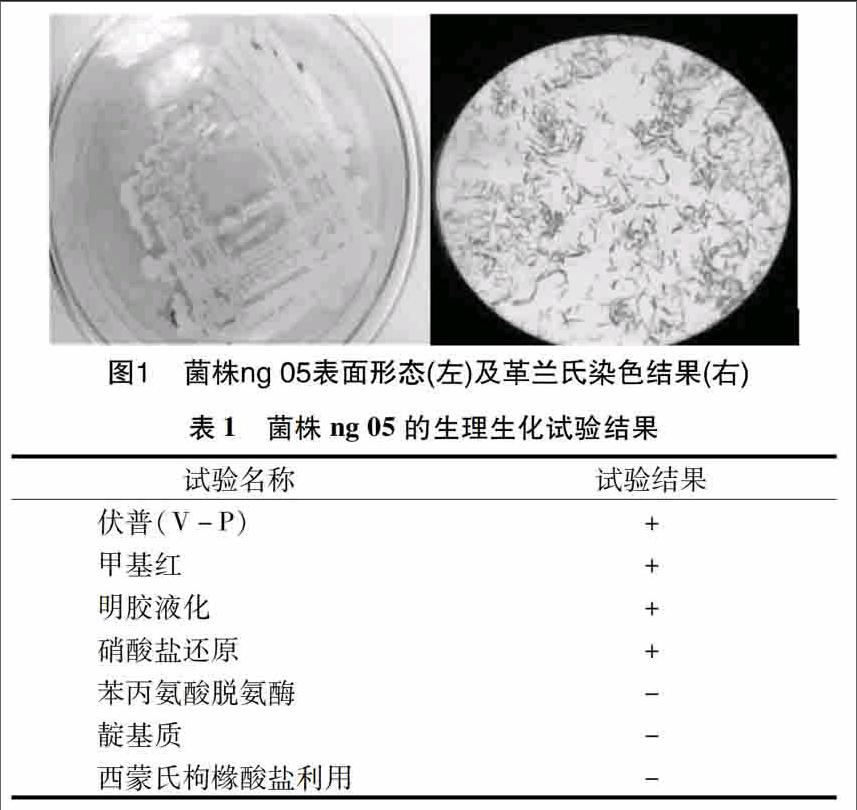
211菌落形态及其生理、生化特征从土壤中筛选出1株Cr(Ⅵ)抗性菌株ng 05,该菌株革兰氏染色后为蓝紫色,为革兰氏阳性菌,菌体大小为(05~25)μm×(12~100)μm,短杆状;在琼脂上,该菌落边沿整齐,表面光滑湿润,易挑取,白色半透明,菌落正反边沿与中央颜色一致(图1)。
由表1可见,菌株ng 05明胶液化试验、伏普(V-P)试验、硝酸盐还原试验和甲基红试验结果呈阳性,苯丙氨酸脱氨酶试验、靛基质试验及西蒙氏枸橼酸盐利用结果呈阴性。根据以上形态学和生理生化鉴定结果,参照《伯杰氏细菌系统分类学手册》,初步判定菌株ng 05为芽孢杆菌。
注:“+”表示示阳性;“-”表示阴性。
21216S rDNA的序列测定与系统发育分析按照细菌DNA提取试剂盒说明书提取菌株ng 05基因组DNA,进行PCR扩增,获得16 S rDNA序列,长度为1 514 bp,用BLAST将获得的16S rDNA序列和GenBank中的所有序列进行对比,结果显示,菌株ng 05与芽孢杆菌属相似度高达99%以上,并且经MEGA 40软件构建16S rDNA的系统发育树(图2)进一步分析。根据形态学、生理生化特征结果以及16S rDNA序列比对结果综合分析,最终将菌株ng 05鉴定为芽孢杆菌属。
22反应温度对Cr(Ⅵ)去除的影响
从图3可以看出,在20~35 ℃下,菌株ng 05对Cr(Ⅵ)均有不同程度的去除,随着温度的升高,去除效率也会逐渐增大,温度为35 ℃的条件下效果最佳,去除率可以达到99%以上,而超过35 ℃后Cr(Ⅵ)去除效率就逐渐下降。因此可知,35 ℃是去除Cr(Ⅵ)的最佳温度。
由于微生物去除Cr(Ⅵ)的过程是酶促反应,在过低的温度下细胞膜流动性的减弱能够阻碍运输系统的正常运行,使基质不能顺利进入胞内供给细菌而满足其正常生长的需求;在过高的温度下,蛋白质会发生变性,而且是不可逆的,进而使去除Cr(Ⅵ)的蛋白酶功能受到损伤,改变细胞膜的结构或影响蛋白合成机制[16],由此说明,此菌株在温度35 ℃时酶促反应最佳。
23pH值对Cr(Ⅵ)的去除效果影响
本试验在pH值5、6、7、8、9、10的范围内研究菌株ng 05对Cr(Ⅵ)去除的影响。从图4可以看出,pH值越高,Cr(Ⅵ)的去除效率也更佳,当pH值为9时,Cr(Ⅵ)去除率最大,达到99%以上,随后pH值继续升高,去除效率则下降。
菌株ng 05去除Cr(Ⅵ)是质子消耗过程,因此Cr(Ⅵ)去除效率随着pH值升高而提高;同时,菌株ng 05去除Cr(Ⅵ)也是酶促反应过程,过高的pH值会对蛋白酶的电离率造成影响,使蛋白酶的功能受损,从而影响其活性。因此,选择合适的pH值对菌株去除Cr(Ⅵ)至关重要。由本试验可知,在pH值为9时,菌株ng 05蛋白酶活性最强,Cr(Ⅵ)去除率也最高。
24不同初始Cr(Ⅵ)浓度对菌株ng 05去除Cr(Ⅵ)的影响
从图5可知,Cr(Ⅵ)浓度为5 mg/L时的去除效果最佳,去除效率达99%以上;但随着Cr(Ⅵ)浓度的升高,去除效率也随之下降。
由于菌株去除Cr(Ⅵ)是酶促反应过程,Cr(Ⅵ)浓度的升高,使细胞表面上的活性位点与铬离子碰撞的机会增大,Cr(Ⅵ) 需求的活性结合位点很多,进而增强了蛋白酶的催化效率,直到满足限制浓度,达到饱和状态。一旦Cr(Ⅵ)浓度高于限制浓度,菌株去除Cr(Ⅵ)效率就会随着金属离子浓度的增大而降低,所以Cr(Ⅵ)浓度为5 mg/L時的去除效果最佳。
25红外光谱分析(FTIR)
由图6可见,ng05菌株细胞表面存在多种官能团:3 38675 cm-1 处的吸收峰是羟基,2 92645 cm-1处的是 —CH3、—CH2的对称和反对称的变形伸缩振动吸收带,1 65381 cm-1 处的可能是羧基基团中的羰基峰,或者是羰基、氨基的共轭峰;1 40013 cm-1处的吸收峰为—CH3与 —CH2 的弯曲振动;1 06769 cm-1处的吸收峰可能是多糖或多糖类似物的C—O键和硅酸盐杂质的Si—O键伸缩振动峰[17]。对比Cr(Ⅵ)处理前后的FTIR谱,3 38675 cm-1处的羟基吸收峰,加入Cr(Ⅵ)后从3 38675 cm-1处发生位移至 3 29957 cm-1,吸收峰相对反应前均有很大减弱。
对于微生物去除Cr(Ⅵ),大部分学者认为是胞外还原作用。Chatterjee等认为,细胞壁表面的—OH与—NH参与 Cr(Ⅵ) 的还原[18]。而Kang等则认为,可以通过细胞表面的—C[FY=,1]O形式吸附Cr(Ⅵ)[19]。在本研究中,结合Cr(Ⅵ)处[CM(25]理前后菌体的FTIR谱图分析结果显示,吸收峰相对反应[CM)]
前均有很大减弱,说明菌体与Cr(Ⅵ)反应后表面的羟基数量减少,可能是由于羟基作为电子供体,参与了氧化还原反应[20],被还原而得的Cr(Ⅲ)主要形成氢氧化物沉淀或者Cr(Ⅲ)与羧基、羰基形成络合物[21]存在于菌体表面。
3结论
从东北林业大学林场土壤中筛选分离出1株Cr(Ⅵ)抗性菌株ng 05,对其进行形态学鉴定、生理生化分析以及16S rDNA序列比对鉴定表明,菌株ng 05为芽孢杆菌属。
不添加培养基的纯菌去除Cr(Ⅵ)的效果在35 ℃、pH值为9、初始Cr(Ⅵ)浓度为5 mg/L的条件下效果最佳,去除率达99%以上。
采用FTIR方法分析可知,在反应前后,菌体表面上的羟基作为电子供体将Cr(Ⅵ)还原为Cr(Ⅲ),氨基、羧基、C—H与Cr(Ⅲ)在表面形成络合物,研究结果可为Cr(Ⅵ)去除机制提供基础理论依据。
参考文献:
Narayani M,Shetty K VChromium-resistant bacteria and their environmental condition for hexavalent chromium removal:a review[J] Critical Reviews in Environmental Science and Technology,2013,43(9):955-1009
周宜开 环境流行病学基础与实践[M] 北京:人民卫生出版社,2013:249-252
[3]周梦芝,王华锋,郑月慧,等 常见重金属污染与男(雄)性不育[J] 中国公共卫生,2013,29(5):769-772
[4]Xu Y,Zhao D Reductive immobilization of chromate in water and soil using stabilized iron nanoparticles[J] Water Research,2007,41(10):2101-2108
[5]Petruzzelli D,Passino R,Tiravanti G Ion exchange process for chromium removal and recovery from tannery wastes[J] Water Science & Technology,1995,36(2/3):197-207
[6]Camargo F A O,Okeke B C,Bento F M,et al Diversity of chromium-resistant bacteria isolated from soils contaminated with dichromate[J] Applied Soil Ecology,2005,29(2):193-202
[7]Barbooti M M,Ageena N A,Tooma M A Removal of chromium from electroplating wastewater by simple chemical treatment and ion exchange[J] Eng Technol,2008,26:11-13
[8]申如香,瞿建国,张晓旗,等 微生物法处理冷轧含铬(Ⅵ)废水的实验研究[J] 上海化工,2001(1):4-6[HJ174mm]
[9]瞿建国,申如香,徐伯兴,等 硫酸盐还原菌还原Cr(Ⅵ)的初步研究[J] 华东师范大学报(自然科学版),2005(1):105-112
[10]朱玲玲,曹佳妮,张文,等 一株耐铬细菌的鉴定及其还原铬性能分析[J] 环境科学学报,2013,33(10):2717-2723
[11]Mutter O,Patmalnieks A,Rapoport A Interrelations of the yeast Candida utilis and Cr(Ⅵ):metal reduction and its distribution in the cell and medium[J] Process Biochemistry,2001,36(10):963-970
[12]Muter O,Lubinya I,Millers D,et al Cr(Ⅵ) sorption by intact and dehydrated Candida utilis cells in the presence of other metals[J] Process Biochemistry,2002,38(1):123-131
[13]布坎南R E,吉布斯E N 伯杰氏细菌鉴定手册[M] 8版 颜子颖,王海林,译 北京:科学出版社,1999:498-501
[14]Gibbons N E伯杰氏细菌鉴定手册[M] 北京:科学出版社,1984:482-484
[15]苏文海 二苯碳酰二肼分光光度法测定六价铬方法的改进[J] 环境科学导刊,2009,28(5):77-79
[16]Narayani M,Shetty K V Chromium-resistant bacteria and their environmental condition for hexavalent chromium removal:a review[J] Critical Reviews in Environmental Science and Technology,2013,43(9):955-1009[HJ176mm]
[17]宋東涛,李吉进,聂俊华,等 膨润土对土壤腐殖质特性的影响[J] 生态环境学报,2008,17(2):722-726
[18]Chatterjee S,Ghosh I,Mukherjea K K Uptake and removal of toxic Cr(Ⅵ) by Pseudomonas aeruginosa:physic-chemical and biological evaluation[J] Current Science,2011,101(5):645-652
[19]Kang S Y,Lee J U,Kim K W Biosorption of Cr(Ⅲ) and Cr(Ⅵ) onto the cell surface of Pseudomonas aeruginosa[J] Biochemical Engineering Journal,2007,36(1):54-58
[20]Krishnani K K,Meng X G,Christodoulatos C Biosorption mechanism of nine different heavy metals onto biomatrix from rice husk[J] Journal of Hazardous Materials,2008,153(3):1222-1234
[21]Shen Y S,Wang S L,Huang S T,et al Biosorption of Cr(Ⅵ) by coconut coir:spectroscopic investigation on the reaction mechanism of Cr(Ⅵ) with lignocellulosic material[J] Journal of Hazardous Materials,2010,179(1/2/3):160-165

