稳定表达猪SAMHD1蛋白的MARC-145细胞系构建与鉴定
杨 莘,姜一峰,虞凌雪,刘 欢,周艳君,高 飞,黄勤峰,童光志
(中国农业科学院 上海兽医研究所,上海 200241)
·研究论文·
稳定表达猪SAMHD1蛋白的MARC-145细胞系构建与鉴定
杨 莘,姜一峰,虞凌雪,刘 欢,周艳君,高 飞,黄勤峰,童光志
(中国农业科学院 上海兽医研究所,上海 200241)
SAMHD1作为宿主的天然免疫限制性因子,参与机体的天然免疫调控,在机体抗病毒感染过程中发挥重要的作用。为了建立稳定表达猪SAMHD1的细胞系,本研究将猪SAMHD1全长编码基因克隆至慢病毒载体pWPXL,构建重组质粒pWPXL-pSAMHD1。将重组质粒与慢病毒包装质粒共转染293T细胞,获得重组慢病毒。将该慢病毒感染MARC-145细胞,经嘌呤霉素筛选后,获得表达猪SAMHD1基因的MARC-pSAMHD1细胞系。经检测发现,该细胞系传至10代,仍能稳定表达猪SAMHD1蛋白。该细胞系的建立为猪SAMHD1抗病毒特性和猪繁殖与呼吸综合征病毒致病机理等研究奠定了坚实的基础。
SAMHD1;猪;慢病毒系统;MARC-145细胞
Abstract:The sterile alpha motif and HD domain 1 (SAMHD1) protein has been identi fi ed as a novel restriction factor that participates in processes of host innate immunity and plays an important role in antiviral infection. To establish a cell line stably expressing porcine SAMHD1, the CDS of porcine SAMHD1 gene was cloned into lentiviral vector pWPXL and transfected into 293T cells together with the packaging plasmids to get the recombinant lentivirus. MARC-145 cells were infected with the recombinant lentivirus and screened by puromycin to establish the cell line expressing porcine SAMHD1. The porcine SAMHD1 gene was shown to be stably expressed in MARC-145 cells. The established cell line is a useful tool to explore the antiviral roles of porcine SAMHD1 and pathogenesis of Porcine reproductive and respiratory syndrome virus.
Key word:SAMHD1; porcine; lentiviral system; MARC-145 cells
天然免疫限制因子作为机体先天性免疫系统的组成部分,在病毒感染的早期发挥重要的抗病毒作用。目前已知4种免疫限制因子,分别为TRIM5α、APOBEC3G(A3G)、Tetherin(BST-2)和SAMHD1,它们在HIV-1的脱壳、复制过程中的基因组超变异、子代病毒的释放等方面发挥重要的限制作用[1-3]。其中,SAMHD1作为最新发现的抗病毒限制因子,具有三磷酸水解酶活性,能够使细胞内的dNTP水平保持在一个较低的状态,从而抑制HIV-1逆转录过程,导致成熟的病毒粒子无法形成。此外,SAMHD1还具有核糖核酸酶活性,在拮抗逆转录病毒感染方面发挥重要作用。
SAMHD1作为一种严格的细胞核内定位蛋白,在髓系细胞中呈现高表达,但在脑和胸腺中不表达。它主要包含两个结构域,不育α基序(sterile alpha motif,SAM)结构域和组氨酸/天冬氨酸残基(HD)结构域。SAM结构域在蛋白-RNA和蛋白-蛋白的互作间发挥重要作用,而HD结构域具有两个高度保守的基序,其具有磷酸水解酶活性,介导SAMHD1的抗病毒作用[4]。SAMHD1的功能活性主要体现在非增殖细胞中,在增殖细胞中SAMHD1的活性受磷酸化调节,细胞内CyclinA/CDK1复合体以及CDK2在参与SAMHD1的磷酸化调控[5,6]。针对SAMHD1的生物学特性研究发现,SAMHD1的转录活性受到甲基化的调节[7,8]。SAMHD1能够被I型干扰素诱导上调表达[9],其中干扰素调节因子3(interferon regulatory factor 3,IRF3)在SAMHD1诱导表达调控过程中发挥重要作用[10]。
SAMHD1具有广泛的抗病毒作用,除逆转录病毒外,SAMHD1也能够抑制I型单纯疱疹病毒(Herpes simplex virus Ⅰ,HSV-1)、乙型肝炎病毒(Hepatitis B virus,HBV)、猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)等的增殖[11,12]。可见,通过建立表达猪SAMHD1蛋白的细胞系对深入开展SAMHD1功能的研究具有重要的应用价值。因此,本研究通过慢病毒表达系统,以MARC-145细胞为载体细胞,建立能稳定表达猪SAMHD1的细胞系,用于SAMHD1功能和病毒逃逸其限制性的机制研究。
1 材料和方法
1.1 细胞、质粒和菌株MARC-145细胞、293T细胞由本实验室保存;DMEM培养基、胎牛血清购自Thermo Fisher公司;含有猪SAMHD1全长编码基因的p3×FLAG-pSAMHD1真核表达质粒由本实验室保存;pWPXL质粒、pMD2.G质粒和psPAX2质粒购自Addgene公司;DH5α感受态细胞购自TaKaRa有限公司。
1.2 试剂与抗体Phanta® Super Fidelity DNA Polymerase购自诺唯赞公司;限制性内切酶购自NEB公司;凝胶回收试剂盒、T4 DNA连接酶购自TaKaRa公司;Lipofectamine 2000转染试剂、嘌呤霉素购自Invitrogen公司;慢病毒颗粒滴度检测试剂盒购自上海少辛生物科技有限公司;RIPA细胞裂解液购自Thermo Fisher公司;RNA提取试剂盒、质粒抽提试剂盒购自Qiagen公司;猪SAMHD1单克隆抗体(5M1株)由本实验室制备并保存[13];β-actin抗体、辣根过氧化物酶标记抗鼠IgG抗体购自Sigma公司。
1.3 重组慢病毒载体的构建与拯救根据GenBank中提交的猪SAMHD1基因序列(GenBank登录号:KJ473485),设计1对引物扩增猪SAMHD1全长GTCCTTTGCA-3',引物两端分别引入BamH I 和Mlu I酶切位点(下划线碱基),引物由上海捷瑞公司合成;高保真DNA聚合酶扩增猪SAMHD1全长基因后,克隆至pWPXL载体中,构建重组慢病毒质粒pWPXL-pSAMHD1,并转化至DH5α感受态细胞。将重组质粒pWPXL-pSAMHD1和包装质粒pMD2.G、psPAX2按照2∶2∶3的比例转染至293T细胞中。48 h后收取细胞上清,并采用0.45 μm的滤膜过滤后,分装备用。
1.4 过表达猪SAMHD1蛋白的细胞系筛选MARC-145细胞铺6孔板,细胞密度约为90%时,感染1.3获得的重组慢病毒,并同时加入8 μg/mL的polybrene增强感染试剂。48 h后,进行第2次感染重组慢病毒。继续培养48 h后,加入终浓度为20 μg/mL的嘌呤霉素进行筛选,经过3代筛选后进行重组蛋白的表达鉴定。
1.5 细胞总RNA的提取与cDNA的合成MARC-145细胞收集后,细胞离心去除上清,进行总RNA的提取和cDNA的合成,具体参照文献[14]进行。以MARC-145细胞cDNA为模板,采用RT-PCR的方法鉴定猪SAMHD1基因的稳定性,扩增的目的片段经琼脂糖凝胶电泳回收后,送上海生工生物工程有限公司测序。
1.6 EGFP荧光和Western blot鉴定与分析细胞筛选传代至第10代后,进行EGFP荧光观察。细胞采用4%的中性甲醛固定后,经PBS漂洗3遍,采用倒置荧光显微镜直接观察重组SAMHD1的表达与定位;将收集的第3、7、10代MARC-145细胞,加入RIPA细胞裂解液,经5×SDS-PAGE上样buffer处理后,进行SDS-PAGE电泳和Western blot分析。猪SAMHD1单抗以1∶1000倍稀释作为一抗,辣根过氧化酶标记的山羊抗小鼠IgG抗体1∶6000倍稀释作为二抗,分析重组猪SAMHD1的表达。
2 结果
2.1 重组慢病毒载体pWPXL-pSAMHD1的构建与鉴定以p3×FLAG-pSAMHD1真核表达质粒为模板,经PCR扩增猪SAMHD1全长基因,扩增产物经琼脂糖凝胶电泳,结果显示在约1800 bp处出现特异性条带(图1 A),符合预期片段大小(1884 bp)。扩增产物经BamH I 和Mlu I双酶切后,克隆至pWPXL载体中。阳性质粒经双酶切鉴定发现,猪SAMHD1全长基因片段已正确插入表达载体中(图1 B)。
2.2 稳定表达猪SAMHD1基因的MARC-145细胞系筛选pWPXL-pSAMHD1阳性质粒与包装质粒共转染293T细胞后,获得重组慢病毒。经嘌呤霉素抗性连续筛选EGFP表达阳性的MARC-145细胞克隆3次,获得的阳性克隆经扩大培养,经EGFP荧光检测发现,MARC-145细胞阳性克隆株稳定表达猪SAMHD1蛋白,且表达的猪SAMHD1蛋白均定位于细胞核中(图2)。
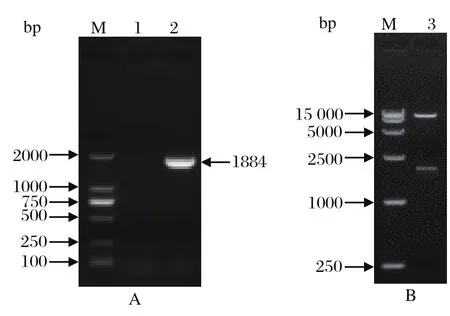
图1 重组质粒pWPXL-pSAMHD1鉴定结果Fig. 1 Identi fi cation of recombinant pWPXL-pSAMHD1 plasmid
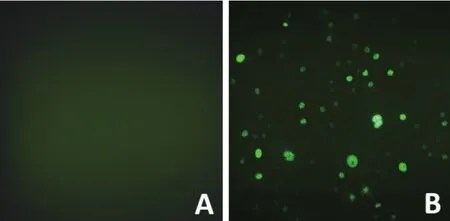
图2 阳性表达SAMHD1 MARC-145细胞的筛选(100×)Fig. 2 The positive MARC-145 cells overexpressing SAMHD1 screened by puromycin(100×)
2.3 RT-PCR分析猪SAMHD1基因的表达提取MARC-145细胞阳性克隆株第10代细胞的总RNA,采用引物pWPXL-pSAMHD1 forward 和pWPXL-pSAMHD1 reverse,经RT-PCR鉴定猪SAMHD1基因。结果显示,在约1800 bp处出现特异片段(图3),与猪SAMHD1全基因片段大小相符。扩增的PCR片段经回收测序,测序结果显示为猪SAMHD1全长基因序列。
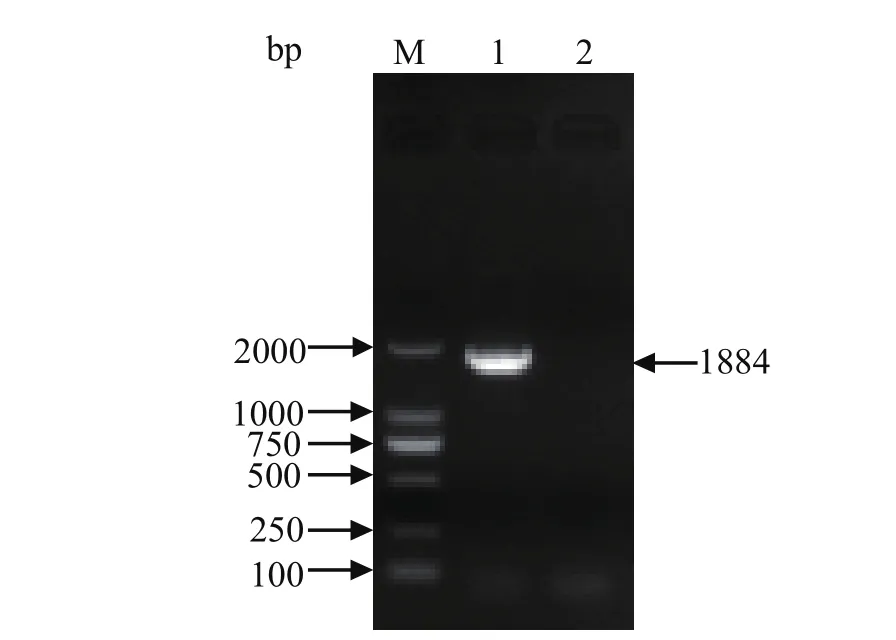
图3 MARC-145细胞系中的猪SAMHD1基因稳定性鉴定Fig. 3 Identi fi cation of porcine SAMHD1 gene in MARC-145 cells by RT-PCR
2.4 Western blot分析重组蛋白表达收集第3、7、10代MARC-145细胞阳性克隆株,进行Western blot分析。结果发现,在不同代次的MARC-145细胞中,重组表达的猪SAMHD1蛋白能够被猪SAMHD1单克隆抗体所识别,表明猪SAMHD1蛋白在MARC-145细胞中获得稳定表达(图4)。
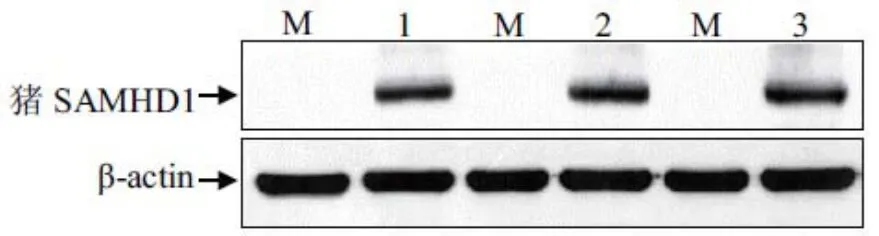
图4 猪SAMHD1在MARC-145细胞系中表达检测Fig. 4 Identi fi cation of porcine SAMHD1 expression in MARC-145 cells by Western blot
3 讨论
病毒与宿主的“斗争”仍在愈演愈烈。在病毒入侵细胞的过程中,细胞会利用多种策略来抑制病毒的复制;同时,病毒也会利用自身编码蛋白来拮抗宿主免疫系统的识别与清除。研究发现,某些猴免疫缺陷病毒(SIVsm/mac)编码的辅助蛋白Vpx,能够靶向降解SAMHD1,从而拮抗其抗病毒作用,造成病毒对髓系细胞的有效感染[15,16]。
猪繁殖与呼吸综合征病毒(Porcine reproductive and respiratory syndrome virus,PRRSV)是危害世界范围内养猪业的重要病毒之一,特别是高致病性猪繁殖与呼吸综合征病毒(Highly pathogenic porcine reproductive and respiratory syndrome virus,HPPRRSV)的出现,更加大了对养猪业的危害[17]。目前,针对PRRSV如何利用自身编码蛋白来逃避机体免疫系统的识别和清除,从而有利于自身的感染和复制,成为近年来针对PRRSV研究的热点。最近研究证实,SAMHD1作为一种天然限制性因子,能够阻止HP-PRRSV在MARC-145细胞中的复制,其作用机制在于SAMHD1能够抑制PRRSV复制过程中基因组互补RNA链的产生。同时,PRRSV感染其靶细胞-猪肺泡巨噬细胞(PAMs),能够上调SAMHD1蛋白的表达[11]。针对其调控通路研究发现,TLR3和RIG-I/MDA5免疫通路参与调控SAMHD1的表达,其下游重要的干扰素转录调控因子3(IRF3)在SAMHD1转录表达过程中发挥重要作用[10]。目前,有多种方法建立稳定表达外源蛋白的细胞系,相对于质粒转染目的细胞筛选获得稳定细胞系的方法,慢病毒包装具有高效的表达特性。因此,在探索PRRSV感染靶细胞过程拮抗猪SAMHD1的作用机制的研究中,需要建立稳定表达猪SAMHD1蛋白的细胞系。由于PAM细胞为原代细胞,分离与培养条件较为复杂,且不能传代培养。MARC-145细胞作为PRRSV体外培养的传代细胞系,细胞内的SAMHD1蛋白呈高度磷酸化的状态,失去了生物学活性[11]。因此,我们采用慢病毒表达系统在MARC-145细胞中表达猪SAMHD1,来弥补PAM细胞不能传代的缺陷,对深入探索猪天然免疫限制因子与PRRSV感染相互作用的机制提供了新的平台。
SAMHD1其抗病毒机制仍然在不断探索,是否有新的病毒基因参与调控其抗病毒活性目前仍不清楚。病毒也在不断的进化,是否会出现一定的变异,进而逃避SAMHD1的抗病毒活性,仍需后续的探索研究。深入了解SAMHD1的功能,对研发新型抗病毒药物和揭示机体固有免疫新的机制,都具有深远的意义。
[1] Stremlau M, Owens C M, Perron M J, et al. The cytoplasmic body component TRIM5alpha restricts HIV-1 infection in Old World monkeys[J]. Nature, 2004,427(6977)∶ 848-853.
[2] Sheehy A M, Gaddis N C, Choi J D, et al. Isolation of a human gene that inhibits HIV-1 infection and is suppressed by the viral Vif protein[J]. Nature, 2002,418(6898)∶ 646-650.
[3] Neil S J, Zang T, and Bieniasz P D. Tetherin inhibits retrovirus release and is antagonized by HIV-1 Vpu[J].Nature, 2008, 451(7177)∶ 425-430.
[4] Rice G I, Bond J, Asipu A, et al. Mutations involved in Aicardi-Goutieres syndrome implicate SAMHD1 as regulator of the innate immune response[J]. Nat Genet,2009, 41(7)∶ 829-832.
[5] Cribier A, Descours B, Valadao A L, et al.Phosphorylation of SAMHD1 by cyclin A2/CDK1 regulates its restriction activity toward HIV-1[J]. Cell reports, 2013, 3(4)∶ 1036-1043.
[6] White T E, Brandariz-Nunez A, Valle-Casuso J C, et al.The retroviral restriction ability of SAMHD1, but not its deoxynucleotide triphosphohydrolase activity, is regulated by phosphorylation[J]. Cell host & microbe, 2013, 13(4)∶441-451.
[7] Yan J, Kaur S, DeLucia M, et al. Tetramerization of SAMHD1 is required for biological activity and inhibition of HIV infection[J]. J Biol Chem, 2013, 288(15)∶ 10406-10417.
[8] de Silva S, Hoy H, Hake T S, et al. Promoter methylation regulates SAMHD1 gene expression in human CD4+T cells[J]. J Biol Chem, 2013, 288(13)∶ 9284-9292.
[9] Chen Z, Zhang L, and Ying S. SAMHD1∶ a novel antiviral factor in intrinsic immunity[J]. Future microbiology,2012, 7(9)∶ 1117-1126.
[10] Yang S, Zhan Y, Zhou Y, et al. Interferon regulatory factor 3 is a key regulation factor for inducing the expression of SAMHD1 in antiviral innate immunity[J].Sci rep, 2016, 6∶ 29665.
[11] Yang S, Shan T, Zhou Y, et al. Molecular cloning and characterizations of porcine SAMHD1 and its roles in replication of highly pathogenic porcine reproductive and respiratory syndrome virus[J]. Dev Com, 2014, 47(2)∶234-246.
[12] Kim E T, White T E, Brandariz-Nunez A, et al.SAMHD1 restricts herpes simplex virus 1 in macrophages by limiting DNA replication[J]. J Virol, 2013, 87(23)∶12949-12956.
[13] Yang S, Zhou Y J, Zhan Y, et al. Development of monoclonal antibodies specifically recognizing the endogenous sterile alpha motif and HD domain 1 protein in porcine cell lines[J]. Monoclon Antib Immunodiagn Immunother, 2014, 33(5)∶ 344-349.
[14] 杨莘, 周艳君, 姜一峰, 等. 猴源天然免疫限制性因子SAMHD1单克隆抗体的制备与鉴定[J]. 中国兽医科学,2014(9)∶ 921-926.
[15] Hrecka K, Hao C, Gierszewska M, et al. Vpx relieves inhibition of HIV-1 infection of macrophages mediated by the SAMHD1 protein[J]. Nature, 2011, 474(7353)∶658-661.
[16] Laguette N, Sobhian B, Casartelli N, et al. SAMHD1 is the dendritic- and myeloid-cell-specific HIV-1 restriction factor counteracted by Vpx[J]. Nature, 2011,474(7353)∶ 654-657.
[17] Tong G Z, Zhou Y J, Hao X F, et al. Highly pathogenic porcine reproductive and respiratory syndrome, China[J].Emerg Infect Dis, 2007, 13(9)∶ 1434-1436.
ESTABLISHMENT AND IDENTIFICATION OF A MARC-145 CELL LINE STABLY EXPRESSING PORCINE SAMHD1
YANG Shen, JIANG Yi-feng, YU Ling-xue, LIU Huan, ZHOU Yan-jun, GAO Fei, HUANG Qin-feng,TONG Guang-zhi
(Shanghai Veterinary Research Institute, CAAS, Shanghai 200241, China)
S852.42
A
1674-6422(2017)04-0001-06
2016-12-08
国家重点基础研究发展计划(973计划)项目(2014CB542700);国家科技支撑计划课题(2015BAD12B01-1);国家自然科学基金项目(31502072,31302098);国家生猪现代产业技术体系建设项目(CARA-36)
杨莘,男,博士,主要从事猪繁殖与呼吸综合征病毒致病机制研究
童光志,E-mail:gztong@shvri.ac.cn
——一道江苏高考题的奥秘解读和拓展

