4-羟苯基维胺在不同载体中对人瘢痕疙瘩成纤维细胞增殖及凋亡影响
李周娜 陈香儒 金哲虎
133000吉林延吉,延边大学附属医院皮肤科
4-羟苯基维胺在不同载体中对人瘢痕疙瘩成纤维细胞增殖及凋亡影响
李周娜 陈香儒 金哲虎
133000吉林延吉,延边大学附属医院皮肤科
目的探讨4-羟苯基维胺(4-HPR)在不同载体中对人瘢痕疙瘩成纤维细胞(HKF)增殖及凋亡的影响。方法采用薄膜-超声分散法制备4-HPR脂质体溶液及4-HPR微泡溶液。用不同浓度(0~80 mg/L)4-HPR脂质体溶液作用原代HKF 6~48 h后,噻唑蓝(MTT)法检测细胞增殖情况。将部分HKF分成3组,分别用15 mg/L 4-HPR溶液、4-HPR脂质体溶液、4-HPR微泡处理,每组再分成两个亚组,一个亚组在给药后接受超声处理,另一亚组不做超声处理。作用24 h后,噻唑蓝(MTT)法检测HKF的增殖情况。流式细胞仪检测15 mg/L 4-HPR脂质体或4-HPR微泡处理24 h后HKF的凋亡情况。结果成功制备4-HPR脂质体溶液及4-HPR微泡溶液。MTT检测显示,4-HPR脂质体溶液在1~80 mg/L浓度范围内对HKF增殖有抑制作用,且增殖抑制率与药物浓度呈正相关(r=0.633,P<0.01)。超声处理后4-HPR微泡组与4-HPR溶液及4-HPR脂质体组对HKF的增殖抑制作用差异均有统计学意义(P<0.01)。4-HPR脂质体组和4-HPR微泡组HKF凋亡率分别为(21.81±3.73)%和(39.79±1.61)%,较对照组(6.18±0.61)%均显著增加(均P<0.01)。结论成功制备4-HPR微泡,不同载体中4-HPR可促进HKF凋亡,进而抑制增殖,其中4-HPR微泡结合超声抑制作用较4-HPR脂质体强。
维甲酸;瘢痕疙瘩;成纤维细胞;细胞增殖;4-羟苯基维胺
维A酸类药物对体外培养的成纤维细胞(fibroblast,FB)DNA合成具有干扰作用,可抑制成纤维细胞增殖及胶原代谢[1]。4-羟苯基维胺(4-hydroxyphenyl-retinamide,4-HPR)是人工合成的全反式维A酸文献显示,4-HPR对多种恶性肿瘤细胞有较高的抗肿瘤活性,毒性低于其他维A酸类药物[2]。临床上瘢痕疙瘩有肿瘤样生长的特性,推测4-HPR也可用于增生性瘢痕和瘢痕疙瘩的治疗。但4-HPR水溶性差,直接给药效果不佳。为了开发一种治疗瘢痕疙瘩的纳米药物载体,提高4-HPR的溶解度,我们结合超声波技术,研究4-HPR对人瘢痕疙瘩成纤维细胞(HKF)增殖及凋亡的作用,为临床上更好地治疗瘢痕疙瘩提供依据。
材料与方法
一、材料
1.细胞株:将瘢痕疙瘩原代培养保存于液氮中的HKF(来自中国医学科学院药物研究所)取出,复苏,在37℃、5%CO2培养箱中培养,细胞长满90%时传代,取第3~5代细胞用于实验。
2.主要试剂和仪器:流式细胞仪(FACS Calibur)产自美国BD公司;超声波细胞粉碎机(JY92-IIN)产自宁波新芝生物科技股份有限公司;4-HPR产自南京圣赛化工有限公司;Annexin V-FITC/PI细胞凋亡试剂盒产自上海贝博生物科技有限公司;噻唑蓝(MTT)、胆固醇、甲醇(HPLC级)均产自美国Sigma-Aldrich公司;DMEM培养基产自美国HyClone公司;甲氧基聚乙二醇一二硬脂酰磷脂酰乙醇胺-2000(mPEG-DSPE2000)产自美国 Laysan Bio公司;蛋黄卵磷脂(EPC)产自上海东尚公司。
二、方法
1.药物配制:
(1)4-HPR 溶液:20 μg 4-HPR 加入 200 μl 0.04%的二甲基亚砜(DMSO)溶解,-20℃长期保存,实验时用DMEM培养液稀释至相应浓度。
(2)4-HPR脂质体:EPC 28 mg、胆固醇2.5 mg、mPEG-DSPE2000 3 mg、4-HPR 3 mg,加入适量氯仿,涡旋、转蒸得到淡黄色膜状物,加入4 ml去离子水水浴水化,静置后得到载4-HPR脂质体混悬液,水膜过滤得4-HPR脂质体溶液[3]。
(3)4-HPR微泡:取4-HPR脂质体溶液1 ml,加入10 μl全氟戊烷,冷水浴内超声60 s,得4-HPR微泡溶液。置于4℃冰箱内密封保存,30 d内保存过程中,观察外观变化。
2.细胞增殖实验(MTT法):
(1)不同浓度4-HPR脂质体溶液对细胞增殖的影响:采用MTT比色法检测。将HKF以4 000个/孔的密度接种于96孔培养板,培养24 h后,弃去旧培养液,分别向各孔内加入4-HPR脂质体溶液,使药物终浓度分别为0、1、2.5、5、10、20、40和80 mg/L,同时设空白组(不加细胞),继续培养6、12、24、48 h后取出培养板,每孔加入(避光条件下)5 g/L的MTT溶液 20 μl,置 CO2培养箱内避光孵育 4 h,加 DMSO 150 μl,振荡10 min,置酶标仪490 nm波长下检测各孔吸光度(A)。细胞增殖抑制率(%)=(A对照-A实验)/(A对照-A空白)× 100%。
(2)超声及不同载体中HRP对细胞增殖的影响:细胞接种实验如同前操作,细胞分为3组,分别用含15 mg/L 4-HPR溶液、4-HPR脂质体溶液和4-HPR微泡的含药培养液培养24 h,每组再分为2个亚组,超声亚组给药后立即进行超声,另一亚组则不予超声处理。超声方法为在培养皿底部涂层超声耦合剂,利用低强度聚焦超声仪以频率3 MHz,功率 1 W/cm2,刺激周期 20%,超声 30 s[4]。设对照组,仅加入细胞,但不给药,其他处理同上。MTT法检测细胞增殖情况,具体方法同上。
3.流式细胞仪检测细胞凋亡率:将HKF以1×105个/孔接种入6孔培养板内培养48 h。实验分为对照组、4-HPR脂质体组、4-HPR微泡组:4-HPR脂质体组和4-HPR微泡组分别加入15 mg/L 4-HPR脂质体和微泡,对照组则加入含等体积5%葡萄糖的培养基。继续培养24 h后,收集各组细胞,冷PBS洗涤2次,加入结合液400 μl悬浮细胞,再加入5 μl膜联蛋白Ⅴ-异硫氰酸荧光素染色液,混匀后4℃避光孵育15 min,再加10 μl碘化丙锭染色液,混匀,4 ℃孵育(避光)5 min后,收集细胞立即用流式细胞仪检测。
4.统计学方法:所有数据以Excel记录,计量资料用±s表示,用SPSS17.0软件进行统计学处理,细胞增殖抑制率比较采用重复测量的方差分析,组间比较采用Bonferroni法,药物浓度与细胞增殖抑制率的关系采用Pearson相关分析,对成纤维细胞凋亡的影响采用独立样本T检验进行比较,P<0.05为差异有统计学意义。。
结 果
一、不同载体药物形态学观察
4-HPR脂质体溶液及4-HPR微泡溶液在外观上未见明显区别,均呈现为略带蓝色乳光的淡黄色澄清液体。在透射电镜下观察4-HPR脂质体溶液及4-HPR微泡溶液均呈球形或类球形结构,大小均匀、外观圆整(图1)。两种溶液置于4℃冰箱内密封保存,30 d保存过程中,一直为淡黄色澄清液体,说明制备药物稳定性良好,可用于下一步实验。
二、4-HPR脂质体溶液对HKF增殖的影响
1~80 mg/L 4-HPR脂质体溶液作用24 h对HKF增殖有抑制作用,抑制率和药物浓度呈正相关(r=1.158,P< 0.001)。见图2。半数抑制浓度(IC50)估计值为15.01 mg/L,95%置信区间为13.10~17.02 mg/L。重复测量的方差分析显示,增加溶液浓度或者延长作用时间均能使细胞增殖抑制率增加(F值分别为5.45、11.26,P值均 < 0.001),并且药物浓度和作用时间表现为两个相对独立的因素,彼此之间交互作用不显著(F=0.217,P=0.685)。
三、4-HPR溶液、4-HPR脂质体和4-HPR微泡联合超声对HKF增殖的影响
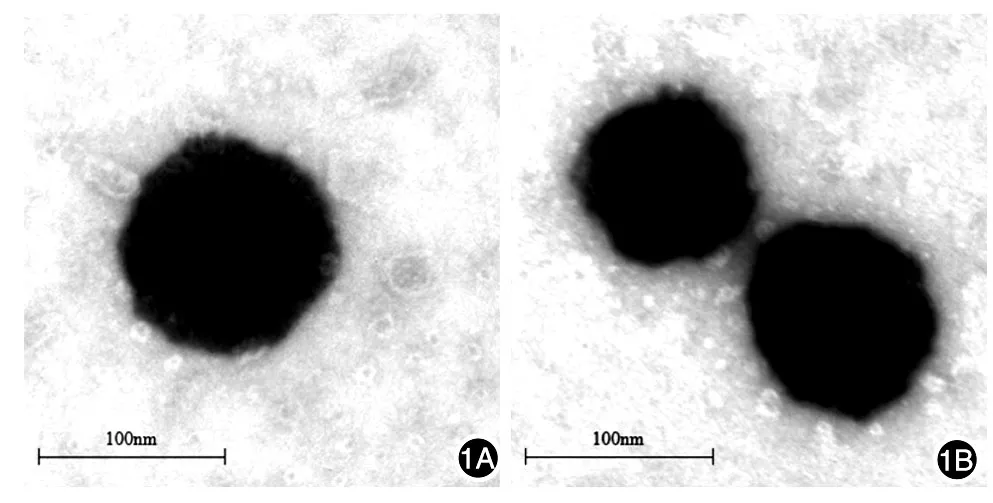
图1 透射电镜观察4-HPR脂质体(1A)和4-HPR微泡(1B)
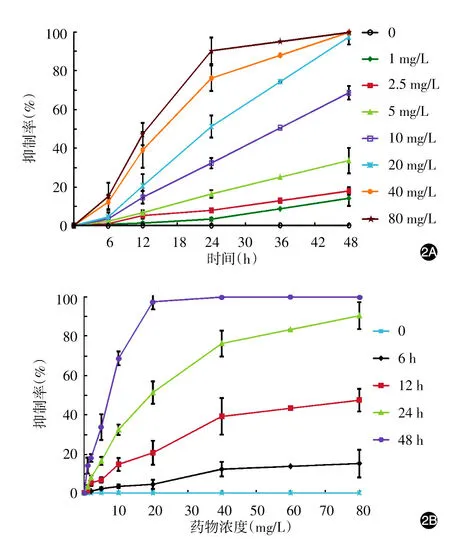
图2 不同浓度4-羟苯基维胺作用不同时间对人瘢痕疙瘩成纤维细胞增殖的影响 2A:增殖抑制率随时间的变化曲线;2B:增殖抑制率随药物浓度的变化曲线
在不超声的情况下,4-HPR溶液对HKF的抑制作用大于4-HPR微泡和4-HPR脂质体,而4-HPR微泡和4-HPR脂质体的抑制作用相当。超声处理后,4-HPR微泡对HKF的抑制率显著增加(t=9.440,P=0.001),4-HPR溶液和4-HPR脂质体的抑制作用也明显增强;对照组联合超声对HKF的增殖抑制率约为10%,见表1。
四、4-HPR对HKF凋亡的影响
4-HPR脂质体组和4-HPR微泡组HKF凋亡率分别为(21.81±3.73)%和(39.79±1.61)%,较对照组(6.18±0.61)%均显著增加(t值分别为16.59、52.12,均P< 0.01)。见图3。
讨 论
由于4-HPR的水溶性较差,在制备4-HPR脂质体的过程中,载体与药物的比例要适当,使所投的载体能包裹药物,尽量降低游离药物的量。本研究选择氯仿作为溶剂溶解4-HPR、PEG-DSPE和EPC,得到澄清的溶液,未见沉淀,溶解良好,旋蒸后成膜均匀。在4-HPR脂质体中加入全氟戊烷超声后得到4-HPR微泡,稳定性增强,全氟戊烷能够很好地包裹在脂质体内部。
表1 各组药物在有或无超声处理时对瘢痕疙瘩成纤维细胞增殖的抑制率(%,±s)
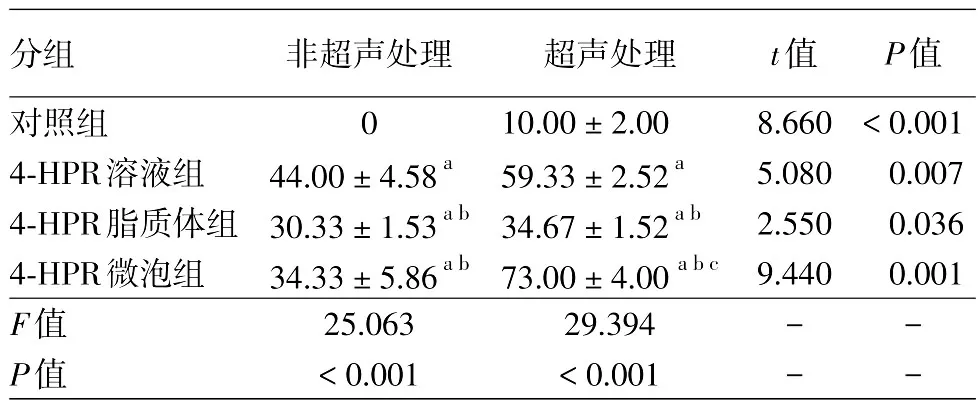
表1 各组药物在有或无超声处理时对瘢痕疙瘩成纤维细胞增殖的抑制率(%,±s)
注:n=5。a:与对照组比较,P < 0.01;b:与4-HPR溶液组比较,P<0.05或<0.01;c:与4-HPR脂质体组比较,P<0.01
分组对照组4-HPR溶液组4-HPR脂质体组4-HPR微泡组F值P值P值<0.001 0.007 0.036 0.001 t值8.660 5.080 2.550 9.440非超声处理0 44.00±4.58a 30.33±1.53ab 34.33±5.86ab 25.063<0.001超声处理10.00±2.00 59.33±2.52a 34.67±1.52ab 73.00±4.00abc 29.394<0.001----
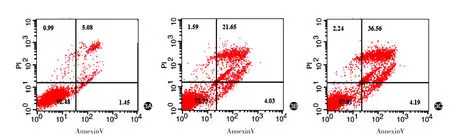
图3 流式细胞仪观察不同载体中4-HPR对瘢痕疙瘩成纤维细胞凋亡的影响 3A:对照组;3B:4-HPR脂质体组;3C:4-HPR微泡组
大量研究表明,4-HPR在体外实验中可引起多种肿瘤细胞的凋亡[5]。4-HPR主要通过维A酸受体(RAR)和非RAR途径抑制细胞生长及诱导肿瘤细胞凋亡,但具体作用机理尚未明确,目前认为主要是通过提高活性氧、神经酰胺的水平,刺激半胱天冬酶活性增加等机制来诱导肿瘤细胞凋亡[6]。
本研究显示,4-HPR对HKF增殖的抑制作用具有浓度、外界条件依赖性。在药物浓度相同的情况下,4-HPR溶液对HKF的抑制作用明显强于4-HPR微泡和4-HPR脂质体,可能是因为4-HPR溶液中药物直接暴露于单层贴壁细胞,而4-HPR脂质体与4-HPR微泡在细胞培养过程中脂质体结构逐渐分解缓慢释药,所以作用较4-HPR溶液缓慢。而且,超声处理后4-HPR溶液组和4-HPR脂质体组细胞抑制率相对于未经超生处理时有明显升高,表明超声波对药物的释放和吸收有促进作用;4-HPR微泡组由于超声的作用,微泡破碎,对细胞的抑制作用显著大于4-HPR溶液组、4-HPR脂质体组;对照组超声处理后对细胞具有一定的增殖抑制,说明超声不仅对纳米粒的释药和药物吸收有促进作用,对HKF的增殖也有抑制作用。
细胞凋亡实验显示,在同等强度超声作用下,4-HPR脂质体组和4-HPR微泡组HKF凋亡率与对照组相比均明显增高,其中4-HPR微泡组最为显著,说明4-HPR微泡联合超声能更有效地诱导HKF凋亡。
综上,我们认为4-HPR可以有效抑制HKF增殖,诱导其发生凋亡,且4-HPR微泡联合超声较4-HPR溶液、4-HPR脂质体溶液能更有效地抑制HKF增殖并诱导其凋亡,为临床上更好地治疗瘢痕疙瘩提供理论和实验依据。
[1]Huang C,Ogawa R.Pharmacological treatment for keloids[J].Expert Opin Pharmacother,2013,14(15):2087-2100.DOI:10.1517/14656566.2013.826651.
[2]Sogno I,Venè R,Ferrari N,et al.Angioprevention with fenretinide:targeting angiogenesis in prevention and therapeutic strategies[J].Crit Rev Oncol Hematol,2010,75(1):2-14.DOI:10.1016/j.critrevonc.2009.10.007.
[3]Badaoui FZ,张灿.载药聚合物胶束的制备和肿瘤靶向性研究进展[J].北方药学,2013,10(6):61-62,63.
[4]Rapoport NY,Nam KH,Gao Z,et al.Application of ultrasound for targeted nanotherapy of malignant tumors[J].Acoust Phys,2009,55(4-5):594-601.DOI:10.1134/S1063771009040162.
[5]Vratilova J,Frgala T,Maurer BJ,et al.Liquid chromatography method for quantifying N-(4-hydroxyphenyl)retinamide and N-(4-methoxyphenyl)retinamide in tissues[J].J Chromatogr B Analyt Technol Biomed Life Sci,2004,808(2):125-130.DOI:10.1016/j.jchromb.2004.02.031.
[6]Gao ZG,Fain HD,Rapoport N.Controlled and targeted tumor chemotherapy by micellar-encapsulated drug and ultrasound[J].J Control Release,2005,102(1):203-222.DOI:10.1016/j.jconrel.2004.09.021.
Effects of 4-hydroxyphenyl retinamide in different vehicles on the proliferation and apoptosis of human keloid fibroblasts
Li Zhouna,Chen Xiangru,Jin Zhehu
Department of Dermatology,Yanbian University Hospital,Yanji 133000,Jilin,China
Jin Zhehu,Email:jinzh_621@163.com
ObjectiveTo evaluate effects of 4-hydroxyphenyl retinamide(4-HPR)in different vehicles on the proliferation and apoptosis of human keloid fibroblasts(HKFs).MethodsA filmultrasonic dispersion method was used to prepare 4-HPR liposome solution and 4-HPR microbubbles.Primary HKFs werein vitrotreated with the 4-HPR liposome solution at different concentrations of 0-80 mg/L for 6-48 hours,and the proliferative activity of HKFs was evaluated by methyl thiazolyl tetrazolium(MTT)assay.Some other HKFs were divided into 3 experimental groups to be treated with 15 mg/L 4-HPR solution(4-HPR solution group),15 mg/L 4-HPR liposome solution(4-HPR liposome solution group)and 15 mg/L 4-HPR microbubbles(4-HPR microbubble group),respectively,and each group was divided into ultrasonic-treated and-untreated subgroups.HKFs without treatment served as control group.After 24-hour treatment,MTT assay was conducted to evaluate the proliferative activity of HKFs in the above groups,flow cytometry to detect apoptosis of HKFs in all groups except the 4-HPR solution group.ResultsThe 4-HPR liposome solution and 4-HPR microbubbles were successfully prepared.MTT assay showed inhibitory effects of 4-HPR liposome solution at concentrations of 1-80 mg/L on the proliferation of HKFs,and the proliferation inhibition rate was positively associated with the drug concentrations(r=0.633,P< 0.01).After the ultrasonic treatment,inhibitory effects on the proliferation of HKFs significantly differed among the 4-HPR microbubble group,4-HPR solution group and 4-HPR liposome solution group(P< 0.01).The 4-HPR liposome solution group and the 4-HPR microbubble group both showed significantly increased apoptosis rates(21.81% ±3.73%,39.79% ±1.61%,respectively)compared with the control group(6.18% ± 0.61%,bothP< 0.01).ConclusionThe 4-HPR microbubbles are successfully prepared,and 4-HPR in different vehicles all can promote HKF apoptosis and suppress HKF proliferation,among which,4-HPR microbubbles in combination with ultrasonic treatment have stronger inhibitory effects than the 4-HPR liposome solution.
Tretinoin;Keloid;Fibroblasts;Cell proliferation;4-Hydroxyphenyl-retinamide
金哲虎,Email:jinzh_621@163.com
10.3760/cma.j.issn.0412-4030.2017.03.010
国家自然科学基金(81260233);吉林省教育厅“十二五”科学技术研究项目[吉教科合字(2012)第2号];吉林省卫生厅科研课题(2011Z085);吉林省产业技术研究与开发专项(2013C034)
Fund programs:National Natural Science Foundation of China (81260233);Science and Technology Research Project of the Education Department of Jilin Province during the 12th Five-Year Plan Period[(2012)2];Research Foundation of Health Department of Jilin Province of China(2011Z085);Research and Development Planning Project of Industries and Technology of Jilin Province of China(2013C034)
2016-12-02)
(本文编辑:尚淑贤)

