Array-ELISA检测六项肿瘤标志物诊断结直肠癌的临床价值分析
傅桂霞
(青岛市第九人民医院检验科,山东 青岛 266002)
Array-ELISA检测六项肿瘤标志物诊断结直肠癌的临床价值分析
傅桂霞
(青岛市第九人民医院检验科,山东 青岛 266002)
目的探讨微阵列酶联免疫法(Array-ELISA)检测六项肿瘤标志物诊断结直肠癌(CRC)的临床价值。方法选择49例CRC患者作为CRC组,选择19例同期进行结直肠手术的良性病变患者作为良性组,另取同期71例健康体检者作为对照组。采集3组患者的静脉血,通过Array-ELISA技术进行六项肿瘤标志物(AFP、CEA、PSA、CA125、CA153及CA199)检测。比较3组血清六项肿瘤标志物检测结果、CRC组ROC AUC结果、以及CRC组PRE与6项肿瘤标志物的相关参数。结果(1)CRC组血清CEA、AFP、CA199及CA125水平均高于良性组与对照组(P<0.05)。3组PSA与CA153水平比较,差异无统计学意义(P>0.05)。(2)单项检测中CEA(AUC=0.916,P=0.001)具有最高的诊断价值,Logistic回归模型建立的PRE面积为0.932,均高于单项指标检测。(3)本组CRC患者中的CEA特异度、灵敏度与准确率在单项中最高;联合检测中Logistic回归预测变量PRE的特异度、灵敏度与准确率高于CEA(P<0.05)。结论Array-ELISA对CRC患者六项肿瘤标志物均有理想的检测效果,但单项肿瘤标志物的特异度、灵敏度具有一定的局限性,六项指标联合检测可以有效提高CRC的检出率。
Array-ELISA;六项肿瘤标志物;结直肠癌;临床价值
结直肠癌(colorectal cancer,CRC)是临床最为常见的恶性肿瘤,由于早期无特异性的表现,多数患者就诊时往往已步入晚期,继而丧失了最佳的治疗时机[1]。因此,尽早采取有效的诊断与治疗措施是延长CRC患者生存时间的关键。研究发现,单项肿瘤标志物对CRC的特异性与敏感性具有一定的局限性,而多项肿瘤标志物则可以提高CRC的诊断率,且对转移、复发与术后疗效具有显著的评价作用[2]。微阵列酶联免疫法(Array-ELISA)是生命科学中的一项高新科技检测技术,其技术平台主要包括现代微阵列技术、酶促化学发光技术及低温电荷耦合器成像技术。为了进一步完善CRC患者的临床诊疗方案,本研究采用Array-ELISA法对49例CRC患者进行了六项肿瘤标志物检测,并采用ROC曲线与Logistic回归分析来探讨六项肿瘤标志物对CRC的临床诊断价值,现报告如下。
1 资料与方法
1.1一般资料
选择2016年1月至2016年12月本院收治的49例CRC患者作为CRC组,其中男性26例,女性24例;平均年龄(65.2±5.2)岁;选择同期于本院进行结直肠手术的19例良性病变患者作为良性组,其中男性10例,女性9例;平均年龄(65.5±5.3)岁。(1)所有患者均经组织病理学检查证实;(2)原发性病变;(3)本次研究内容已告知患者或其家属,并取得其知情同意。排除标准:(1)合并血液系统、免疫系统疾病;(2)近期有感染史。另取同期于本院进行体检的71例健康体检者作为对照组(均无结直肠疾病史,临床检查未见异常),其中男性36例,女性35例;平均年龄(65.7±5.4)岁。3组研究对象在性别及年龄构成比较中差异无统计学意义(P>0.05)。
1.2检测方法
在晨起空腹状态下,采集3组患者的静脉血3 mL,放置20 min后,离心5 min,控制室温在1 800×g,使血清分离,对肿瘤标志物[糖类抗原 125(CA125)、癌胚抗原(CEA)、前列腺特异性抗原(PSA)、糖类抗原 199(CA199)、甲胎蛋白(AFP)和糖类抗原153 (CA153)]进行检测。(1)试剂与仪器:ECLIA分析仪由德国罗氏公司提供,均配置原厂校准品、试剂与质控物。Array-ELISA六项肿瘤标志物检测试剂盒由北京华大吉比爱生物技术有限公司提供。(2)Array-ELISA原理:采用双抗体夹心试剂盒,以微阵列形式将CA153、CEA、AFP、CA199、CA125及PSA特异性抗体组织排布在微孔板内,其中加入待检测血浆标本或标准品,待发生反应后洗涤,添加酶标抗体工作液给予持续性温育反应,完成反应后再次洗涤,最后添加发光液,根据待测标志物的浓度来增加发光信号。通过生物芯片阅读设备准确采集与处理微孔板内微阵列信号、图像,结合数据处理软件,获取到六项肿瘤标志物标本内的定量数据结果。(3)Array-ELISA检测步骤:将六项肿瘤标志物标本、50 μL待测标本及质控品依次加入微孔板内;第1次温育;采用封口膜将其封口,并振荡45 min,温度控制在37 ℃;5次洗液洗板,拍干;之后加入50 μL酶标抗体工作液,第2次温育;再予5次洗板,拍干;最后在每个孔内加入发光液A与B混合物40 μL,马上放入到生物芯片阅读设备内进行检测。
1.3观察指标
(1)观察3组血清六项肿瘤标志物检测结果。参照试剂参考指标:CA153<31.3 U/mL、CA199<37 U/mL、CA125<35 U/mL、CEA0.00~5.00 ng/mL、AFP 0.00~7.00 ng/mL、PSA 0.00~4.00 ng/mL,<参考指标为阴性,≥参考指标为阳性。(2)观察CRC组的ROC AUC结果。以AFP、CEA、PSA、CA125、CA153及CA199为检验变量,将诊断结果作为状态变量进行ROC曲线分析。(3)观察CRC组PRE与六项肿瘤标志物的相关参数。通过Forward condition法实施Binary Logistic回归分析[3],去除无用变量,分析其余变化,得到CRC的概率预测方程,即P=1/[1+e-(-1.253+0.068AFP+0.033CA199-0.065CA154-0.018CA125)],计算出个体预测值的变量PRE,并以似然比检测Logistic回归模型。
1.4统计学分析
通过SPSS15.0对六项肿瘤标志物的数据分布情况进行状态检验,非正态分布以Mann Whitney U及Kruskal-Wallis检验,正态分布以方差分析;计数资料、特异性与敏感性对比以χ2检验。采用Logistic回归选择变量,建立回归方程与新变量,各项单项指标与新变量进行ROC曲线分析。
2 结果
2.1 3组血清六项肿瘤标志物检测结果对比
CRC组血清CEA、AFP、CA199及CA125水平均高于良性组与对照组,差异有统计学意义(P<0.05)。3组PSA与CA153水平对比差异无统计学意义(P>0.05)。见表1。
2.2 CRC组ROC AUC评价
单项检测中,CEA(AUC=0.916,P=0.001)具有最高的诊断价值,CA153(AUC 0.576)与PSA(AUC=0.553)ROC曲线几乎成对角线,诊断价值较低;Logistic回归模型建立的PRE面积为0.932,均高于单项指标检测。见表2。
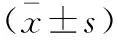
表1 3组血清六项肿瘤标志物检测结果对比
*P<0.05,与良性组比较;#P<0.05,与对照组比较。

表2 CRC组ROC AUC评价
2.3 CRC组PRE与6项肿瘤标志物相关参数评价
本组CRC患者中的CEA特异度、灵敏度与准确率在单项中最高;联合检测中Logistic回归预测变量PRE的特异度、灵敏度与准确率高于CEA(P<0.05)。见表3。
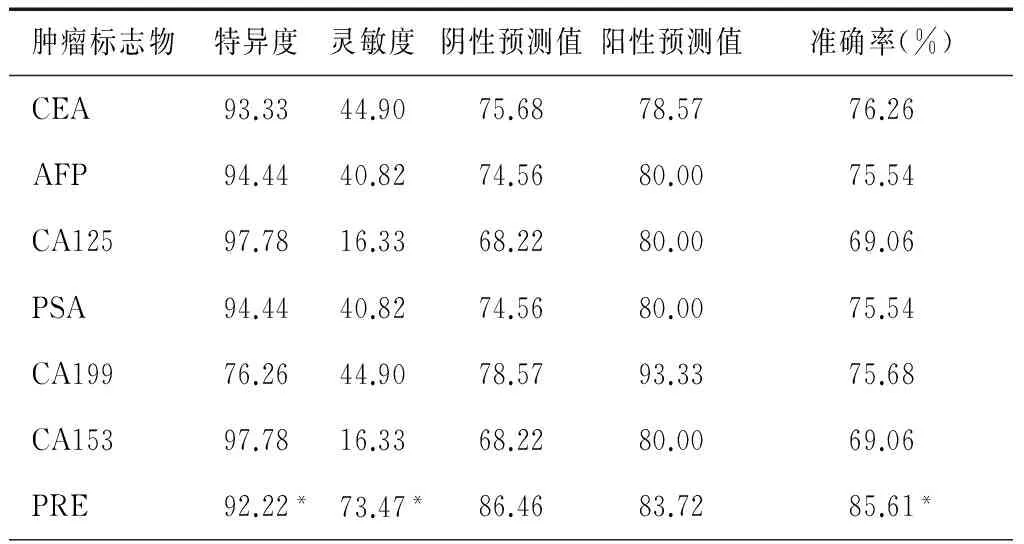
表3 CRC组PRE与6项肿瘤标志物相关参数评价
*P<0.05,与CEA比较。
3 讨论
近年来,随着医学检验技术的不断发展与完善,CRC患者除了采用影像学与病理学诊断外,血清肿瘤标志物检测也得到了临床的广泛关注[4]。肿瘤标志物又称为肿瘤标记物,是恶性肿瘤细胞中的特征性存在,或由恶性肿瘤细胞异常形成的物质,或是宿主对肿瘤刺激反应而形成的物质,可作为评价肿瘤发生、进展、判断抗肿瘤治疗效果的一类物质。肿瘤标志物主要存在于肿瘤患者体液、血液、组织及排泄物内,可以通过生物学、免疫学及化学方法检测到[5-6]。然而,研究发现,单个肿瘤标志物的特异性与敏感性有限,所以国际上普遍采用多项标志物联合方案进行检验,以便保证诊疗质量[7]。目前,临床主要采用酶免疫分析、放射免疫分析、时间分辨荧光免疫分析、化学发光免疫分析、生物芯片技术及ECLIA技术进行肿瘤标志物检验[8]。上述传统检测方法各具有优势,所以在较长一段时间,各项方式以互补方式应用。
现阶段,医学界所发现的肿瘤标志物约100余种,而选择正确的标志物组合对肿瘤诊断具有至关重要的作用[9]。美国癌症学会、美国临床生化学会等研究发现,六项肿瘤标志物PSA、CEA、AFP、CA199、CA125及CA153是评价肿瘤最为明确、稳定及敏感度高的标志物,几乎可以适用于任何常见的肿瘤,对临床诊断与评价抗肿瘤治疗效果具有重要的意义[10-11]。CEA是检测CRC最为灵敏的指标,但因单项检测存在一定的假阴性与假阳性,所以临床易发生漏诊。多项研究指出,为了有效降低误诊与漏诊的发生概率,采用多个肿瘤标志物联合检测来提高诊断CRC诊断的准确率与灵敏度十分必要[12-13]。Array-ELISA试剂盒可以对六项肿瘤标志物进行检测,不仅缩短了检测时间,且一次性检出,控制了单项检测的成本[14]。Array-ELISA的检测原则是在相互无影响的基础上,将肿瘤标志物抗体等多类特异性生物活性物以固定的微阵列方式排列在每个微孔板板孔中,当血浆内抗原/抗体特异性结合于包被抗体/抗原后,再结合于酶标抗体而形成免疫复合物,添加发光液,由生物芯片分析,继而获取到多项定量检测指标。本研究采用Array-ELISA技术对CRC患者的六项肿瘤标志物进行检测,结果显示CRC组血清CEA、AFP、CA199及CA125水平均高于良性组与对照组(P<0.05)。3组PSA与CA153水平对比差异无统计学意义(P>0.05)。同时,本研究采用Logistic回归分析,拟合最佳回归曲线与ROC曲线,观察六项肿瘤标志物联合诊断CRC的效果,以及特异度、灵敏度及准确率。结果提示,单项检测中CEA(AUC=0.916,P=0.001)具有最高的诊断价值,说明CEA是CRC诊断的最佳单项标志物,这与部分研究结果相符[15]。采用联合检测时,Logistic回归分析所得出的预测变量PRE面积为0.932,均高于单项指标检测。此结果可见,联合检测能够有效提高CRC的诊断效能。此外,本组CRC患者中的CEA特异度、灵敏度与准确率在单项中最高,联合检测中Logistic回归预测变量PRE的特异度、灵敏度与准确率高于CEA(P<0.05),进一步说明联合检测利于CRC的检出。
总之,Array-ELISA对CRC患者六项肿瘤标志物均有理想的检测效果,但单项肿瘤标志物诊断CRC的特异度、灵敏度具有一定的局限性,六项指标联合检测可以有效提高CRC的检出率。临床可以通过六项肿瘤标志物结合影像学及个体情况对CRC患者进行综合评价,以便提高诊疗效果。
[1] 石博,黄可欣,李天舒,等.上皮性卵巢肿瘤患者血清及癌组织中CD34、PCNA蛋白的表达[J].中国妇幼保健,2014,29(16):2483-2485.
[2] 应军,赵静.四种方法检测抗双链DNA抗体诊断效能的对比分析[J].华西医学,2014,29(7):1305-1308.
[3] 沈建康,袁建明,蔡中瑞.CEA、CA199、CA724及HSP60在胃癌患者血清中的表达及应用价值[J].川北医学院学报,2016,31(6):848-850.
[4] 邱振华,王茂生,杨长福,等.卵巢癌患者联合检测血清HE4和CA125的临床价值[J].国际检验医学杂志,2014,35(15):1984-1985,1988.
[5] Shimada H,Noie T,Ohashi M,etal.Clinical significance of serumtumor markers for gastric cancer:a systematic review of literature by the Task Force of the Japanese Gastric Cancer Association[J].Gastric Cancer,2014,17(1):26-33.
[6] 王起来,常红叶.电化学发光免疫法和酶联免疫法检测血清糖类抗原125的对比分析[J].中国实验诊断学,2014,18(10):1715-1716.
[7] 姚家奎,韩东升,周林,等.ECLIA法定量检测乙肝血清标志物的临床应用[J].国际检验医学杂志,2014,35(22):3122-3123.
[8] 李彤,周芨,李清,汪广杰.碱基切除修复基因APE1,XRCC1多态性和肿瘤标志物CA199,CEA与鼻咽癌的临床关联研究[J].川北医学院学报,2015,30(5):667-672.
[9] 吴君荣,赵惠柳,舒宏,等.抗凝血酶-Ⅲ在甲胎蛋白阴性肝硬化和肝癌的鉴别诊断价值[J].国际检验医学杂志,2016,37(20):2875-2876.
[10] Li XS,Xu Q,Fu XY,etal.Heat shock protein 22 overexpression is associated with the progression and prognosis in gastric cancer[J].J Cancer Res Clin Oncol,2014,140(8):1305-1313.
[11] 吴寒静,王凯,马卫红,等.血清肿瘤标志物NSE、SCC、CYFRA21-1与CEA联合检测在肺癌诊断中的应用价值研究[J].国际检验医学杂志,2016,37(22):3218-3220.
[12] 李宏杰,应雄江,鄢姣,等.ELISA测定HBsAg血清样本经化学发光法定量检测与乳胶免疫层析法两对半检测结果分析[J].中国卫生检验杂志,2015,25(6):856-859.
[13] 张彩华.癌胚抗原125与附睾蛋白4联合检测在子宫病变中的诊断意义[J].中国肿瘤临床与康复,2015,22(04):6-408.
[14] 韩光辉,张丽君,周奇.新型卵巢肿瘤标志物人附睾蛋白4的两种定量检测方法的比较与分析[J].中国妇幼保健,2015,30(13):2086-2088.
[15] 杨娜.酶联免疫法与电化学发光法检测AFP肿瘤标志物结果的对比分析[J].中国医学工程,2015,23(4):129-131.
ClinicalvalueofArray-ELISAindetectingsixtumormarkersindiagnosisofcolorectalcancer
FU Gui-xia
(DepartmentofLaboratory,QingdaoNinthPeople’sHospital,Qingdao266002,Shandong,China)
Objective:To evaluate the clinical value of Array-ELISA in the detection of six tumor markers in colorectal cancer (CRC).Methods49 cases of CRC patients as CRC group,19 cases of benign lesions were selected for colorectal surgery as the benign group,71 healthy subjects another same medical examination as the control group.The venous blood of three groups of patients was collected,and six tumor markers (AFP,CEA,PSA,CA125,CA153 and CA199) were detected by Array-ELISA technique.The serum markers of six tumor markers,the results of CRC,ROC and AUC in the three groups were observed and compared,and the parameters related to PRE and 6 tumor markers in group CRC were observed.ResultsThe serum CEA,CRC,CA199 and CA125 levels in CRC group were higher than those of benign group and control group (P<0.05).There was no significant difference between the three groups of PSA and CA153 (P>0.05).The single detection of CEA (AUC=0.916,P=0.001) had the highest diagnostic value of the Logistic regression model to establish the area for the PRE 0.932,were higher than the single index detection.The patients with CRC CEA in specificity,sensitivity and accuracy was the highest in the individual,combined detection in Logistic regression prediction variable PRE specificity,sensitivity and accuracy was higher than that of CEA (P<0.05).ConclusionArray-ELISA marker detection effect has the ideal of CRC patients with six tumor,but single tumor marker specificity and sensitivity has certain limitations,combined detection of six indexes can effectively improve the detection rate of CRC.
Array-ELISA;Six tumor markers;Colorectal cancer;Clinical value
10.3969/j.issn.1005-3697.2017.05.038
2017-05-14
傅桂霞(1971-),女,主管检验师。E-mail:fuguixia71@126.com
时间: 2017-10-10 02∶28
http://kns.cnki.net/kcms/detail/51.1254.R.20171010.0228.078.html
1005-3697(2017)05-0781-04
R735.3
A
(学术编辑廖涛)
本刊网址:http://www.nsmc.edu.cn作者投稿系统http://noth.cbpt.cnki.net邮箱xuebao@nsmc.edu.cn

