石油降解菌群的筛选、构建及其降解特性研究*
詹亚斌 张 桥 陈凯伦 李方敏 马立安#
(1. 长江大学生命科学学院,湖北 荆州 434025;2.长江大学化学与环境工程学院,湖北 荆州 434025)
石油降解菌群的筛选、构建及其降解特性研究*
詹亚斌1张 桥1陈凯伦2李方敏2马立安1#
(1. 长江大学生命科学学院,湖北 荆州 434025;2.长江大学化学与环境工程学院,湖北 荆州 434025)
为了构建高效石油降解混合菌群,从潜江某油田采集8个石油污染土样(分别记为S1~S8)和2个石油污染水样(分别记为W3、W4),以石油为唯一碳源进行富集驯化培养;采用外观评分、石油降解率、石油3组分降解率、饱和烃中正构烷烃色谱分析等方法筛选石油降解优势菌群,构建石油降解混合菌群;采用正交试验研究混合菌群最佳降解条件。结果表明,富集的10个石油降解菌群中S3、S4、S5、S6、S8为优势菌群,培养30d后的石油降解率分别为21.67%、22.34%、27.23%、20.46%、19.99%;菌群W3、W4对石油乳化效果较好;混合菌群M3(S3+S4+S5+S8+W3+W4)为石油降解优势混合菌群,其最佳降解条件为35 ℃、pH7.60、含油率1.70%,在最佳条件下培养30d后,混合菌群M3对石油降解率达30.71%,比最优菌群S5的石油降解率提高了12.78%。
石油 污染土壤 石油降解菌群 土壤修复
Abstract: In order to construct high efficient petroleum-degrading flora,eight oil-contaminated soil samples (signed S1-S8) and two oil-contaminated water samples (signed W3 and W4) were collected from an oil field in Qian Jiang. Taking petroleum as the sole carbon source,the enrichment and domestication were carried out to obtain the flora,and finally the flora with good petroleum-degrading performance were screen by scoring criteria of appearance,petroleum removal rate and gas chromatographic. The predominant petroleum-degrading flora were applied to constructed mixed flora. The oil degradation characteristics of mixed flora were studied by orthogonal experiment. The results showed that five bacteria of S3,S4,S5,S6,S8 displayed the perfect petroleum removal efficiency,the petroleum degrading rate was 21.67%,22.34%,27.23%,20.46% and 19.99% respectively after 30 d of culture. The mixed bacteria M3 (S3+S4+S5+S8+W3+W4) was the superior mix flora for petroleum degrading,the oil removal rate reached 30.71% in 30 days at optimal growth conditions of 35 ℃,pH 7.60,oil content 1.70%. It was 12.78% higher than that of superior flora S5.
Keywords: petroleum; contaminated soil; petroleum-degrading flora; soil remediation
随着社会经济的发展,人们对石油资源的需求量越来越大,然而石油在勘探、开采、运输以及储存过程中存在不同程度的泄露,对环境造成了严重的污染。石油进入土壤和水体中会破坏生态环境,危害人类健康[1]。随着石油污染情况日益严重,对其进行治理已经刻不容缓[2]。
微生物修复技术是石油污染土壤治理的重要途径之一[3-4],大量研究表明微生物对降解土壤中的石油起着重要作用[5-8]。微生物修复技术具有成本低、操作简单、处理效果好、不破坏生态环境等优点,是最有前景的修复技术之一。石油组成十分复杂,一种微生物不可能实现石油污染物的完全降解,混合菌群降解石油效果较好。陈立等[9]从陕北某油田的石油污染土壤中筛选石油降解单菌,并将其组成菌群进行石油污染土壤的修复,经过11~32 d的修复,土壤中石油污染物降解率可达69.52%~88.11%;而未添加降解菌的土壤中,石油污染物降解率基本在10%以内。韩慧龙等[10]将1株细菌和1株真菌互作,证实了真菌和细菌协同修复石油污染耕地的可行性及其良好的应用前景。
本研究从潜江某油田石油污染土壤和水样中筛选出石油降解优势菌群,构建混合菌群并研究其对石油的降解特性,以期实现微生物混合菌群对石油中不同烃类的高效降解,从而为微生物修复石油污染研究提供一定理论基础。
1 材料与方法
1.1 实验材料
1.1.1 石油污染样品
石油污染样品采自潜江某油田作业油井及废弃老井附近,共采集8个污染土样,分别记为S1~S8,土样采集深度为地表20~25 cm,另采集2个污染水样,分别记为W3、W4,所有样品无菌密闭保存,样品基本信息见表1。

表1 样品基本信息
1.1.2 培养基
富集驯化培养基[11]:NaNO31.5 g、(NH4)2SO41.5 g、K2HPO41.0 g、MgSO4·7H2O 0.5 g、KCl 0.5 g、NaCl 5.0 g、FeSO4·7H2O 0.01 g、CaCl20.02 g、蒸馏水1 000 mL、pH 7.0、石油质量分数2%。
1.1.3 主要仪器
索式提取器、旋转蒸发仪、层析柱、氮吹仪、紫外分光光度计、摇床、恒温培养箱等。
1.2 分析方法
土壤pH测定参照《森林土壤pH值的测定》(LY/T 1239—1999);土壤含油量采用重量法测定[12],将S1~S8土样过2 mm筛后,称取5.0 g置于索氏提取器的样品槽中,在蒸馏瓶中加入100 mL二氯甲烷/丙酮(体积比80∶20)混合溶液,于54 ℃恒温水浴锅下萃取8 h,54 ℃旋转蒸发器中浓缩,将浓缩液用玻璃棒倾斜倒入下层装有无水硫酸钠的特制漏斗中,最终流入已称重的25 mL干燥烧杯中,在通风厨中挥发至近干,放于真空干燥箱中40 ℃、0.04 MPa干燥30 min,取出置于干燥器中冷却至室温称重,根据土壤含油量计算含油率。
水样含油量测定:在培养瓶中加入100 mL水样,滴入1 mL盐酸破乳,将破乳后水样无损转移至分液漏斗中,分4次一共加入80 mL二氯甲烷萃取出石油,用无水硫酸钠除水后,室温晾干至有机溶剂挥发完全,分液下来的石油放置真空干燥箱40 ℃、0.04 MPa下干燥30 min后,取出置于干燥器中冷却至室温称重,根据水样含油量计算含油率。
1.3 石油降解菌群的富集、驯化
分别将石油污染土样5.0 g或污染水样5.0 mL转接到石油质量浓度为20 g/L的富集驯化培养基中,于28 ℃、150 r/min恒温摇床振荡培养7 d,将获得的菌液按照5%(质量分数)的接种量重新转接到新鲜的含20 g/L石油的富集驯化培养基中,以7 d为1个周期,连续培养3个周期,取第3个周期菌悬液中的菌群作为实验用菌群,将富集驯化的得到菌群与石油污染土样或水样对应编号。
1.4 石油降解菌群的筛选
1.4.1 外观评分
取100 mL富集驯化培养基加入到250 mL的三角瓶中,将1.3节富集驯化3个周期的菌悬液以1%(质量分数,下同)的接种量接入到三角瓶中,于28 ℃、150 r/min恒温摇床振荡培养30 d,同时设置不加菌群的富集驯化培养基作为空白对照组(CK组),培养结束后根据培养基中石油降解后颗粒大小、培养基浑浊程度和乳化情况进行外观评分,总分10分,评分细则见表2。
参考水样含油量测定方法,分别测量各菌群培养30 d后富集驯化培养基中石油的质量浓度,根据式(1)计算各菌群的石油降解率。
D=(c0-cs)/c0×100%
(1)
式中:D为石油降解率,%;c0为CK组富集驯化培养基中石油的质量浓度,mg/L;cs为接菌组富集驯化培养基中石油的质量浓度,mg/L。
1.4.2 石油3组分降解率的测定
石油的组成十分复杂,通常含有饱和烃、芳香烃、非烃、沥青质等4种组分,其中沥青质中含有胶质,密度高,黏度大,微生物降解效果不明显,因此本研究主要分析各菌群对石油中饱和烃、芳香烃及非烃的降解效果。本研究采用的石油样品中饱和烃∶芳烃∶非烃的质量比为4.78∶1.00∶1.50。利用柱层析的方法分离出各富集驯化培养基中的饱和烃、芳香烃、非烃,参考《岩石中可溶有机物及石油族组分分析》(SY/T 5119—2008)测定各组分的质量浓度,参考式(1)分别计算菌群培养30 d后3种组分的降解率。

表2 外观评分细则
1.4.3 饱和烃组成的气相色谱分析
向廷生等[13]在用本源微生物降解辽河石油污染土壤时发现,经微生物培养30 d后,石油饱和烃中的正构烷烃降解明显,培养60 d后正构烷烃几乎被完全降解,而芳烃和非烃降效果不明显,考虑到本研究所用的石油样品主要成分为饱和烃,故气相色谱只用于分析饱和烃中正构烷烃含量变化。分析方法如下:提取上述柱层析分离得到的饱和烃,经干燥后准确称取约10 mg,加入0.25 mL二氯甲烷溶解,然后在各样品中分别加入0.960 6 μg/μL氘代正二十四烷(C24D50)标样(美国Sigma公司)100 μL,使用气相色谱仪测定饱和烃中各组分含量。
色谱分析条件为:7890A型气相色谱仪(美国Agilent),色谱柱:HP-5型苯基-甲基聚硅氧烷柱(30 m×0.25 mm×0.25 μm),载气(N2)流速:1 mL/min,空气流速:400 mL/min,H2流速:30 mL/min,尾吹气流速:45 mL/min,不分流进样,进样量1 μL。升温程序:50 ℃保持1 min,以15 ℃/min的速率升至100 ℃,然后以4 ℃/min的速率升至310 ℃,保持20 min,进样口温度315 ℃,检测器温度320 ℃。
1.4.4 生物量的测定
在波长600 nm下测富集驯化培养基的吸光度(OD600),OD600可用于表征培养基中菌群生物量,一般菌群生物量与石油降解率成正比,因此可以通过测生物量筛选优势石油降解菌群[14]。
1.5 混合菌群的构建与筛选
从石油污染土样及水样中培养出的石油降解菌群中筛选优秀菌群,按各菌群的石油降解特性构建3个混合菌群,将3个混合菌群以1%的接种量接入富集驯化培养基中,于28 ℃、150 r/min恒温摇床振荡培养10 d,考察3个混合菌群对石油3组分降解率及OD600,筛选出优势混合菌群。
1.6 优势混合菌群的降解特性研究
温度、pH、含油率是影响石油降解菌群生长的重要因素,各因素水平过高或过低都不利于微生物对石油的降解[15]。前期单因素实验表明,各菌群降解石油的最适pH为8.00,这与污染土样的pH相近。含油率为0.50%、2.00%时微生物生长都较好,考虑到污染土样含油率平均值为2.21%,选取含油率水平在2.00%上下,结合微生物最适温度,本研究设置优势混合菌群石油降解正交实验(见表3),在不同条件下恒温摇床振荡(150 r/min)培养10 d,测定OD600获取最佳反应条件,在最佳条件下设置5组平行,培养30 d后测石油降解率,结果取平均值。
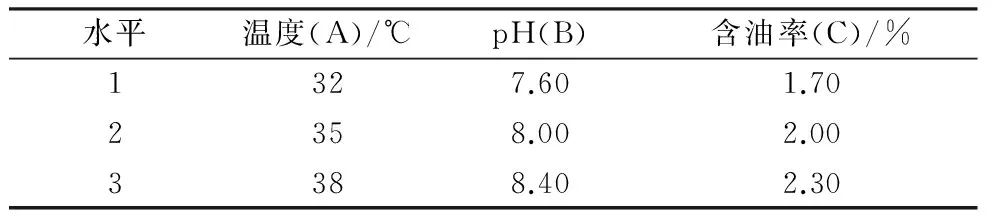
表3 正交实验因素水平
2 结果与分析
2.1 石油污染土样pH和含油率分析
石油污染土样的pH和含油率测定结果见表4。由表4可见,石油污染土壤的pH为7.92~8.82,平均值为8.23。8个土样中含油率最低为0.63%,最高为6.64%,平均值为2.22%。
2.2 石油降解菌群的富集、驯化与筛选结果
2.2.1 外观评分与石油降解率分析
将菌群培养30 d后的富集驯化培养基进行外观评分和石油降解率分析,结果如表5所示。由表5可见,各菌群外观评分排序为S3>S8>S5>S4>W3>W4>S6=S2>S7>S1;石油降解率排序为S5>S4>S3>S6>S8>W4>S1>S7>W3>S2;菌群S3、S4、S5、S8、W3和W4能使培养液变混浊,肉眼观察具有较好的降油效果;菌群S3、S4、S5、S6、S8对石油具有较高的降解效果,石油降解率分别为21.67%、22.34%、27.23%、20.46%、19.99%。其中菌群S2并不降解石油,但肉眼观察对石油具有一定的乳化效果。

表4 污染土样pH和含油量
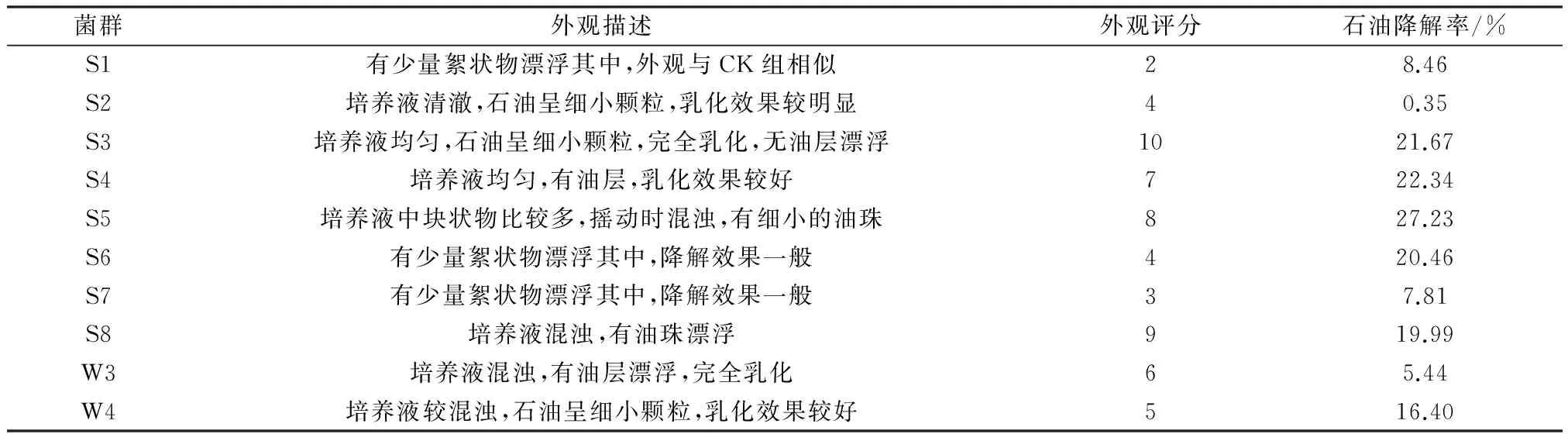
表5 菌群外观评分及石油降解率

图1 各菌群对石油3组分的降解率Fig.1 The removal rate of three componets of oil by microbial flora
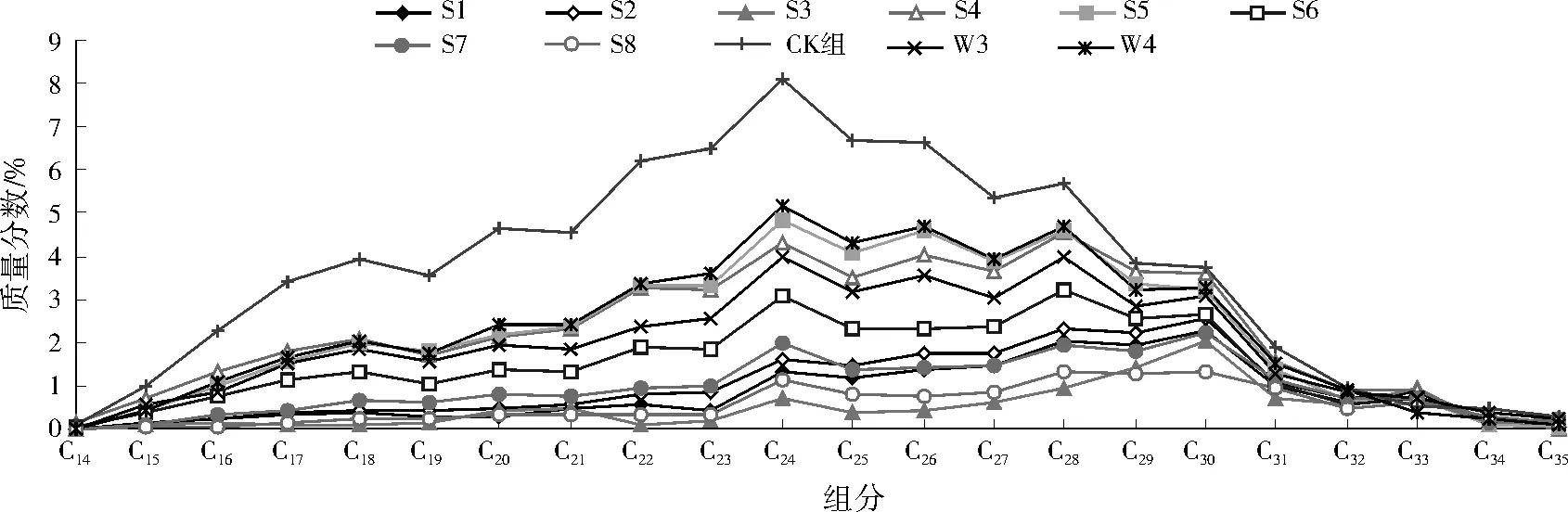
图2 色谱检测结果Fig.2 The result of gas chromatographic
2.2.2 石油3组分降解率分析
各菌群培养30 d后,富集驯化培养基中的饱和烃、芳香烃、非烃的降解率如图1所示。
由图1可见,菌群S4、S5对饱和烃具有较好的降解效率,饱和烃降解率分别为15.77%、18.80%;菌群S3、S4、S5对芳香烃具有较好的降解效率,芳香烃降解率分别为37.07%、40.54%、46.62%;S4、S5对非烃降解效果最好,非烃降解率分别为29.46%、30.85%。
2.2.3 正构烷烃降解率分析
各菌群培养30 d后,富集驯化培养基中正构烷烃的气相色谱分析结果见图2。
从CK组色谱分析结果可知,本研究采用的石油样品正构烷烃的主要组分为C22~C28,质量分数均在5%以上。10个菌群对C16~C28具有好的降解效果,各组分质量分数与CK组相差明显,菌群对C14、C15以及C29~C35降解效果不明显。其中菌群S3、S8培养30 d后,各组分质量分数相对最低,说明S3、S8对正构烷烃降解效果最好,可以初步确定具有高效降解石油的潜质。
2.3 混合菌群的构建与筛选
根据2.2节中石油降解菌群的富集驯化与筛选结果,初步筛选出6个石油降解菌群S3、S4、S5、S8、W3、W4构建混合菌群,其中菌群S3、S4、S5、S8的石油降解率较高,菌群W3、W4对石油乳化效果较好,3个石油降解混合菌群M1(S3+S5+S8)、M2(S4+W3+W4)和M3(S3+S4+S5+S8+W3+W4)在富集驯化培养基中培养10 d后的外观评分和OD600测定结果如表6所示。由表6可见,混合菌群M3的外观评分最高、OD600最大,为石油降解优势混合菌群。

表6 混合菌群外观评分及OD600测定
2.4 优势混合菌群降解特性
混合菌群M3的石油降解正交试验结果见表7。由表7可见,各影响因素中温度的极差R最大,是影响混合菌群M3降解石油的关键因子,其次是pH,而含油率的影响最小。此外,混合菌群M3降解石油的最适培养条件为A2B1C1,即温度35 ℃、pH 7.6、含油率1.7%,经过进一步验证,混合菌群M3在最适条件下对石油的降解率为30.71%,比最优菌群S5的石油降解率提高了12.78%。

表7 正交试验结果
3 讨 论
由于本研究采集的石油污染土壤含油量平均值为2.22%,因此在后续的富集驯化及培养实验中,均将培养基中的含油量设定为2.00%进行石油降解菌群的富集、驯化以及降解特性研究。单一的石油降解菌群筛选方法均存在一定缺陷,如外观评分法简单快捷,但受人为主管因素干扰太大;重量法测定石油降解率、石油3组分降解率和饱和烃组成成分能准确反映菌群对石油的降解效果,但实验过程繁琐、周期长、成本较高;生物量可以间接反应石油降解效率,且测定方法简单快捷,为此本研究首先采用多种方法筛选获得石油降解优势菌群,综合分析菌群的石油降解能力,筛选优势石油降解菌群,构建石油降解混合菌群,采用外观评分法以及生物量测定方法筛选优势混合菌群,用生物量测定方法研究其降解特性,在确定石油降解优势混合菌群最佳降解条件后,采用重量法测定其石油降解率,在确保筛选结果的同时简化筛选流程。
4 结 论
潜江某油田8个土样含油量平均值为2.22%,pH平均值为8.23;富集的10个菌群中S3、S4、S5、S6、S8为优势石油降解菌群,培养30 d后的石油降解率分别为21.67%、22.34%、27.23%、20.46%、19.99%;菌群W3、W4对石油乳化效果较好;利用菌群S3、S4、S5、S8、W3、W4构建3个石油降解混合菌群M1(S3+S5+S8)、M2(S4+W3+W4)和M3(S3+S4+S5+S8+W3+W4),其中混合菌群M3对石油降解效果最好,其对石油降解的最佳条件为温度35 ℃、pH 7.60、含油率1.70%,在此条件下培养30 d的石油降解率30.71%,比最优菌群S5的石油降解率(27.23%)提高了12.78%。
[1] 王立坤.船舶溢油事故报告关键影响因子与行为偏好分析[J].安全与环境学报,2013,13(6):212-217.
[2] 吴健,谭娟,王敏,等.某石油污染滩涂沉积物中总石油烃和多环芳烃组成分布特征及源解析[J].安全与环境学报,2016,16(1):282-287.
[3] TEBKOWSKA M,ZBOROWSKA E,KARWOWSKA E,et al.Bioremediation of soil polluted with fuels by sequential multiple injection of native microorganisms: field-scale processes in Poland[J].Ecological Engineering,2011,37(11):1895-1900.
[4] 杨茜,吴蔓莉,曹碧霄,等.石油降解菌的筛选、降解特性及其与基因的相关性研究[J].安全与环境学报,2014,14(1):187-192.
[5] YANG Yuyin,WANG Jie,LIAO Jingqiu,et al.Abundance and diversity of soil petroleum hydrocarbon-degrading microbial communities in oil exploring areas[J].Applied Microbiology & Biotechnology,2015,99(4):1935-1946.
[6] LI Fengmei,GUO Shuhai,HARTOG N,et al.Isolation and characterization of heavy polycyclic aromatic hydrocarbon-degrading bacteria adapted to electrokinetic conditions[J].Biodegradation,2016,27(1):1-13.
[7] GUTIERREZ T.Identifying polycyclic aromatic hydrocarbon-degrading bacteria in oil-contaminated surface waters atDeepwaterHorizonby cultivation,stable isotope probing and pyrosequencing[J].Reviews in Environmental Science and Biotechnology,2011,10(4):301-305.
[8] HERNANDO P B,KOICHI S,CHIHIRO I.Preferential utilization of petroleum oil hydrocarbon components by microbial consortia reflects degradation pattern in aliphatic-aromatic hydrocarbon binary mixtures[J].World Journal of Microbiology and Biotechnology,2011,27(5):1109-1117.
[9] 陈立,万力,张发旺,等.土著微生物原位修复石油污染土壤试验研究[J].生态环境学报,2010,19(7):1686-1690.
[10] 韩慧龙,陈镇,杨健民,等.真菌-细菌协同修复石油污染土壤的场地试验[J].环境科学,2008,29(2):454-461.
[11] 李宝明,阮志勇,姜瑞波.石油降解菌的筛选、鉴定及菌群构建[J].中国土壤与肥料,2007(3):68-72.
[12] 王如刚,王敏,刘晓伟,等.超声—索氏萃取—重量法测定土壤中总石油烃含量[J].分析化学,2010,38(3):417-420.
[13] 向廷生,王慧敏,陶文,等.本源微生物降解辽河石油的非烃分子结构变化[J].地球化学,2013,42(6):567-575.
[14] ADAMA S,OTOIDOBIGA C,HARMONIE C,et al.Isolation and characterization of hydrocarbon-degrading bacteria from wastewaters in Ouagadougou,Burkina Faso[J].Journal of Environmental Protection,2014,5(12):1183-1196.
[15] 詹亚斌,马立安.生物修复石油污染土壤研究进展[J].长江大学学报(自科版),2016,13(33):52-56.
Isolationandconstructionofpetroleum-degradingfloraandtheirdegradingcharacteristics
ZHANYabin1,ZHANGQiao1,CHENKailun2,LIFangmin2,MALi’an1.
(1.SchoolofLifeScience,YangtzeUniversity,JingzhouHubei434025;2.SchoolofChemicalandEnvironmentalEngineering,YangtzeUniversity,JingzhouHubei434025)
2016-12-26)
詹亚斌,男,1991年生,硕士研究生,主要从事环境微生物研究。#
。
*国家自然科学基金资助项目(No.41271482)。
10.15985/j.cnki.1001-3865.2017.08.010

