三叶青藤茎叶药材饮片质量控制研究
谢 平, 陈 丹, 黄 娇, 朱仙慕, 马国萍, 傅爱珍
三叶青藤茎叶药材饮片质量控制研究
谢 平, 陈 丹, 黄 娇, 朱仙慕, 马国萍, 傅爱珍
目的建立三叶青藤茎叶药材饮片质量控制方法。方法采用薄层色谱法鉴别药材饮片;建立其砷盐、重金属杂质限量检查法以及水分、总灰分、酸不溶性灰分检测法;测定其浸出物含量;以异荭草苷为指标性成分,采用NaNO2-Al(NO3)3-NaOH比色法,在500 nm检测波长、优化显色反应条件,控制三叶青藤茎叶药材饮片中总黄酮含量。结果3 批三叶青藤茎叶药材饮片薄层色谱在对照物出现斑点的相应位置显相同颜色荧光斑点,且各成分分离良好;4 批三叶青藤茎叶药材饮片水分测定结果为4.05%~6.77%,总灰分6.06%~7.25%,酸不溶性灰分0.64%~1.65%,水溶性浸出物16.00%~27.09%,醇溶性浸出物15.42%~27.07%,砷盐杂质限量<1 ppm,重金属杂质限量<10 ppm;建立的比色法在7.73~61.82 μg/mL范围内线性关系良好,回归方程A=1.50×10-2C-1.78×10-2(r=0.999 6),4 批三叶青藤茎叶药材饮片总黄酮含量20.83~21.50 mg/g。结论所建立的薄层色谱鉴别、水分、总灰分、酸不溶性灰分、浸出物及总黄酮含量测定法可作为三叶青藤茎叶药材饮片内控质量标准的参考依据。
三叶青; 质量控制; 诊断, 鉴别; 比色法
三叶青(Tetrastigmahemsleyanum)为葡萄科崖爬藤属植物,是我国特有的珍稀药用植物、民间常用药。药理实验研究表明,三叶青具有抗肿瘤、抗炎、解热镇痛、抗病毒、保肝以及免疫调节等多种药理作用[1-3],全草用药的有华佗风痛宝片、结石康胶囊等,其中活性成分包括黄酮类化合物及有机酸类成分等。福建省、浙江省中药饮片炮制规范已收载三叶青块根[4-5]、湖南省中药饮片炮制规范则收载有三叶青全草[6]。目前,除三叶青块根用于抗肿瘤治疗外,三叶青藤茎叶(地上部分)水煎液也常作为抗肿瘤辅助治疗方法。课题组研究证实,三叶青藤茎叶粗提物及总黄酮提取物均具有良好的抗炎作用[7]。因此,有必要研究建立三叶青藤茎叶药材饮片质量控制方法。比色法是中国药典较常见的总黄酮含量测定法[8],方法简便、快速、准确。课题组前期研究表明,三叶青藤茎叶含有异荭草苷、荭草苷等活性成分。本研究采用其主要活性成分异荭草苷为指标成分,以NaNO2-Al(NO3)3-NaOH比色法对三叶青藤茎叶药材饮片中总黄酮进行定量分析,并建立其定性定量质量控制方法,为三叶青藤茎叶药用价值的深入研究和制剂的研发及应用奠定基础。
1 材料与方法
1.1材料
1.1.1仪器 双光束紫外可见分光光度计(UV-4802型,尤尼柯上海仪器有限公司);电动喷雾器(Yoko-PN,武汉药科新技术开发有限公司);多功能紫外分析仪(ZF1-I,上海嘉鹏科技有限公司)。
1.1.2试药 三叶青藤茎叶(福州集珍园生物科技有限公司提供,福建中医药大学药学院中药鉴定教研室范世明高级实验师鉴定);异荭草苷对照品(批号:JZ16091910)及异牡荆苷对照品(批号:JZ15082101)(南京景竹生物科技有限公司);荭草苷对照品(批号:111776-201302)、牡荆苷对照品(批号:111686-201603)、牡荆素鼠李糖对照品(批号:111667-200602)均为中国食品药品检定研究院;异荭草苷-2-O’-鼠李糖苷(自制,纯度98%);聚酰胺薄膜(浙江台州路桥四甲生化塑料厂);36%乙酸、甲醇等试剂均为分析纯,水为超纯水。
1.2方法
1.2.1三叶青藤茎叶药材饮片的薄层色谱鉴别
1.2.1.1供试品溶液的制备 称取三叶青藤茎叶药材饮片粗粉约1 g,加甲醇25 mL超声处理30 min即得。
1.2.1.2绿原酸、异荭草苷及异荭草苷-2’-O-鼠李糖苷对照品溶液的制备 精密称取绿原酸对照品适量,加甲醇制成每1 mL含1 mg绿原酸的溶液,即得;精密称取异荭草苷对照品适量,加甲醇制成每1 mL含0.5 mg异荭草苷的溶液,即得;精密称取异荭草苷-2’-O-鼠李糖苷对照品适量,加甲醇制成每1 mL含1 mg异荭草苷-2’-O-鼠李糖苷的溶液,即得。
1.2.1.3阴性对照溶液的制备 不含三叶青藤茎叶药材饮片粗粉,按“1.2.1.1”方法操作,即得。
1.2.1.4薄层色谱分析 分别吸取绿原酸对照品溶液、异荭草苷-2’-O-鼠李糖苷对照品溶液、异荭草苷对照品溶液、供试品溶液及阴性对照溶液各2 μL,点于同一块聚酰胺薄膜上,以36%乙酸为展开剂,展开,取出,晾干,喷以3%三氯化铝乙醇溶液,于105 ℃加热5 min,置于365 nm紫外灯下检视。
1.2.2水分测定 分别取三叶青藤茎叶药材饮片粗粉约2 g,精密称定,按《中国药典》(2015年版)四部通则(0832)水分测定法项下第二法(烘干法)测定,计算供试品中含水量(%)。
1.2.3灰分测定
1.2.3.1总灰分测定 分别取三叶青藤茎叶药材饮片粗粉约3 g,精密称定,按《中国药典》(2015年版)四部通则(2302)灰分测定法项下测定总灰分,计算供试品中总灰分含量。
1.2.3.2酸不溶性灰分测定 分别取总灰分项下所得灰分,按《中国药典》(2015年版)四部通则(2302)灰分测定法项下测定酸不溶性灰分,计算供试品中酸不溶性灰分的含量(%)。
1.2.4浸出物测定
1.2.4.1水溶性浸出物(冷浸法) 分别取三叶青藤茎叶药材饮片粗粉约4 g,精密称定,按《中国药典》(2015年版)四部通则(2201)浸出物测定法项下水溶性浸出物冷浸法测定,计算供试品中水溶性浸出物的含量(%)。
1.2.4.2水溶性浸出物(热浸法) 分别取三叶青藤茎叶药材粗粉约2 g,精密称定,按《中国药典》(2015年版)四部通则(2201)浸出物测定法项下水溶性浸出物热浸法测定,计算供试品中水溶性浸出物的含量(%)。
1.2.4.3醇溶性浸出物测定 分别取三叶青藤茎叶药材饮片粗粉约2 g,精密称定,分别置100~250 mL的锥形瓶中,分别精密加入(30%,40%,50%,60%,70%,80%)乙醇50 mL,按《中国药典》(2015年版)四部通则(2201)浸出物测定法项下醇溶性浸出测定,计算供试品中醇溶性浸出物的含量(%)。
1.2.5砷盐检查 分别取三叶青藤茎叶药材粗粉1.2,3,6 g(相当于限量5,2,1 ppm),按《中国药典》(2015年版)四部通则(0822)砷盐检查法项下第一法(古蔡氏法)检查,将生成的砷斑与标准砷斑比较。
1.2.6重金属检查 取三叶青藤茎叶药材粗粉1,2,4 g(相当于限量20,10,5 ppm),按《中国药典》(2015年版)四部通则(0821)重金属检查法项下进行检查。
1.2.7三叶青藤茎叶药材饮片总黄酮含量测定
1.2.7.1对照品溶液的制备 分别精密称取荭草苷、异荭草苷、异荭草苷-2’-O-鼠李糖苷、牡荆苷、异牡荆苷及牡荆素-鼠李糖苷对照品适量,分别加甲醇制得每1 mL中含荭草苷0.105 0 mg对照品溶液,每1 mL中含异荭草苷0.170 0 mg对照品溶液,每1 mL中含异荭草苷-2’-O-鼠李糖苷0.210 4 mg对照品溶液,每1 mL中含牡荆苷0.108 2 mg对照品溶液,每1 mL中含异牡荆苷0.109 4 mg对照品溶液,每1 mL中含牡荆素-鼠李糖苷0.105 0 mg对照品溶液。
1.2.7.2供试品溶液的制备 精密称取三叶青藤茎叶药材饮片粗粉约0.5 g,置索氏提取器中,加石油醚(60~90 ℃)100 mL,加热回流至近无色,弃去石油醚,药渣挥干石油醚,再加入25 mL 60%乙醇回流提取2 h,浓缩至浸膏,用30%甲醇复溶,定量转移至25 mL量瓶中,用30%甲醇稀释至刻度,摇匀,即得。
1.2.7.3显色方法的筛选
1.2.7.3.1直接测定法 分别精密吸取各对照品溶液和供试品溶液各1 mL,置25 mL量瓶中,加水稀释至刻度,摇匀,放置15 min,以相应溶剂为空白,于200~800 nm进行连续波长扫描及比较。
1.2.7.3.2AlCl3显色法 分别精密吸取各对照品溶液和供试品溶液各1 mL,置10 mL量瓶中,加10%AlCl3溶液1 mL,加水稀释至刻度,摇匀,放置15 min,以缺供试品的显色体系为空白,于200~800 nm波长范围扫描及比较。
1.2.7.3.3NaNO2-Al(NO3)3-NaOH显色法 分别精密吸取各对照品溶液和供试品溶液各1 mL,置25 mL量瓶中,加5%NaNO2溶液1 mL,摇匀,放置6 min,加10%Al(NO3)3溶液1 mL,摇匀,放置6 min,加4%NaOH溶液10 mL,加水稀释至刻度,摇匀,放置15 min,以缺供试品的显色体系为空白,于200~800 nm波长范围扫描。
1.2.7.4NaNO2,Al(NO3)3及NaOH溶液浓度考察 分别精密吸取异荭草苷对照品溶液、供试品溶液各1 mL,分别置25 mL量瓶中,配制10份。分别平行加入1 mL 2%,5%,10% NaNO2溶液;分别平行加入1 mL 2.5%,5%,10%,15% Al(NO3)3溶液;分别平行加入1 mL 4%,6%及8% NaOH溶液。其余操作参照“1.2.7.3”,测定吸光度。分别考察NaNO2,Al(NO3)3及NaOH溶液浓度。
1.2.7.5加NaNO2,Al(NO3)3及NaOH溶液后静置时间考察 分别精密吸取异荭草苷对照品溶液、供试品溶液各1 mL,置25 mL量瓶中,配制12份。加入1 mL 5% NaNO2溶液,摇匀,分别静置2,4,6及8 min;平行加入1 mL 5% Al(NO3)3溶液,摇匀,静置2,4,6及8 min;分别平行加入1 mL 6% NaOH溶液,摇匀,分别静置5,10,15及20 min。其余操作参照“1.2.7.3”,测定吸光度。分别考察加入NaNO2或Al(NO3)3或NaOH溶液后的最佳静置时间。
1.2.7.6NaNO2,Al(NO3)3及NaOH溶液加入量考察 分别精密吸取异荭草苷对照品溶液、供试品溶液各1 mL,分别置25 mL量瓶中,配制9份。分别平行加入0.5,1及2 mL 5% NaNO2溶液;分别平行加入0.5,1及2 mL 5% Al(NO3)3溶液;分别平行加入5,10及15 mL 6% NaOH溶液。其余操作参照“1.2.7.3”法,测定吸光度。分别考察NaNO2,Al(NO3)3及NaOH溶液的最适宜加入量。
1.2.7.7标准曲线制备与线性关系考察 分别精密吸取异荭草苷对照品溶液1,2,3,4,5及8 mL,置25 mL量瓶中,精密加入5%亚硝酸钠溶液1 mL,摇匀,放置6 min,再精密加入5%硝酸铝溶液1 mL,摇匀,放置6 min,精密加入4%氢氧化钠试液10 mL,加水稀释至刻度,摇匀放置10 min,滤过,以空白的显色体系为参比,在500 nm波长处测定吸光度,以浓度C(μg·mL-1)为横坐标,吸光度(A)为纵坐标,绘制标准曲线。
1.2.7.8精密度试验 取3 mL异荭草苷对照品溶液(0.193 0 mg/mL),置25 mL量瓶中,按“1.2.7.7”项下同法操作显色,滤过,在500 nm波长处测定吸光度,重复测定6次。
1.2.7.9重复性试验 取同一批样品,分别精密称取约0.5 g,6份,参照“1.2.7.2”和“1.2.7.7”方法制备供试品溶液、同法操作显色,在500 nm波长处测定吸光度,计算总黄酮含量。
1.2.7.10稳定性试验 取供试品溶液置25 mL量瓶中,参照“1.2.7.7”方法操作显色,分别在0,5,10,15,20,25及30 min测定,在500 nm波长处测定吸光度。
1.2.7.11加样回收率试验 分别精密称取同一批的三叶青藤茎叶药材饮片粗粉约0.25 g,共6份,分别精密加入异荭草苷对照品适量,参照“1.2.7.2”和“1.2.7.7”方法制备供试品溶液、同法操作显色,测定,计算。
1.2.7.12样品含量测定 分别取4批三叶青藤茎叶药材饮片,精密称取药材饮片粗粉0.5 g,参照“1.2.7.2”方法制备供试品溶液,参照“1.2.7.7”方法操作显色,以空白显色体系为参比,在500 nm波长处测定吸光度,计算不同批次三叶青藤茎叶药材饮片的总黄酮含量。
2 结 果
2.1三叶青藤茎叶药材饮片的薄层色谱鉴别 3批三叶青藤茎叶药材饮片在对照品、对照药材出现斑点的相应位置上,显相同颜色的荧光斑点(图1)。
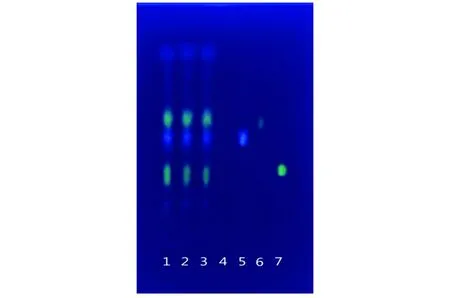
1~3:3批三叶青藤茎叶药材饮片; 4:阴性对照; 5:绿原酸;6:异荭草苷-2’-O-鼠李糖苷;7:异荭草苷.图1 三叶青藤茎叶药材饮片薄层色谱图Fig 1 Aerial parts of Tetrastigma Hemsleyanum herbal pieces chromatogram
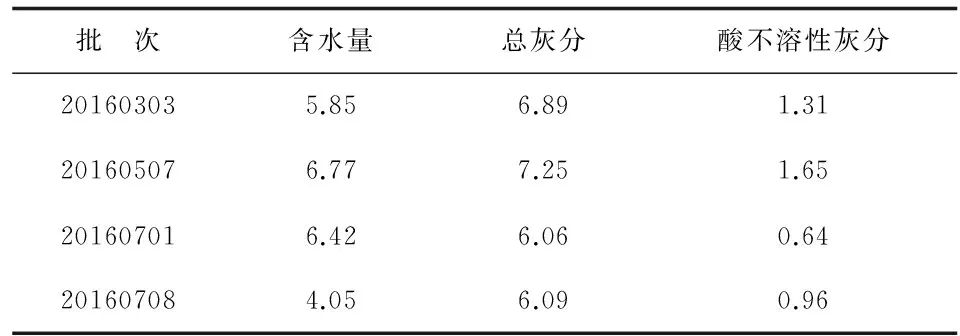
2.2水分测定 4批三叶青藤茎叶药材饮片水分含量为4.05%~6.77%,平均含水量为5.77%(表1)。
2.3灰分测定 总灰分测定结果表明,4批三叶青藤茎叶药材饮片总灰分6.06%~7.25%,平均值为6.57%。酸不溶性灰分测定结果表明,4批三叶青藤茎叶药材饮片酸不溶性灰分0.64%~1.65%,平均值为1.14%(表1)。
表1水分、总灰分及酸不溶性灰分测定结果
Tab1The determination results of moisture, total ash, acid-insoluble ash
%
2.4浸出物测定 4批三叶青藤茎叶药材饮片冷浸法水溶性浸出物16.00%~17.58%,热浸法水溶性浸出物23.93%~27.09%(表2)。醇溶性浸出物测定结果表明,30%~50%乙醇作为提取溶剂时浸出物的含量较高,但随着乙醇浓度的进一步增大,浸出物的含量减少;各醇溶性浸出物含量为15.42%~27.07%(表3)。
2.5砷盐检查 各批次砷盐杂质限量均<1 ppm(表4)。
2.6重金属检查 各批次重金属杂质限量均<10 ppm(表5)。

表2 水溶性浸出物测定结果
n=3. RSD:相对标准偏差.

表3 醇溶性浸出物测定结果
n=3. RSD:相对标准偏差.
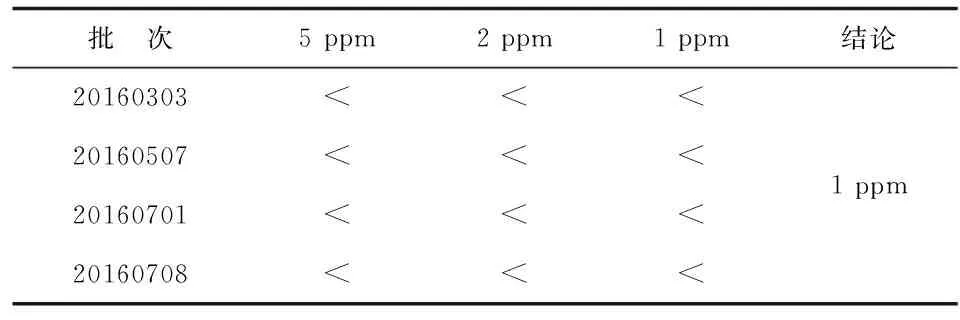
表4 砷盐检查结果
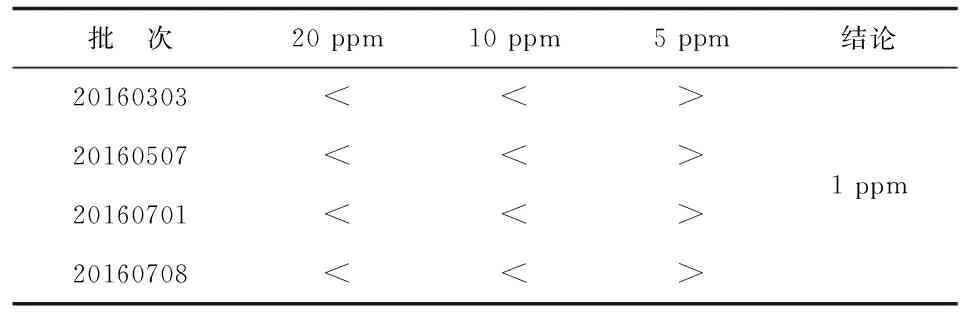
表5 重金属检查结果
2.7三叶青藤茎叶药材饮片总黄酮含量测定
2.7.1显色方法的筛选 直接测定法或AlCl3显色法显示各对照品溶液与供试品溶液最大吸收波长有一定偏差。NaNO2-Al(NO3)3-NaOH显色法显示荭草苷、异荭草苷、异荭草苷-2’-O-鼠李糖苷和牡荆苷各对照品溶液和供试品溶液紫外吸收光谱在500 nm波长处均有最大吸收峰,故选择NaNO2-Al(NO3)3-NaOH比色法,选取三叶青藤茎叶药材饮片中含量较高且对照品较易获得的活性成分异荭草苷为代表性成分,测定波长500 nm,作为测定三叶青藤茎叶总黄酮含量方法(图2)。
2.7.2NaNO2,Al(NO3)3及NaOH浓度考察 当加入5%NaNO2、5%Al(NO3)3溶液时,对照品溶液和供试品溶液吸光度最大,故选择加入5%NaNO2、5%Al(NO3)3溶液。加入不同浓度的NaOH溶液后,对照品溶液和供试品溶液吸光度呈增大趋势,至6%~8%趋于平缓,故选择加入6%NaOH溶液(表6)。
2.7.3加NaNO2、Al(NO3)3、NaOH溶液后静置时间考察 加入NaNO2溶液后,对照品溶液在4~6 min吸光度趋于稳定;供试品溶液则在6~8 min吸光度较稳定,故选择加入5%NaNO2溶液后静置6 min使之充分反应。加入Al(NO3)3溶液后,二者都在6 min后趋于稳定,说明二者与Al3+络合反应至少需要6 min才能完成,故选择加入5%Al(NO3)3溶液静置6 min后,再加入NaOH溶液,所测吸光度较准确。加入NaOH溶液后,对照品溶液和供试品溶液在10 min已达稳定,综合考虑,故选择在加入6%NaOH溶液显色10~15 min后测定其吸光度(表7)。

图2 NaNO2-Al(NO3)3-NaOH显色法法扫描光谱图Fig 2 The spectra of NaNO2-Al(NO3)3-NaOH reaction system
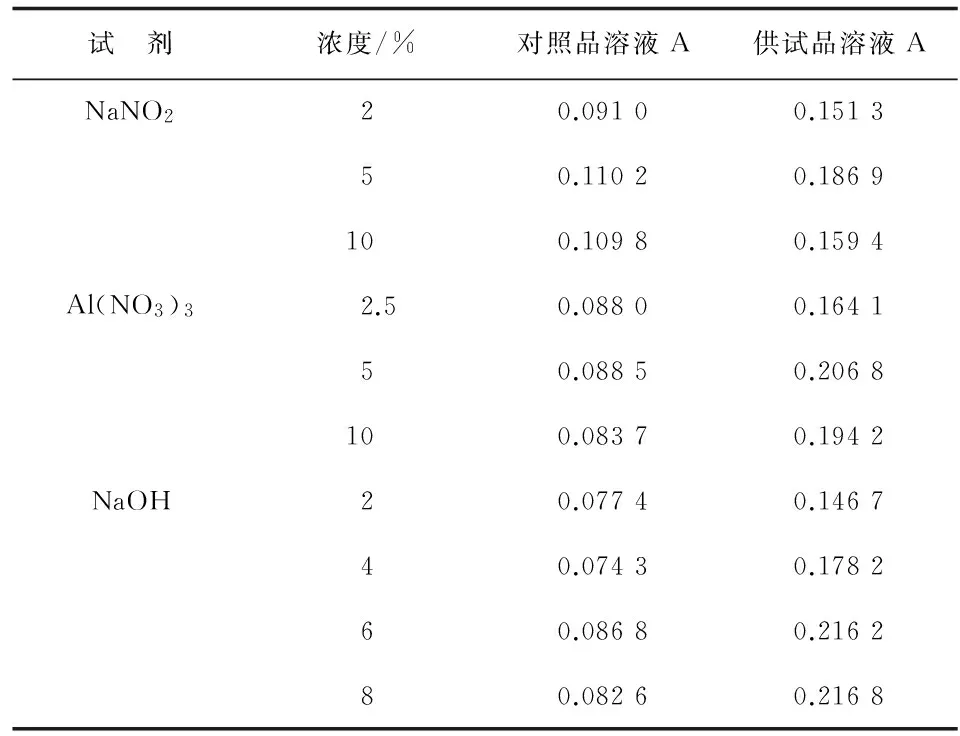
试 剂浓度/%对照品溶液A供试品溶液ANaNO220.09100.151350.11020.1869100.10980.1594Al(NO3)32.50.08800.164150.08850.2068100.08370.1942NaOH20.07740.146740.07430.178260.08680.216280.08260.2168
2.7.4NaNO2,Al(NO3)3及NaOH溶液加入量考察 随着5%NaNO2溶液用量的增加,吸光度上升,至1 mL左右吸光度趋于稳定,故选择加入1 mL 5%NaNO2溶液。随着5%Al(NO3)3溶液用量的增加,吸光度上升,加入5%Al(NO3)3溶液量超过1 mL后吸光度开始下降,故选择加入1 mL 5%Al(NO3)3溶液效果较好。NaOH的主要作用是使黄酮类化合物开环,生成2’-羟基查尔酮而显色,当加入10~15 mL 6%NaOH溶液时,反应基本完全,故选择加入10 mL 6%NaOH溶液(表8)。

表7 静置时间对吸光度的影响

表8 显色溶液体积对吸光度的影响
2.7.5标准曲线制备与线性关系考察 实验结果表明,异荭草苷的回归方程A=1.50×10-2C-1.78×10-2(r=0.999 6),异荭草苷在7.73~61.82 μg/mL浓度范围内线性关系良好(图3)。
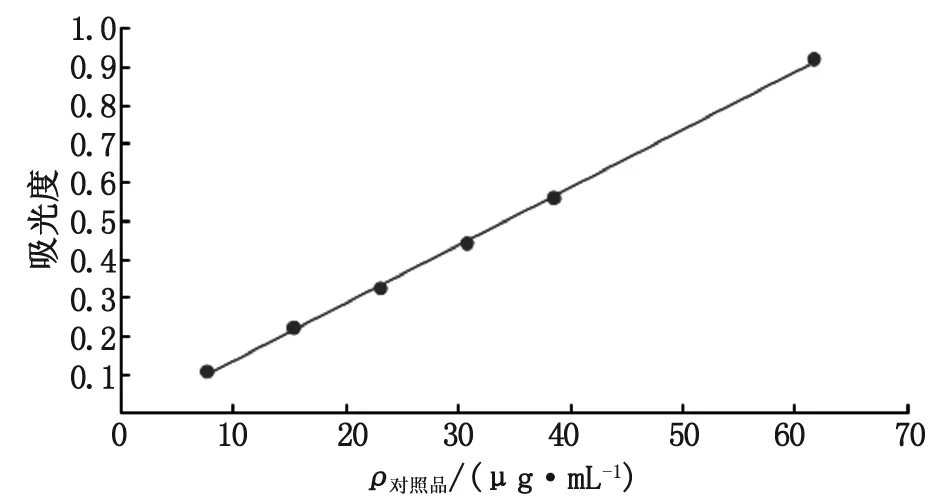
图3 标准曲线图Fig 3 The standard curve
2.7.6精密度试验 在500 nm波长处测定异荭草苷对照品溶液(0.193 0 mg/mL)吸光度的相对标准偏差RSD为0.09%(n=6),仪器精密度良好。
2.7.7重复性试验 同一批三叶青藤茎叶总黄酮平均含量为21.37 mg/g,RSD为3.25%(n=6),该方法重复性良好。
2.7.8稳定性试验 各时间点测定供试品溶液总黄酮含量的RSD为0.93%,该显色方法在30 min内基本稳定。
2.7.9加样回收率试验 该三叶青藤茎叶药材饮片总黄酮含量测定方法的平均回收率为99.75%,RSD为2.69%(n=6),方法准确度良好(表9)。
2.7.10样品含量测定 运用已建立的总黄酮含量测定法,测定不同批次三叶青藤茎叶药材饮片的总黄酮含量(表10)。

表9 加样回收率试验结果
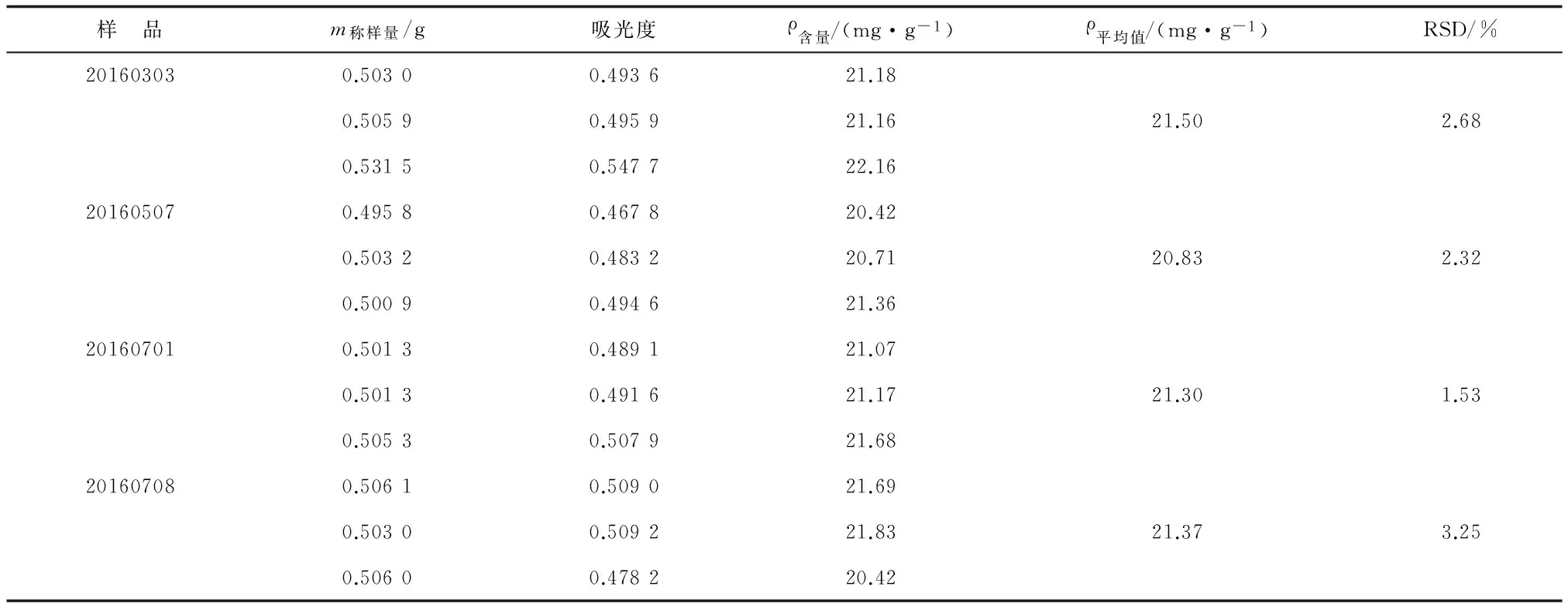
表10 样品总黄酮含量测定结果
n=3. RSD:相对标准偏差.
3 讨 论
福建省中药饮片炮制规范、浙江省中药饮片炮制规范对三叶青块根采用性状、显微鉴别及化学反应鉴别,对其水分、总灰分进行检查,要求水分不得超过14.0%,总灰分不得过4.0%;湖南省中药饮片炮制规范仅对三叶青全草进行性状、显微鉴别及酚类颜色反应鉴别,三叶青药材饮片还缺乏比较完整的质量控制方法。故实验针对三叶青藤茎叶药材饮片进行较为系统的鉴别、检查、含量测定等质量控制方法的研究。
聚酰胺薄膜具有较好的亲水和亲脂双重性能,适用于可形成氢键吸附的含黄酮类成分的中药分离。采用聚酰胺薄膜,选择三叶青藤茎叶主成分绿原酸、异荭草苷、异荭草苷-2’-O-鼠李糖苷为对照,曾分别比较不同展开剂系统如正丁醇-乙醇-水(6∶35∶59),氯仿-乙酸乙酯-甲醇-甲酸(5∶5∶4∶0.6),氯仿-丙酮-无水乙醇-水(4∶3∶3.6∶0.4),乙酸乙酯-乙醇-水-冰醋酸(6∶2∶0.5∶0.2),氯仿-丙酮-冰乙酸-无水乙醇(4∶1∶3∶2)等,当采用36%乙酸为展开剂时分离效果较好,斑点分离效果最佳。
课题组前期研究表明,黄酮是三叶青藤茎叶中的主要有效成分,具有良好的抗炎镇痛作用,还具备辅助抗肿瘤作用,临床应用多用水煎煮服用,中药总黄酮的提取一般用极性稍大的混合溶剂。因此,浸出物测定中选用水、乙醇作为浸出溶剂,并选取了不同浓度的乙醇为溶剂比较,其中50%乙醇作为提取溶剂时浸出物的含量较高。根据水溶性浸出物平均含量为21.24%,醇溶性浸出物平均含量为24.95%,以4批样品结果平均值的80%计算,暂定水溶性、醇溶性浸出物含量不得低于16.99%,19.96%。
中药材检查水分、灰分、重金属及砷盐等项目,可为药材饮片的贮藏、控制杂质含量及保证纯度提供参考。三叶青藤茎叶药材饮片平均含水量为5.77%,以4批次样品水分测定结果平均值的120%计算,暂定水分不得超过6.92%;总灰分平均值为6.57%,酸不溶性灰分平均值为1.14%,暂定总灰分不得超过7.88%,酸不溶性灰分不得超过1.37%;砷盐杂质限量<1 ppm,重金属杂质限量<10 ppm。
三叶青藤茎叶中含有大量的叶绿素等脂溶性色素,影响比色测定。因此,在总黄酮的含量测定中应将三叶青藤茎叶先行脱脂处理,然后再用60%乙醇回流提取2 h。
三叶青藤茎叶药材中主要含黄酮糖苷类成分,并以C-苷为主,主要的碳苷黄酮有荭草苷、异荭草苷、异荭草苷-2-O’-鼠李糖苷、牡荆苷及异牡荆苷等[9],由于各成分与供试品溶液紫外吸收光谱最大吸收波长存在差异,故不适宜采用直接法测定总黄酮含量;采用比色法,对不同显色方法进行筛选,在AlCl3显色体系下,各成分与供试品溶液的可见光区最大吸收也存在一定差异;经比较最终选择以含量较高且对照品较容易获得的异荭草苷作为代表性成分,采用NaNO2-Al(NO3)3-NaOH显色法,供试品溶液和各成分溶液在500 nm均有最大吸收。
采用NaNO2-Al(NO3)3-NaOH显色法,供试品加入NaOH溶液后,可能出现部分红色絮状漂浮物,可能是三叶青藤茎叶药材提取液中含有原花色素类杂质在碱性环境下与Al3+形成红色絮状络合物沉淀,会使测定结果偏高。经实验比较,结合过滤操作后测定三叶青藤茎叶药材饮片总黄酮含量,经方法学考察,结果的准确度、重复性等均符合要求,该方法的建立为三叶青藤茎叶药材饮片进一步开发利用提供了可快速准确控制其总黄酮含量的定量方法,并为饮片企业内控质量标准的制订奠定基础。
[1] 蔡韦炜,陈 丹,范世明,等. 中药三叶青化学成分及药理作用研究进展[J]. 天津药学,2014,26(1):38-41.
[2] 林 婧,纪明妹,黄泽豪,等. 三叶青的化学成分及其体外抗肿瘤活性研究[J]. 中国药学杂志,2015,50(8): 658-663.
[3] Feng Z,Hao W, Lin X,etal. Antitumor activity of total flavonoids fromTetrastigmahemsleyanumDiels et Gilg is associated with the inhibition of regulatory T cells in mice[J].Oncotargets&Therapy,2014,7:947-956.
[4] 福建省食品药品监督管理局. 福建省中药饮片炮制规范[M]. 2012年版. 福州:福建科学技术出版社,2013:10-11.
[5] 浙江省卫生厅. 浙江省中药炮制规范[M]. 杭州: 浙江科学技术出版社,2005:18-19.
[6] 汪文涛. 湖南省中药饮片炮制规范[M]. 长沙: 湖南科学技术出版社,2010:358-359.
[7] 廖淑彬,蔡韦炜,陈 丹,等. 闽产三叶青地上部分提取物体内抗炎镇痛作用研究[J]. 中国现代应用药学,2017,34(3):319-324.
[8] 林 婧,黄泽豪,许 文,等. 不同产地三叶青总黄酮含量及对肝癌细胞增殖的抑制率比较[J]. 福建中医药大学学报,2014,5(5):40-41.
[9] Sun Y,Li H,Hu J,etal. Qualitative and quantitative analysis of phenolics inTetrastigmahemsleyanumand their antioxidant and antiproliferative activities[J].JAgricultural&FoodChemistry,2013,61(44):10507-10515.
StudiesontheQualityControloftheAerialPartsofTetrastigmaHemsleyanumHerbalPieces
XIEPing,CHENDan,HUANGJiao,ZHUXianmu,MAGuoping,FUAizhen
DepartmentofPharmacy,FujianUniversityofTCM,FujianFuzhou350122,China
Objective To establish the quality control methods of the aerial parts ofTetrastigmaHemsleyanumherbal pieces.MethodsIdentify herbal pieces by TLC method; The moisture, total ash, acid-insoluble ash and extract were analyzed according to the methods in Chinese Pharmacopoeia (2015). With isoorientin used as reference, the detection wave length set at 500 nm and the color reaction conditions optimized, the content of total flavonoids was determined by NaNO2-Al(NO3)3-NaOH colorimetric method.ResultsIn the TLC conditions, three batches of the aerial parts ofTetrastigmaHemsleyanumherbal pieces showed the same color spots as the isoorientin reference, and the components were well separated. The moisture, total ash, acid-insoluble ash, water-soluble and alcohol-soluble extract of the samples varied in the ranges of 4.05%~6.77%, 6.06%~7.25%, 0.64%~1.65%, 16.00%~27.09% and 15.42%~27.07% respectively. The contents of heavy metals and arsenic salts were less than ten over one million and one over one million respectively. There was a good linear relationship in the range of 7.73~61.82 μg/mL, with the equationA=1.50×10-2C-1.78×10-2(r=0.999 6). The flavonoids content in four batches of the aerial parts ofTetrastigmaHemsleyanumherbal pieces varied in the range of 20.83~21.50 mg/g.ConclusionThe results can be used as a reference to the quality control of the aerial parts ofTetrastigmaHemsleyanumherbal Pieces.
Tetrastigmahemsleyanum; quality control; diagnosis, differential; colorimetry
R24; R282.71; R284.1
A
1672-4194(2017)05-0291-08
2017-05-19
福建省科技计划项目(2010Y2004);中管局中药分析学重点学科校管课题(X2014096-学科)
福建中医药大学 药学院,福州 350122
谢 平,男,福建中医药大学2015级硕士研究生
陈 丹. Email:gscd2@163.com
(编辑:张慧茹)

