牡丹胚培养快速成苗技术研究
徐 莉 成仿云 钟 原
(北京林业大学园林学院国家花卉工程技术中心,北京 100083)
牡丹胚培养快速成苗技术研究
徐 莉 成仿云*钟 原
(北京林业大学园林学院国家花卉工程技术中心,北京 100083)
以‘凤丹’及紫斑牡丹种胚为外植体,通过研究激素、光照条件、培养基成分及活性炭(AC)等对离体胚培养的影响,建立了牡丹胚培养直接成苗的高效、快捷的方法。主要结果:在改良MS(钙加倍)+0.2 g·L-1AC+0.5 mg·L-1BA+0.5 mg·L-1GA中离体胚10 d胚根萌动,20 d长出真叶,25 d根系发达,40 d移栽,3个月后幼苗长势良好。实验得出适宜‘凤丹’的培养基:改良MS(钙加倍、大量元素加倍)+0.6 g·L-1AC+1.0 mg·L-1GA,紫斑牡丹:改良MS(钙加倍、大量元素加倍)+0.6 g·L-1AC+0.5 mg·L-1GA;其中‘凤丹’的成苗率63.88%,成活率66.34%,紫斑成苗率93.75%,成活率在品种间有差异,最佳可达100%。
胚培养;‘凤丹’;紫斑牡丹;活性炭
牡丹(Paeoniasect. Moutan)是中国传统名花,作为药用及观赏植物历史悠久,现又发掘了其作为油料作物资源的优质潜力[1]。‘凤丹’(P.ostii‘Fengdan’)和紫斑牡丹(P.rockii)是牡丹中籽含油量高的两大类群,且具有长势强、开花盛、抗性强等多种优良特性,是我国优质的牡丹种质资源[2]。牡丹开花授粉得到种子,自然状态下播种繁殖大约需3个月左右才能萌发生根,且种子具有典型的上胚轴休眠现象,露地播种一般在第二年春季出苗,且出苗率低,幼苗质量不稳定[3],实生苗一般需要养护3~5年才能开花,然后再经历初选、复选和定名等过程,推出一个新品种至少要10年以上时间[4]。因此,研究应用胚培养技术对缩短牡丹育种周期、提高育种效率有重要价值。
胚培养技术在梅花[5]、芍药[6]及各类果树[7~9]等植物上已取得较好的效果。而有关牡丹胚离体培养的研究基本上集中在胚萌发直接成苗[10~12]以及先诱导不定芽再生根成苗[13~16]两个方面。这两方面的关键都是牡丹种子休眠的解除,关于前者,Julie等研究发现GA促进上胚轴的生长,低浓度的BA与GA效果相同,在只含GA不含细胞分裂素的培养基上发生的根细长,ABA与各种浓度的GA配合均抑制上胚轴的生长。Zilis等研究将种胚萌发时间由8个月缩短至12~14周。王莹等通过使用IAA与GA配合使紫斑牡丹成苗率为11%。关于后者,刘会超等通过BA与IBA打破上胚轴休眠,然后通过IAA诱导生根,使‘凤丹’成苗率为91.67%,周期65 d;王莹等通过IAA与GA打破上胚轴休眠,然后通过IBA继代在1/2MS+0.05%AC中直接生根,生根率54%,周期85 d。但这些研究都以紫斑或‘凤丹’单一基因型为研究对象,前者成苗率低,后者步骤复杂,周期较长,且牡丹试管苗生根较难,二者都缺少后期移栽成活及生长情况说明,都没能建立高效的成苗方法。
AC因具有促进生根的作用而常被用于试管苗生根诱导[17],且AC有很强的吸附特性,能把植物组织外泌的及培养基成分中抑制生长的物质吸附掉,如组织外泌的酚类[18]、蔗糖高压灭菌产生的糖醛类[19]、琼脂中的脂肪酸等有害物质[20]。本研究为探求牡丹种胚成苗的简单、高效、快捷的成苗方法,使用AC以促进胚根生长与真叶萌发同步进行,但AC在吸附生长抑制物质的同时会把有促进作用的物质也吸附掉,如生长调节剂NAA、BA、IAA、ABA、2,4-D等[21~24]及有机营养物硫胺素、生物素、Fe-EDTA、烟酸、叶酸和吡哆醇[25~26]等,本研究的重点是胚直接萌发、快速成苗。为此,以AC为中心影响因子,考虑到其吸附特性,研究其与激素、光照条件、培养基成分等相互作用对胚萌发直接成苗的影响,通过对‘凤丹’与紫斑牡丹的对比分析,分别建立了它们的快速成苗技术,同时重点对AC在此过程中的重要作用进行了分析。
1 材料与方法
1.1 种子采集与离体培养
材料采集与离体培养:2016年8月在北京延庆“国家牡丹综合栽培标准化示范区”基地采收牡丹成熟种子,层积沙藏处理30 d后备用。将种子洗净,流水冲洗15 min,洗涤剂漂洗15 min,再用自来水冲洗30 min后置于超净工作台上。用70%酒精与5%的次氯酸钠溶液分别浸泡消毒1与15 min,然后用无菌水冲洗5次。用刀镊将种胚取出接种于培养基中培养,每处理15个外植体,3个重复。
培养条件:基本培养基为改良MS(钙加倍),添加蔗糖30 g·L-1、琼脂7.5 g·L-1,pH为5.8~6.0;培养温度为(20±1℃),光照时数为每天14 h光照,光照强度32.4 μmol·m-2·s-1(荧光灯)。
移栽条件:移栽基质为经过120℃高压灭菌20 min的珍珠岩∶蛭石∶草炭土=1∶1∶1的混合基质[27],移栽苗在人工气候室中培养,人工气候室条件:温度(20±1℃),湿度90%,光照强度32.4 μmol·m-2·s-1,光照时数为每天14 h光照。
1.2 试验内容
1.2.1 不同因素组合对胚培养的影响
将‘凤丹’以及紫斑牡丹‘红莲’(P.rockii‘Honglian’)的种胚接种于不同因素组合处理的培养基中,观察胚培养情况。
表1光、激素及活性炭处理组合
Table1Combinationoflight,hormonesandactivatedcarbon
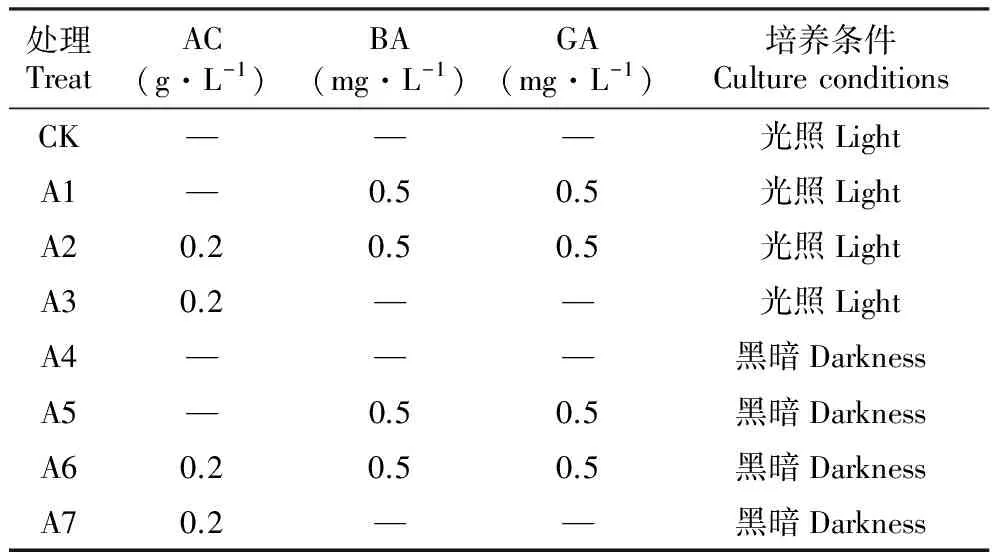
处理TreatAC(g·L-1)BA(mg·L-1)GA(mg·L-1)培养条件CultureconditionsCK———光照LightA1—0.50.5光照LightA20.20.50.5光照LightA30.2——光照LightA4———黑暗DarknessA5—0.50.5黑暗DarknessA60.20.50.5黑暗DarknessA70.2——黑暗Darkness
①AC+光条件+BA+GA:处理组合如表1,培养30 d观察形态发展变化情况。
②AC+BA:BA浓度分别为0、0.25、0.5、1.0 mg·L-1、无AC的CK、B1-3及BA浓度分别为0、0.25、0.5、1.0、4.0、8.0、12.0 mg·L-1、分别添加0.2 g·L-1AC的B4-10。培养30 d观察形态发展变化情况并统计平均株高(植株上部顶端到根茎的距离)、平均芽长(子叶间长出不定芽的长度)及生根率。
③AC+GA:GA浓度分别为0、0.5、1.0 mg·L-1、无AC的CK、C1-2及GA浓度分别为0、0.5、1.0 mg·L-1、分别添加0.6 g·L-1AC的C3-5。培养30 d观察形态发展变化情况并统计萌发率、真叶率(子叶间抽出真叶的种胚/接种的总种胚数×100%)、并对平均根长及平均真叶长(子叶间长出真叶的长度)进行双因素方差分析。
④AC+不同母液成分含量:母液成分分别为不变、大量元素双倍、Fe盐双倍、有机元素双倍、分别添加0.5 mg·L-1GA及0.6 g·L-1AC,命名为CK、D1-3。培养30 d观察形态发展变化情况并统计生根率、真叶率、平均根长及平均真叶长。
⑤AC浓度:AC浓度分别为0.2、0.4、0.6、0.8 g·L-1、分别添加0.5 mg·L-1GA,分别标记为E1-4,40 d后统计萌发率、成苗率(既生根又有真叶抽出的种胚/接种的总种胚数×100%)及平均根长。
1.2.2 不同牡丹品种胚培养效果
将‘凤丹’以及紫斑牡丹‘红莲’、‘京华晴雪’(P.rockii‘Jinghua Qingxue’)、‘银红飞荷’(P.rockii‘Yinhong Feihe’)、‘蓝荷’(P.rockii‘Lanhe’)种子分别称量千粒重,种胚接于添加0.6 g·L-1AC、0.5 mg·L-1GA的培养基,40 d移栽时统计萌发率、成苗率以及平均根长,移栽培养3个月后统计移栽成活率、株高及叶片数。
1.3 数据分析
数据用SPSS17.0统计分析,用Duncan氏法进行差异显著性检测及双因素方差分析。
2 结果与分析
2.1 AC和光条件、激素对胚培养的影响
AC对BA、GA会产生特殊作用,使胚向两个不同的方向发展。观察发现‘凤丹’与紫斑在各处理的发展趋势基本一致,下述以‘凤丹’为例具体描述。同时添加BA、GA的培养基在有AC与无AC时胚的形态发展差异显著(图版Ⅰ:B-C),A1中5 d时子叶先萌动,而A2中10 d时根先萌动;A1中子叶及上胚轴发育,下胚轴及根部不发育,而A2中子叶及上胚轴发育不明显,而下胚轴发育并长出根;A1中无根生长但子叶间有芽长出,而A2根先伸长,然后子叶间抽出一片真叶,与种子正常萌发状态相似,20 d真叶抽出成苗,25 d根部发育完全,具根毛(图版Ⅰ:I),40 d可移栽至基质中(图版Ⅰ:J-K),并在人工气候室中培养,3个月后牡丹苗长势健壮,已发新芽(图版Ⅰ:L),可大大缩短牡丹育苗周期。
黑暗条件、AC及激素都能促进胚根萌动,且影响作用大小依次为激素>AC>黑暗条件。表2中CK与A4对比,可知胚在不添加任何物质的培养基中根萌发慢,需20~25 d,且子叶不发育,但A4黑暗条件下只需15~20 d;CK与A3对比可知AC也有利于根萌发,只需15 d,而A2与A3对比可知,在激素作用下胚根萌动只需10 d;激素控制芽或真叶的生长,有激素添加A1-2、A5-6中有芽或真叶,而无激素添加的CK及A3、A4、A7中无;A1与A5,A2与A6对比说明黑暗条件虽不影响子叶间芽或真叶的生长,但胚苗白化不转绿,不利于生长(图版Ⅰ:A-H)。
表2光、激素及活性炭对‘凤丹’胚培养的影响
Table2Effectoflight,hormonesandactivatedcarbonontheembryoculture

处理Treat形态发展状况SituationCK前20d胚基本不萌发,20~25d时根萌动伸长,但子叶仍不发育Embryobasiclynotgerminatedbetweenthefirst20d,therootbe⁃gantostretchin20-25d,butcotyledonsarestillnotdeveloped.A15d子叶开始变绿,15d子叶成宽厚的两片,20d子叶间芽长出,根不伸长Cotyledonsbegantoturngreenafter5d,andthickerin15d,budsgrewoutfromcotyledonsin20d,buttherootdoesnotstretched.A210d时子叶变黄白色,胚根萌动,15d胚根1cm,20d子叶间真叶抽出Cotyledonsturnyellowish⁃whitein10d,radiclestartstretchedandto1cmin15d,euphyllagrewoutfromcotyledonsin20d.A310d子叶打开膨大,15d根萌动,之后根伸长但子叶不发育,无芽无真叶Cotyledonsopenedtoenlargein10d,rootstartstretchedin15d,thentherootstillstretchedbutcotyledonsarenotdeveloped,nobudsnoleaves.A4形态发展变化与CK同,只是15~20d时根已萌动FromchangessamewithCK,onlytherootstartstretchedin15-20d.A5形态发展变化与A1同,只是颜色偏白,不绿FromchangessamewithA1,onlythecoloriswhite,notgreen.A6形态发展变化与A2同,只是整体白化FromchangessamewithA2,onlyoverallwhitening.A7形态发展变化与A3同FromchangessamewithA3.
2.2 AC与BA对胚培养的影响
观察发现,B1-3中牡丹种胚的形态发展一致,即子叶发育成厚实的两片,子叶间长出芽,有部分根长出,与对照差异明显(图版Ⅱ:A-D),随着BA浓度的增加,胚苗平均芽长相应增加,而生根率相应减少。通过CK与B1-3对比可知BA具有促进子叶发育及芽生长的作用,且高浓度的BA会抑制根的发育。‘凤丹’与紫斑胚苗在不同BA浓度下平均株高、平均芽长及生根率存在差异,二者的胚根生长对于BA浓度的敏感度不一样,‘凤丹’比紫斑更加敏感,在BA为0.5 mg·L-1时生根率为0,而紫斑在0.5 mg·L-1时生根率为25%,在1.0 mg·L-1时生根率为0(表3)。
表3BA与活性炭对胚培养的影响
Table3EffectsofBAandactivatedcarbononembryoculture

品种Species处理Treat株高Plantheight(cm)芽长Budslength(cm)生根率Rootingrate(%)‘凤丹’P.ostii‘Fengdan’B11.62±0.39a0.22±0.07b65.00±7.07aB21.19±0.22b0.50±0.15a0.00±0.00bB31.49±0.33ab0.51±0.11a0.00±0.00b紫斑P.rockiiB11.34±0.47a0.16±0.05c80.00±0.00aB21.11±0.47a0.36±0.08b25.00±21.21bB31.11±0.34a0.50±0.09a0.00±0.00c
注:表中数据为均值+标准差;大小写字母表示P<0.05水平差异显著 下同。
Note:The data in the table is mean+standard deviation;Letter stands for significantly different inP<0.05 The same as below.
CK与B4-8中种胚发育的形态基本一致,即只有根长,子叶不发育,为黄白色,且子叶间无芽,表明培养基中BA可能没有发挥作用(图版Ⅱ:E-F)。而随着培养基中BA浓度增加,在B9中胚苗根部发育,子叶由黄转绿,胚芽生长(图版Ⅱ:G,I);B10中子叶绿色,部分根生长受抑制,与B1相似(图版Ⅱ:H,J)。可见AC对BA具有有限的吸附作用。
2.3 AC与GA对胚培养的影响
调查发现,在C1-2与C4-5中,离体胚发育形态变化一致,即10 d时根萌动,子叶发育不明显,20 d时有真叶抽出,而CK与C3中只有根生长,真叶率为0,可见GA具有促进真叶抽出及根萌发作用。
GA与活性炭对胚培养的影响在‘凤丹’与紫斑牡丹中差异明显(表4),萌发率虽无明显差异,但‘凤丹’的根更容易抽长,平均根长均高于紫斑,而紫斑更容易长出真叶,真叶率明显高于‘凤丹’;在本实验中添加AC的C3-5中‘凤丹’与紫斑的平均根长和平均真叶长均高于不添加AC的CK、C1-2培养基,对GA与AC在胚培养中对平均根长及平均真叶长的影响进行方差分析,如表5~6所示,在‘凤丹’胚培养中,GA对平均根长及平均真叶长的影响极显著(P<0.01),而AC对平均根长的影响显著(P<0.05),对平均真叶长的影响不显著(P>0.05)。在紫斑胚培养中,GA对平均根长的影响显著,对平均真叶长的影响极显著,而AC对平均根长的影响极显著(P<0.01),对平均真叶长的影响不显著(P>0.05)。GA促进牡丹胚培养的平均根长及平均真叶长,而AC促进平均根长,可见AC+GA对于牡丹胚培养具有积极的作用。‘凤丹’在C5处理中真叶率、平均根长、平均真叶长最高为63.88%、1.63 cm、0.61 cm;紫斑在C4处理中真叶率、平均根长、平均真叶长较高为100%、1.04 cm、1.38 cm;综合数据分析,‘凤丹’适宜浓度为0.6 g·L-1AC+1.0 mg·L-1GA,紫斑适宜浓度为0.6 g·L-1AC+0.5 mg·L-1GA。
表4GA与活性炭对胚培养的影响
Table4EffectofGAandactivatedcarbononembryoculture
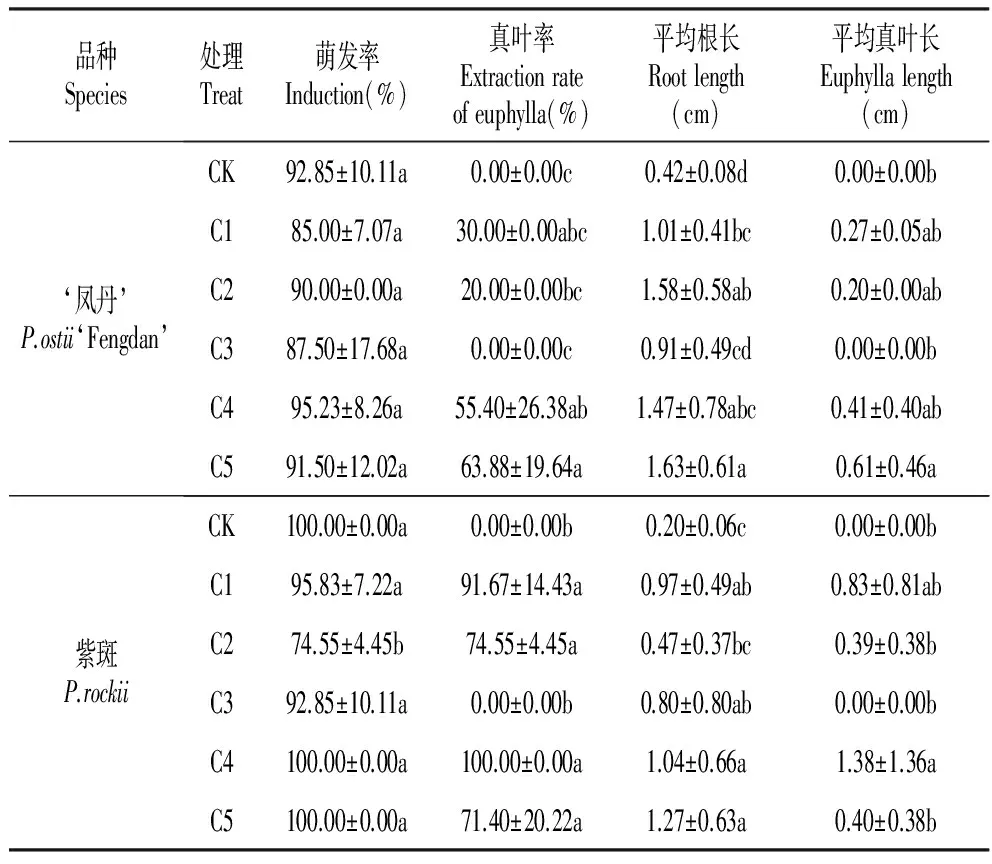
品种Species处理Treat萌发率Induction(%)真叶率Extractionrateofeuphylla(%)平均根长Rootlength(cm)平均真叶长Euphyllalength(cm)‘凤丹’P.ostii‘Fengdan’CK92.85±10.11a0.00±0.00c0.42±0.08d0.00±0.00bC185.00±7.07a30.00±0.00abc1.01±0.41bc0.27±0.05abC290.00±0.00a20.00±0.00bc1.58±0.58ab0.20±0.00abC387.50±17.68a0.00±0.00c0.91±0.49cd0.00±0.00bC495.23±8.26a55.40±26.38ab1.47±0.78abc0.41±0.40abC591.50±12.02a63.88±19.64a1.63±0.61a0.61±0.46a紫斑P.rockiiCK100.00±0.00a0.00±0.00b0.20±0.06c0.00±0.00bC195.83±7.22a91.67±14.43a0.97±0.49ab0.83±0.81abC274.55±4.45b74.55±4.45a0.47±0.37bc0.39±0.38bC392.85±10.11a0.00±0.00b0.80±0.80ab0.00±0.00bC4100.00±0.00a100.00±0.00a1.04±0.66a1.38±1.36aC5100.00±0.00a71.40±20.22a1.27±0.63a0.40±0.38b
2.4 AC与母液成分含量对胚培养的影响
据观察,CK中胚苗子叶为黄白色并不转绿,而D1-3中,子叶分别为绿色、微绿色、基部绿色上端白色三种情况(图版Ⅱ:K),可见这3种母液成分含量双倍的培养基对于子叶转绿有促进作用,且作用大小为大量元素>铁盐>有机元素。如表7所示,‘凤丹’和紫斑的生根率都较高,但是紫斑的真叶率远高于‘凤丹’。‘凤丹’D1-3的平均真叶长均高于CK,但只有D1的平均根长高于CK;紫斑D1-3的平均根长均高于CK,但只有D1的平均真叶长高于CK,综合上述分析,大量元素加倍为适宜的母液成分含量。

表5 GA与AC对‘凤丹’平均根长及平均真叶长影响的方差分析

表6 GA与AC对紫斑平均根长及平均真叶长影响的方差分析
表7母液成分含量与活性炭对胚培养的影响
Table7Effectofcontentofmotherliquorandactivatedcarbononembryoculture
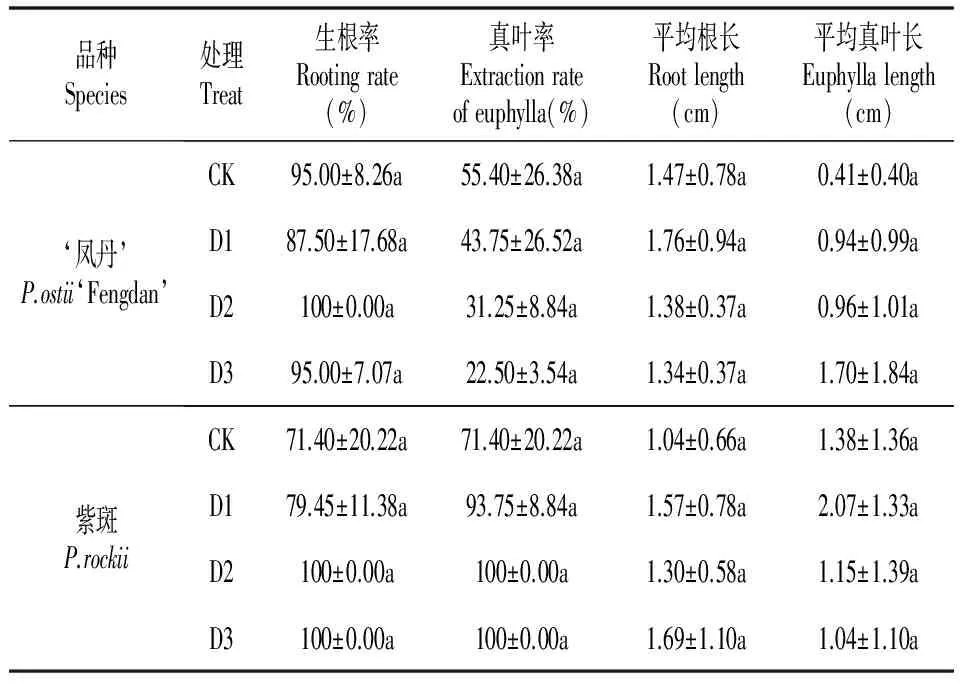
品种Species处理Treat生根率Rootingrate(%)真叶率Extractionrateofeuphylla(%)平均根长Rootlength(cm)平均真叶长Euphyllalength(cm)‘凤丹’P.ostii‘Fengdan’CK95.00±8.26a55.40±26.38a1.47±0.78a0.41±0.40aD187.50±17.68a43.75±26.52a1.76±0.94a0.94±0.99aD2100±0.00a31.25±8.84a1.38±0.37a0.96±1.01aD395.00±7.07a22.50±3.54a1.34±0.37a1.70±1.84a紫斑P.rockiiCK71.40±20.22a71.40±20.22a1.04±0.66a1.38±1.36aD179.45±11.38a93.75±8.84a1.57±0.78a2.07±1.33aD2100±0.00a100±0.00a1.30±0.58a1.15±1.39aD3100±0.00a100±0.00a1.69±1.10a1.04±1.10a
表8活性炭浓度对胚培养的影响
Table8Effectofactivatedcarbonconcentrationonembryoculture

品种Species处理Treat生根率Rootingrate(%)真叶率Extractionrateofeuphylla(%)平均根长Rootlength(cm)平均真叶长Euphyllalength(cm)‘凤丹’P.ostii‘Fengdan’E1100±0.00a41.67±11.79a2.35±1.55b2.78±1.35bE295.24±8.25a80.95±21.82a3.00±1.10ab4.70±1.38aE383.33±23.57a61.91±6.74a3.79±1.07a4.71±1.68aE4100±0.00a75.40±29.38a3.58±1.38ab3.75±1.65ab紫斑P.rockiiE166.33±0.47a83.32±0.02a2.00±2.18b1.03±0.67bE285.72±20.20a100±0.00a2.83±2.28ab2.13±1.81bE385.36±0.50a100±0.00a5.85±1.89a4.25±2.16aE471.63±0.28a86.21±0.71a4.72±2.96ab4.13±1.23a
2.5 AC浓度对胚培养的影响
根据表8,‘凤丹’与紫斑胚的生根率及真叶率存在很大区别,‘凤丹’的生根率较高,但真叶率较低,而紫斑的真叶率高、生根率相对低些。综合数据分析,‘凤丹’与紫斑各自在E3处理时平均根长及平均芽长均最高,因此E3处理为最佳处理,在进行紫斑与‘凤丹’牡丹胚培养时适宜添加的活性炭浓度为0.6 g·L-1。
2.6 牡丹品种对胚培养的影响
‘凤丹’与紫斑形态发展步骤基本一致,但在萌发率、成苗率及移栽成活率上存在差异。如表9所示,萌发率与种子千粒重成正比,千粒重大,种胚体积大且营养含量高,方便接种操作且种胚生长发育好,种胚体积小,接种不便,易造成机械损伤,导致细菌污染及胚死亡。‘凤丹’千粒重最大为402 g,萌发率最高为98.33%,紫斑品种间差异大,‘蓝荷’最小为212 g,萌发率最低为63.33%,其它较为相似;基因型对成苗率影响较大,因较易抽出真叶,4个紫斑品种成苗率皆比‘凤丹’高,‘凤丹’的成苗率最低为53.33%;移栽3月后统计数据如表10所示,移栽成功的胚苗在株高及叶片数上相差不大,长势良好(图版Ⅱ:L),4个紫斑品种的移栽成活率皆高于凤丹,‘红莲’及‘银红飞荷’的移栽成活率为100%,‘蓝荷’为75.25%,‘京华晴雪’为66.34%,‘凤丹’的移栽成活率最低为42.5%。移栽成活率与平均根长及成苗率相关,‘凤丹’的移栽成活率低可能因为其成苗率低,真叶抽出少,导致移栽后不容易进行光合作用成活,‘京华晴雪’的平均根长较低,故而移栽成活率低,而‘蓝荷’的平均根长及成苗率皆低,综上,在此种胚培养方式下,紫斑品种的成苗率及成活率均高于‘凤丹’。
表9牡丹品种对胚培养的影响
Table9Effectoftreepeonyvarietiesonembryoculture

品种Species千粒重/100g1000grainweight萌发率Induction(%)成苗率Seedlingrate(%)平均根长Rootlength(cm)‘凤丹’P.ostii‘Fengdan’4.0298.33±2.88a53.33±2.89e5.07±2.03ab‘京华晴雪’P.rockii‘JinghuaQingxue’3.6595.00±1.00a91.67±2.89a4.23±2.39bc‘银红飞荷’P.rockii‘YinhongFeihe’3.6776.67±0.58c75.67±1.15c5.16±1.76ab‘红莲’P.rockii‘Honglian’2.8984.33±4.04b81.67±2.89b6.34±191a‘蓝荷’P.rockii‘Lanhe’2.1263.33±2.89d61.67±2.89d3.39±1.67c
表10移栽3个月后不同牡丹品种的生长情况
Table10Growthoftreepeonyvarietiesafterthreemonthsoftransplantation
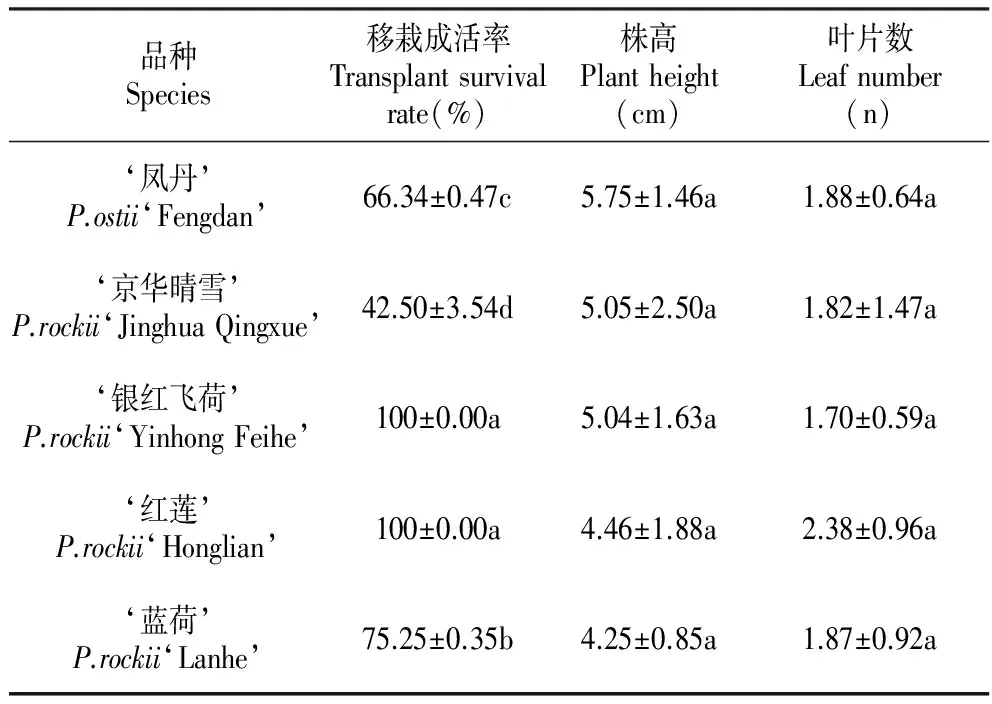
品种Species移栽成活率Transplantsurvivalrate(%)株高Plantheight(cm)叶片数Leafnumber(n)‘凤丹’P.ostii‘Fengdan’66.34±0.47c5.75±1.46a1.88±0.64a‘京华晴雪’P.rockii‘JinghuaQingxue’42.50±3.54d5.05±2.50a1.82±1.47a‘银红飞荷’P.rockii‘YinhongFeihe’100±0.00a5.04±1.63a1.70±0.59a‘红莲’P.rockii‘Honglian’100±0.00a4.46±1.88a2.38±0.96a‘蓝荷’P.rockii‘Lanhe’75.25±0.35b4.25±0.85a1.87±0.92a
3 讨论
3.1 AC对牡丹胚培养直接成苗的作用
在植物组织培养中,AC常被用于防止组织褐化、促进生长与分化、促进根的形成、阻止不需要的愈伤的生长、及试管苗根诱导形成等[28~29],同时它会吸附激素和培养基成分,高浓度的AC与生长调节剂合用时常抵消生长调节剂的作用,为了探究AC对胚培养直接成苗的影响及作用机理,将其单独及与激素、光照条件、培养基成分等组合使用,研究结果表明AC对胚培养的影响主要在两个方面:一是对胚的直接影响,二是通过对激素及培养基成分的吸附而产生的间接作用。研究发现AC确有促进生根的作用,这与James等的研究结果一致;而关于其作用机理,有人认为是因为其提供了黑暗环境[30],也有人认为是吸附了抑制生长的有害物质[19],由本研究结果:对胚根萌动的影响作用大小AC>黑暗条件,本研究认为活性炭有利于生根主要是因为活性炭吸附了抑制生长的有害物质,同时提供了遮光条件,所以添加AC处理的‘凤丹’与紫斑的平均根长和平均真叶长均高于不添加AC的培养基。关于其吸附能力的问题比较复杂,卜学贤曾研究得出在液相中每100 mg AC大约吸附100 μg左右的生长调节物质[31]。但固体培养基中情况不同,因固体培养基操作不便,难以准确计算出AC对激素的具体吸附量,只能通过胚苗的生长情况来推测激素的吸附值[32]。本研究得出BA在浓度升高时促进芽的生长但抑制胚根,然而在添加AC的培养基中需高浓度的BA才能表现BA的作用效果,这与Takayawa和Misawa的研究一致[33],本研究中4.0 mg·L-1的BA被0.2 g·L-1AC全部吸附,而8.0 mg·L-1的BA在0.2 g·L-1AC中仍能发挥一定作用,12 mg·L-1的BA在0.2 g·L-1AC中对胚培养的效果与不加AC但BA为0.25 mg·L-1相似,为BA与AC使用提供参考,避免AC使用的盲目性。在不加AC的CK与C1-2中,随着GA浓度的增加,紫斑的真叶率、平均真叶长和平均根长均是先上升后下降,而‘凤丹’品种除了平均根长是相应增加外,其它两项均是先上升后下降,可见GA对胚培养的影响有限度,在0.5 mg·L-1时较佳,而‘凤丹’的平均根长相应增加,可能与‘凤丹’品种的根容易抽长有关。而在添加AC的C3-5中,随着GA浓度的增加,‘凤丹’的真叶率、平均真叶长和平均根长均是相应增加,而紫斑除了平均真叶长是先上升后下降外,其它两项均是相应增加。推测AC对GA也有一定的吸附作用使GA浓度下降到适宜生长的范围内,但在GA+AC中各项数据都高于不添加AC的处理,添加0.6 g·L-1AC、0.5 mg·L-1GA与0.5 mg·L-1GA不加AC的处理中GA对胚苗的作用效果相似,可见AC对不同激素的吸附能力不一,这与王港的研究结果一致[34],且对BA的吸附能力远大于对GA的吸附能力。植物在光合作用中需要铁、镁等多种成分,而AC吸附培养基成分,所以大量元素加倍、铁盐加倍、有机成分加倍的处理与对照相比都有一定的转绿效果,且在平均根长与真叶长上有促进作用。
3.2 激素对牡丹胚培养直接成苗的作用
如何协调上、下胚轴生长,是牡丹胚离体萌发、直接成苗的关键,其中激素发挥着至关重要的作用。本研究表明,加入BA可以促进上胚轴的生长,但随着浓度增加下胚轴长势不好。GA可以打破上胚轴休眠特性,使上胚轴明显伸长,抽出真叶,且促进胚根萌动,但同时也表现为弱苗状,这与Julie的研究一致。NAA及2,4-D在胚培养时易诱导愈伤[13],IAA使种胚膨大,仅上胚轴生长[35],不利于胚直接成苗,IBA对于后期试管苗根诱导有促进作用[36]。为了提高胚培养直接成苗效率,在激素选择上Julie通过GA直接打破上下胚轴休眠成苗,但根苗细弱,难以移栽。曹小勇[37]通过低浓度0.1 mg·L-1的BA,通过一代培养促使牡丹胚的上胚轴、下胚轴及胚根均正常生长,顶芽萌动,形成完整幼苗,但难以把握BA浓度对下胚轴的抑制作用,且本研究中发现低浓度BA中培养的胚根生长状况不佳,后期移栽存在问题。刘会超通过6-BA先诱导上胚轴生长、再通过IBA诱导胚根生长来形成完整幼苗。步骤复杂,且根诱导率不高。综合认为,本研究中单独利用GA打破上、下胚轴休眠,同时辅以AC吸附抑制生长的有害物质,改良培养基成分提高胚苗质量是简易、高效的方式。
4 结论
牡丹种胚直接成苗技术可以使牡丹种胚快速成苗,缩短育种周期,提高种子萌发率,加速杂交育种进程;通过研究发现了‘凤丹’和紫斑牡丹种胚直接成苗的简单、高效、快捷的成苗方法:采牡丹成熟种子,层积沙藏处理一个月,采用胚培养方法可达到10 d生根,20 d萌发真叶成苗,25 d根系发达,40 d移栽且移栽培养3个月后幼苗健壮的效果,大大缩短了育种周期。紫斑胚培养培养基为:改良MS(钙加倍、大量元素加倍)+0.6 g·L-1AC+0.5 mg·L-1GA;‘凤丹’为:改良MS(同上)+0.6 g·L-1AC+1.0 mg·L-1GA。
1.Li S S,Yuan R Y,Chen L G,et al.Systematic qualitative and quantitative assessment of fatty acids in the seeds of 60 tree peony(PaeoniasectionMoutan DC.) cultivars by GC-MS[J].Food Chemistry,2015,173:133-140.
2.李嘉珏.中国牡丹[M].北京:中国大百科全书出版社,2011.
Li J J.Tree Peony of China[M].Beijing:China Encyclopedia Publishing House,2011.
3.成仿云,杜秀娟.低温与赤霉素处理对‘凤丹’牡丹种子萌发和幼苗生长的影响[J].园艺学报,2008,35(4):553-558.
Cheng F Y,Du X J.Effects of Chilling and Gibberellic Acid on the Seed Germination and Seed-ling Growth inPaeoniaostii‘FengDan’[J].Acta Horticulturae Sinica,2008,35(4):553-558.
4.成仿云,李嘉珏,陈德忠,等.中国紫斑牡丹[M].北京:中国林业出版社,2005:77-84.
Cheng F Y,Li J J,Chen D Z,et al.Chinese Flare Mudan[M].Beijing:China Forestry Publishing House,2005:77-84.
5.潘晓,陈瑞丹.‘淡丰后’梅胚培养影响因素的研究[J].北京林业大学学报,2010,2(32):88-92.
Pan X,Chen R D.Factors affecting embryo culture ofPrunusmume‘Dan Fenghou’[J].Journal of Beijing Forest University,2010,2(32):88-92.
6.Shen M M,Tang Z J,Da Silva Jat,et al.Induction and proliferation of axillary shoots from in vitro culture ofPaeonialactifloraPall. mature zygotic embryos[J].New Zealand Journal of Crop and Horticultural Science,2015,43(1):42-52.
7.杜学梅,李登科,王永康,等.枣胚培技术体系的建立[J].园艺学报,2005,32(3):496-499.
Du X M,Li D K,Wang Y K,et al.Estabilishment of Embryo Culture Technical System of Chinese Jujube(ZizyphusjujubeMill.) [J].ActaHorticulturae sinica,2005,32(3):496-499.
8.王际轩,李淑珍,李博文,等.山楂砧木苗的种胚培养[J].园艺学报,1982,9(4):7-10.
Wang J X,Li S Z,Li B W,et al.embryo culture of Hawthorn(Crataeguspinnatifida) rootstocks[J].Acta Horticulturae Sinica,1982,9(4):7-10.
9.王元裕,周碧英,赵安祥,等.柑桔胚培养技术的研究Ⅰ,-成熟种子胚的分离培养[J].园艺学报,1979,6(1):3-8,35.
Wang Y Y,Zhou B Y,Zhao A X,et al.Studies on the technique of citrus embryo culture Ⅰ,The segregate culture of citrus embryos of mature seed[J].ActaHorticulturae sinica,1979,6(1):3-8,35.
10.Zilis M R,Meyer M M.Rapid in vitro germination of immature,dormant embryos[J].Comb ProcAnnu Meet Int Plant Propag Soc,1976.
11.Buchheim J A T,Burkhart L F,Meyer M M Jr.Effect of exogenous gibberellic acid,abscisic acid,and benzylaminopurine on epicotyl dormancy of cultured herbaceous peony embryos[J].Plant cell,Tissue and Organ Culture,1994,36(1):35-43.
12.Wang H,Van Stadenj.Establishment ofinvitrocultures of tree Peonies[J].South African Journal of Botany,2001,67(2):358-361.
13.Brukhin V B,Batygina T B.Embryo culture and somatic embryogenesis in culture ofPaeoniaanomala[J].Phytomorphology,1994,44(34):151-157.
14.刘会超,贾文庆,王坤.牡丹胚培养及丛生苗继代培养研究[J].北方园艺,2010,(6):172-174.
Liu H C,Jia W Q,Wang K.The Culture of Peony Embryo and Subculture of Multiple Bud[J].Northern Horticulture,2010,(6):172-174.
15.王莹,何桂梅,韩丽晓.紫斑牡丹胚培养及幼苗生长的研究[J].湖南农业科学,2012(9):103-106.
Wang Y,He G M,Han L X.Study on Embryo-culture and Seedling Growth forPaeoniarockii[J].Hunan Agricultural Sciences,2012(9):103-106.
16.Jana S,Sivanesan I,Lim M Y,et al.In vitro zygotic embryo germination and somatic embryogenesis through cotyledonary explants ofPaeonialactifloraPall[J].Flower Research Journal,2013,21(1):17-22.
17.James A C,Harris R A,Mantell S H.PaeoniaSpecies(Tree Peonies)[M].//Bajaj Y P S.Trees IV.Berlin Heidelberg:Springer,1996:244-268.
18.Fridborg G,Pedersen M,Landstrom L E,et al.The Effect of Activated Charcoal on Tissue Cultures:Adsorption of Metabolites Inhibiting Morphogenesis[J].Physiologia Plantarum,1978,43(2):104-106.
19.Weatherhead M A,Burdon J,Hensgaw G G.Effects of Activated Charcoal as an Additive Plant Tissue Culture Media:Part 2[J].ZeitschriftFür Pflanzenphysiologie,1979,94(5):399-405.
20.Kohlenbach H W,Wernicke W.Investigations on the Inhibitory Effect of Agar and the Function of Active Carbon in Anther Culture[J].ZeitschriftFür Pflanzenphysiologie,1978,86(5):463-472.
21.Maene L,Debergh P.Liquid medium additions to established tissue cultures to improve elongation and rootinginvivo[J].Plant Cell,Tissue and Organ Culture(PCTOC),1985,5(1):23-33.
22.Constantin M J,Henke R R,Mansur M A.Effect of activated charcoal on callus growth and shoot organogenesis in tobacco[J].In Vitro Cellular & Developmental Biology-Plant,1977,13(5):293-296.
23.Scholl R L,Keathley D E,Baribault T J.Enhancement of Root Formation and Fertility in Shoots Regenerated From Anther and Seedling-Derived Callus Cultures ofArabidopsisthaliana[J].ZeitschriftFür Pflanzenphysiologie,1981,104(3):225-231.
24.Johansson L,Andersson B,Eriksson T.Improvement of anther culture technique:Activated charcoal bound in agar medium in combination with liquid medium and elevated CO2concentration[J].Physiologia Plantarum,2010,54(1):24-30.
25.Bourgin J P,Nitsch J P.Production of haploids nicotiana from excised stamens[J].Annales De Physiologie Vegetale,1967,9(4):377-382.
26.Johansson L B,Calleberg E,Gedin A.Correlations between activated charcoal,Fe-EDTA and other organic media ingredients in cultured anthers ofAnemonecanadensis[J].Physiologia Plantarum,1990,80(2):243-249.
27.Rogers A.Peonies:5th ed[M].Oregon:Timber Press,1995:91-105.
28.李萍,成仿云,张颖星.防褐剂对牡丹组培褐化发生、组培苗生长和增殖的作用[J].北京林业大学学报,2008,30(2):71-76.
Li P,Cheng F Y,Zhang Y X.Effects of browning antagonists on antibrowning,growth and multiplication of tissue culture of tree peony[J].Journal of Beijing Forestry University,2008,30(2):71-76.
29.Pan M J,Van Staden J.The use of charcoal in in vitro culture-A review[J].Plant growth regulation,1998,26(3):155-163.
30.Kuhne U,Gennerich S.Possibilities of improving in vitro rooting in pome and stone fruits[J].Gartenbauwissenschaft,1988,35(6):180-182.
31.卜学贤,陈维伦.活性碳对培养基中植物生长调节物质的吸附作用[J].植物生理学报,1998,14(4):401-405.
Bu X X,Chen W L.The effect of activated charcoal on the adsorption of plant regulators in culture medium[J].ActaPhytophysiologicaSinica,1988,14:401-405.
32.刘用生,曾兆云,王秀芹等,活性炭吸附作用的生物鉴定[J].植物生理学通讯,1995,31(2):123-126.
Liu Y S,Zeng Z Y,Wang X Q.The Biological Assay for the Adsorption of Activated Charcoal[J].Plant Physiology Communications,1995:123-125.
33.Takayama S,Misawa M.Differentiation inLiliumbulbscalesgrown in vitro.Effects of activated charcoal,physiological age of bulbs and sucrose concentration on differentiation and scale leaf formation in vitro[J].Physiologia Plantarum,1980,48(1):121-125.
34.王港,杨秀平,李周岐.活性炭对组织培养中几种植物激素的吸附作用[J].林业科技开发,2006,20(6):26-27.
Wang,Yang X P,Li Z Q.Absorption Effect of Activated Charcoal to Hormones during Plant Tissue Culture[J].China Forestry Science and Technology,2006,20(6):26-27.
35.何桂梅.牡丹远缘杂交育种及其胚培养与体细胞胚发生的研究[D].北京:北京林业大学,2006.
He G M.Studies on Distant Cross-breeding and Embryo in vitro Culture and Somatic Embryogenesis in Tree Peonies[D].Beijing:Beijing Forestry University,2006.
36.Bouza L,Jacques M,Miginiac E.Requirements for in vitro rooting ofPaeoniasuffruticosaAndr.cv.‘Mme de Vatry’[J].Scientiahorticulturae,1994,58(3):223-233.
37.曹小勇.濒危植物紫斑牡丹胚离体培养[J].氨基酸和生物资源,2003,25(2):35-36.
Cao X Y.In Vitro Culture of Embryo of Endangered PlantPaeoniarockii[J].Amino Acids and Biotic Resources,2003,25(2):35-36.

图版Ⅰ A~H.培养30 dCK、A1-7中胚苗;I.培养25 dA2胚苗根部具完整根毛;J.培养40 dA2培养基中胚苗;K.培养40 dA2试管外胚苗;L.移栽培养3个月后胚苗(新芽已出)Plate Ⅰ A-H. Embryo plantlets of treat CK,A1-7 after 30 d culture; I. Root of embryo plantlets of treat A2 have complete root hair after 25 d culture; J. Embryo plantlets of treat A2 after 40 d culture; K. Embryo plantlets outside the tube of treat A2 after 40 d culture; L. Embryo plantlets after transplanting for 3 months(There are new buds)
Beijing supports the common construction project in central University(2016GJ-02)
introduction:XU Li(1994—),female,master,Ornamental Plants and Horticulture.
date:2017-03-27
StudyonRapidSeedling-raisingTechnologyofTreePeonyEmbryoCulture
XU Li CHENG Fang-Yun*ZHONG Yuan
(College of Landscape Architecture,Beijing Forestry,National Flower Engineering Technology Research Center,Beijing 100083)
This study usedPaeoniaostii‘Fengdan’ andPaeoniarockiias explants, established efficient method of Seedling-raising of tree peony embryo culture through the study of hormones, light conditions, medium ingredients and activated carbon(AC) on the in vitro embryo culture. The main result: In vitro embryos radicle germination in 10 d, grow true leaves in 20 d, root system developed in 25 d, transplanting in 40 d, after 3 months the seedlings grow well in the medium of improved MS(calcium doubled)+0.2 g·L-1AC+0.5 mg·L-1GA+0.5 mg·L-1BA. Suitable medium for ‘Fengdan’: improved MS(calcium doubled,macroelement doubled)+0.6 g·L-1AC+1.0 mg·L-1GA; medium forP.rockii: improved MS(calcium doubled,macroelement doubled)+0.6 g·L-1AC+0.5 mg·L-1GA; The seedling rate of ‘Fengdan’ was 63.88%, the survival rate was 66.34%, and the rate of seedling ofP.rockiiwas 93.75%, and survival rates vary among breeds, with a maximum of 100%.
embryo culture;Paeoniaostii‘Fengdan’;Paeoniarockii;activated carbon
北京市支持中央在京高校共建项目(2016GJ-02)
徐莉(1994—),女,硕士研究生,主要从事园林植物与观赏园艺方面的研究。
* 通信作者:E-mail:chengfy@263.net
2017-03-27
* Corresponding author:E-mail:chengfy@263.net
S567.1+5
A
10.7525/j.issn.1673-5102.2017.05.008

