FMU100抗体的超高效液相色谱法定量检测方法的建立
胡 妍, 罗利群, 方树彬, 温振国
FMU100抗体的超高效液相色谱法定量检测方法的建立
胡 妍, 罗利群, 方树彬, 温振国
目的建立UPLC-protein A定量检测FMU100单克隆抗体的方法。方法使用Waters UPLC超高效液相色谱仪,Applied Biosystem的PA ImmunoDetection Sensor Cartridge(2.1×30 mm,20 μm)色谱柱,柱温30 ℃,检测波长280 nm,进样体积10 μL,以流动相A(10 mmol/L PBS含0.15 mmol/L NaCl, pH 7.2)-流动相B(0.15 mmol/L NaCl, pH 2.6)进行梯度洗脱,流速0.5 mL/min。结果在0.034~2.200 mg/mL浓度,线性相关系数r2为0.999 9,浓度与峰面积间呈良好的线性关系;检测限为0.01 mg/mL,定量限为0.07 mg/mL;回收率为98.18%~99.16%;重复性RSD为0.1%~1.9 %;在8 h内,每个2 h测定发酵液中抗体的含量,FMU100抗体峰面积RSD为1.8%;在流动相A pH变化±0.2、流动相B NaCl比例变化±5%、柱温变化±5 ℃、检测波长变化±5 nm、流速相对值变化±20%时,FMU100抗体峰峰面积RSD为1.7%(n=12);检测方法符合系统适应性要求。结论建立的UPLC-protein A定量检测FMU100抗体的方法简单快速、方法可靠,符合方法学验证要求。
色谱法,高压液相; 抗体
活化的T细胞上表达有许多的抑制受体[1],在肿瘤组织中可能被肿瘤利用形成免疫逃逸[2],利用封闭性抗体能调节T细胞活性,对肿瘤的治疗有非常好的效果[3]。FMU100为本单位基于此原理研制的新型人源化单克隆抗体。
高效液相色谱法(high performance liquid chromatography,HPLC)因具有定量精确、灵敏度高、重复性好、自动化程度高等特点,多用于单克隆抗体的含量测定[4-5]。超高效液相色谱(ultra high performance liquid chromatography,UPLC)是从HPLC基础上发展起来的,与HPLC方法比较,UPLC具有节约时间、分辨率更高、更节约溶剂等特点[6-7]。
本研究拟采用与免疫球蛋白上的Fc段特异性结合的protein A为填料的色谱柱作为分析柱[8-10],建立UPLC-protein A定量检测FMU100抗体的方法,并对该检测方法进行方法学研究。
1 材料与方法
1.1材料
1.1.1仪器 超高效液相色谱仪(UPLC H-class bio system,包括四元泵、自动进样器、四通道柱温箱,紫外检测器,Empower 3工作站,美国Waters公司),超声波清洗仪(SB25-12D,宁波新芝生物科技股份有限公司),手持式pH测量仪(SG 23,美国梅特勒-托利多仪器公司)。
1.1.2试剂 FMU100单克隆抗体的工作标准品(纯度为99.6%),由本单位提供。磷酸二氢钠(批号:BCBP2074V),二水磷酸氢钠(批号:BCBN1159V)均为美国Fluka公司。氯化钠(NaCl,批号:BCBN3108V),醋酸(批号:SZBF1200V)均为美国Sigma-Aldrich。实验用水为Milli-pore超纯水。
1.2方法
1.2.1流动相配制 流动相A(PBS,pH 7.2):0.13 g磷酸二氢钠,0.51 g二水磷酸氢二钠,3.50 g NaCl,用超纯水定容至400 mL。流动相B(0.15 mmol/L NaCl,pH 2.6):取1.75 g NaCl,加水溶解,用醋酸将pH调至2.6,用水定容至200 mL。流动相经0.22 μm滤膜过滤后超声5 min。
1.2.2供试品的前处理 取表达FMU100抗体的细胞培养液上清或者空白细胞基上清,10 000 r/min的转速离心10 min,取离心后的上清并转移至液相进样小瓶中。
1.2.3色谱条件 采用Applied Biosystem公司的PA ImmunoDetection Sensor Cartridge(2.1×30 mm,20 μm)色谱柱,柱温30 ℃,检测波长280 nm,进样体积10 μL,梯度洗脱条件如表1所示。
1.2.4方法学验证
1.2.4.1系统适用性试验 取FMU100抗体的细胞培养液上清,离心后,采用“1.2.3”的色谱条件进行分析,并重复进样6次。
1.2.4.2方法的专属性试验 取两种不同的细胞培养基,样品名称分别为“培养基”和“M”,另取表达FMU100单抗的2 L培养袋的细胞培养液上清和5 L发酵罐中的细胞培养液上清,这4种样品采用相同的前处理方法和色谱条件进行分离。
表1FMU100抗体的色谱梯度洗脱条件
Tab1FMU100 antibody chromatographic gradient elution conditions

tminv(mL·min-1)流动相A流动相B00.5100040.5100080.50100100.51000
1.2.4.3线性考察 取2.200 mg/mL的FMU100抗体工作标准品,用流动相A将对照品进行倍比稀释,制得0.034~2.200 mg/mL共7个浓度的溶液,采用“1.2.3”的色谱条件进行分析。
1.2.4.4检测限和定量限 将FMU100抗体的工作标准品进行不断稀释,以信噪比(s/n)=3时的进样浓度为检测限,以s/n=10时的进样浓度为定量限。
1.2.4.5准确度和精密度试验 取细胞培养液上清,平均分成4份,1份加入20%体积的空白培养基,其余3份分别加入20%体积的0.55,1.10,2.20 mg/mL的FMU100抗体工作标准品。4份样品采用相同的色谱条件进行分析,每个样品重复进样3次,计算回收率。配制高(1.650 mg/mL)、中(0.413 mg/mL)、低(0.110 mg/mL)3个浓度梯度的FMU100抗体工作标准品,采用相同的色谱条件,重复进样3次,计算3个浓度的工作标准品的精密度。
1.2.4.6溶液的稳定性和耐用性试验 取含有FMU100抗体的细胞培养液上清,离心处理后,分别于0,2,4,6,8 h进样,每次重复进样3次,总共15次,经计算,这15针样品峰面积的RSD,以考察溶液的稳定性。取含有FMU100抗体的细胞培养液上清,离心处理后,按照“1.2.3”的色谱条件进样2次,记录“FMU100”峰的峰面积,再分别记录流动相A pH变化± 0.2、流动相B NaCl比例变化±5%、柱温变化± 5 ℃、检测波长变化±5 nm、流速相对值变化± 20%时“FMU100”峰的峰面积,每个变化条件下重复进样2次,总共12次,计算这12针样品峰面积的RSD[11]。
2 结 果
2.1系统适用性考察结果 FMU100抗体的色谱图上出现2个明显的峰,第1个吸收峰在4 min内,为流穿峰,流穿色谱柱的物质为细胞培养液中的培养基或者不完整单抗,与色谱柱填料不结合,该峰命名为“unbound”峰。第2个在洗脱区出现的峰,即保留时间为4.91 min的色谱峰则为FMU100抗体的吸收峰,命名为“FMU100”峰。因为样品是未经纯化的细胞培养液上清,所以培养基中紫外吸收物质大于FMU100抗体的紫外吸收峰,即unbound峰峰面积大于FMU100峰的峰面积(图1)。对6次重复进样的FMU100峰进行积分分析,可得FMU100与unbound峰的分离度为40.11,FMU100峰的保留时间均为4.91 min,理论塔板数均值为21 915,峰面积的RSD为0.1%,符合2015版中国药典中高效液相色谱法的系统适应性试验要求,即分离度>1.5,重复性RSD<2%[12]。

图1 UPLC-protein A检测含FMU100抗体的细胞培养液色谱图Fig 1 Chromatograms of cell culture containing FMU100 antibody by UPLC-protein A
2.2方法的专属性结果 4种样品按照“1.2.4.2”方法进行色谱分离,两种不同的培养基均在平衡区固定位置出峰,在洗脱区不出峰,而两种不同培养方式表达的FMU100抗体均在洗脱区4.91 min的位置出峰,未结合的物质与培养基的出峰时间一致(图2)。UPLC-protein A分析FMU100抗体的方法不受干扰物质和培养方式的影响,均能专属特异性地检测出FMU100抗体。
2.3线性结果 随着抗体工作标准品浓度增大,“FMU100”峰的峰面积也随之增大,将浓度与峰面积之间进行线性拟合,得回归方程:
Y=800 285.54X-17 632.08,r2=0.999 9
说明二者之间存在良好的线性关系(图3)。
2.4检测限和定量限 当s/n=3时,FMU100抗体的检测限为0.01 mg/mL;当s/n=10时,FMU100抗体的检测限为0.07 mg/mL。
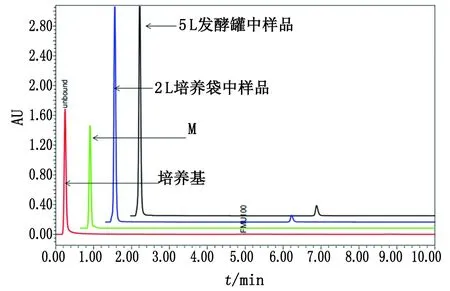
图2 UPLC-protein A专属性考察的色谱图Fig 2 Chromatograms of UPLC-protein A for the specificity test
2.5准确度和精密度试验结果 根据公式:回收率=(加入标品后含量-样品含量)/加入标品量×100%,分别加入了0.55,1.10,2.20 mg/mL的FMU100抗体工作标准品的回收率在98.18%~99.16%,说明该方法检测单克隆抗体准确度高(表2)。3种不同浓度的工作标准品重复进样3次后,计算出每种浓度下标准品3次峰面积的RSD值,经统计,3种标准品的峰面积RSD为0.1%~1.9%,<2%,说明UPLC-protein A定量检测方法精密度高[13]。

A:检测不同浓度的FMU100抗体理化对照品的色谱图;B:质量浓度与FMU100抗体峰面积的线性关系图.图3 不同浓度的FMU100抗体工作标准品的线性关系图Fig 3 Linear relationship of UPLC-protein A for detection seven different concentration of FMU100 antibody

ρ加入标品后含量/(mg·mL-1)ρ样品含量/(mg·mL-1)ρ加入标品量/(mg·mL-1)回收率/%平均回收率/%RSD/%1.0550.9460.1199.0999.090.31.0560.9470.1199.101.0600.9480.1199.081.1630.9460.2298.6398.180.91.1620.9470.2297.731.1640.9480.2298.181.3820.9460.4499.0999.160.21.3860.9470.4499.771.3820.9480.4498.63
RSD:相对标准偏差.
2.6溶液的稳定性和耐用性试验结果 根据溶液稳定性考察方法,每隔2 h重复进样3次,总计15次,经计算,这15次样品峰面积的RSD为1.8%,小于2%,说明样品溶液稳定。根据耐用性试验方法,每个变化条件下重复进样2次,总计12次,经计算,这12次样品峰面积的RSD为1.7%,说明UPLC-protein A定量检测方法的耐用性好。
3 讨 论
在单克隆抗体生产过程中,需快速了解发酵液中抗体表达量,以根据表达量数值对发酵液配方进行调整。发酵液中含有多种非目的性蛋白,对抗体含量测定存在干扰,采用BCA等方法进行含量测定,则需纯化抗体,消耗时间过长,不利于抗体生产中间过程的质量控制。采用UPLC-protein A方法能快速并特异地对发酵液和纯化液中的FMU100抗体进行定量分析。protein A色谱柱能特异性地与完整的单克隆抗体结合,而发酵液中非目的蛋白则流穿色谱柱。通过改变pH,将结合的抗体从色谱柱上洗脱下来进行定量分析,从而避免了杂质的影响。UPLC-protein A定量检测蛋白方法,耗时短(10 min),平衡和洗脱过程充分(20个柱体积),消耗溶剂少(3 mL流动相A,2 mL流动相B)。
本研究建立了UPLC-protein A定量检测FMU100抗体的方法,并进行了方法学验证,主要考察了系统适应性、专属性、线性、检测限和定量限、准确度、精密度、溶液稳定性和系统耐用性。经试验研究,UPLC-protein A定量检测方法能使杂质与抗体峰分离度达到40.11,重复进样得出,抗体峰面积RSD为0.1%;使用不同的空白培养基或者不同的培养方式表达的抗体,使用UPLC-protein A定量检测方法,杂质峰、抗体峰的保留时间固定;在0.034~2.200 mg/mL浓度范围内,线性相关系数r2为0.999 9,浓度与峰面积间呈良好的线性关系;检测限为0.01 mg/mL,定量限为0.07 mg/mL;回收率98.18%~99.16%;重复性RSD为0.1%~1.9%;在8 h内,每个2 h测定发酵液中抗体的含量,每次重复测3次,FMU100抗体峰面积RSD为1.8%;在流动相A pH变化± 0.2、流动相B NaCl比例变化±5%、柱温变化±5 ℃、检测波长变化±5 nm、流速相对值变化±20%时,每个变化条件下重复进样2次,FMU100抗体峰峰面积RSD为1.7%。以上数据表明,UPLC-protein A定量检测FMU100抗体的方法具有良好的系统适应性、专属性、准确度、精密度和系统耐用性,且样品溶液稳定,测定结果可靠,在0.034~2.200 mg/mL范围内,浓度与峰面积间呈良好的线性关系,可依据线性方程对未知样品定量检测;检测限为0.01 mg/mL,定量限为0.07 mg/mL。
本研究建立的UPLC-protein A定量检测FMU100抗体的方法,简单快速,方法可靠,而且符合方法学验证要求,可用于FMU100抗体生产过程中的含量测定和质量控制。
[1] Vassiliki A,Boussiotis M D.Molecular and biochemical aspects of the PD-1 checkpoint pathway[J].NewEnglJMed,2016,375(18):1767-1778.
[2] Brahmer J R,Drake C G,Wollner I,etal.Phase I study of single-agent anti-programmed death-1(MDX-1106)in refractory solid tumors:safety,clinical activity,pharmacodynamics,and immunologic correlates[J].JClinOncol,2010,28(19):3167-3175.
[3] Hirano F,Kaneko K,Tamura H,etal.Blockade of B7-H1 and PD-1 by Monoclonal Antibodies Potentiates Cancer Therapeutic Immunity[J].CancerRes,2005,65(3):1089-1096.
[4] 王军志.生物技术药物研究开发和质量控制[M].北京:科学出版社,2007:81-84.
[5] 国家药典委员会.中华人民共和国药典[M].2015版 三部.北京:中国医药科技出版社,2015:通则50-52.
[6] Gumustas M,Kurbanoglu S,Uslu B,etal.UPLC versus HPLC on drug analysis:advantageous, applications and their validation parameters[J].Chromatographia,2013,76(21):1365-1427.
[7] Nováková L,Matysová L,Solich P.Advantages of application of UPLC in pharmaceutical analysis[J].Talanta, 2006,68(3):908-918.
[8] Forsgren A,Sjöquist J.“Protein A” from S.Aureus I.Pseudo-immune reaction with humanγ-globulin[J].JImmunol,1966,97(6):822-827.
[9] Endresen C,Heggeness M,Grov A.Tryptic fragments of Fc from normal human IgG and their interaction with staphylococcal protein A[J].ScandJImmunol,1974,3(3):261-267.
[10] Hjelm H,Hjelm K,Sjöquist J.Protein A from Staphylococcus aureus.Its isolation by affinity chromatography and its use as an immunosorbent for isolation of immunoglobulins[J].FebsLetters,1972,28(1):73-76.
[11] 国家药典委员会.中华人民共和国药典[M].2015版 三部.北京:中国医药科技出版社,2015:通则23-25.
[12] 王军志.生物技术药物研究开发和质量控制[M].北京:科学出版社,2007:119-124.
[13] 国家药典委员会.中华人民共和国药典[M].2015版 四部.北京:中国医药科技出版社,2015:374-377.
EstablishmentofanUPLCQuantitativeMethodforFMU100Antibody
HUYan,LUOLiqun,FANGShubin,WENZhenguo
InstituteofImmuneTherapy,FacultyofPharmacy,FujianMedicalUniversity,Fuzhou,350122,China
Objective To establish an UPLC-protein A quantitative method for FMU100 antibody and verify the methodology.MethodsAn Applied Biosystem PA ImmunoDetection Sensor Cartridge (2.1×30 mm,20 μm)was installed in UPLC with following parameters: the column temperature at 30 ℃, the detection wavelength of 280 nm and injection volume of 10 μL. The column was equilibrated by 10 mmol/L PBS (containing 0.15 mmol/L NaCl,pH 7.2) as mobile phase A for 4 minutes, then eluted by 0.15 mmo/L NaCl (pH 2.6) as mobile phase B for 4 minutes, reequilibrated by mobile phase A for 2 minutes at last, and the flow rate was 0.5 mL per min.ResultsThe increase peak areas were proportional to the concentration of FMU100 antibody in the range of 0.034~2.2 mg per mL, with linear correlation coefficientr20.999 9. The LOQ was 0.1 μg and DOQ was 0.7 μg. The recovery was 98.18%~99.10%. The RSD of repeatability was 0.1%~1.9 %. From the detection of antibodies content in fermented liquid in 8 h, at interval of 2 h, FMU100 antibodies peak area RSD was 1.8%. In the condition that pH varied ± 0.2 in mobile phase A, sodium chloride concentration in the mobile phase B varied ±5%, the column temperature varied ± 5 ℃,and the flow rate varied ± 20%,and the RSD of peak area was 1.7%. The test method met the requirement of system suitability with excellent specificity.ConclusionThe results showed that UPLC-protein A method is simple , quick, reliable, and meet the requirement of system suitability, therefore this method can be used for content determination and quality control of FMU100 antibody in the process of production.
chromatography, high pressure liquid; antibodies
R392; R446.9; R977.6; R979.5
A
1672-4194(2017)05-0298-05
2017-04-06
福建省自然科学基金(2016J01154)
福建医科大学 药学院免疫治疗研究所,福州 350122
胡 妍,女,助理实验师,医学硕士
温振国. Email: wenzhenguo@fjmu.edu.cn
(编辑:张慧茹)

