温度、光照强度及渗透势对普通白菜下胚轴伸长的交互作用
王红飞 李福凯 尚庆茂,2*
(1农业部园艺作物生物学与种质创制重点实验室,中国农业科学院蔬菜花卉研究所,北京 100081;2环渤海湾地区设施蔬菜优质高效生产协同创新中心,辽宁沈阳 110866)
温度、光照强度及渗透势对普通白菜下胚轴伸长的交互作用
王红飞1李福凯1尚庆茂1,2*
(1农业部园艺作物生物学与种质创制重点实验室,中国农业科学院蔬菜花卉研究所,北京 100081;2环渤海湾地区设施蔬菜优质高效生产协同创新中心,辽宁沈阳 110866)
以翠白3号为试材,研究温度、光照强度及渗透势对普通白菜下胚轴长度、伸长速率的影响,进一步分析单一环境因子的影响效应及复合环境因子的交互作用。结果表明:在温度、光照强度、渗透势协同作用条件下,不同处理间普通白菜下胚轴长度及伸长速率差异达极显著水平,其中弱光×高温×低渗处理的下胚轴长度、伸长速率均达到最大值,强光×低温×高渗处理最小。光照强度对下胚轴伸长的调控作用在下胚轴快速伸长期、平缓伸长期及伸长停滞期均达到极显著水平,温度和渗透势的影响效应仅在下胚轴快速伸长期达到极显著水平。不同环境因子间存在交互作用,温度×光照强度、光照强度×渗透势的交互作用分别在下胚轴快速伸长期和平缓伸长期达到极显著水平,光照强度×温度×渗透势的三因子互作效应在下胚轴快速伸长期达到极显著水平。综上,光照强度是影响普通白菜下胚轴伸长的主效环境因子,且与温度和渗透势存在一定的交互作用,这种交互作用在普通白菜下胚轴快速伸长期和平缓伸长期效应达极显著水平。
普通白菜;下胚轴;环境因子;互作效应
普通白菜〔Brassica campestris L. ssp. chinensis(L.)Makino var. communis Tsen et Lee〕是十字花科芸薹属的重要蔬菜作物,在世界范围内广泛种植(Ge et al.,2014;刘林波 等,2016;Kayum et al.,2017)。在栽培过程中,受弱光、高温及高湿等环境诱导,光合产物在下胚轴过度配置,导致普通白菜幼苗徒长严重,植株细弱,抗逆能力差(Casal,2013;Procko et al.,2014)。
下胚轴是由成熟胚中顶端和基部分生组织之间的细胞发育而成,是根和茎的分界区域(郑相如和范雅兰,1998),下胚轴伸长是长期自然选择的结
果,受外界环境因子和内源激素的双重调控(姜楠等,2014)。弱光显著促进白菜下胚轴伸长,长度为对照的2倍(Procko et al.,2014);高温亦能显著促进拟南芥下胚轴伸长,长度是正常苗的2倍(Koini et al.,2009;Franklin et al.,2011;Proveniers & van Zanten,2013);基质含水量过高会促进不结球白菜下胚轴伸长,在弱光条件下尤为明显,而在强光作用条件下这种促进作用并不显著(徐磊 等,2009)。光照强度对下胚轴伸长的调控主要依赖于光受体,红光受体PHY B受光激发后,由生理失活型Pr转化为生理活跃型Pfr,并由细胞质迁移至细胞核,在细胞核中与PIFS结合,促使PIFS磷酸化 降 解(Kircher et al.,1999;Leivar et al.,2008;Jeong & Choi,2014)。PIFs是一类bHLH转录因子,能促使生长素合成限速酶基因TAA1、YUC8/9的表达量提高,通过提高拟南芥子叶源IAA含量促进下胚轴伸长(Mashiguchi et al.,2011;Sun et al.,2012)。高温对下胚轴伸长的调控机制与光照强度相同,但作用方式相反,高温促使PHYB由生理活跃型Pfr向生理失活型Pr转变,并迁出细胞核,PIFs在细胞核中的积累量增加(Halliday & Davis,2016;Jung et al.,2016)。
虽然目前已有大量关于下胚轴伸长机制的报道(Srivastava et al.,2015;Pedmale et al.,2016;Zheng et al.,2016),但已有研究主要集中在环境因子对蔬菜幼苗生理代谢的影响及单一环境因子调控下胚轴伸长机制等方面,未见复合环境因子调控下胚轴伸长交互作用的报道。本试验以普通白菜品种翠白3号为试材,采用完全正交设计的方法,分析温度、光照强度及渗透势影响普通白菜下胚轴伸长及伸长速率的主效应、二因素互作效应、三因素互作效应,明确在下胚轴不同伸长阶段发挥关键作用的环境因子及互作效应,以提高白菜类蔬菜幼苗栽培管理技术,防止幼苗徒长。
1 材料与方法
1.1 试验材料
试验于2016年4月在中国农业科学院蔬菜花卉研究所进行,供试材料为对环境条件敏感、下胚轴易伸长的普通白菜品种翠白3号,由中国农业科学院蔬菜花卉研究所白菜课题组育成,在人工气候箱内进行培养。
1.2 试验设计
选取饱满一致的种子(粒径>1.5 mm),28℃恒温催芽,胚根突出种皮1 mm后,播于填装120 g园艺级蛭石的透明塑料盒内(长×宽×高=19 cm×13 cm×7.5 cm),播种间距为2 cm,每盒播种量为40粒,播种完毕后覆盖30 g粒径≤2 mm的蛭石,并以顶部灌溉的方式浇灌1/2 Hoagland营养液150 mL,置于人工气候箱内,25 ℃恒温培养36 h。
幼苗出土后,进行温度、光照强度及营养液渗透势的三因素两水平正交试验(表1),光照强度:强光,250 μmol·m-2·s-1;弱光,60 μmol·m-2·s-1。温度:高温,28 ℃;低温,21 ℃。渗透势:高渗,-0.15 MPa;低渗,-0.05 MPa;低渗处理于幼苗出土后浇灌1/2 Hoagland营养液200 mL,高渗处理浇灌含14% PEG6000的1/2×Hoagland营养液200 mL。
1.3 指标测定
采用直尺测量法,逐日测量下胚轴长度(基质表面至子叶节长度)。
利用Microsoft Excel 2007软件整理试验数据并计算下胚轴的日伸长速率;利用SAS 9.2软件进行单因子方差分析和复因子方差分析。

表1 试验设计
2 结果与分析
2.1 温度、光照强度及渗透势对普通白菜下胚轴伸长的影响
在温度、光照强度、渗透势协同作用条件下,不同处理间普通白菜下胚轴长度差异达极显著水平(图1),其中弱光×高温×低渗处理的下胚轴最长,强光×低温×高渗处理的下胚轴最短。
温度、光照强度和渗透势对普通白菜下胚轴伸长速率的影响与下胚轴长度相同(表2),弱光×高温×低渗处理的下胚轴伸长速率最大,强光×低温×高渗处理的下胚轴伸长速率最小。在观测时间范围内,下胚轴伸长速率逐渐降低,第1夭伸长速率最大,为下胚轴的快速伸长期(S1);2~4 d伸长速率明显下降,但总体上维持在较高水平,为平稳伸长期(S2);5~8 d下胚轴以极低的速率伸长,为伸长停滞期(S3)。

图1 不同温度、光照强度及渗透势对普通白菜下胚轴长度的影响

表2 不同温度、光照强度及渗透势对普通白菜下胚轴伸长速率的影响
2.2 温度、光照强度及渗透势对普通白菜下胚轴长度的交互作用
2.2.1 主效应分析 由表3可知,温度、光照强度及渗透势对普通白菜下胚轴伸长的影响均达到极显著水平(P<0.000 1),从光照强度方面来看,弱光处理极显著促进下胚轴伸长,下胚轴长度较强光处理增加1.39 cm;从温度方面来看,高温处理下胚轴长度比低温处理极显著增加0.59 cm;从营养液渗透势方面来看,低渗处理极显著促使下胚轴长度增加0.39 cm。可见,光照强度对普通白菜下胚轴伸长的影响效应明显高于温度和渗透势,是调控普通白菜下胚轴伸长的主效环境因子。

表3 影响普通白菜下胚轴伸长的主效环境因子分析
2.2.2 二因素互作分析 由表4可知,光照强度×温度、温度×渗透势、光照强度×渗透势影响普通白菜下胚轴伸长的交互作用均达到极显著水平,且光照强度×温度的互作效应(P<0.000 1)强于光照强度×渗透势(P=0.004 4)、温度×渗透势(P=0.002 4)的互作效应。
在光照强度和温度互作效应中,同一光照强度条件下温度对普通白菜下胚轴长度的影响达到极显著水平。在弱光条件下,高温促使下胚轴长度增加0.85 cm;而在强光作用条件下,增加量仅为0.32 cm。
在光照强度和渗透势互作效应中,弱光低渗条件下普通白菜下胚轴较弱光高渗条件下极显著增加0.53 cm;在强光作用条件下,低渗促使下胚轴极显著伸长0.24 cm。表明低渗能促进普通白菜下胚轴伸长,在弱光条件下作用效果尤其明显。
温度和渗透势的交互作用达到极显著水平,效应值为0.31 cm。高温低渗处理的普通白菜下胚轴长度极显著高于高温高渗处理。在低温条件下,低渗促使下胚轴极显著伸长0.23 cm;而在高温条件下,低渗能促使下胚轴极显著伸长0.54 cm。表明高温能增强渗透势对普通白菜下胚轴伸长的促进作用。

表4 影响普通白菜下胚轴伸长的二因素互作分析
2.2.3 三因素互作分析 由表5可知,在温度×光照强度×渗透势协同作用条件下,普通白菜下胚轴长度差异达极显著水平。在弱光高温条件下,渗透势对下胚轴长度的效应值为0.87 cm,而在弱光低温条件下仅为0.18 cm,此时温度和渗透势互作效应极显著,促使下胚轴长度增加0.69 cm。在强光条件下,高温和低渗均能极显著促进下胚轴伸长,在强光高温协同作用条件下,低渗促使下胚轴长度极显著增加0.21 cm;在强光低温条件下,低渗促使下胚轴长度增加0.26 cm,二者差异未达到极显著水平。表明在弱光条件下,温度和渗透势间的交互作用对普通白菜下胚轴伸长的影响效应达到极显著水平;但在强光条件下,二者的互作效应未达到极显著水平。
2.3 温度、光照强度及渗透势对普通白菜下胚轴伸长速率的交互作用
依据伸长速率,普通白菜下胚轴伸长可以分为快速伸长期(S1,1 d)、平稳伸长期(S2,2~4 d)及伸长停滞期(S3,5~8 d),各环境因子在不同时期的作用效果不同。
2.3.1 主效应分析 在普通白菜下胚轴伸长过程中,温度、光照强度及渗透势的效应值随下胚轴伸长速率降低而降低(表6)。在S1、S2、S3期,光照强度对下胚轴伸长速率的影响均达到极显著水平;温度和渗透势对下胚轴伸长速率的影响均仅在S1、S2期达到极显著水平。综上,光照强度是影响普通白菜下胚轴伸长速率的主效环境因子,其影响效应在S1、S2、S3期均达到极显著水平。
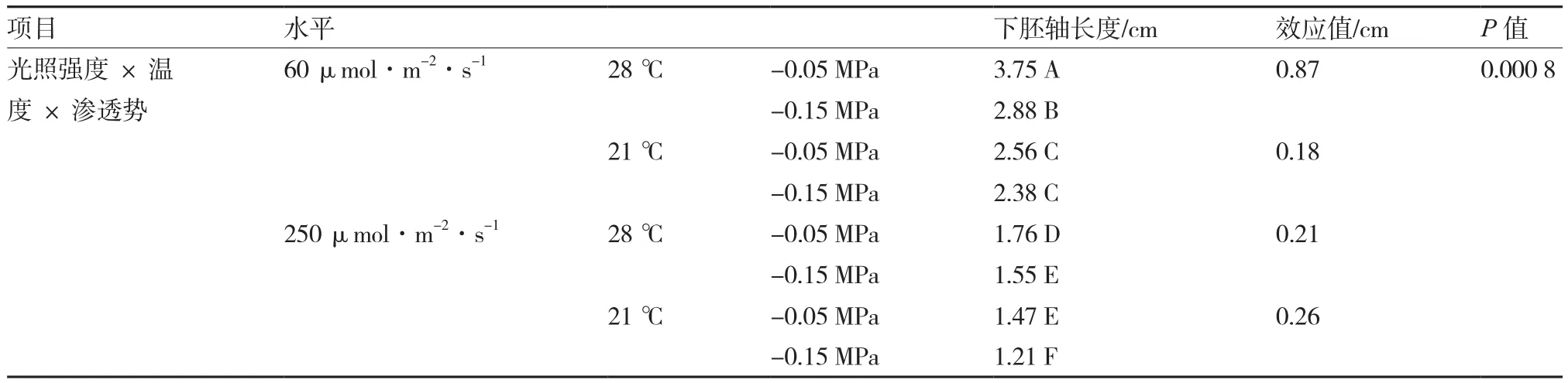
表5 影响普通白菜下胚轴伸长的三因素互作分析

表6 影响普通白菜下胚轴伸长速率的主效环境因子分析
2.3.2 二因素互作分析 光照强度×温度、光照强度×渗透势、温度×渗透势对普通白菜下胚轴伸长速率的影响存在一定的互作效应,其中光照强度×温度互作效应达到极显著水平(表7)。
光照强度×温度的互作效应在S2期达到极显著水平,效应值为0.14 cm·d-1。在弱光条件下,高温能极显著提高S1、S2期的下胚轴伸长速率;在强光条件下,高温仅能极显著提高S2期下胚轴伸长速率。
光照强度×渗透势的互作效应仅在S1期达到极显著水平;在S2期,低渗对下胚轴伸长速率的提高作用仅在弱光条件下达极显著水平;在S3期,营养液渗透势的改变对下胚轴伸长速率的影响未达极显著水平。
温度×渗透势的互作效应对S1和S2期的下胚轴伸长速率的影响部分达极显著水平。在S1期,低渗能极显著提高下胚轴伸长速率,但高温高渗和低温低渗条件下的下胚轴伸长速率差异未达极显著水平;在S2期,低渗仅能极显著提高高温条件下的下胚轴伸长速率;在S3期,下胚轴伸长速率较低,对温度和渗透势的变化不敏感。
2.3.3 三因素互作分析 温度×光照强度×渗透势存在一定互作效应(表8)。弱光高温条件下,低渗能极显著提高S1和S2期普通白菜下胚轴伸长速率;但在低温条件下,这种促进作用未达极显著水平。在强光条件下,温度和渗透势互作对S1、S2、S3期下胚轴伸长速率的影响效应均未达极显著水平。

表7 影响普通白菜下胚轴伸长速率的二因素互作分析
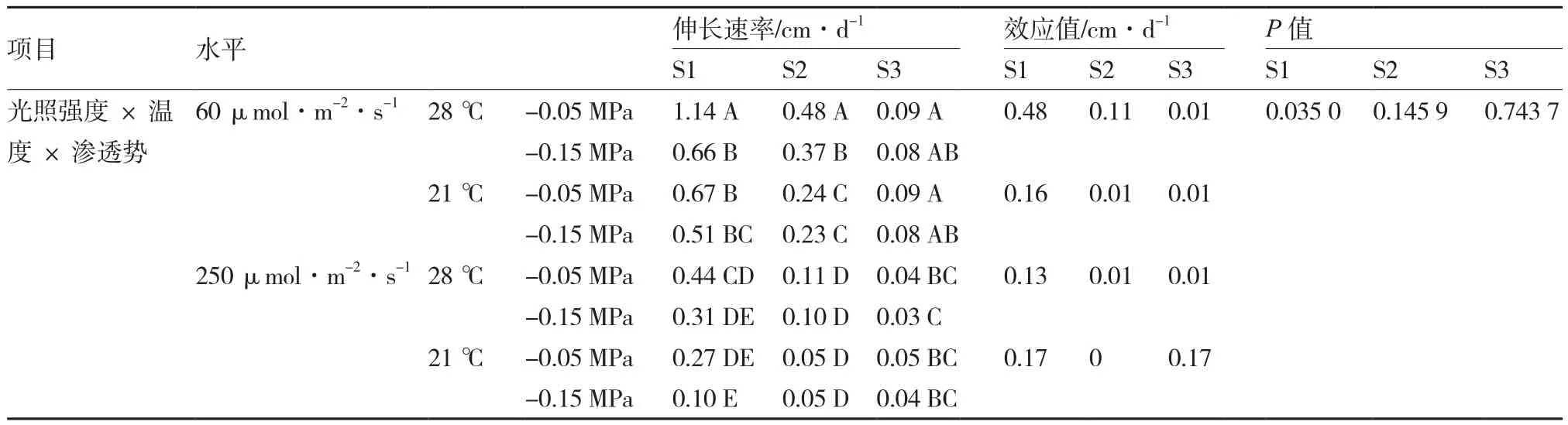
表8 影响普通白菜下胚轴伸长速率的三因素互作分析
3 结论与讨论
下胚轴长度是植物形态建成的重要标志,也是衡量蔬菜幼苗是否健壮的重要指标,在幼苗生长过程中易受高温、弱光和高湿等外界环境因子的影响而使下胚轴过度伸长(de Wit et al.,2014;Pedmale et al.,2016)。
在蔬菜生产过程中,番茄、甜瓜、不结球白菜、黄瓜等蔬菜作物徒长现象普遍存在(侯兴亮 等,2002;毛炜光 等,2007;徐磊 等,2009;周学超等,2010)。为防止幼苗徒长,需要深入了解环境因子在下胚轴伸长过程中的影响效应,为提高蔬菜苗期管理技术提供参考。本试验通过进一步分析发现,弱光、高温、低渗对普通白菜下胚轴伸长的影响主要是通过改变伸长速率影响下胚轴长度,对下胚轴伸长期并无明显影响。幼苗出土后1 d下胚轴伸长速率最大,之后伸长速率迅速下降,在2~4 d呈逐渐降低的趋势,但总体维持在较高水平,5~8 d伸长速率在低水平下维持平衡,下降幅度不明显,这与前人的研究结果一致(Gendreau et al.,1997;Paque et al.,2014)。
周学超等(2010)研究表明,温光协同作用条件下黄瓜下胚轴长度差异显著,且弱光高温条件下的下胚轴长度显著高于其他处理。在低温弱光下,甜瓜幼苗株高反而较高温强光条件下有所降低(李静,2012)。基质含水量和光照强度在调控幼苗下胚轴伸长过程中存在互作效应,高基质含水量能促进不结球白菜下胚轴伸长,在弱光条件尤为明显(徐磊 等,2009)。本试验中,光照强度×温度、光照强度×渗透势、温度×渗透势的交互作用对普通白菜下胚轴伸长的影响均达到极显著水平,在一定光照强度、温度条件下,高温、低渗均能极显著促进下胚轴伸长,且这种促进作用在弱光、高温条件下更为明显,这与徐磊等(2009)的研究结果一致。
本试验首次分析了温度、光照强度及渗透势对普通白菜下胚轴伸长的影响效应,并认为光照强度是调控下胚轴伸长的主效环境因子;此外,3种环境因子间存在交互作用,且在下胚轴快速伸长期和平稳伸长期效应达极显著水平,这对生产实践具有重要指导意义。在实际蔬菜栽培过程中,如有阴雨雾霾等障碍夭气连续出现,要适时补光,严格控制设施环境中的温度和湿度,尤其是在幼苗生长发育早期,避免因弱光、高温和高湿环境交互作用导致幼苗严重徒长。
姜楠,王超,潘建伟.2014.拟南芥下胚轴伸长与向光性的分子调控机理.植物生理学报,50(10):1435-1444.
侯兴亮,李景富,许向阳.2002.弱光处理对番茄不同生育期形态和生理指标的影响.园艺学报,29(2):123-127.
李静.2012.低温弱光胁迫对甜瓜幼苗生长及生理指标的影响.河南农业科学,41(5):106-109.
刘林波,孙万仓,刘自刚,武军艳,方彦,李学才,曾秀存,杨刚,董云,陈奇,方园,袁金海.2016.白菜型冬油菜抗寒相关性状的遗传分析.中国农业科学,49(21):4085-4095.
毛炜光,吴震,黄俊,郭世荣.2007.水分和光照对厚皮甜瓜苗期植株生理生态特性的影响.应用生态学报,18(11):2475-2479.
徐磊,蒋芳玲,吴震,王加倩,周学超.2009.基质含水量和光照强度对不结球白菜生长和品质的影响.江苏农业学报,25(4):865-870.
郑相如,范雅兰.1998.胚轴——有胚植物的一种特殊结构.生物学通报,33(5):10-11.
周学超,蒋芳玲,明村豪,胡宏敏,蒋倩,吴震.2010.不同温光处理对黄瓜幼苗生长及光合色素含量的影响.江西农业学报,22(12):20-25.
Casal J J.2013.Photoreceptor signaling networks in plant responses to shade.Annual Review of Plant Biology,64:403-427.
de Wit M,Lorrain S,Fankhouser C.2014.Auxin-mediated plant architectural changes in response to shade and high temperature.Physiologia Plantarum,151:13-24.
Franklin K A,Lee S H,Patel D,Kumar S V,Spartz A K,Gu C,Ye S,Yu P,Breen G,Cohen J D,Wigge P A,Gray W M.2011.PHYTOCHROME-INTERACTING FACTOR 4(PIF4)regulates auxin biosynthesis at high temperature.Proceedings of the National Academy of Sciences of the United States of America,108(50):20231-20235.
Ge F W,Tao P,Zhang Y,Wang J B.2014.Characterization of AQP gene expressions in Brassica napus during seed germination and in response to abiotic stresses.Biologia Plantarum,58(2):274-282.
Gendreau E,Traas J,Desons T,Grandjean O,Caboche M,Höfte H.1997.Cellular basis of hypocotyl growth in Arabidopsis thaliana.Plant Physiology,114:295-305.
Halliday K J,Davis S J.2016.Light-sensing phytochromes feel the heat.Science,354(6314):832-833.
Jeong J,Choi G.2014.Phytochrome-interacting factors have both shared and distinct biological roles.Molecules and Cells,35(5):371-380.
Jung J H,Domijan M,Klose C,Biswas S,Ezer D,Gao M,Khattak A K,Box M S,Charoensawan V,Cortijo S,Kumar M,Grant A,Locke J C,Schäfer E,Jaeger K E,Wigge P A.2016.Phytochromes function as thermosensors in Arabidopsis.Science,354(6314):886-889.
Kayum M A,Park J I,Nath U K,Biswas M K,Kim H T,Nou I S.2017.Genome-wide expression profiling of aquaporin genes confer responses to abiotic and biotic stresses in Brassica rapa.BMC Plant Biology,17(1):23-40.
Kircher S,Kozma-Bognar L,Kim L,Adam E,Harter K,Schäfer E,Nagy F.1999.Light quality-dependent nuclear import of the plant photoreceptors phytochrome A and B.The Plant Cell,11:1445-1456.
Koini M A,Alvey L,Allen T,Tilley C A,Harberd N P,Whitelam G C,Franklin K A.2009.High temperature-mediated adaptations in plant architecture require the bHLH transcription factor PIF4.Current Biology,19:408-413.
Leivar P,Monte E,Oka Y,Liu T,Carle C,Castillon A,Huq E,Quail P H.2008.Multiple phytochrome-interacting bHLH transcription factors repress premature seedling photomorphogenesis in darkness.Current Biology,18(23):1815-1823.
Mashiguchi K,Tananka K,Sakai T,Sugawara S,Kawaide E H,Natsume M,Hanada A,Yaeno T,Shirasu K,Yao H,Mcsteen P,Zhao Y,Hayashi K,Kamya Y,Kasahara H.2011.The main auxin biosynthesis pathway in Arabidopsis.Proceedings of the National Academy of Sciences of the United States of America,108(45):18512-18517.
Paque S,Mouille G,Grandont L,Alabad í D,Gaertner C,Goyallon A,Muller P,Primard-Brisset C,Sormani R,Bl á zquez M A,Perrot-Rechenmann C.2014.AUXIN BINDING PROTEIN1 links cell wall remodeling,auxin signaling,and cell expansion in Arabidopsis.The Plant Cell,26:280-295.
Pedmale U V,Huang S S,Zander M,Cole B J,Hetzel J,Ljung K,Reis P A,Sridevi P,Nito K,Nery J R,Ecker J R,Chory J.2016.Cryptochromes interact directly with PIFs to control plant growth in limiting blue Light.Cell,164:233-245.
Procko C,Crenshaw C M,Ljung K,Noel J P,Chory J.2014.Cotyledon-generated auxin is required for shade-induced hypocotyl growth in Brassica rapa.Plant Physiology,165:1285-1301.
Proveniers M C G,van Zanten M.2013.High temperature acclimation through PIF4 signaling.Trends in Plant Science,8(2):1360-1385.
Srivastava A K,Senapati D,Srivastava A,Chakraborty M,Gangappa S N,Chattopaghyay S.2015.Short hypocotyl in white light1 interacts with Elongated Hypocotyl5(HY5)and Constitutive Photomorphogenic1(COP1)and promotes COP1-mediated degradation of HY5 during Arabidopsis seedling development.Plant Physiology,169:2922-2934.
Sun J,Qi L,Li Y,Chu J,Li C.2012.PIF4-mediated activation of YUCCA8 expression integrates temperature into the auxin pathway in regulating Arabidopsis hypocotyl growth.PLoS Genetics,8(3):e1002594.
Zheng Z Y,Guo Y X,Nov á k O,Chen W,Ljung K,Noel J P,Chory J.2016.Local auxin metabolism regulates environment-induced hypocotyl elongation.Nature Plants,21(2):1-9.
Interaction of Temperature,Light Intensity and Osmotic Potential on Brassica campestris L. ssp. chinensis(L.)Makino var. communis Tsen et Lee Hypocotyl Elongation
WANG Hong-fei1,LI Fu-kai1,SHANG Qing-mao1,2*
(1Key Laboratory of Biology and Genetic Improvement of Horticultural Crops,Ministy of Agriculture,Institute of Vegetables and Flowers,Chinese Academy of Agriculture Sciences,Beijing 100081,China;2Collaborative Innovation Center for Superior Quality and High Efficient Production of Protected Vegetable Surround Bohai Gulf Region,Shenyang 110866,Liaoning,China)
This experiment took Brassica campestris L.ssp.chinensis(L.)Makino var.communis Tsen et Lee‘Cuibai No.3’as material and investigated the effect of temperature,light intensity and osmotic potential on the length and elongation rate of hypocotyl.The paper also analyzed the influential effect of single environmental factor and its interaction with compound environmental factor.The results indicated that there existed extreme significant differences in length and elongation rate of hypocotyl,and the length and elongation rate reached maximum under the treatment of high temperature,low light and low permeability,and it was minimum under the treatment of low temperature,high light and high permeability.Illumination intensity could regulate Brassica campestris L.ssp.chinensis(L.)Makino var.communis Tsen et Lee hypocotyl elongation significantly in the stages of rapid elongation,gentle elongation and lag growth,while temperature and osmotic potential only had significant effect in the stage of rapid elongation.Interactions were existed among the 3 environmental factors.The interaction existed among different environment factors.The interaction between temperature×Illumination intensity,and Illumination intensity×osmotic potential reaced significant level in the stage of gentle and rapid elongation period, respectively.The interaction effects of illumination intensity×temperature×osmotic potential reached significant level in rapid elongation stage.In conclusion,illumination intensity was the major environment factor for hypocotyl elongation,and had certain interaction with temperature and osmotic potential.This interaction had significant effect in rapid and gentle elongation stages.
Brassica campestris L.ssp.chinensis(L.)Makino var.communis Tsen et Lee;Hypocotyl;Environmental fact;Interaction
王红飞,女,博士研究生,主要从事白菜下胚轴伸长机制研究,E-mail:wanghongfei0329@163.com
*
(Corresponding author):尚庆茂,男,研究员,博士生导师,主要从事蔬菜栽培生理及分子生物学研究,E-mail:shangqingmao@caas.cn
2017-06-14;接受日期:2017-08-25
国家自然科学基金项目(31172001),国家现代农业产业技术体系建设专项(CARS-25),公益性行业(农业)科研专项(201303014),中国农业科学院科技创新工程项目(CAAS-ASTIPIVFCAAS),现代农业人才支撑计划项目(2016)

