PAI-1对气道平滑肌增殖和ERK表达的影响
王亮,朱述阳,于晨希,刘文静,朱洁晨
(徐州医科大学附属医院 呼吸内科,江苏 徐州 221006)
PAI-1对气道平滑肌增殖和ERK表达的影响
王亮,朱述阳,于晨希,刘文静,朱洁晨
(徐州医科大学附属医院 呼吸内科,江苏 徐州 221006)
目的 探讨纤溶酶原激活物抑制物-1(PAI-1)对气道平滑肌增殖的调控作用,以及对细胞外调节蛋白激酶(ERK)表达的影响。方法 体外培养小鼠气道平滑肌细胞(ASMCs)并分为7组:空白对照组、PAI-1 5 μg/L 组、PAI-1 10 μg/L 组、PAI-1 20 μg/L 组、PAI-1 40 μg/L 组、PAI-1 80 μg/L 组、PAI-1 100 μg/L组。放入37℃培养箱分别培养12、24和48 h,采用CCK-8检测ASMCs的A值,计算增殖率。以增殖率最高的实验组的浓度和作用时间作为PAI-1作用最适浓度和最适作用时间,进一步分6组:A组(空白对照);B组(PAI-1 20 μg/L);C 组(PAI-1 40 μg/L);D 组(PAI-1 80 μg/L);E 组(PAI-1 100 μg/L);F 组(PAI-1 最适浓度+ERK通道抑制剂PD98059 10 μmol/L),用CCK-8检测ASMCs的增殖,Western blot检测ERK蛋白的表达,实时荧光定量聚合酶链反应检测ERK mRNA的表达。结果 5~100 μg/L PAI-1作用ASMCs 12、24和48 h后细胞增殖率结果显示,在相同浓度下,不同时间各组比较,差异有统计学意义(P<0.05),以48 h时ASMCs增殖率最高;在相同时间下,不同浓度各组比较,差异有统计学意义(P<0.05),80 μg/L PAI-1的ASMCs增殖率最高;故选取48 h为最适作用时间,80 μg/L为最适浓度进行后续实验。再次分组的实验结果表明,B、C、D、E组的ERK磷酸化水平和ERK mRNA的相对表达量与A组比较,差异有统计学意义(P<0.05),B、C、D、E组增高;B、C、D、E组两两比较结果显示,除B组与E组比较,差异无统计学意义(P>0.05)外,其余各组两两比较,差异有统计学意义(P<0.05),当PAI-1浓度波动于20~80 μg/L时,ERK磷酸化水平和ERK mRNA相对表达量随浓度升高而增高,>80 μg/L后则不再增高;加入PD98059的F组与D组比较,差异有统计学意义(P<0.05),ERK磷酸化水平和ERK mRNA表达降低。结论 外源性PAI-1可以通过促进ERK通路的表达,进而促进ASMCs的增殖。
纤溶酶原激活物抑制物-1;细胞外调节蛋白激酶;气道平滑肌细胞;哮喘
哮喘是一种以慢性气道炎症为特征的异质性疾病[1]。哮喘的反复发作可引起气道重塑,导致不可逆气流受限及持续性非特异性支气管高反应性,因此气道重塑被认为是除气道慢性炎症之外,哮喘的另一个主要特征。哮喘的气道重塑主要表现为气道平滑肌细胞(airway smooth muscle cell,ASMCs)量的增加、上皮细胞增生、杯状细胞化生、网状基底膜增厚、血管生成等[2]。其中,ASMCs量的增加是气道重塑最重要的影响因素,而参与该环节的机制中包含ASMCs增殖、肥大及迁移[3]。纤溶酶原激活物抑制物-1(plasminogen activator inhibitor-1,PAI-1)是丝氨酸蛋白酶抑制剂家族成员之一,是尿激酶型纤溶酶原激活物和组织型纤溶酶原激活物主要的生理抑制剂。在细胞周期中,PAl-1转录水平的变化及其在细胞内的积聚对细胞形态的维持、细胞与其间质的黏附、细胞增殖、信号转导及基因表达等都有重要意义[4]。已有临床研究和体外实验发现,PAI-1在哮喘发病及气道重塑中发挥重要作用[5-8]。本研究旨在观察PAI-1小鼠ASMCs中细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)通路的干预作用,从细胞分子水平研究PAI-1对体外培养的小鼠ASMCs增殖的影响。
1 材料与方法
1.1 实验材料
清洁级雌性BALB/c小鼠11只、体重20~24 g(徐州医学院实验动物中心提供),PAI-1(大连美仑生物技术有限公司),α-平滑肌肌动蛋白(α-smooth muscle actin,α-SMA)(武汉博士德生物工程有限公司),活细胞计数法(cell counting kit-8,CCK-8)试剂盒(上海碧云天生物技术研究所),兔抗甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)(杭州贤至生物有限公司),兔抗ERK(武汉三鹰生物技术有限公司),兔抗p-ERK(美国CST公司),ERK激酶抑制剂PD98059(美国Sigma-Aldrich公司),辣根过氧化物酶标记的山羊抗兔二抗(武汉博士德生物工程有限公司),Trizol裂解液(北京艾德莱生物科技有限公司),dNTP Mixture(北京天根生化科技有限公司),2×All-in-oneTMqPCR Mix(美国Vazvme公司),Ex Taq、DL2000 DNA Marke(日本 TaKaRa公司)。
1.2 方法
1.2.1 ASMCs的培养及鉴定 无菌分离小鼠气道平滑肌组织,采用贴壁法培养原代ASMCs[9];用胰酶消化法进行传代,并自然纯化[9],实验用第4和5代。培养的ASMCs采用免疫组织化学法检测α-SMA的表达,并进行鉴别。
1.2.2 CCK-8法 取上述对数生长期细胞,用含15%胎牛血清改良伊格尔培养基(dulbecco's modified eagle medium,DMEM),将细胞密度调整到1×105个 /ml,接种于 96 孔板,100 μl/孔,在周边加入100 μl无菌磷酸盐缓冲溶液。培养24 h后,换不含血清的DMEM培养24 h,使细胞生长同步于G0期。根据不同处理方法将细胞分为7组:空白对照组、PAI-1 5μg/L组、PAI-1 10μg/L组、PAI-1 20μg/L组、PAI-1 40 μg/L 组、PAI-1 80 μg/L 组、PAI-1 100 μg/L组,每组重复7次,放入37℃培养箱分别培养12、24和48 h。按照每孔培养基总体积的10%加入CCK-8溶液,继续孵育4 h,用酶标仪测定450 nm处的吸光度值,依据公式计算增殖率,增殖率=(A处理组/A阴性对照组-1)×100%。再根据以上7个实验组的增殖率结果,以增殖率最高的实验组的浓度和作用时间作为PAI-1作用最适浓度和最适作用时间,进一步分6组进行后续检测,具体分组如下:A组(空白对照组);B组(PAI-1 20 μg/L);C 组(PAI-1 40 μg/L);D 组(PAI-1 80 μg/L);E 组(PAI-1 100 μg/L);F组(PAI-1 最适浓度+ERK通道抑制剂PD98059 10μmol/L)。
1.2.3 Western blot检测 ASMCs按上述A、B、C 3组干预后,倒掉培养液,洗涤细胞3次,加入无线电免疫沉淀裂解液和苯甲基磺酰氟混合物,置于冰上裂解30 min,刮下细胞移至1.5 ml离心管中,4℃、12 000 r/min离心5 min,取上清液,聚氰基丙烯酸正丁酯法测定蛋白浓度。取40 μg样品蛋白进行聚丙烯酰胺凝胶电泳,然后将蛋白转移至聚偏氟乙烯膜上,用含5%脱脂奶粉的三羟甲基氨基甲烷缓冲盐溶液(tris buffered saline and tween 20,TBST)(封闭液)浸泡聚偏氟乙烯膜,室温摇床封闭2 h,加入GAPDH 一抗(1∶1 000)、ERK 一抗(1∶5 000)、p-ERK 一抗(1∶2 000),4℃孵育过夜,TBST 洗膜 5或6次,5 min/次,加入辣根过氧化物酶标记的羊抗兔二抗(1∶5 000),37℃摇床孵育 2 h,再次洗膜,滴加增强化学发光试剂显影,曝光成像,用Band Scan分析胶片灰度值。
1.2.4 实时荧光定量聚合酶链反应(quantitative real-time polymerase chain reaction,qRT-PCR) 收集各组细胞,采用Trizol法提取细胞总RNA,逆转录为cDNA,于-20℃冰箱冷藏保存。以β-actin作为内参基因,qRT-PCR检测ERK mRNA的相对表达量。β-actin正向引物:5'-CCCATCTATGAGGGTTA CGC-3',反向引物:5'-TTTAATGTCACGCACGATTT C-3';ERK 正向引物:5'-GGCTTTCTGACCGAGTATG TG-3',反向引物:5'-TTTAGGTCCTCTTGGGATGG-3'。总反应体系20 μl,主要反应条件:95℃预变性10 min,95℃变性 30 s,60℃退火 30 s,共 40 个循环后进行溶解曲线检测。每个反应管内的荧光信号达到设定的阈值时所经历的循环数定义为Ct值;每对引物在每个模板中做3个重复管,得到的Ct值取平均值,每个目的基因的Ct平均值减去对应模板的内参基因的Ct平均值,得到△Ct。根据公式ΔCt=(Ct目的基因-Ct内参基因)和ΔΔCt=(ΔCt研究组-ΔCt对照组),最终数据以2-△△Ct进行分析。
1.3 统计学方法
数据分析采用SPSS 20.0和Graph Pad 5.1统计软件,计量资料以均数±标准差(±s)表示,多组比较用单因素方差分析或重复测量设计的方差分析,进一步两两比较用LSD-t法,P<0.05为差异有统计学意义。
2 结果
2.1 ASMCs的鉴定
倒置光学显微镜下观察,培养的小鼠ASMCs呈梭形,束状排列,细胞间相互交错呈峰谷状(见图1A)。免疫细胞化学检测发现,α-SMA呈阳性,其胞质内可见红色荧光,证实培养的细胞为ASMCs(见图 1B)。

图1 小鼠ASMCs
2.2 CCK-8法检测结果
2.2.1 不同浓度PAI-1对ASMCs增殖的影响CCK-8法分别检测12、24和48 h时各组ASMCs的A值,计算细胞增殖率。结果表明,80 μg/L PAI-1作用 48 h时,ASMCs增殖率为(46.64±0.830)%,为最高值。不同浓度PAI-1体外刺激ASMCs 12、24和48h后的增殖率比较,采用重复测量设计的方差分析,球形检验结果表明差异无统计学意义(P=0.210),认为多次测量结果间无相关性,故采用单变量方差分析。结果显示:①不同时间ASMCs的增殖率比较,差异有统计学意义(F=3 826.486,P=0.000),作用 48 h时,ASMCs的增殖率最大;②不同浓度PAI-1刺激下ASMCs的增殖率比较,差异有统计学意义(F=1 825.566,P=0.000),PAI-1 80 μg/L 刺激下 ASMCs的增殖率最大;③不同浓度PAI-1刺激下ASMCs的增殖率变化趋势比较,差异有统计学意义(F=289.290,P=0.000)。见附表和图 2。
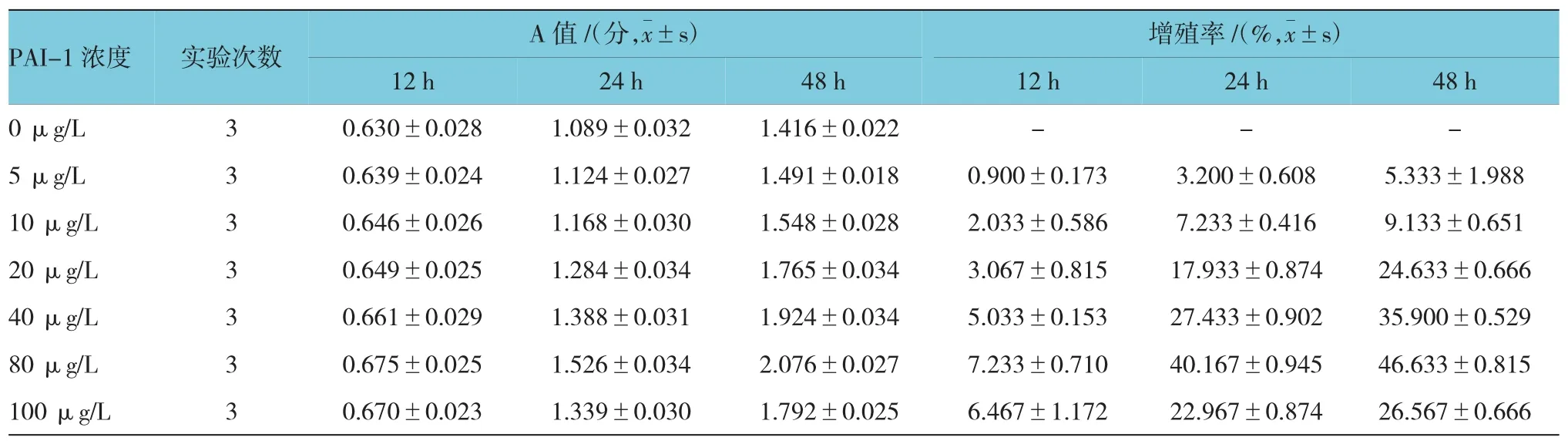
附表 不同浓度PAI-1体外刺激ASMCs各时间的A值和增殖率比较
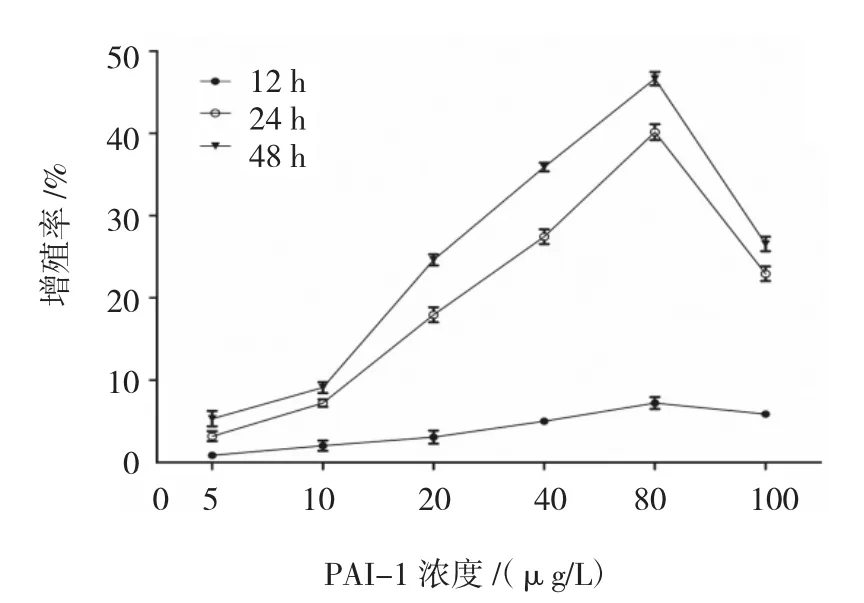
图2 不同浓度PAI-1体外刺激ASMCs各时间的增殖率变化趋势
2.2.2 同时加入PD98059和PAI-1对ASMCs生长的影响 各组A值比较,经单因素方差分析,差异有统计学意义(F=142.980,P=0.000)。进一步组间两两比较,经LSD-t检验,B、C、D、E 组与A组比较,差异有统计学意义(t=8.218、17.177、22.817 和 8.930,均 P=0.000),B、C、D、E 组高于 A 组,提示各浓度PAI-1均可引起ASMCs增殖;F组(PAI-1 80 μg/L+PD98059 80 μg/L)与A组比较,差异有统计学意义(t=3.874,P=0.002),F组高于 A 组,表明 ERK 抑制剂PD98059部分抑制PAI-1引起的ASMCs增殖;F组与D组比较,差异有统计学意义(t=18.943,P=0.000),F组低于D组,提示PAI-1所引起的ASMCs增殖,可能与ERK通道有关(见图3)。
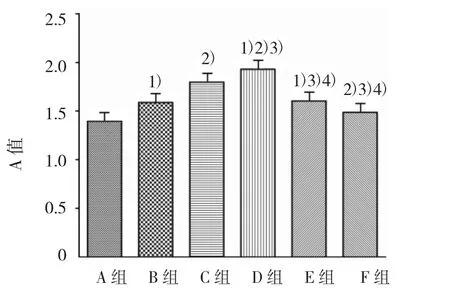
图3 ASMCs作用48 h各组的A值比较
2.3 PAI-1对小鼠ASMCs的ERK蛋白表达影响
各组ERK蛋白、p-ERK蛋白表达及ERK磷酸化水平比较,经单因素方差分析,差异有统计学意义(F=72.294、87.809 和 27.946,均 P=0.000)。①各组ERK蛋白表达水平比较,经LSD-t检验,B、C、D、E组高于A组,D组高于B、C、E组,C组高于B、E组,D组高于F组(P<0.05);B组与E组比较,差异无统计学意义(P>0.05);②各组p-ERK蛋白表达水平比较,经 LSD-t检验,B、C、D、E 组高于 A 组,D 组高于B、C、E组,C组高于B、E组,D 组高于 F组(P<0.05);B组与E组比较,差异无统计学意义(P>0.05);③各组 ERK 磷酸化水平比较,经 LSD-t检验,B、C、D、E 组高于A组,提示各浓度PAI-1均可促进ERK1/2磷酸化;D 组高于B、C、E 组,C组高于 B、E 组(P<0.05),B组与E组比较差异无统计学意义(P>0.05),表明当PAI-1浓度波动于20~80 μg/L时,ERK1/2磷酸化水平随浓度升高而增高,>80 μg/L,ERK1/2磷酸化水平则不再增高;D组高于F组(t=8.612,P=0.000),显示PAI-1引起ERK1/2磷酸化增高的现象可被PD98059抑制。见图4。
2.4 PAI-1对小鼠ASMCs细胞ERK mRNA表达的影响
各组ERK mRNA水平比较,经单因素方差分析,差异有统计学意义(F=229.035,P=0.000)。进一步各组间两两比较,经LSD-t检验,B、C、D、E组高于A组,D组高于B、C、E组,C组高于 B、E组,D组高于F组(P<0.05);B组与E组比较差异无统计学意义(P>0.05)。见图 5。
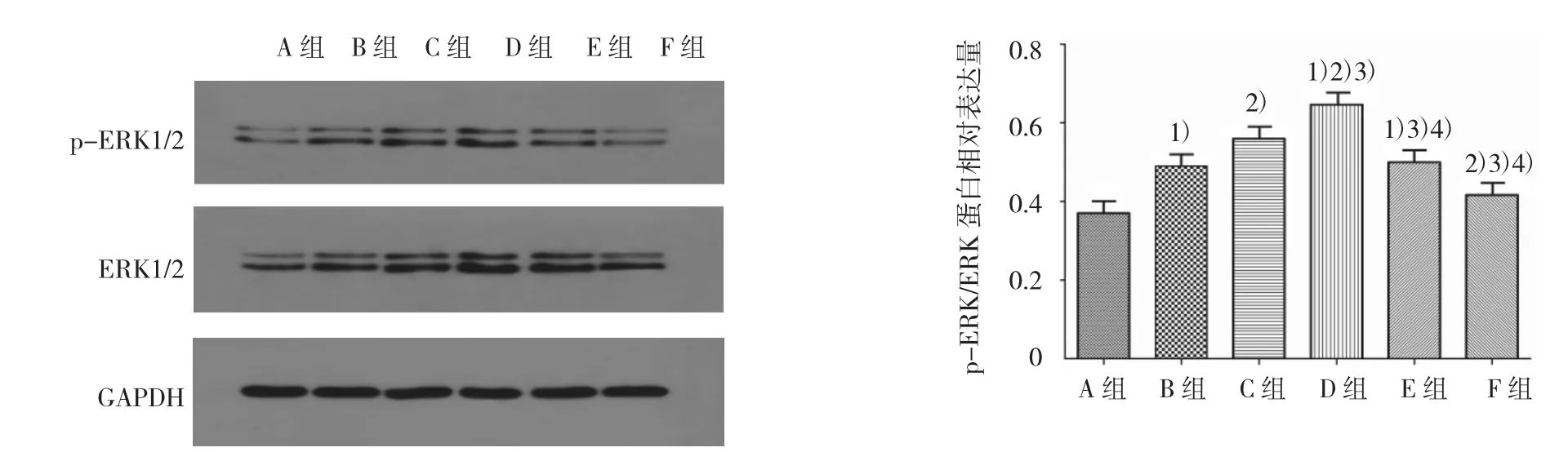
图4 各组ASMCs的ERK蛋白表达水平
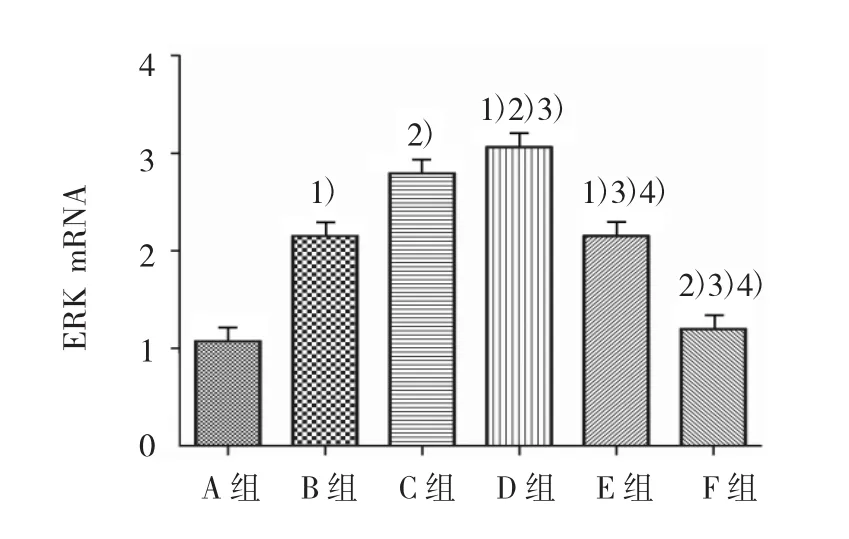
图5 各组ASMCs的ERK mRNA表达水平比较
3 讨论
气道重塑是慢性哮喘反复发作和顽固性哮喘的重要病理基础,其中ASMCs的增殖是其重要环节之一[10]。WOODRUFF等[11]指出,难治性哮喘患者与正常人相比,ASMCs的数量增加(50~80)%,这一现象主要由平滑肌的增殖而不是肥大引起。JAMES等[12]研究表明,在致死性哮喘(主要是重度哮喘)患者中,气道平滑肌层厚度增加是由于大、中、小气道的ASMCs增生;无论是致死性或是非致死性哮喘,ASMCs肥大均发生在大气道。过度增殖的ASMCs引起气道管腔狭窄,气流通过受限,且ASMCs增殖会导致气道高反应[13],使气道对变应刺激源更加敏感,收缩更为强烈,导致更为严重的急性发作。同时增殖后的ASMCs由收缩型向增殖/合成型转化[14],分泌大量细胞因子参与哮喘的炎症反应,炎症可进一步促进气道重塑,导致恶性循环。由此可见ASMCs增殖处于哮喘气道重塑的关键环节,抑制ASMCs增殖可能成为治疗难治性哮喘的一个重要靶点。
PAI-1是纤溶系统中重要的调控物质之一,其主要作用是抑制u-PA和t-PA。在正常情况下,PAI-1在血浆中的含量是极低的(0~60 ng/ml),大部分以潜在活性形式存在于血小板中(200~300 ng/ml)[15-16]。在一些病理条件下,如感染、中风、心肌梗死、糖尿病、肥胖症、败血症和癌症等,PAI-1水平升高[17-18]。异常的PAI-1表达也在哮喘中存在。已有研究证实,PAI-1在致死性哮喘患者增多的肥大细胞内高度表达[5],且PAI-1的4G等位基因频率增多与血浆中PAI-1的高表达相关,患有哮喘的父母易于将该等位基因遗传给孩子[6-7]。哮喘患者升高的PAI-1血浆水平也与减少的用力肺活量相关[19]。体外实验表明,PAI-1可通过促进气道炎症、气道重塑及气道高反应,在哮喘发病机制中扮演重要角色[3,8,20-23]。目前,关于 PAI-l对哮喘气道重塑的研究主要集中两方面,即PAI-1通过抑制纤溶和MMP-9的活化,促进纤维蛋白和细胞外基质沉积[8,23]、PAI-1通过影响VEGF的活化调节血管生成[8,22],但是PAI-1对ASMCs增殖的影响国内外还少有研究。本研究结果显示,PAI-1能促进体外培养ASMCs增殖,并有一定的时间和浓度依赖性。PAI-1在各时间均能刺激ASMCs的增殖,随时间延长,刺激增强;在各剂量中,从5μg/L增至80μg/L,增殖率逐渐升高,>80μg/L后,增殖率不再增加。
ERK是EAPKs家族中的一员,主要包括2种异构体ERK1和ERK2,ERK1/2可由生长因子通过Ras-Raf-MEK通路的磷酸化而被激活,与细胞增殖、转化及分化相关的MAPK[24-25]。有研究表明,TGF-β1可通过激活ERK信号途径促进ASMCs的增殖,罗红霉素能够抑制上述途径[26-29]。XIE等[27]实验表明,ERK1/2信号通路在哮喘大鼠ASMCs由收缩型向增殖/合成型转化中发挥关键作用。YAO等[28]研究表明,白杨素能够通过抑制ERK1/2信号途径的激活,从而抑制人ASMCs的增殖。CHEN等[30]研究发现,PAI-1可能促进ERK的表达增加,从而导致血管平滑肌细胞的增殖。本研究结果显示,PAI-1可以促进大鼠ASMCs的增殖,与ERK信号通路有关,该效应存在一定的浓度依赖性;PD98059可以抑制该效应,但不能恢复至对照水平,说明ERK通路可能不是PAI-1引起大鼠ASMCs增殖的唯一效应通路。
综上所述,在体外实验中,外源性PAI-1可以通过促进ERK通路的磷酸化,而促进ASMCs的增殖。而减少PAI-1的作用和抑制ERK通路的磷酸化可减少ASMCs的增殖,从而可能减缓哮喘气道重塑的发生。
[1]BOUSQUET J,HUMBERT M.GINA 2015:the latest iteration of a magnificent journey[J].European Respiratory Journal,2015,46(3):579-582.
[2]AL-MUHSEN S,JOHNSON J R,HAMID Q.Remodeling in asthma[J].Journal of Allergy and Clinical Immunology,2011,128(3):451-462.
[3]JOHNSON P R A,BURGESS J K.Airway smooth muscle and fibroblasts in the pathogenesis of asthma[J].Current Allergy and Asthma Reports,2004,4(2):102-108.
[4]MŁYNARSKA A,WASZYROWSKI T,KASPRZAK J D.Plasminogen activator inhibitor-1(PAI-1):pathogenetic role in coronary disease[J].Kardiologia Polska,2007,65(9):1109.
[5]CHO S H,TAM S W,DEMISSIE-SANDERS S,et al.Production of plasminogen activator inhibitor-1 by human mast cells and its possible role in asthma[J].The Journal of Immunology,2000,165(6):3154-3161.
[6]CHO S H,HALL I P,WHEATLEY A,et al.Possible role of the 4G/5G polymorphism of the plasminogen activatorinhibitor1 gene in the development of asthma[J].Journal of Allergy and Clinical Immunology,2001,108(2):212-214.
[7]PAMPUCH A,KOWAL K,BODZENTA-LUKASZYK A,et al.The 675 4G/5G plasminogen activator inhibitor-1 promoter polymorphism in house dust mite-sensitive allergic asthma patients[J].Allergy,2006,61(2):234-238.
[8]OH C K,ARIUE B,ALBAN R F,et al.PAI-1 promotes extracellular matrix deposition in the airways of a murine asthma model[J].Biochemical and Biophysical Research Communications,2002,294(5):1155-1160.
[9]卓致远,黄茂,崔学范,等.组织贴块法培养小鼠气道平滑肌细胞[J].中国组织化学与细胞化学杂志,2007,16(2):247-250.
[10]HASSAN M,JO T,RISSE P A,et al.Airway smooth muscle remodeling is a dynamic process in severe long-standing asthma[J].Journal of Allergy and Clinical Immunology,2010,125(5):1037-1045.
[11]WOODRUFF P G,DOLGANOV G M,FERRANDO R E,et al.Hyperplasia of smooth muscle in mild to moderate asthma without changes in cell size or gene expression[J].American Journal of Respiratory and Critical Care Medicine,2004,169(9):1001-1006.
[12]JAMES A.Airway remodeling in asthma[J].Current Opinion in Pulmonary Medicine,2005,11(1):1-6.
[13]BROOK B S,PEEL S E,HALL I P,et al.A biomechanical model of agonist-initiated contraction in the asthmatic airway[J].Respiratory Physiology Neurobiology,2010,170(1):44-58.
[14]DAMERA G,DRUEY K M,COOPER P R,et al.An RGS4-mediated phenotypic switch of bronchial smooth muscle cells promotes fixed airway obstruction in asthma[J].PLoS One,2012,7(1),DOI:10.1371/journal.pone.0028504.
[15]BROGREN H,KARLSSON L,ANDERSSON M,et al.Platelets synthesize large amounts of active plasminogen activator inhibitor 1[J].Blood,2004,104(13):3943-3948.
[16]CRAEN B V D,DECLERCK P J,GILS A.The biochemistry,physiology and pathological roles of PAI-1 and the requirements for PAI-1 inhibition in vivo[J].Thrombosis Research,2012,130(4):576-585.
[17]GRAMLING M W,CHURCH F C.Plasminogen activator inhibitor-1 is an aggregate response factor with pleiotropic effects on cell signaling in vascular disease and the tumor microenvironment[J].Thrombosis Research,2010,125(5):377-381.
[18]DECLERCK P J,GILS A.Three decades of research on plasminogen activator inhibitor-1:a multifaceted serpin[C].Seminars in Thrombosis and Hemostasis,2013,39(4):356-364.
[19]CHO S,KANG J,LYTTLE C,et al.Association of elevated plasminogen activator inhibitor 1 levels with diminished lung function in patients with asthma[J].Annals of Allergy Asthma Immunology,2011,106(5):371-377.
[20]SWAISGOOD C M,ARONICA M A,SWAIDANI S,et al.Plasminogen is an important regulator in the pathogenesis of a murine model of asthma[J].American Journal of Respiratory and Critical Care Medicine,2007,176(4):333-342.
[21]TEZUKA T,OGAWA H,AZUMA M,et al.IMD-4690,a novel specific inhibitor for plasminogen activator inhibitor-1,reduces allergic airway remodeling in a mouse model of chronic asthma via regulating angiogenesis and remodeling-related mediators[J].PLoS One,2015,10(3):DOI:10.1371/journal.pone.e0121615.
[22]MIYAMOTO S,HATTORI N,SENOO T,et al.Intra-airway administration of small interfering RNA targeting plasminogen activator inhibitor-1 attenuates allergic asthma in mice[J].American Journal of Physiology-Lung Cellular and Molecular Physiology,2011,301(6):L908-L916.
[23]LEE S H,EREN M,VAUGHAN D E,et al.A plasminogen activatorinhibitor-1 inhibitorreducesairwayremodeling in a murine model of chronic asthma[J].American Journal of Respiratory Cell and Molecular Biology,2012,46(6):842-846.
[24]ANDREEFF M.Targeted therapy of acute myeloid leukemia[M].New York:Springer,2015:275-305.
[25]黄文林,朱孝峰.信号转导与疾病[M].第2版.北京:人民卫生出版社,2012:275-305.
[26]CHEN G,KHALIL N.TGF-β1increases proliferation of airway smooth muscle cells by phosphorylation of map kinases[J].Respiratory Research,2006,7(1):2.
[27]XIE M,LIU X S,XU Y J,et al.ERK1/2 signaling pathway modulates the airway smooth muscle cell phenotype in the rat model of chronic asthma[J].Respiration,2007,74(6):680-690.
[28]YAO J,ZHANG Y S,FENG G Z,et al.Chrysin inhibits human airway smooth muscle cells proliferation through the extracellular signal-regulated kinase 1/2 signaling pathway[J].Molecular Medicine Reports,2015,12(5):7693-7698.
[29]DAI Y,LI F,WU L,et al.Roxithromycin treatment inhibits TGF-beta1-induced activation of ERK and AKT and downregulation of caveolin-1 in rat airway smooth muscle cells[J].Respir Res,2014,15:96.
[30]CHEN Y,BUDD R C,KELM R J,et al.Augmentation of proliferation of vascular smooth muscle cells by plasminogen activator inhibitor type 1[J].Arteriosclerosis Thrombosis and Vascular Biology,2006,26(8):1777-1783.
Effect of PAI-1 on proliferation of airway smooth muscle cells and expression of extracellular regulated protein kinase
Liang Wang,Shu-yang Zhu,Chen-xi Yu,Wen-jing Liu,Jie-chen Zhu
(Department of Respiratory Medicine,the Affiliated Hospital of Xuzhou Medical University,Xuzhou,Jiangsu 221006,China)
Objective To investigate the regulation of plasminogen activator inhibitor-1(PAI-1)on the proliferation of airway smooth muscle cells (ASMCs)and its effect on extracellular regulated protein kinase(ERK).Methods The ASMCs of mice culturedin vitrowere divided into 7 groups:control group,PAI-1 5 μg/L group,PAI-1 10 μg/L group,PAI-1 20 μg/L group,PAI-1 40 μg/L group,PAI-1 80 μg/L group and PAI-1 100 μg/L group.All groups were cultured respectively for 12,24 and 48 h in a 37℃ incubator.The absorbance values were tested by CCK-8,and the proliferation rates were calculated.The concentration and intervention time of the experimental group with the highest proliferation rate were taken as the optimal concentration and time of PAI-1 action.Then the subjects were further divided into 6 groups:group A(blank control),group B(PAI-1 20 μg/L),group C(PAI-1 40 μg/L),group D(PAI-1 80 μg/L),group E(PAI-1 100 μg/L)and group F (the optimal concentration of PAI-1+the inhibitor of ERK PD98059 10 μmol/L).The proliferation of ASMCs was detected by CCK-8.The expression of ERK protein was detected by Western blot.And the expression of ERK mRNA was detected by qRT-PCR.Results After 5-100 μg/L PAI-1 acted upon ASMCs for 12,24 and 48 h,the proliferation rates of each test group at different time points were statistically different (P<0.05),and the proliferation rates reached the maximal levels at the 48th h;at the same time point the proliferation rates of the test groups with different concentrations were statistically different(P<0.05),and the proliferation rates of ASMCs reached the peak at the concentration of 80 μg/L.Therefore,80 μg/L of PAI-1 was chosen to be the optimum concentration,and 48 hours was set to be the optimal intervention period for the subsequent experiments.In the subsequent experiments,the results showed that compared to the group A,ERK phosphorylation levels and the expressions of ERK mRNA in the groups B,C,D and E were significantly increased (P<0.05);in the pairwise comparison of the groups B,C,D and E,the ERK phosphorylation levels and the expressions of ERK mRNA in the ASMCs were statistically different only between the groups B and E (P < 0.05).When PAI-1 concentration varied from 20 to 80 μg/L,ERK phosphorylation leveland the expression ofERK mRNA increased with the concentration;when the concentration went up over 80 μg/L,the phosphorylation level of ERK no longer increased.Compared with the group D,the ERK phosphorylation level and the expression of ERK mRNA were decreased in the group F(added with PD98059)(P<0.05).Conclusions Exogenous PAI-1 may promote the proliferation of ASMCs through ERK pathway.
plasminogen activator inhibitor-1;extracellular regulated protein kinase;airway smooth muscle cells;asthma
R562.25
A
10.3969/j.issn.1005-8982.2017.26.004
1005-8982(2017)26-0018-07
2016-03-14
朱述阳,E-mail:jiechenz356@sohu.com
(童颖丹 编辑)

