光助类Fenton法降解水中土霉素的研究*
林正锋,唐梓伦,王 史
(海南出入境检验检疫局 检验检疫技术中心,海南 海口 570311)
光助类Fenton法降解水中土霉素的研究*
林正锋,唐梓伦,王 史
(海南出入境检验检疫局 检验检疫技术中心,海南 海口 570311)
四环素类抗生素在废水中很难降解处理,由此造成的环境污染已引起广泛关注。本论文选取常见的抗生素土霉素作为研究对象,采用廉价易得的普通铁粉作为催化剂,研究光照、溶液的pH值、土霉素初始浓度、铁粉的投加量、H2O2投加量等因素对土霉素的去除效果的影响,发现在紫外光照、铁粉投加量为2.0g·L-1、pH值为6.0、H2O2投加量为20mg·L-1的催化条件下,质量浓度为50mg·L-1的土霉素溶液5h内基本完全降解,去除率高达98%。该研究结果表明,紫外光对铁粉的催化降解有协同作用,光催化去除过程符合一级反应动力学模型。紫外光条件下铁粉对水溶液中的土霉素有很好的去除效果。
土霉素;铁粉;光催化降解;去除
四环素类抗生素是全世界广泛应用的一类重要的抗生素,在动物体内难以代谢,因此,大量的四环素类抗生素最终被排放至废水系统中。从废水处理厂排放到环境的抗生素受到越来越多的关注,因为微生物对抗生素耐药性不断增加,严重威胁着生态安全[1]。由于在废水中很难降解处理,这类抗生素在土壤、地表水、地下水、沿海甚至饮用水中被检测出来[2,3]。
废水处理厂主要采用活性污泥法去除四环素,但是效果较差,这是因为这类抗生素不能被生物降解反而会杀死大多数的微生物。目前,主要采用吸附、电子脉冲辐解、光催化降解等方法来处理四环素类抗生素[4-7],这些方法均有各自的优势和局限性。近年来,零价铁粉在降解处理有机污染物方面的应用受到广泛关注,因为它是高效且无毒的催化剂。零价铁可以有效降解含氯的有机化合物[8]、硝基芳香化合物[9]、染料[10]等一系列的有机污染物。零价铁在氧、H2O2、低分子量有机酸等存在条件下可产生O2化性能较强的活性氧物种-羟基自由基(·OH)[11,12],该自由基可降解矿化难降解性有机污染物为无毒无害的无机小分子(CO2、H2O等)[13]。Hua Chen[14]和Ozge Hanay[15]等研究者报道了基于纳米零价铁降解和吸附土霉素的研究,结果表明纳米零价铁能有效地去除水体系中的土霉素。实际上,起到吸附和降解作用的是纳米零价铁转化成的羟基铁氧化物,除此土霉素也可以通过与金属的螯合作用生成Fe-TC络合物而除去[14,15]。普通铁粉较纳米零价铁具有廉价易得的优势,其在与H2O2形成的非均相类芬顿体系具有H2O2用量少、催化材料易回收的优点[16],而且可避免其他类芬顿体系有效作用的pH值范围窄、催化剂易失活且难再生等问题[16]。
本论文研究了普通零价铁粉在催化降解土霉素的催化性能,初步探讨了不同条件,包括光照条件、pH值、土霉素的初始浓度、铁粉的投加量、H2O2的用量等对土霉素去除率的影响。同时,研究反应过程中羟基自由基的产生及变化、土霉素及其降解中间产物的变化,揭示基于零价铁的光助类芬顿体系氧化降解土霉素的机制,为基于零价铁的光助类芬顿体系氧化并矿化土霉素以及其他抗生素提供科学的理论依据和技术参考。
1 实验部分
1.1 实验试剂
土霉素标准品、铁粉(200目)、购于阿拉丁试剂公司;其他药品和溶剂为分析纯购于国药集团化学试剂有限公司;实验中使用的水均由Milli-Q超纯水系统生产。
1.2 土霉素浓度的测定方法
准确称取一定量土霉素标准品,用超纯水配成100mg·L-1溶液,然后用该溶液分别配置成一系列浓度已知的土霉素标准品溶液,然后通过高效液相色谱分析,取波长为355nm处进行积分得到峰面积值。由样品浓度与峰面积的关系得到标准曲线为y=16.655x-7.042(R2=0.9984)。
1.3 光催化降解土霉素实验
在100mL的锥形瓶中加入50mg·L-1的土霉素50mL,然后加入一定量的铁粉,用0.1mol·L-1H2SO4或0.1mol·L-1NaOH调节pH值。在室温磁力搅拌的条件下,加入一定浓度的H2O2,同时打开光源(250W高压汞灯),继续搅拌。每隔一定时间(10min、30min、1h、2h、3h、4h 和 5h)采样。取样后立即离心分离,然后进行高效液相色谱检测,以355nm处进行积分得到峰面积,并对照标准曲线获得反应后的土霉素含量。
研究光照条件对去除率的影响时,铁粉的投加量为 1.0g·L-1,初始 pH 值为 3.0,H2O2投加量为20mg·L-1;将反应装置分别置于室内、暗处、250W高压汞灯距离10cm处,其他条件和操作相同。研究pH值对去除率的影响时,初始pH值设定为3.0、6.0、8.0、10.0,紫外光照,铁粉的投加量为 1.0g·L-1,
H2O2投加量为20mg·L-1。研究土霉素初始浓度的影响时,土霉素初始浓度变为 20、40、60、80mg·L-1,pH值为 6.0,紫外光照,铁粉的投加量为 1.0g·L-1,H2O2投加量为20mg·L-1。研究铁粉投加量的影响时,紫外光照,将铁粉的投加量变为 0.1、0.5、1.0、1.5、2.0g·L-1,初始pH 值为 6.0,H2O2投加量为 20mg·L-1。研究 H2O2投加量的影响时,紫外光照,将初始pH值设定为6.0,铁粉的投加量为 2.0g·L-1,H2O2投加量为 0、10、20、50mg·L-1。
1.4 HO·的测定方法
采用苯甲酸荧光光度法测定HO·的含量[17]。方法为:在具塞四面透光比色皿中,加入浓度为0.01mol·L-1苯甲酸1mL,以及不同反应时间的样品溶液1mL,定容到3mL,用LS-55荧光分光光度计(PerkinElmer)测定·OH相对含量,激发波长λex=300nm,发射波长λem=410nm,狭逢宽度均为10nm。
1.5 紫外-可见、红外光谱的测定方法
紫外-可见吸收光谱测定方法为:取30mL样品液在旋转蒸发仪上进行浓缩,取3mL浓缩液置于两面透光比色皿中在在SHIMADZU UV-2450紫外分光光度计上进行测量。
红外光谱的测定方法为:在一定量的光谱级溴化钾中分别加入少量的浓缩后的样品液,然后放置真空干燥箱中60℃下干燥过夜,将加样后的溴化钾压片,在PerkinElmerSpectrumII型傅里叶变换红外光谱仪上进行扫描,扫描的波数范围为4000~400cm-1。
2 结果与讨论
2.1 光照条件对去除效率的影响
光照条件Fenton、类Fenton体系的氧化降解有协同作用[18],因此,研究铁粉在暗处、室内光和高压汞灯光照条件对土霉素去除率的影响,结果如图1所示。pH 值为 3.0,铁粉投加量为 1.0g·L-1,H2O2浓度为20 mg·L-1的条件下,高压汞灯光照的去除土霉素的效果最好,去除速度最快;在反应30min内去除率达到61%,3h后去除率达到82%。其次是室内光,在暗处条件下土霉素的去除效果最差。究其原因,酸性暗室条件下,该体系中可能存在如下几个反应,释放出HO·,氧化土霉素降解。

而在室内光和高压汞灯紫外光的作用下,体系中可能还存在反应式(4)[18],释放出更多的HO·,因而土霉素的去除率更高。紫外光照强度越大,反应式(4)的几率更大,因而土霉素的去除率最高。


图1 光照条件对土霉素去除率的影响Fig.1 Influence of different photo conditions on the OTC removal efficiency
2.2 pH值对去除效率的影响
pH值是Fenton、类Fenton体系的催化降解作用的重要影响因素[3,19]。铁粉投加量1.0g·L-1作为催化剂,H2O2浓度为 20mg·L-1,在不同 pH 值(3.0,6.0,7.0,8.0,10.0)条件下降解土霉素的去除率见图2。

图2 紫外光照条件下不同pH值对土霉素去除率的影响Fig.2 Influence of different pH values on the OTC removal efficiency under UV light
从图2可知,pH值为3.0到pH值为7.0,土霉素的去除率随时间逐渐增大,当反应时间为3h基本达到稳定。这说明了弱酸光照条件下,铁粉去除土霉素效果最好,在此条件下的去除过程可能包括快速吸附和降解两个过程[3]。随着pH值不同,土霉素在溶液中可以带正电荷、负电荷和两性离子,存在H3L+、H2L0、HL-、L2-等形式[19]。在 pH 值为 3.0~7.0 的体系中,土霉素主要的存在形式是H2L0,而铁粉在此pH值条件下带正电荷,因此,可以吸附H2L0形式存在的土霉素。而pH值为8.0~10.0的条件下,土霉素的去除率很低,分别是12%和10%。在此条件下土霉素以HL-和L2-存在,铁粉带负电荷,静电排斥作用使得吸附作用很弱,因此,土霉素在偏碱性条件下的除去率很低。
在酸性光照条件下,其中,当pH值为6.0时,土霉素的去除率最高,反应3h的去除率达到92%。对比pH值3.0和6.0,强酸pH值3.0条件下的去除率反而较低,这与Ozge Hanay等人报道的结果一致[15]。原因是强酸与铁反应生成Fe3+而不是生成羟基氧化铁(FeOOH),而生成的Fe3+在酸环境中不会吸附土霉素[3]。
2.3 土霉素初始浓度的影响
众多研究表明,零价铁颗粒与土霉素的反应是在催化剂表面进行[11,12]。大多数表面反应可用Langmuir-Hinshelwood动力学模型进行描述[20],这个模型可表示为一级动力学方程:

式中 c:土霉素浓度,t:为反应时间,K:反应速率常数。对该方程进行积分得到:

土霉素的初始浓度为 20,40,60,80,100mg·L-1。pH 值为 6.0,Fe0的投加量均为 1.0g·L-1,H2O2浓度为 20 mg·L-1的条件下研究不同土霉素初始浓度对铁粉催化降解的效果。以土霉素浓度的对数lnc对反应时间t作图,得到不同土霉素初始浓度下的结果,见图3。可以看到lnc对t呈现较好的线性关系,降解动力学符合一级动力学模型。

图3 不同土霉素初始浓度下lnc与t的关系Fig.3 Relationship between lnc and t under different initial concentrations of OTC
从图3可以得出,反应速率常数随着土霉素的初始浓度的增大而减小,从0.0327min-1减小到0.0192min-1。这是因为当铁粉投加量一定时,铁粉的表面积一定,即铁粉表面上的反应位点的数量是一定的,当增大土霉素的浓度,反应位点被土霉素和降解的中间产物覆盖,这会直接影响反应速率,导致其下降。这与TiO2光催化降解土霉素的研究结果一致[21]。
2.4 铁粉投加量对去除效率的影响
在 pH值为 6.0、H2O2浓度为 20mg·L-1、紫外光照条件下研究铁粉投加量对土霉素去除的效果,结果见图4。
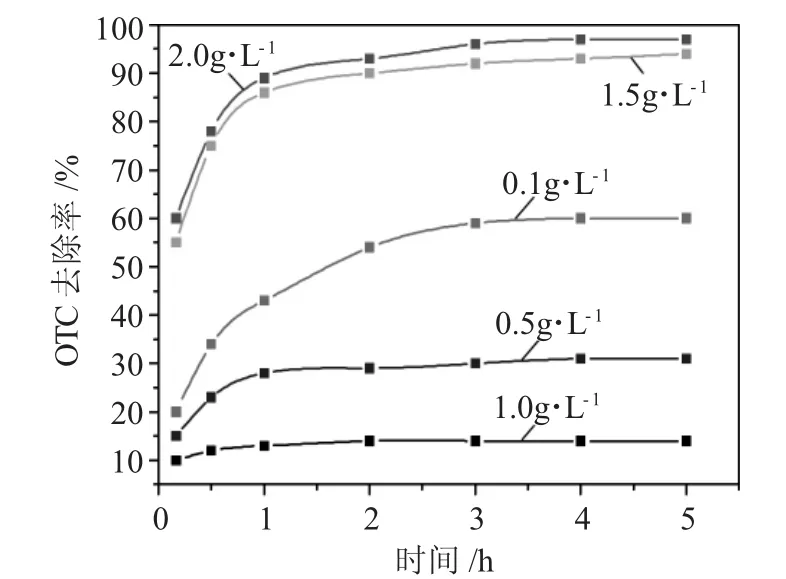
图4 紫外光照条件下不同铁粉投加量对土霉素去除率的影响Fig.4 Influence of different concentration of Fe on the OTC removal efficiency under UV light
从图4可知,土霉素的去除率随着铁粉的投加量增大而增大。铁粉投加量为2.0g·L-1的条件下,土霉素的去除率在反应3h时达到95%,该条件下土霉素的去除效果最好。在相同条件下,增加铁粉的投加量可以增加溶液中铁的含量,根据前述公式(2)(4)可知,铁的含量增加能产生更多的活性自由基HO·,因此,加快土霉素的氧化降解。
2.5 H2O2投加量对去除效率的影响
在pH值为6.0紫外光照条件下改变H2O2的投加量,土霉素的去除率随时间的变化见图5。

图5 紫外光照条件下不同H2O2投加量对土霉素去除率的影响Fig.5 Influence of different[H2O2]on the OTC removal efficiency under UV light
当 H2O2投加量从 0mg·L-1增大到 20mg·L-1时,土霉素的去除率随着H2O2投加量的增加而增大。H2O2的投加量为20mg·L-1时,反应3h土霉素的去除率达到97%。继续加大H2O2的投加量至50mg·L-1,去除率反而会降低,这可能是因为HO·与H2O2发生了如式(5)的副反应[18]。该副反应生成的HO2·自由基对有机物的氧化活性低于HO·[18],因此,即使加入高浓度H2O2也不能有效利用,导致土霉素的除去率降低。

2.6 HO·的测定
为了初步判断去除过程中氧化反应生成的活性物种HO·的变化,采用苯甲酸荧光光度法测定HO·的含量,结果见图6。
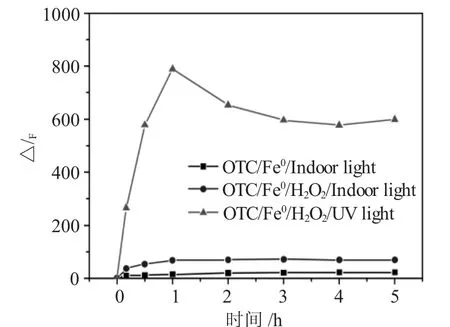
图6 反应过程中HO·的含量的变化Fig.6 Variation of HO·during the removal process
从图6中可以得出,不加光照,几乎不产生HO·;当加紫外光照后,OTC/Fe0/H2O2/紫外光体系在1h时产生HO·的量达到最大,随后随着反应的进行,HO·的量出现下降趋势,这可能是由于HO·的消耗的大于产生所导致的。而OTC/Fe0/室内光体系生成的HO·的量比紫外光照体系产生HO·的量少很多。表明对土霉素的降解体系,光照可以促进产生HO·,紫外光照比自然光照条件更优,OTC/Fe0/H2O2/紫外光体系可以有效快速地降解土霉素。
2.7 降解过程中的波普分析
土霉素是具有并苯结构的衍生物,分子中含有4个六元环,两个羰基(C=O),还有一个酰胺基团(-CONH2)等,这些特征基团为波普分析提供了可能性。降解过程中的样品,通过紫外-可见吸收光谱扫描,可以初步判断降解产物基团。实验得出如图7的UV-Vis图谱。
从图7中可以得出,土霉素在280nm和346nm处有强吸收峰,这些峰归属于并苯结构中π-n和π-π跃迁。随着降解反应时间的延长,在这两处的吸收峰逐渐减弱,说明了去除过程中土霉素的并苯结构发生破坏,这与采用纳米零价铁作为催化剂降解土霉素的降解过程一致[3]。

图7 土霉素降解过程中的紫外-可见吸收光谱图Fig.7 UV-Vis absorbance of samples during the OTC removal process
除了用紫外-可见吸收光谱分析去除过程中土霉素的分解,还利用红外光谱测定在去除过程中基团的变化,结果见图8。

图8 土霉素降解过程中的红外光谱图Fig.8 FTIR spectra of samples during the OTC removal process
由图8可见,3342cm-1处的宽峰为-OH和酰胺基团上的-NH2的特征吸收峰;1620cm-1处很强的吸收峰为C=O的特征吸收峰;由于C=O的特征吸收峰很强,掩盖了苯环在1500~1600 cm-1处的C=C特征振动吸收峰;1348cm-1是C-CH3的伸缩振动吸收峰;1213和1180cm-1分别是C-O和C-N伸缩振动吸收峰;844和690cm-1是苯环上的C-H特征吸收峰。图7中4条曲线分为反应时间是0、0.5、2、4h反应物的红外光谱。可见随着反应的进行,1400~1000 cm-1的峰逐渐减弱,说明C-CH3、C-O和C-N等官能团发生降解[3]。在反应4h后,1620 cm-1处的强吸收峰也减弱,苯环和C=O发生部分降解。各个反应时间样品的红外光谱的变化,说明了降解过程中土霉素的结构逐渐被破坏,产生的降解中间体的分子结构还需借助质谱分析进一步研究。
3 结论
本论文研究土霉素在铁粉作为催化剂作用下的去除过程,结果表明土霉素的初始浓度、铁粉的投加量、初始pH值和H2O2的浓度等都是去除过程的重要影响因素。在紫外光照条件下,初始浓度为50mg·L-1的土霉素溶液,铁粉投加量为2.0g·L-1,pH值为6.0,H2O2浓度为 20mg·L-1,反应时间 5h,土霉素的去除率高达98%。紫外光照下铁粉作用土霉素的降解反应符合一级反应动力学方程。借助紫外-可见吸收光谱和红外光谱初步判断了降解过程产物的变化。
[1] H.Storteboom,M.Arabi,J.G.Davis,B.Crimi,A.Pruden,Tracking Antibiotic Resistance Genes in the South Platte River Basin Using Molecular Signatures of Urban,Agricultural,And Pristine Sources[J].Environmental Science&Technology,2010,44:7397-7404.
[2] Y.Gao,Y.Li,L.Zhang,et al.Adsorption and removal of tetracycline antibiotics from aqueous solution by graphene oxide[J].Journal of Colloid and Interface Science,2012,368:540-546.
[3] Y.Fu,L.Peng,Q.Zeng,et al.High efficient removal of tetracycline fromsolution bydegradation and flocculation with nanoscale zerovalent iron[J].Chemical EngineeringJournal,2015,270:631-640.
[4] L.Zhang,X.Song,X.Liu,L.Yang,et al.Studies on the removal of tetracycline by multi-walled carbon nanotubes[J].Chemical EngineeringJournal,2011,178:26-33.
[5] L.Peng,Y.Ren,J.Gu,et al.Iron improving bio-char derived from microalgae on removal oftetracycline fromaqueous system[J].Environmental Science and Pollution Research,2014,21:7631-7640.
[6] J.Jeong,W.Song,W.J.Cooper,et al.Degradation of tetracycline antibiotics:Mechanisms and kinetic studies for advanced oxidation/reduction processes[J].Chemosphere,2010,78:533-540.
[7] J.Bai,Y.Liu,J.Li,et al.A novel thin-layer photoelectrocatalytic(PEC)reactor with double-faced titania nanotube arrays electrode for effective degradation oftetracycline[J].Applied Catalysis B:Environmental,2010,98:154-160.
[8] C.-B.Wang,W.-x.Zhang.Synthesizing Nanoscale Iron Particles for Rapid and Complete Dechlorination of TCE and PCBs[J].Environmental Science&Technology,1997,31:2154-2156.
[9] X.Zhang,Y.-m.Lin,X.-q.Shan,et al.Degradation of 2,4,6-trinitrotoluene (TNT)from explosive wastewater using nanoscale zero-valent iron[J].Chemical Engineering Journal,2010,158:566-570.
[10] J.Fan,Y.Guo,J.Wang,et al.Rapid decolorization of azo dye methyl orange in aqueous solution by nanoscale zerovalent iron particles[J].Journal ofHazardous Materials,2009,166:904-910.
[11] S.E.Mylon,Q.Sun,T.D.Waite.Process optimization in use of zero valent iron nanoparticles for oxidative transformations[J].Chemosphere,2010,81:127-131.
[12] C.R.Keenan,D.L.Sedlak.Factors affecting the yield of oxidants from the reaction of manoparticulate zero-valent iron and oxygen[J].Environmental Science&Technology,2008,42:1262-1267.
[13] D.-h.Kim,J.Kim,W.Choi.Effect ofmagnetic field on the zerovalent iron induced oxidation reaction[J].Journal ofHazardous materials,2011,192:928-931.
[14] H.Chen,H.Luo,Y.Lan,et al.Removal of tetracycline from aqueous solutions using polyvinylpyrrolidone (PVP-K30)modified nanoscalezerovalentiron[J].JournalofHazardousMaterials,2011,192:44-53.
[15] .Hanay,B.Y1ld1z,S.Aslan,et al.Removal of tetracycline and oxytetracycline by microscale zerovalent iron and formation of transformation products[J].Environmental Science and Pollution Research,2014,21:3774-3782.
[16] D.H.Bremner,A.E.Burgess,D.Houllemare,et al.Phenol degradation using hydroxyl radicals generated from zero-valent iron and hydrogen peroxide[J].Applied Catalysis B:Environmental,2006,63:15-19.
[17] 陈冠华,田益玲,杨更亮,等.荧光分光光度法测定中药对羟自由基的清除率[J].光谱学与光谱分析,2002,634-636.
[18] H.Shemer,Y.K.Kunukcu,K.G.Linden.Degradation of the pharmaceutical Metronidazole via UV,Fenton and photo-Fenton processes[J].Chemosphere,2006,63:269-276.
[19] C.Gu,K.G.Karthikeyan.Interaction of Tetracycline with Aluminum and Iron Hydrous Oxides[J].Environmental Science&Technology,2005,39:2660-2667.
[20] X.Zhang,F.Wu,N.Deng.Degradation of paracetamol in self assembly β-cyclodextrin/TiO2suspension under visible irradiation[J].Catalysis Communications,2010,11:422-425.
[21] 黄丽萍,陈东辉,黄满红,等.TiO2光催化降解水中土霉素的动力学研究[J].环境工程学报,2012,57-62.
Photocatalytic degradation of oxytetracycline in aqueous solutions using Fenton-like system*
LIN Zheng-feng,TANG Zi-lun,WANG Shi
(Inspection and Quarantine Teehology dispese Center,Hainan Entry-Exit Inspeetion and Quarantime Bureau,Haikou 570311,China)
Tetracycline antibiotics in wastewater are difficult to dispose.The serious tetracycline pollution in the environment has attracted wide attention.In this paper,the removal of the common antibiotic oxytetracycline(OTC)using readily available inexpensive iron powder as a catalyst was investigated.It was found that degradation of OTC was strongly dependent on the light,the pH value of solution,the initial concentration of oxytetracycline,the dosage of iron powder and the dosage of H2O2.Under UV radiation,pH 6.0,after 5h of reaction,the removal efficiency can reach 98%when the quality of iron powder is 1.0g·L-1,H2O2is 20mg·L-1and the initial concentration of OTC is 50mg·L-1.The UV light has a synergistic effect on the catalytic degradation of iron powder in this system.The kinetics study revealed the photodegradation rate followed first-order kinetics.All these results revealed that iron powder can be applied in the reduction of potential contaminants such as tetracyclines.
oxytetracycline;iron powder;photodegradation;removal
X703.1
A
10.16247/j.cnki.23-1171/tq.20171028
2017-08-05
海南省自然科学基金项目(214035)
林正锋(1983.02-),男,本科,工程师,研究方向:分析化学。

