黄酒中不产生物胺乳酸菌的筛选及应用
徐建芬 - 毛杰琪 - 魏晓璐 - 刘双平,5 -,5
(1. 江南大学粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;2. 上海金枫酒业股份有限公司,上海 200063; 3. 无锡市第一中学,江苏 无锡 214100;4. 江南大学食品学院,江苏 无锡 214122; 5. 国家黄酒工程技术研究中心,浙江 绍兴 312000) (1. National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi, Jiangsu 214122, China; 2. Shanghai Jinfeng Wine Co., Ltd., Shanghai 200063 China; 3. Wuxi No.1 Senior High School, Wuxi, Jiangsu 214100, China; 4. School of Food Science and Technology, Jiangnan University, Wuxi, Jiangsu 214122, China; 5. National Engineering Research Center of Chinese Rice Wine, Shaoxing, Zhejiang 312000, China)
黄酒中不产生物胺乳酸菌的筛选及应用
徐建芬1,2XUJian-fen1,2毛杰琪3MAOJie-qi3魏晓璐1,4WEIXiao-lu1,4刘双平1,4,5LIUShuang-ping1,4,5
(1. 江南大学粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;2. 上海金枫酒业股份有限公司,上海 200063; 3. 无锡市第一中学,江苏 无锡 214100;4. 江南大学食品学院,江苏 无锡 214122; 5. 国家黄酒工程技术研究中心,浙江 绍兴 312000) (1.NationalEngineeringLaboratoryforCerealFermentationTechnology,JiangnanUniversity,Wuxi,Jiangsu214122,China; 2.ShanghaiJinfengWineCo.,Ltd.,Shanghai200063China; 3.WuxiNo.1SeniorHighSchool,Wuxi,Jiangsu214100,China; 4.SchoolofFoodScienceandTechnology,JiangnanUniversity,Wuxi,Jiangsu214122,China; 5.NationalEngineeringResearchCenterofChineseRiceWine,Shaoxing,Zhejiang312000,China)
为筛选不产生物胺的乳酸菌菌株,对黄酒发酵醪液及米浆水中的微生物进行培养及与分离纯化,发现3株菌不具有氨基酸脱羧酶活性,但具有一定的生物胺降解能力。使用黄酒发酵液培养该3株菌,发现在2.50%Vol的黄酒培养液中,3株菌能正常生长;在8.80%Vol黄酒培养液中,菌株5-4和8-3生长能力明显弱于14-2-1;在15.70%Vol黄酒培养液中,3株菌均受到严重抑制。菌株14-2-1生长速率最快,繁殖最旺,经鉴定为植物乳杆菌,同时菌株产酸能力较强,产酸速率也较快,表现出一定的优越性,应用于黄酒酿造中,能有效降低黄酒中生物胺的含量。
乳酸菌;生物胺;筛选;测序;鉴定
黄酒主要是以谷物(南方主要以糯米,北方以黍米和玉米)为原料,麦曲为糖化剂,酒母或活性干酵母为发酵剂,经浸米、蒸煮、发酵、压榨、过滤、煎酒、贮存和勾兑而成的一种低酒度(14%~20%Vol)的发酵酒精饮料[1-2]。黄酒发酵是糖化和酒精发酵同时进行的双边发酵,同时也是开放式的半固态发酵。微生物的共同作用酿成了黄酒独特的口感及风味[3],其中真菌和芽孢杆菌产酶使淀粉糖化,酵母利用糖类代谢产酒精,醋酸菌和乳酸菌产有机酸降低pH。与此同时,发酵过程中存在的有害微生物会代谢产生影响人体健康的物质,生物胺就是其中一种[4]。生物胺主要是由微生物分泌的氨基酸脱羧酶催化游离氨基酸脱羧生成的[4-5]。大量研究[6-9]表明,微生物代谢产生物胺的能力具有一定的特异性,即使同一菌属的细菌,它们所分泌的氨基酸脱羧酶的种类以及促进产生物胺的能力也大不相同。黄酒中富含多种氨基酸,加上自身特殊的酿造工艺,使得黄酒与其他发酵酒(啤酒、葡萄酒)相比,生物胺含量较高[10]。据报道[11],一定浓度的酒精(<10%Vol)可以增加氨基酸脱羧酶的活性,而酒精又会抑制胺类氧化酶的活性导致生物胺积累过量,有多种生物胺会引起头痛、高血压、恶心和呕吐等不适症状,所以对酒类产品中生物胺的限量标准理应比普通食品更加严格。
目前,有效降低黄酒发酵过程中生物胺含量的研究报道相对较少,有学者[12]通过敲除酿酒酵母的特定基因,该基因主要编码了一种蛋白质水解酶,从而使生物胺含量降低了25.5%。丰富的氨基酸使得黄酒具有多种味觉层次[13-14],所以降低氨基酸含量可能会使黄酒的品质降低。黄酒中的生物胺主要是由乳酸菌代谢产生的,而乳酸菌可产细菌素,细菌素能够抑制同种或亲缘关系较近的种[15]。因此,如果可以筛得一株既不具氨基酸脱羧酶活性、又能产细菌素的乳酸菌,并将其应用于黄酒酿造中,以最大程度降低黄酒中的生物胺含量。本研究拟从黄酒发酵醪液以及米浆水中筛选一株不产生物胺的乳酸菌,以期今后可将其应用于降低生物胺黄酒的发酵工艺提供理论依据。
1 材料与方法
1.1 材料
黄酒发酵醪液及米浆水样品:取自浙江省绍兴某黄酒厂;
dNTP、琼脂糖等分子生物试剂:加拿大BBI公司;
其他试剂:国产分析纯;
MRS培养基:参照文献[16]制备;
液体脱羧酶培养基:参照文献[17]制备;
生物胺检测培养基:参照文献[18]制备;
乳酸菌选择培养基:MRS培养基中加入10 g/L CaCO3;
乳酸菌传代培养基:在MRS液体培养基中分别添加终浓度为10 g/L的氨基酸(组氨酸、酪氨酸、缬氨酸、精氨酸、鸟氨酸和赖氨酸),调pH至6.40,121 ℃高压灭菌15 min。
1.2 方法
1.2.1 不产生物胺乳酸菌的初筛 将样品按梯度(10-1,10-2,10-3,10-4,10-5,10-6,10-7)进行稀释,各取200 μL涂布于MRS固体培养基,倒置于37 ℃厌氧培养1~2 d。
取上述平板上乳白或灰白、中间凸起的单菌落于乳酸菌选择培养基上进行划线分离,倒置于37 ℃厌氧培养1~2 d,挑取其中有溶钙圈的单菌落进行分离纯化[19],重复多次。观察并记录平板上单菌落的形态特征,最后选取具有类似乳酸菌形态的单菌落进行传代培养,再用液体脱羧酶培养基进行氨基酸脱羧酶活性的检测。
将菌株以10 mL/L接种于MRS液体培养基中进行活化,37 ℃培养24 h,然后转接到乳酸菌传代培养基中,37 ℃培养24 h,传代培养3次。将传代3次后的乳酸菌培养液接种于液体脱羧酶培养基中,以不接培养液的培养基为对照。于37 ℃厌氧培养4 d后,观察颜色变化,黄色为阴性,红色或紫色为阳性。
1.2.2 不产生物胺乳酸菌的复筛 经1.2.1检测后,选取较优的10株乳酸菌进行复筛,各取200 μL传代3次后的培养液涂布于相应的生物胺检测平板上,倒置于37 ℃厌氧培养24 h,观察平板颜色变化情况,黄色为阴性,红色或紫色为阳性。
1.2.3 乳酸菌降解混合生物胺能力的检测 将1.2.2筛得的乳酸菌活化后,以20 mL/L分别接于pH 5.50的含有7种生物胺(酪胺、精胺、亚精胺、腐胺、尸胺、组胺、色胺,浓度分别为100 mg/L)的MRS液体培养基中[20],以未接种乳酸菌的培养基做对照(0 h),置于37 ℃厌氧培养,定时取样检测培养液的吸光度OD600及生物胺含量,比较分析乳酸菌降解生物胺的能力。按式(1)计算生物胺降解率。

(1)
式中:
Y——生物胺降解率,%;
W0——对照组中生物胺含量,mg/L;
W1——试验组中生物胺含量,mg/L。
1.2.4 乳酸菌在黄酒培养液中生长能力的检测 黄酒培养液:在黄酒发酵过程中,按酒精度取样3次,尽量使发酵醪酒精度呈梯度变化。将发酵醪经10 000 r/min离心10 min获得上清液,测定不同发酵醪的基本理化指标,另取200 mL上清液于无菌蓝盖瓶中,于70 ℃杀菌20 min后置于室温冷却备用。
将1.2.2筛得的乳酸菌用MRS液体培养基活化后,调整菌液吸光度OD600为0.8,以20 mL/L接种量接种于上述黄酒培养液中,取样测定培养液的吸光度OD600、还原糖含量、总酸含量和pH,比较分析不同乳酸菌在不同黄酒培养液中的生长能力。
1.2.5 乳酸菌的分子生物学鉴定 提取乳酸菌DNA,并进行PCR扩增。采用50.0 μL反应体系:Master Mix 25.0 μL,引物27f 0.5 μL,引物1492r 0.5 μL,无菌水24.0 μL。引物序列为通用引物序列。反应条件:95 ℃预变性5 min;94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸2 min,扩增产物用0.8% 的琼脂糖凝胶进行电泳检测,并使用QIAquick Gel Extraction Kit回收PCR产物[21],将所得产物送至南京金斯瑞生物科技有限公司进行测序。
1.2.6 黄酒酿造工艺 大米浸泡之后进行蒸煮,冷却后与水、麦曲、酒母、淀粉酶、糖化酶以及乳酸菌扩培液混合落料发酵,水温控制在24~28 ℃。前酵温度控制在28 ℃,发酵4 d,每天开耙1次;后酵自然温度发酵,发酵时间为12~14 d。具体工艺配方见表1。
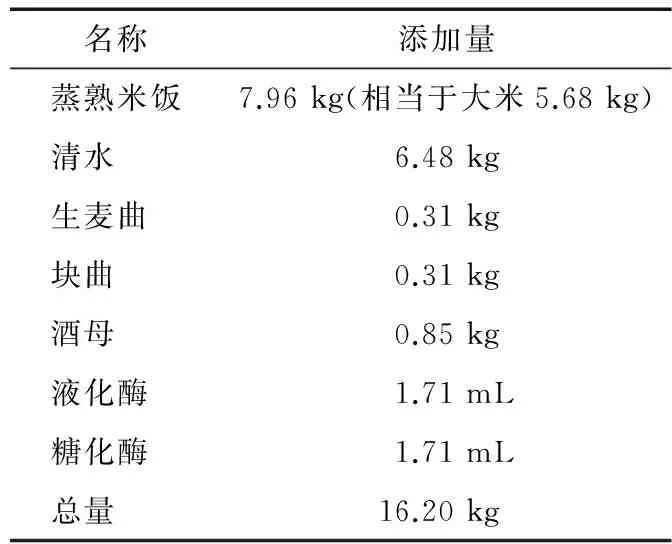
表1 黄酒酿造的工艺配方Table 1 Technological formula of CRW brewing
2 结果与分析
2.1 不产生物胺乳酸菌的筛选
2.1.1 不产生物胺乳酸菌的初筛 经过多次分离筛选,最终从传统黄酒发酵醪中分离得到18株乳酸菌,通过液体脱羧酶培养基进行不产生物胺乳酸菌的初筛发现18株菌均无色氨酸和鸟氨酸脱羧酶活性,只有3株菌(14-2-1、4-3和8-4)不具精氨酸脱羧酶活性,菌株14-2-1对6种氨基酸都不具备脱羧酶活性。因为黄酒中精胺含量很少,一般不超过2 mg/L[22],所以,不以精氨酸脱羧酶活性为主要依据,筛选10株乳酸菌进行下一步试验。
2.1.2 不产生物胺乳酸菌的复筛 初筛较优的10株乳酸菌产生物胺能力检测结果见表2。10株乳酸菌中只有菌株14-2-1 不产精胺,其他9株菌产精胺能力各不相同,且10株乳酸菌均不产其他5种生物胺。
传代3次后的乳酸菌培养液pH变化见表3,菌株14-2-1添加6种氨基酸的菌液pH与其他菌株之间有显著性差异(P<0.05),说明其产酸能力较强,表现出一定的优越性。通过产生物胺及产酸能力综合分析,选取14-2-1、8-3和5-4进行下一步试验。
† “+”表示反应阳性,“-”表示反应阴性;括号中数字代表产精胺能力强弱,10.0表示能力最强,0.0表示能力最弱。
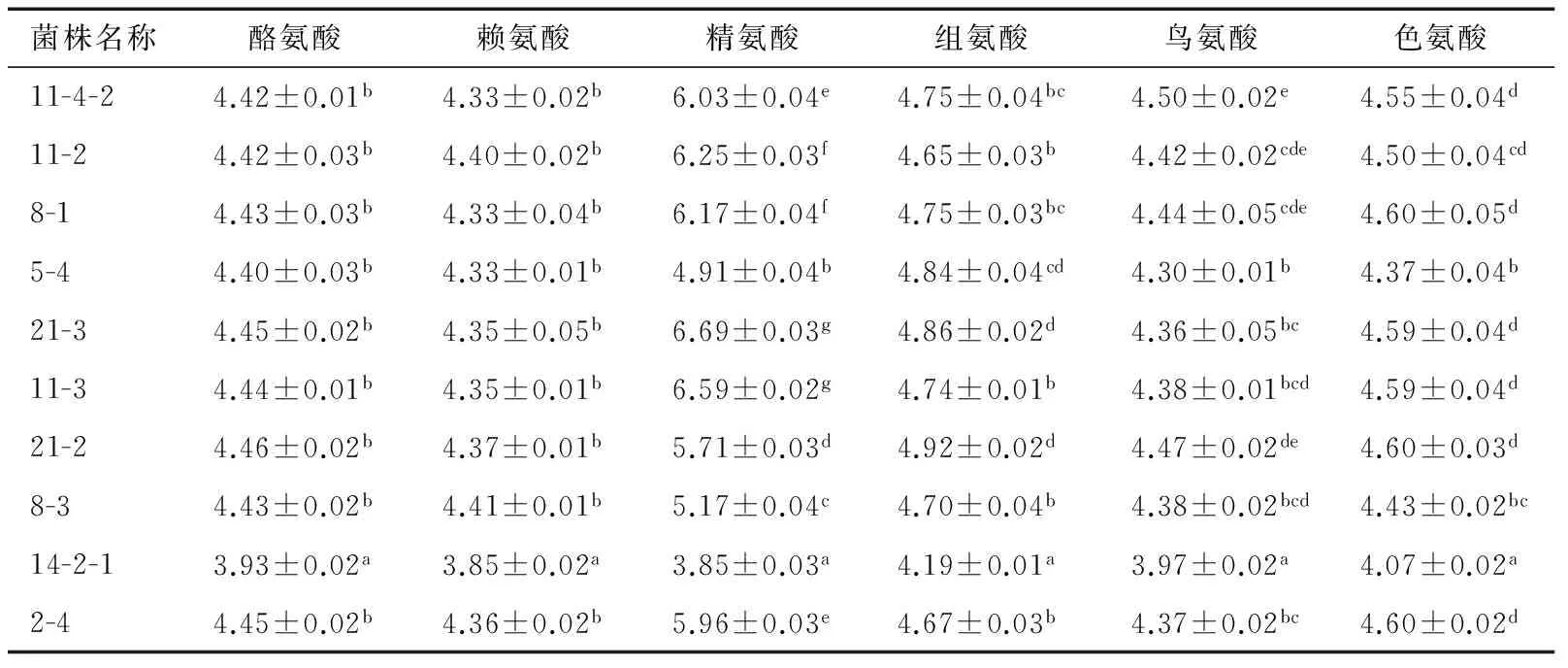
表3 传代3次后的乳酸菌培养液pH变化†Table 3 Changes of pH of Lactobacillus culture
† 同列数据上标不同表示数据之间有显著性差异,P<0.05。
2.2 乳酸菌降解混合生物胺能力的比较
2.2.1 乳酸菌生长曲线 3株乳酸菌的生长曲线见图1,前12 h乳酸菌处于对数生长期,其中乳酸菌14-2-1和8-3的生长速率较快;乳酸菌14-2-1和5-4在18 h开始缓慢生长进入静止期和衰亡期,而乳酸菌8-3在12 h就开始进入静止期和衰亡期;培养结束时,乳酸菌14-2-1的吸光度OD600最大,8-3最小,综上表明乳酸菌14-2-1生长速率最快,繁殖最旺。
2.2.2 乳酸菌对混合生物胺降解能力比较 3株乳酸菌对混合生物胺的降解能力见表4,其中3株菌均不能降解酪胺和精胺,且对亚精胺都有较强的降解能力,培养结束时降解率分别达71.60%,72.21%,68.14%。乳酸菌8-3对腐胺、尸胺、组胺和色胺有一定的降解能力,降解率分别为2.00%,4.99%,10.04%,17.27%,13.40%;乳酸菌5-4对腐胺、尸胺、组胺和色胺有一定的降解能力,降解率分别为4.63%,24.68%,17.07%,14.44%;乳酸菌14-2-1不具有降解腐胺的能力,但对尸胺、组胺和色胺有一定的降解能力,降解率分别为21.58%,29.71%,8.10%。
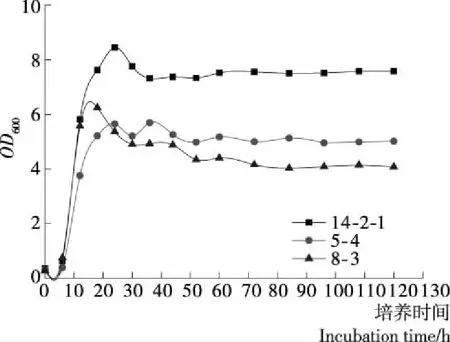
图1 不同乳酸菌生长曲线Figure 1 The growth curve of different Lactobacillus表4 不同乳酸菌对混合生物胺的降解率Table 4 Degradation rate of mixed biogenic amines by different Lactobacillus

%
2.3 不产生物胺乳酸菌的代谢特性分析
酒精会抑制微生物的生长,乳酸菌具备一定的耐酒精胁迫能力,才能保证其在黄酒酿造过程中正常代谢。研究选取3个不同发酵阶段(发酵12,22,45 h)的黄酒发酵液培养乳酸菌,3个阶段黄酒培养液的理化指标见表5。

表5 不同黄酒培养液理化指标检测结果†Table 5 Detection results of different fermentation mash
† A、B、C分别代表发酵12,22,45 h 的黄酒醪液。
2.3.1 乳酸菌在黄酒培养液的生长能力比较 在A中培养时,在2.50%Vol的酒精度下,菌株浓度达到相当水平(图2),3株菌株均能正常生长代谢。在B中培养时,菌株5-4 和8-3已经受到了抑制,OD600明显低于菌株14-2-1。在C中培养时,因为酒精度较高(15.70%Vol),还原糖含量只有6.68 g/L,3株菌均受到了严重的抑制,几乎不再生长,所以在黄酒后酵过程不会对黄酒有太大影响。
2.3.2 乳酸菌14-2-1的产酸特性 将乳酸菌14-2-1用MRS液体培养基培养24 h,对最终培养液进行有机酸含量检测,以0 h未接种乳酸菌的培养液为对照,结果见表6。乳酸菌14-2-1具有较强的产乳酸能力,并能产生一定的乙酸;同时,培养结束后产生大量气泡,表明菌株14-2-1属于异型发酵乳酸菌。
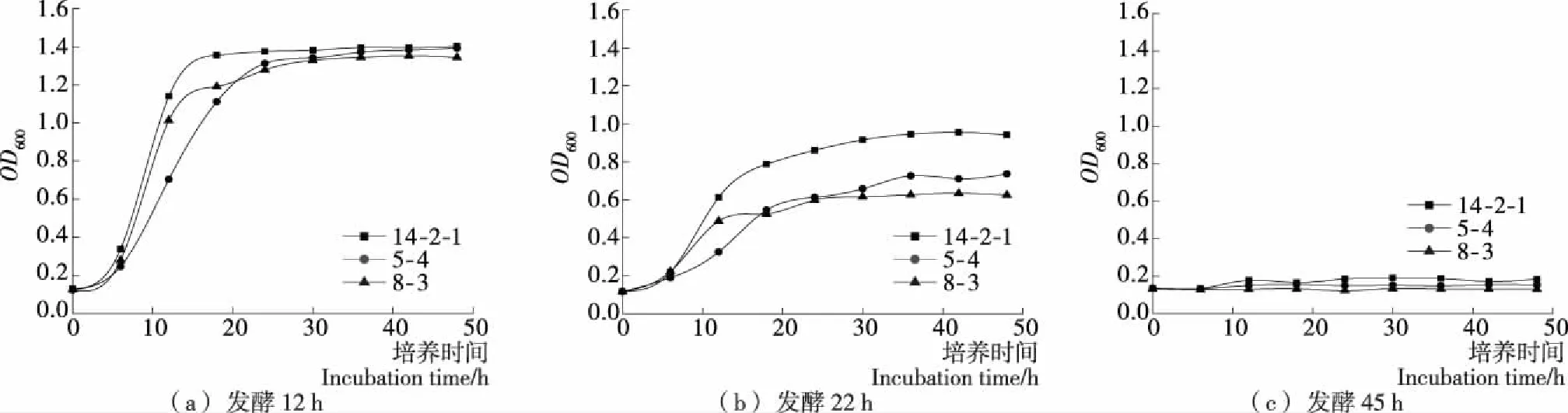
图2 乳酸菌在不同黄酒培养液中的生长曲线Figure 2 The growth curve of Lactobacillus in different fermentation mash
2.4 乳酸菌14-2-1的分子生物学鉴定
菌株14-2-1经PCR扩增得到的16S rDNA片段,经琼脂糖凝胶电泳后,在凝胶上出现了一条约1 500 bp的条带,接着对扩增后的PCR产物进行测序分析。测序结果表明,菌株14-2-1的16S rDNA序列共1 429 bp。用MEGA 7.0软件和Neighbor-joining法构建系统发育树见图3,菌株14-2-1与Lactobacillusplantarumstrain BCH-2的亲缘关系较近,可以确定是植物乳杆菌(Lactobacillusplantarum)。
2.5 植物乳杆菌14-2-1降低黄酒生物胺能力验证
将植物乳杆菌14-2-1应用于黄酒酿造中,采用传统浸米酿造工艺进行落料发酵,其中植物乳杆菌14-2-1(MRS液体培养基直接培养获得的活菌液)的添加量分别为生米质量的0.1,1.0,5.0,10.0,50.0,100.0 mL/kg,以不添加植物乳杆菌为对照样。不添加乳酸菌的对照组发酵指标与正常酿造黄酒无差异[23],发酵过程见表7,随着植物乳杆菌14-2-1添加量的增加,总酸含量越高,还原糖残留越多,而生物胺含量越低,表明植物乳杆菌14-2-1产酸可有效抑制杂菌的代谢,从而降低黄酒酿造过程中的生物胺含量。
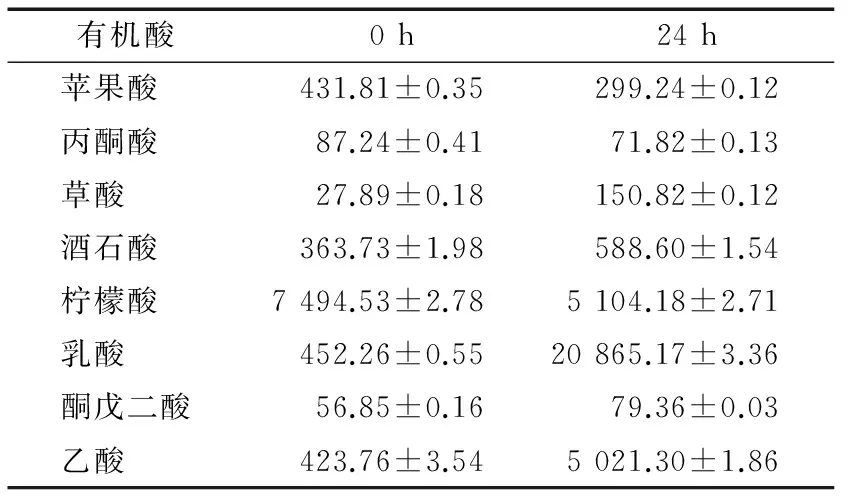
表6 乳酸菌14-2-1的产酸特性Table 6 Acid production characteristic of Lactobacillus 14-2-1 mg/L

表7 不同发酵工艺发酵醪指标的检测Table 7 Detection results of fermentation mash with different crafts

图3 基于16S rDNA序列构建的系统进化树Figure 3 Phylogenetic tree based on the sequence homology of 16S rDNA gene
3 结论
本研究从黄酒发酵醪液中分离、培养纯化获得3株具有一定生物胺降解能力的菌株,其中菌株14-2-1生长速率最快,繁殖最旺。在黄酒发酵液中培养该3株菌,发现在2.50%Vol 的黄酒培养液中,3株菌吸光度OD600达到相当水平,能正常生长;在8.80%Vol黄酒培养液中,菌株5-4和8-3受到一定抑制,吸光度OD600明显低于菌株14-2-1;在15.70%Vol 黄酒培养液中,3株菌均受到严重抑制,几乎不再生长。其中,菌株14-2-1产酸能力较强,产酸速率较快,表现出一定的优越性,经鉴定为植物乳杆菌,能够有效降低黄酒中生物胺含量,为今后研究降低黄酒中生物胺含量提供了理论支持。
[1] 毛青钟. 黄酒和清酒生产问答[M]. 北京: 中国轻工业出版社, 2003: 45-47.
[2] QUE Fei, MAO Lin-chun, ZHU Cheng-gang, et al. Antioxidant properties of Chinese yellow wine,its concentrate and volatiles[J]. LWT-Food Science and Technology, 2006, 39(2): 111-117.
[3] 毛青钟, 宣贤尧. 绍兴黄酒的酿造特点[J]. 中国酿造, 2006, 25(4): 5-8.
[4] 张微, 李秀缺, 陆容, 等. 浅谈食品中生物胺的检测方法[J]. 食品工程, 2007(4): 55-57.
[5] 赵中辉. 水产品贮藏过程中生物胺的变化及组胺形成机制的研究[D]. 青岛: 中国海洋大学, 2011: 15-16.
[7] MARCOBAL A, DE L R B, MORENO-ARRIBAS M V, et al. Evidence for horizontal gene transfer as origin of putrescine production in Oenococcus oeni RM83[J]. Applied and Environmental Microbiology, 2006, 72(12): 7 954-7 958.
[8] COTON M, ROMANO A, SPANO G, et al. Occurrence of biogenic amine-forming lactic acid bacteria in wine and cider[J]. Food Microbiology, 2010, 27(8): 1 078-1 085.
[9] PESSIONE E, MAZZOLI R, GIUFFRIDA M G, et al. A proteomic approach to studying biogenic amine producing lactic acid bacteria[J]. Proteomics, 2005, 5(3): 687-698.
[10] 张敬, 赵树欣, 薛洁, 等. 发酵型饮料酒中生物胺含量的调查与分析[J]. 食品与发酵工业, 2012, 38(6): 165-170.
[12] GUO Xue-wu, GUAN Xiang-yu, WANG Ya-zhou. Reduction of biogenic amines production by eliminating the PEP4 gene inSaccharomycescerevisiaeduring fermentation of Chinese rice wine[J]. Food Chemistry, 2017, 178: 208-211
[13] 李家寿. 黄酒色、香、味成分来源浅析[J]. 酿酒科技, 2001(3): 48-50.
[14] 王家林, 张颖, 于秦峰. 黄酒风味物质成分的研究进展[J]. 酿酒科技, 2011(8): 96-98.
[15] 李平兰, 张篪, 江汉湖. 乳酸菌细菌素研究进展[J]. 微生物学通报, 1998, 25(5): 295-298.
[16] LIU Shuang-ping, YU Jian-xin, WEI Xiao-lu, et al. Sequenc-ing-based screening of functional microorganism to decrease the formation of biogenic amines in Chinese rice wine[J]. Food Control, 2016, 64: 98-104.
[17] BOVER-CID S, HOLZAPFEL W H. Improved screening procedure for biogenic amine production by lactic acid bacteria[J]. International Journal of Food Microbiology, 1999, 53(1): 33.
[18] 周韩玲, 杜丽平, 孟镇, 等. 黄酒发酵醪中产生物胺乳酸菌的分离鉴定与评价[J]. 食品与发酵工业, 2011, 37(8): 47-50.
[19] 章银珠. 陈化黄酒腐败微生物分离鉴定和特性研究[D]. 无锡: 江南大学, 2008: 18-19.
[20] 吴燕燕, 钱茜茜, 陈玉峰, 等. 咸鱼中生物胺降解菌的筛选与降解特性研究[J]. 食品工业科技, 2016, 37(18): 173-179.
[21] 刘芸雅. 绍兴黄酒发酵中微生物群落结构及其对风味物质影响研究[D]. 无锡: 江南大学, 2015: 16-17.
[22] 华永有, 周芬霞, 林宏琳, 等. HPLC-FLD法检测黄酒中9种生物胺[J]. 中国卫生检验杂志, 2014(6): 761-764.
[23] 姬中伟, 黄桂东, 毛健, 等. 浸米时间对黄酒品质的影响[J]. 食品与机械, 2013, 29(1): 49-52.
StudyonisolationandapplicationoflacticacidbacteriawithoutbiogenicamineformationfromChinesericewine
In order to screen the strains without producing biogenic amines, some microorganisms were isolated from the fermentation mash and rice soaking water of Chinese rice wine. It was found that three strains had no amino acid decarboxylase activity, and had a certain ability of biogenic amines degradation. Moreover, the metabolic characteristics of the three strains were analyzed. The results showed thatOD600of the three strains reached a considerable level in the culture medium of 2.50%Vol. In the 8.80%Vol culture medium, strains 5-4 and 8-3 were inhibited whoseOD600was significantly lower than that of strain 14-2-1. In 15.70%Vol culture medium, the three strains were seriously inhibited and scarcely grew. The strain 14-2-1 identified asLactobacillusplantarumhad better acid production capacity, showing a certain superiority. Therefore, strain 14-2-1 could be used in Chinese rice wine brewing, and effectively reduce the biogenic amines of Chinese rice wine.
lactic acid bacteria; biogenic amine; screening; sequencing; identification
国家自然科学基金面上项目(编号:31771968,31701593, 31571823);国家重点研发计划(编号:2016YFD0400504,2017YFD0400103);江苏省自然科学基金-面上研究项目(编号:BK20171405,BK20161293);金山区企业产学研科技成果转化项目(编号:2016-CXY-01)
徐建芬,女,上海金枫酒业股份有限公司中级工程师,本科。
刘双平(1986—),男,江南大学副教授,博士。
E-mail:liushuangping668@126.com
2017—05—10
10.13652/j.issn.1003-5788.2017.09.005

