有机酸-湿热复合处理土豆抗性淀粉的益生特性
刘 旸 李晓文 - 祝 红 谢 涛 易翠平 -
(1. 长沙理工大学化学与生物工程学院,湖南 长沙 410015;2. 湖南工程学院化学化工学院,湖南 湘潭 411104) (1. College of Chemistry and Biology Science, Changsha University of Science & Technology, Changsha, Hunan 410015,China; 2. College of Chemical Engineering, Hunan Institute of Engineering, Xiangtan, Hunan 411104, China)
有机酸-湿热复合处理土豆抗性淀粉的益生特性
刘 旸1LIUYang1李晓文1LIXiao-wen1祝 红1ZHUHong1谢 涛2XIETao2易翠平1YICui-ping1
(1. 长沙理工大学化学与生物工程学院,湖南 长沙 410015;2. 湖南工程学院化学化工学院,湖南 湘潭 411104) (1.CollegeofChemistryandBiologyScience,ChangshaUniversityofScience&Technology,Changsha,Hunan410015,
China; 2.CollegeofChemicalEngineering,HunanInstituteofEngineering,Xiangtan,Hunan411104,China)
采取有机酸-湿热复合处理制备了土豆抗性淀粉(AH-HMT RS3),重点研究了有机酸种类及浓度、淀粉乳浓度对土豆AH-HMT RS3中慢速消化淀粉(SDS)、抗性淀粉(RS)的形成及其益生作用的影响。结果表明:无酸湿热处理土豆淀粉时,淀粉乳浓度对SDS、RS的形成几乎无影响;与无酸湿热复合处理相比,无论淀粉乳浓度高低,4种有机酸-湿热复合处理所得土豆AH-HMT RS3中RS含量增高了21.89%~45.09%,且高浓度酸比低浓度酸更能促进RS的生成,促进RS水平增高程度从大到小依次为柠檬酸、乙酸、琥珀酸和乳酸。随着土豆AH-HMT RS3中RS含量增加,其对双歧杆菌、乳酸杆菌的增殖作用更大,更能促进短链脂肪酸(SCFAs)特别是丁酸的大量产生。因此,土豆AH-HMT RS3具有开发成为新益生素的潜力。
土豆;抗性淀粉;有机酸-湿热复合处理;益生特性
根据被酶消化的速率,淀粉可分为快速消化淀粉(RDS)、慢速消化淀粉(SDS)和抗性淀粉(RS)三类。RDS和SDS在消化道内能完全消化,而RS对小肠的消化与吸收具有抗性,但在大肠内能被肠道微生物发酵形成短链脂肪酸(SCFAs),主要是乙酸、丙酸和丁酸[1]。RS的发酵产物有助于预防结肠癌、降低心脏病风险、影响代谢和炎性肠疾病如糖尿病、憩室炎。SDS也具有潜在的保健功能,如稳定糖代谢、控制糖尿病、调节心理、消除饱腹感[1-2]。
鉴于RS与SDS的益生作用,已有许多研究[3-5]报道了如何提高不同来源淀粉中SDS和RS的含量。湿热处理(HMT)就是其中最常见的方法,其影响因素有加热温度、湿含量、加热时间、淀粉来源、直链淀粉含量、链长分布和淀粉结晶度等。除此之外,与单纯湿热处理比,如果在湿热处理之前将淀粉部分酸水解,则可以进一步提高RS的产量[4,6]。据研究[7-10],柠檬酸溶液在高温下处理淀粉可提高SDS和RS的含量。
尽管已有许多关于柠檬酸-湿热处理提高淀粉中SDS和RS含量的研究报道[11-13],但有关不同有机酸影响淀粉中SDS和RS形成的研究仍非常有限。而多数有机酸处理都能改变淀粉的内部结构和理化性质,产生更多的短链、形成具有不同熔点的结晶体、增加表观直链淀粉含量和冷水溶解性。因此,本试验旨在研究在不同湿含量(或淀粉乳浓度)条件下采用不同有机酸(柠檬酸、乙酸、琥珀酸和乳酸)-湿热复合处理土豆淀粉,测定其对SDS、RS形成以及对肠道益生菌增殖和SCFAs产生的影响,以期为全新土豆淀粉类益生因子的开发提供理论依据。
1 材料与方法
1.1 材料与试剂
淀粉:土豆淀粉,四川友嘉食品有限公司;
营养培养基:9.240 g NaHCO3、7.125 g Na2HPO4·12H2O、0.470 g NaCl、 0.450 g KCl、0.100 g Na2SO4、0.055 g CaCl2、0.047 g MgCl2和0.400 g 尿素溶解于990 mL碳酸盐缓冲液中,并与10 mL微量元素溶液[含36.8 mg FeSO4·7H2O、19.00 mg MnSO4·7H2O、4.40 mg ZnSO4·7H2O、1.20 mg CoCl2·6H2O、1.98 mg CuSO4·5H2O和0.17 mg Mo7(NH4)6O24·4H2O]混匀;
分离培养基:TP选择性培养基(Bifidobacteriasp)和LBS选择性培养基(Lactobacilli),美国Life Tech公司;
淀粉转葡萄苷酶:400 AGU/mL,丹麦Novozymes公司;
转化酶:20万 SU/g,丹麦Novozymes公司;
猪胰液素、葡萄糖氧化酶/过氧化物酶(GOPOD)试剂盒:美国Sigma-Aldrich公司;
柠檬酸、乙酸、琥珀酸、乳酸:食用级,苏州奥德赛化学品有限公司;
其他试剂均为分析纯。
1.2 酸-湿热复合处理
参照文献[13]的方法,修改如下:称取适量土豆淀粉置于500 mL锥形瓶中,分散到水中制成淀粉乳(淀粉∶水质量比1∶3.5或1∶1),分别加入柠檬酸、乙酸、琥珀酸、乳酸4种有机酸(0.25%和0.50%,干基),混合均匀,将混合淀粉乳液置于高压灭菌锅中110 ℃加热1 h。冷却至室温,储存在4 ℃ 的环境中12 h,再次循环,将产品置于40 ℃干燥箱烘干,粉碎,过120目筛,即得土豆抗性淀粉(RS3)。
1.3 RDS、SDS与RS含量的测定
参照文献[12]和[14]的方法,修改如下:称取50 mg重结晶淀粉粉末放入15 mL离心管,取2.5 mL含0.02%叠氮钠、pH 5.2的盐酸-醋酸钠缓冲液混匀,预热至37 ℃。将8 g 猪胰α-淀粉酶溶于10 mL上述缓冲液中,于37 ℃孵育10 min,1 500×g离心得到的上清液即为α-淀粉酶溶液。使用前在α-淀粉酶溶液中混入125 μL(300 U/mL)淀粉葡萄糖酶即得混合酶液。5份200 μL混合酶液与100 μL淀粉乳液的混合液配制后,立即置于37 ℃往复式振荡水浴(振幅35 mm,每分钟振荡170次)中依次反应0,20,60,120,180 min,加入96%的乙醇溶液900 μL钝化酶活性并使之沉淀。沉淀在4 ℃贮放1 h,4 ℃、5 000×g离心10 min。上清液中的还原糖含量采用葡萄糖氧化酶/过氧化物酶(GOPOD)试剂盒测定。
快速消化淀粉、缓慢消化淀粉和抗性淀粉含量由0(G0),20(G20),120(G120) min时的葡萄糖含量以及样品的初始干重(S)按式计算:
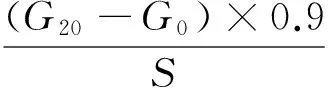
(1)
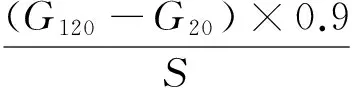
(2)
RS=1-(RDS+SDS),
(3)
式中:
RDS——快速消化淀粉含量,%;
SDS——缓慢消化淀粉含量,%;
RS——抗性淀粉含量,%;
G0——0 min时葡萄糖含量,mg;
G20——20 min时葡萄糖含量,mg;
G120——120 min时葡萄糖含量,mg;
S——样品的初始干重,mg。
1.4 体外厌氧发酵
1.4.1 混合酶液配制 2.8 mL淀粉转葡萄苷酶用蒸馏水稀释至8 mL(酶活力为140 AGU/mL)。4支离心管中每支放入1.8 g猪胰液素,分别用20 mL蒸馏水悬浮混匀,离心管振动10 min后于1 500×g离心10 min。从每支离心管中取出13.5 mL上清液合并得54 mL,再与6 mL稀淀粉转葡萄苷酶溶液、4 mL转化酶混合。
1.4.2 酶解消化 称取1 g抗性淀粉放入50 mL带盖试管中,加入0.1 mol/L的醋酸盐缓冲液(pH 5.2)20 mL混合。将带盖试管放入沸水浴中振荡糊化10 min,取出于冰浴中冷却至37 ℃,放入5粒玻璃珠(Φ5 mm),再移入37 ℃水浴中平衡20 min。加入5 mL混合酶液,带盖试管置于水平振荡摇床(振幅35 mm,每分钟振荡160次)上消化6 h。之后移入85 ℃水浴中维持15 min钝化酶。在带盖试管中加入95%的乙醇300 mL沉淀未消化淀粉,离心收集未消化淀粉,干燥粉碎过120目筛,用于厌氧发酵。
1.4.3 厌氧发酵 参照文献[15]的方法,修改如下:取年龄23~31岁健康男子(此前至少3个月以上未注射抗生素,没有预先服用已知的益生元或益生菌,没有胃肠病史)的粪便,贮存于充满CO2的气瓶中。粪便按1∶5 (g/mL)与营养培养基混合均匀,并用6层医用纱布过滤。称取100 mg混合酶液消化的样品(唯一碳源)放入15 mL带盖试管中,加入10 mL 粪便滤液。同时制作一份加入粪便滤液的空白。在37 ℃水浴中鼓入CO2以维持发酵所需的厌氧环境。为使接种物分布均匀,每12 h振动带盖试管20 s。
1.4.4 活细菌计数 用厌氧稀释液将种子培养液稀释至合适的浓度,接种每个选择性培养基,然后在好氧或厌氧条件下培养。培养36 h,每12 h活菌计数一次。
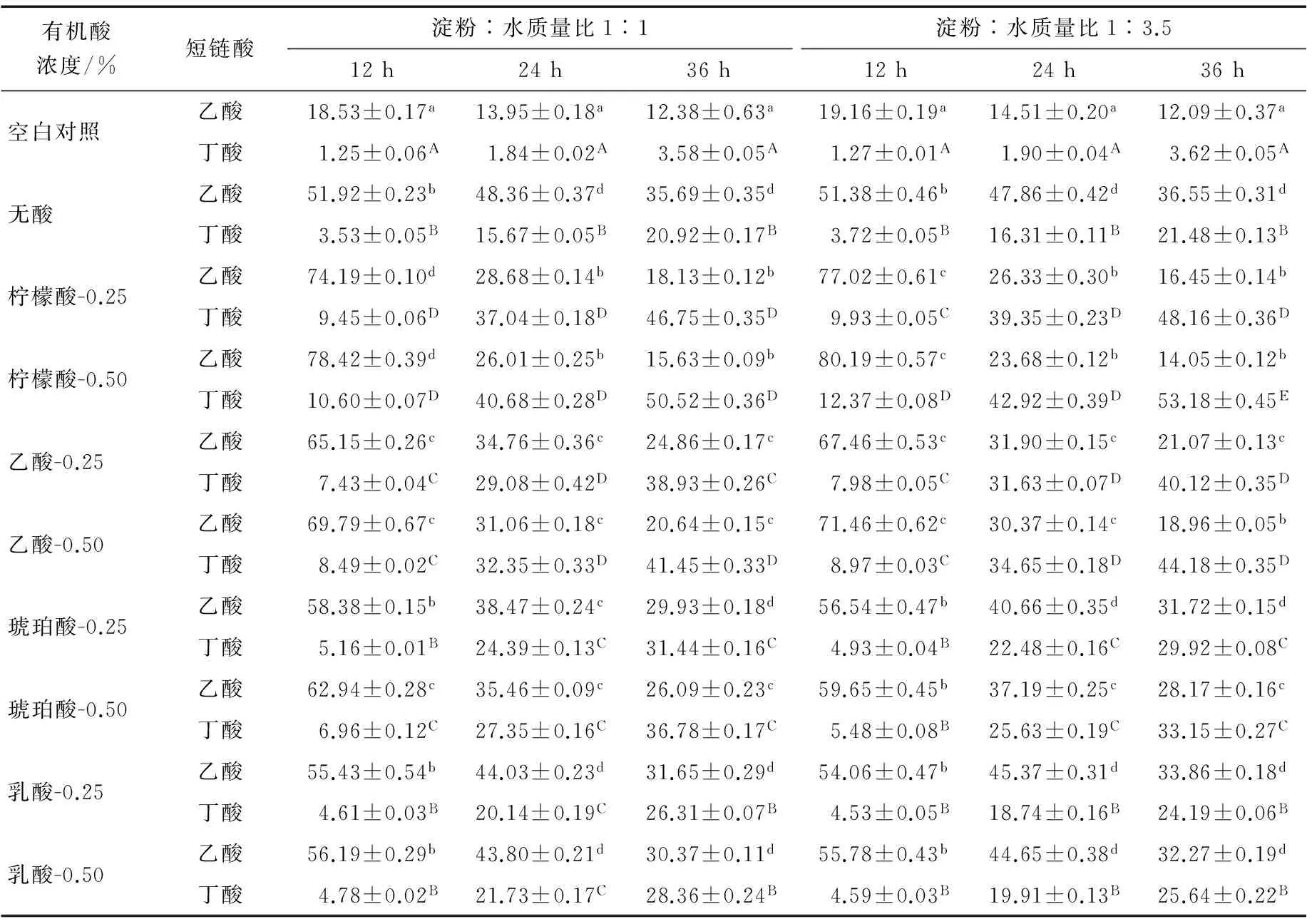
1.4.5 短链脂肪酸(SCFA)分析 参照文献[16],总短链脂肪酸含量以乙酸、丙酸与丁酸的总和表示。
1.4.6 数据处理 所有数据为3个平行试验的平均值,且采用SPSS 20.0进行显著性分析。
2 结果与分析
2.1 RDS、SDS与RS含量
研究[17-18]发现通过向淀粉浆中加入有机酸(如柠檬酸)可以提高RS3中的RS含量,因为有机酸通过羟基使淀粉分子酯化,酸水解支链淀粉的分支点,淀粉结构的改变对酶消化产生抗性。湿热处理常被用于增加颗粒结构完整的淀粉中SDS和RS的含量[3]。如果继续对经有机酸或淀粉酶类处理的淀粉进行加热、冷却处理,可以大幅增加RS3中RS含量[19-20]。由表1可知,无论淀粉乳浓度高低,4种有机酸-湿热复合处理所得土豆RS3中RS的含量(54.96%~78.64%)都显著高于无酸湿热处理的(P<0.01),说明有机酸-湿热复合处理有利于促进RS的生成。而且高浓度酸比低浓度酸对RS生成的影响相对要显著些,它们对土豆RS3中RS生成的影响程度从大到小依次为柠檬酸、乙酸、琥珀酸和乳酸。经有机酸-湿热复合处理得到的土豆RS3中RS含量增加,也可能是酸水解产生了低分子质量的水解产物(既有来自直链淀粉的线性分子,也有来自支链淀粉的分支链与直链分子),它们在湿热作用下通过直链—直链、支链—支链、直链—支链分子之间的相互作用形成双螺旋和区室化结构,限制了酶的水解[5,16];而且,有机酸与淀粉的酯化反应可能在淀粉分子链之间形成对酶水解具有抗性的交联结构[8]。另外,与无酸湿热处理相比,有机酸-湿热复合处理后RDS含量显著减少(P<0.01),而SDS含量有降(柠檬酸和乙酸处理)有升(琥珀酸和乳酸处理),可能是有机酸-湿热处理淀粉中RDS和/或SDS更多地转化成了对消化酶水解具有抗性的RS。在有机酸浓度不变情况下,柠檬酸或乙酸处理时,低浓度淀粉乳更能促进RS的生成,而琥珀酸或乳酸处理时,结果正好相反。
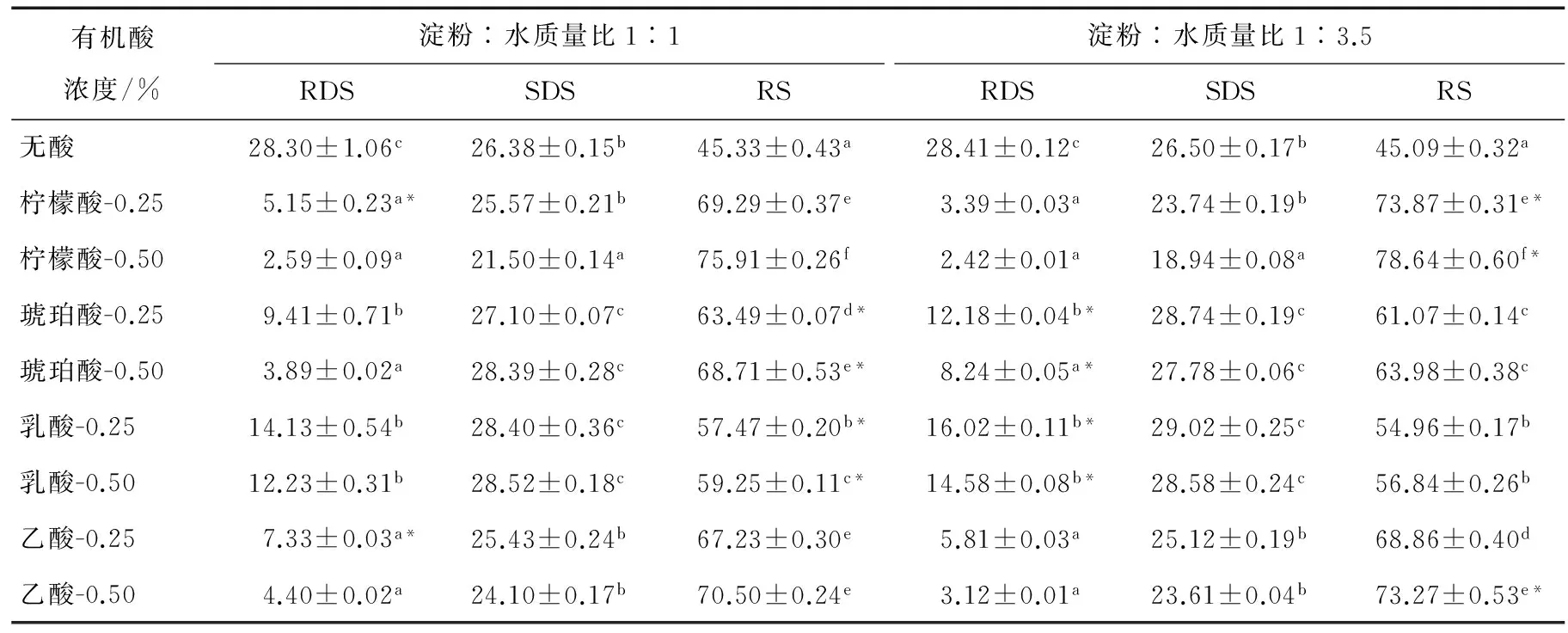
表1 无酸和有机酸-湿热处理土豆淀粉的RDS、SDS与RS含量†Table 1 RDS, SDS and RS of potato starches without and with acid and heat-moisture treatments %
† 上标字母表示同列数据具有显著性差异(P<0.05);*表示同种酸浓度、不同淀粉含量的同类淀粉含量具有显著性差异(P<0.05)。
2.2 肠道菌群的变化
RS在人体大肠内能被不同的微生物发酵利用,涉及各种代谢过程,包括厌氧微生物降解有机质产生代谢能用于菌体生长,改善肠道微生物菌群的结构[21]。由表2可知,与空白对照相比,无酸-湿热处理所得土豆RS3对双歧杆菌与乳酸杆菌有较好的增殖作用(0.01 2.3 短链脂肪酸的产生 RS主要的末端代谢产物是短链脂肪酸(SCFAs)、气体(CO2、CH4、H2)和热量。SCFAs对宿主能产生重要的生理作用,如降低胞内pH值,促进矿物质吸收,减少结肠内次级代谢产物胆汗酸的生成,以及改善大肠内微生物菌群分布等[1,24-25]。在SCFAs中,丁酸是大肠细胞优先的能量来源,能抑制肠癌细胞的扩散[1]。有关RS促进SCFAs生产与改善微生物菌群分布的研究始终不断,RS作为唯一碳源对丁酸的生成有很强的影响[22,26]。由表3可知。空白对照在整个发酵过程中产酸一直维持在低水平(P>0.05),但以无酸、有机酸-湿热处理所得土豆RS3作为唯一碳源时,随着RS3中RS含量的增加,不仅产酸水平显著高于空白对照(P<0.01),而且前期(0~12 h)积累的乙酸在发酵后期(24~36 h)显著减少(P<0.01),同时伴随后期丁酸水平的显著提高(P<0.01)。这些结果与已有文献[1,21,27]报道是一致的。 表2 大便接种物分批发酵过程中双歧杆菌与乳酸杆菌计数变化†Table 2 Changes in bifidobacteria and lactobacilli counts during fecal batch fermentations lg(CFU/mL) † 上标小写字母表示同列数据双歧杆菌具有显著性差异(P<0.05);上标大写字母表示同列数据乳酸杆菌具有显著性差异(P<0.05)。 表3 大便接种物分批发酵过程中乙酸与丁酸的变化†Table 3 Changes in acetic acid and butyric acid during fecal batch fermentation mmol/L † 上标小写字母表示同列数据乙酸具有显著性差异(P<0.05);上标大写字母表示同列数据丁酸具有显著性差异(P<0.05)。 通过对比4种有机酸-湿热复合处理土豆RS3中RS的含量变化,证明了在湿热处理前用有机酸水解淀粉能有效地提高RS的产量,且4种有机酸对RS生成的提升幅度大小顺序依次为柠檬酸、乙酸、琥珀酸和乳酸。同时发现采取有机酸-湿热复合处理制备的土豆抗性淀粉因RS含量增加,能有效地改善肠道微生物菌群结构,从而提高了具有重要生理作用的SCFAs含量,体现了土豆AH-HMT RS3的益生性。但未对不同有机酸前处理促进RS生成时对淀粉乳浓度高低需求的不一致做出研究,此外关于土豆RS3的未消化部分是如何促进肠道菌群生长也非常值得探索,或许与肠道复杂的菌群结构有关。 [1] TOPPING D L, CLIFTON P M. Short-chain fatty acids and human colonic function: Roles of resistant starch and nonstarch polysaccharides [J]. Physiological Reviews, 2001, 81(3): 1 031-1 064. [2] LEHMANN U, ROBIN F. Slowly digestible starch-its structure and health implications: A review [J]. Trends in Food Science and Technology, 2004, 18(7): 346-355. [3] ZAVAREZE E R, DIAS A R G. Impact of heat-moisture treatment and annealing in starches: A review [J]. Carbohydrate Polymers, 2011, 83(2): 317-328. [4] BRUMOVSKY J O, THOMPSON D B. Production of boiling-stable granular resistant starch by partial acid hydrolysis and hydrothermal treatments of high amylose maize starch [J]. Cereal Chemistry, 2001, 78(6): 680-689. [5] CHUNG Hyun-jung, LIU Qiang, HOOVER R. Impact of annealing and heat-moisture treatment on rapidly digestible, slowly digestible and resistant starch levels in native and gelatinized corn, pea and lentil starches [J]. Carbohydrate Polymers, 2009, 75(3): 436-447. [6] SHIN S I, BYUN J, PARK K H, et al. Effect of partial acid hydrolysis and heat-moisture treatment on formation of resistant tuber starch [J]. Cereal Chemistry, 2004, 81(2): 194-198. [7] LIU Huan, LIANG Rong, ANTONIOU J, et al. The effect of high moisture heat-acid treatment on the structure and digestion property of normal maize starch [J]. Food Chemistry, 2014, 159(11): 222-229. [8] SHIN S I, LEE C J, KIM D I, et al. Formation, characterization, and glucose response in mice to rice starch with low digestibility produced by citric acid treatment [J]. Journal of Cereal Science, 2007, 45(1): 24-33. [9] XIE Xue-ju, LIU Qiang. Development and physicochemical characterization of new resistant citrate starch from different corn starches [J]. Starch/Stoke, 2004, 56(8): 364-370. [10] SHIN S I, LEE C J, KIM M J, et al. Structural characteristics of low-glycemic response rice starch produced by citric acid treatment [J]. Carbohydrate Polymers, 2009, 78(3): 588-595. [11] HUNG P V, VIEN N L, PHI N T L. Resistant starch improvement of rice starches under a combination of acid and heat-moisture treatments [J]. Food Chemistry, 2016, 191: 67-73. [12] SUN Qing-jie, ZHU Xiao-lei, SI Fu-mei, et al. Effect of acid hydrolysis combined with heat moisture treatment on structure and physicochemical properties of corn starch [J]. J Food Sci Technol, 2015, 52(1): 375-382. [13] KIM W, SHIN M. Effects of organic acids and starch water ratios on the properties of retrograded maize starches [J]. Food Sci Biotechnol, 2011, 20(4): 1 013-1 019. [14] 谢涛, 曾红华, 汪婕, 等. 4种抗性淀粉的主要理化特性[J]. 中国粮油学报, 2014, 29(9): 78-84. [15] 谢涛, 张淑远. 重结晶红薯淀粉体外消化前后益生作用与结构变化[J]. 农业机械学报, 2013, 44(8): 203-208. [16] HOOVER R, VASANTHAN T. The flow properties of native, heat moisture treated and annealed starches from wheat, oat, potato and lentil [J]. J Food Biochem, 2010, 18(2): 67-82. [17] GURAYA H S, JAMES C, CHAMPAGNE E T. Effect of cooling and freezing on the digestibility of debranched rice starch and physical properties of the resulting material [J]. Starch/Stärke, 2015, 53(2): 64-74. [18] MUN S H, SHIN M. Mild hydrolysis of resistant starch from maize [J]. Food Chem, 2006, 96(1): 115-121. [19] PONGJANTA J, UTAIPATTANACEEP A, NAIVIKUL O. Debranching enzyme concentration effected on physicochemical properties andα-amylase hydrolysis rate of resistant starch type III from amylose rice starch [J]. Carbohyd Polym, 2009, 78(1): 5-9. [20] LEE S K, MUN S H, SHIN M. Enzyme-resistant starch formation from mild acid-treated maize starches [J]. Korean J Food Sci Technol, 1997, 29(6): 1 309-1 315. [21] HIGGINS J A, BROWN I L. Resistant starch: a promising dietary agent for the prevention/treatment of inflammatory bowel disease and bowel cancer [J]. Curr Opin Gastroenterol, 2013, 29(2): 190-194. [22] WANG X, BROWN I L, KHALED D, et al. Manipulation of colonic bacteria and volatile fatty acid production by dietary high amylose maize (amylomaize) starch granules [J]. J Appl Microbiol, 2002, 93(3): 390-397. [23] BAE C H, PARK M S, JI G E, et al. Effects of phosphorylated cross-linked resistant corn starch on the intestinal microflora and short chain fatty acid forming during in vitro human fecal batch culture [J]. Food Sci Biotechnol, 2013, 22(6): 1 649-1 654. [24] SCHWIERTZ A, LEHMANN U, JACOBASCH G, et al. Influence of resistant starch on the SCFA production and cell counts of butyrate producingEubacteriumspp. in the human intestine [J]. J Appl Microbiol, 2002, 93(1): 157-162. [25] HYLLA S, GOSTNER A, DUSEL G, et al. Effect of resistant starch on the colon in healthy volunteers: possible implications for cancer prevention [J]. Am J Clin Nutr, 1998, 67(1): 136-142. [26] LE BAY G, MICHEL C, BLOTTIERE H M, et al. Enhancement of butyrate production in the rat caecocolonic tract by long-term ingestion of resistant potato starch [J]. Brit J Nutr, 1999, 82(5): 419-426. [27] FUENTES-AARAGOZAE A C, RIQUELME-NAVARRETE M J, SNCHEZ-ZAPATA E, et al. Resistant starch as functional ingredient: A review [J]. Food Research International, 2010, 43(4): 931-942. Probioticpropertiesofpotatoresistantstarchesmodifiedbyacombinationoforganicacidandheat-moisturetreatments Some potato resistant starches (AH-HMT RS3) were made by using acid hydrolysis combined with heat-moisture treatment (AH-HMT), and the effects of different types and concentration of organic acids and the starch slurry concentration on the formation of slowly digestive starch (SDS) and resistant starch (RS) in potato RS3 were investigated. The results demonstrated that the starch slurry concentrations had no effect on the formation of SDS and RS when the potato starches were modified by no acid combined with heat-moisture treatment (HMT). Compared with no acid-HMT, the RS contents in potato AH-HMT RS3 made by AH-HMT increased 21.89%~45.09%, non-influenced by the starch slurry concentration. As to the improvement of RS formation, high acid concentration was better that the lower one. The increased levels of RS from high to low were ordered as citric acid, acetic acid, succinic acid and latic acid. With the increase of RS content, the potato AH-HMT RS3 had stronger effect on the proliferations of bifidobacteria and lactobacilli and could promote more short chain fatty acids (SCFAs), especially butyric acid formation. Therefore, potato AH-HMT RS3 had the developmental potential of a new probotic. Potato resistant starch; Organic acid hydrolysis combined with heat-moisture treatment; Probiotic property 长沙市科技计划项目(编号:Kq1602040) 刘旸,男,长沙理工大学在读硕士研究生。 易翠平(1973—),女,长沙理工大学教授,博士。 E-mail:109823769@qq.com 2017—03—07 10.13652/j.issn.1003-5788.2017.09.007
3 结论

