肌萎缩侧索硬化症患者睡眠障碍及睡眠呼吸障碍特点分析
王芳 黄朝阳 丁岩 李宁 王玉平 詹淑琴
肌萎缩侧索硬化症患者睡眠障碍及睡眠呼吸障碍特点分析
王芳 黄朝阳 丁岩 李宁 王玉平 詹淑琴
目的通过多导睡眠图监测肌萎缩侧索硬化症患者睡眠结构和睡眠呼吸事件,探讨其睡眠障碍和睡眠呼吸障碍特点。方法共36例患者根据是否存在延髓症状分为肢体受累组(14例)和延髓麻痹组(22例),记录一般资料以及睡眠障碍和睡眠呼吸障碍相关主诉,包括入睡困难、睡眠维持困难或早醒、呼吸不畅或鼾症、夜尿症、不宁腿综合征、肌肉疼痛等;Appel肌萎缩侧索硬化症量表(AALS)评价延髓功能、呼吸功能、上下肢肌力和肌肉功能;多导睡眠图监测脑电图、眼动图、心电图、肌电图、体位、鼾声、口鼻气流量、胸腹式呼吸和指端脉搏血氧饱和度,以及睡眠相关参数包括总睡眠时间、睡眠效率、睡眠潜伏期、觉醒次数、非快速眼动睡眠期各期和快速眼动睡眠期比例、睡眠呼吸暂停低通气指数。Pearson相关分析评价快速眼动睡眠期睡眠呼吸暂停低通气指数和周期性腿动与临床资料和AALS评分的相关性。结果延髓麻痹组患者AALS总评分(P=0.007)、延髓功能评分(P=0.000)和呼吸功能评分(P=0.000)高于,上肢肌力(P=0.016)低于肢体受累组。两组患者均出现睡眠结构紊乱,表现为睡眠片段化,其中延髓麻痹组觉醒次数多于(P=0.027)、快速眼动睡眠期比例低于(P=0.009)、周期性腿动次数少于(P=0.020)肢体受累组;两组患者睡眠呼吸障碍主要表现为低通气,其中延髓麻痹组睡眠呼吸暂停低通气指数(P=0.038)、快速眼动睡眠期和非快速眼动睡眠期睡眠呼吸暂停低通气指数(P=0.031,0.049)高于肢体受累组。Pearson相关分析显示,快速眼动睡眠期睡眠呼吸暂停低通气指数与病程(r=0.654,P=0.028)以及AALS总评分(r=0.458,P=0.034)、延髓功能评分(r=0.572,P=0.030)、呼吸功能评分(r=0.756,P=0.002)呈正相关,周期性腿动与病程(r=0.574,P=0.030)以及AALS总评分(r=0.321,P=0.042)、上肢肌肉功能(r=0.656,P=0.028)和下肢肌肉功能(r=0.754,P=0.015)评分呈正相关。结论 肌萎缩侧索硬化症患者存在失眠、睡眠呼吸障碍、周期性肢体运动障碍等多种形式的睡眠障碍。多导睡眠图可以监测到睡眠呼吸障碍,为尽早进行无创性正压通气提供临床依据。
肌萎缩侧索硬化; 睡眠障碍; 多道睡眠描记术
肌萎缩侧索硬化症(ALS)是一种选择性侵犯上下运动神经元的致死性神经变性病,主要表现为延髓、四肢、躯干进行性肌无力和肌萎缩,包括呼吸肌无力[1]。发病率为1~3/10万,患病率为4~6/10万,生存期 3 ~ 5 年,呼吸功能衰竭是最主要死因[2⁃3]。目前,主要以临床表现为基础,结合神经电生理学、神经病理学和神经影像学等多项检查,综合评价后明确诊断,其中,肌电图是公认的明确诊断的必要工具,有助于发现和确定运动神经元受损范围以及肌肉失神经支配和再生现象[4]。肌电图可以给临床医师提供重要诊断信息,但不能反映病程中呼吸功能衰竭的进展情况[5]。既往研究显示,包括肌萎缩侧索硬化症在内的运动神经元病患者均存在睡眠紊乱现象[6⁃7]。此外,肌萎缩侧索硬化症患者呼吸功能障碍在疾病早期即可能存在,部分患者在日间立位时无主观呼吸困难症状,但在夜间睡眠中可以出现呼吸功能障碍[2]。是否出现呼吸功能障碍与疾病预后密切相关,因此,呼吸功能障碍的早期诊断和严重程度的评价即显得尤为重要。夜间多导睡眠图(PSG)是监测睡眠障碍和睡眠呼吸障碍(SDB)的重要方法,主要用于睡眠障碍和睡眠呼吸障碍的诊断[8]。尽管神经肌肉病是多导睡眠图监测的适应范围,但是一直以来并未在此类疾病的诊断中真正发挥作用。本研究采用多导睡眠图监测肌萎缩侧索硬化症患者睡眠障碍和睡眠呼吸障碍,以期为肌萎缩侧索硬化症早期呼吸功能障碍的识别提供新的途径。
资料与方法
一、临床资料
1.纳入标准 (1)肌萎缩侧索硬化症符合世界神经病学联盟(WFN)1998年修订的El Escorial诊断标准[9⁃10],包括确诊的(definite)和拟诊的(possible)肌萎缩侧索硬化症。(2)年龄 > 18 岁。(3)均有睡眠障碍和睡眠呼吸障碍,并行多导睡眠图监测。(4)本研究经首都医科大学宣武医院道德伦理委员会审核批准,所有患者或其家属均知情同意并签署知情同意书。
3.一般资料 选择2010年10月-2014年10月在首都医科大学宣武医院神经内科就诊的确诊的和拟诊的肌萎缩侧索硬化症患者36例,男性22例,女性14例;年龄35~72岁,平均(52.63±10.81)岁;体重指数(BMI)17.92~30.35 kg/m2,平均(22.82±2.89)kg/m2;病程6~36 个月,中位病程12.00(9.50,14.00)个月;肢体瘫痪程度均上肢重于下肢,其中17例表现为肢体无力远端重于近端,10例为肢体无力近端重于远端,9例为肢体无力近端与远端无明显差异。
二、研究方法
1.临床资料采集 详细记录患者性别、年龄、体重指数、病程、首发症状与体征,以及睡眠障碍和睡眠呼吸障碍相关主诉,包括入睡困难、睡眠维持困难或早醒、呼吸不畅或鼾症、夜尿症、不宁腿综合征(RLS)、肌肉疼痛等。
2.Appel肌萎缩侧索硬化症量表评价 所有患者均由同一位神经内科医师采用Appel肌萎缩侧索硬化症量表(AALS)[11]评价其延髓功能、呼吸功能、上下肢肌力和肌肉功能,其中,延髓功能评分为6~30分、呼吸功能评分6~30分、肌力评分为6~36分、上肢肌肉功能评分6~33分、下肢肌肉功能评分6~35分,总评分为30~164分,评分越高、功能缺损越严重。
3.多导睡眠图监测 所有患者于安静、舒适、清洁、温度可调的多导睡眠图监测室内进行睡眠监测,检测前一晚行适应性睡眠,采用澳大利亚Compumedics公司生产的E系57导联多导睡眠图监测系统,监测时间为夜间22:00至次日清晨7:00,连续记录9 h,同时进行6导联脑电图(根据国际10⁃20系统安置电极,分为 F3⁃A2、F4⁃A1、C3⁃A2、C4⁃A1、O1⁃A2、O2⁃A1)、眼动图、心电图、肌电图(颏肌和胫骨前肌)、体位、鼾声、口鼻气流量(压力式和热敏式)、胸腹式呼吸和指端脉搏血氧饱和度(SpO2)监测。并以2007年美国睡眠医学会(AASM)制定的睡眠分期作为睡眠及相关事件判断标准[12],通过计算机辅助产生试验所需的睡眠参数:总睡眠时间(TST),睡眠效率(SE),睡眠潜伏期(SL),觉醒次数,非快速眼动睡眠期(NREM)包括1、2和3期共3期,快速眼动睡眠期(REM),非快速眼动睡眠期各期和快速眼动睡眠期在总睡眠时间中所占比例,睡眠呼吸暂停低通气指数(AHI)。
三、统计分析方法
本研究数据采用SAS 9.2统计软件进行处理与分析。计数资料以相对数构成比(%)或率(%)表示,行Fisher确切概率法。呈正态分布的计量资料以均数±标准差(x±s)表示,行两独立样本的t检验;呈非正态分布的计量资料以中位数和四分位数间距[M(P25,P75)]表示,行 Wilcoxon秩和检验。睡眠呼吸障碍与临床资料和AALS评分的相关性采用Pearson相关分析。以P≤0.05为差异具有统计学意义。
结 果
一、临床资料的比较
36例患者根据是否存在延髓症状分为肢体受累组(单纯累及上肢或同时累及上下肢,无延髓症状)和延髓麻痹组(累及延髓,伴或不伴肢体受累)。(1)肢体受累组:共14例患者,男性10例,女性4例;年龄35~70岁,平均(61.97±7.54)岁;体重指数(BMI)19.42 ~ 24.25 kg/m2,中位值 22.65(20.68,23.40)kg/m2;病程 6~36 个月,中位病程 12.00(10.50,13.75)个月;单纯累及上肢6例,同时累及上下肢8例;伴括约肌功能障碍2例;睡眠障碍和睡眠呼吸障碍主诉主要包括入睡困难(4例,28.57%)、睡眠维持困难或早醒(6例,42.86%)、呼吸不畅或鼾症(4例,28.57%)、夜尿症(6例,42.86%)、不宁腿综合征(5例,35.71%)、肌肉疼痛(4例,28.57%)。(2)延髓麻痹组:共22例患者,男性12例,女性10例;年龄34~72岁,平均为(53.19±10.38)岁;体重指数(BMI)17.92 ~ 30.35 kg/m2,中位值为 22.60(21.15,25.25)kg/m2;病程 6~36 个月,中位病程为 12(8,18)个月;单纯累及延髓3例,同时累及延髓和上肢8例,同时累及延髓和上下肢11例;伴有呼吸困难13例,主要表现为轻度呼吸障碍,仅3例为夜间阵发性呼吸困难或端坐呼吸;伴括约肌功能障碍1例;睡眠障碍和睡眠呼吸障碍主诉包括入睡困难(7例,31.82%)、睡眠维持困难或早醒(10例,45.45%)、呼吸不畅或鼾症(13例,59.09%)、不宁腿综合征(5例,22.73%)、夜尿症(11例,50%)、肌肉疼痛(6例,27.27%)。肢体受累组与延髓麻痹组患者一般资料比较,性别、年龄、体重指数、病程、睡眠障碍和睡眠呼吸障碍相关主诉差异无统计学意义(均P>0.05,表1),均衡可比。
二、Appel肌萎缩侧索硬化症量表的比较
延髓麻痹组患者AALS总评分(P=0.007)、延髓功能评分(P=0.000)和呼吸功能评分(P=0.000)均高于肢体受累组且差异具有统计学意义,表明延髓麻痹患者神经功能缺损更加严重、延髓功能和呼吸功能障碍更加严重;延髓麻痹组患者上肢肌力低于肢体受累组且差异具有统计学意义(P=0.016),表明肢体受累患者上肢肌力下降更加明显;而两组患者握力和侧夹力、上肢肌肉功能评分、下肢肌力和下肢肌肉功能评分比较,差异无统计学意义(均P>0.05,表2)。

表1 延髓麻痹组与肢体受累组患者一般资料的比较Table 1. Comparison of general data between bulbar palsy group and limb involvement group
表2 延髓麻痹组与肢体受累组患者AALS评分的比较(±s,评分)Table 2. Comparison of AALS Scores between bulbar palsy group and limb involvement group(±s,score)
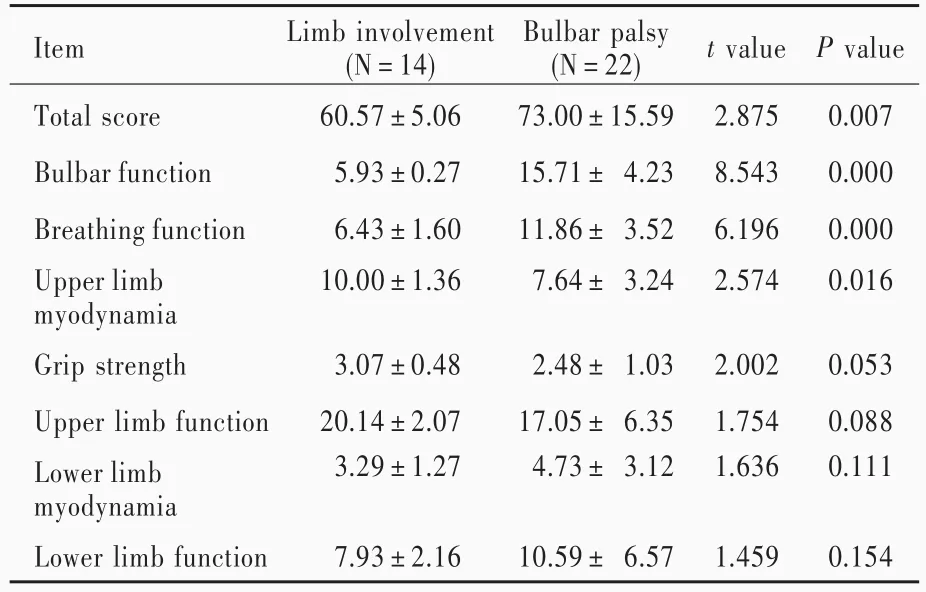
表2 延髓麻痹组与肢体受累组患者AALS评分的比较(±s,评分)Table 2. Comparison of AALS Scores between bulbar palsy group and limb involvement group(±s,score)
Item Total score Bulbar function Breathing function Upper limb myodynamia Grip strength Upper limb function Lower limb myodynamia Lower limb function Limb involvement(N=14)60.57±5.06 5.93±0.27 6.43±1.60 10.00±1.36 3.07±0.48 20.14±2.07 3.29±1.27 7.93±2.16 Bulbar palsy(N=22)73.00±15.59 15.71±4.23 11.86±3.52 7.64±3.24 2.48±1.03 17.05±6.35 4.73±3.12 10.59±6.57 t value 2.875 8.543 6.196 2.574 2.002 1.754 1.636 1.459 P value 0.007 0.000 0.000 0.016 0.053 0.088 0.111 0.154
三、多导睡眠图监测的比较
1.睡眠结构 两组患者均出现睡眠结构紊乱,表现为睡眠连续性中断,呈睡眠片段化,其中延髓麻痹组患者觉醒次数多于(P=0.027)、快速眼动睡眠期比例低于(P=0.009)、周期性腿动(PLM)次数少于(P=0.020)肢体受累组且差异有统计学意义,而睡眠片段化比例、总睡眠时间、睡眠效率、睡眠潜伏期和非快速眼动睡眠期各期比例组间差异无统计学意义(均P>0.05,表3),提示延髓麻痹组患者睡眠质量更差。
2.睡眠呼吸事件 两组患者睡眠呼吸障碍主要表现为低通气,无论是阻塞性、中枢性或是混合性睡眠呼吸暂停均十分少见。延髓麻痹组患者睡眠呼吸暂停低通气指数(P=0.038)、快速眼动睡眠期和非快速眼动睡眠期睡眠呼吸暂停低通气指数(P=0.031,0.049)均高于肢体受累组且差异有统计学意义,而平均指端脉搏血氧饱和度、最低指端脉搏血氧饱和度、平均低通气时间、最长低通气时间组间差异无统计学意义(均P>0.05,表3),提示延髓麻痹组更易出现睡眠呼吸障碍。进一步对快速眼动睡眠期和非快速眼动睡眠期睡眠呼吸暂停低通气指数进行分析,结果显示,延髓麻痹组患者快速眼动睡眠期睡眠呼吸暂停低通气指数高于非快速眼动睡眠期(Z=2.385,P=0.022),表明延髓麻痹患者睡眠呼吸障碍主要发生于快速眼动睡眠期;延髓麻痹组有14例患者(63.64%)快速眼动睡眠期睡眠呼吸暂停低通气指数>5次/h,其中9例(40.91%)>15次/h,即63.64%的延髓麻痹患者于快速眼动睡眠期发生低通气事件,且高达40.91%表现为中重度低通气事件。
四、快速眼动睡眠期睡眠呼吸暂停低通气指数和周期性腿动与临床资料和Appel肌萎缩侧索硬化症量表评分的相关性
Pearson相关分析显示,快速眼动睡眠期睡眠呼吸暂停低通气指数与病程(r=0.654,P=0.028)以及AALS总评分(r=0.458,P=0.034)、延髓功能评分(r=0.572,P=0.030)、呼吸功能评分(r=0.756,P=0.002)呈正相关,而与性别(r=⁃0.345,P=0.487)、年龄(r=⁃0.253,P=0.965)、上肢肌力(r=⁃0.059,P=0.810)和上 肢肌肉 功能评分(r=0.354,P=0.144)、下肢肌力(r=⁃0.077,P=0.755)和下肢肌肉功能评分(r=0.254,P=0.317)均无关联性,表明病程越长、延髓功能和呼吸功能障碍越严重的肌萎缩侧索硬化症患者越易在快速眼动睡眠期出现睡眠呼吸障碍;周期性腿动与病程(r=0.574,P=0.030)以及AALS总评分(r=0.321,P=0.042)、上肢肌肉功能(r=0.656,P=0.028)和下肢肌肉功能(r=0.754,P=0.015)评分呈正相关,而与性别(r=⁃0.418,P=0.679)、年龄(r=⁃0.014,P=0.835)、延髓功能评分(r=⁃0.047,P=0.963)、呼吸功能评分(r=⁃0.241,P=0.724)、上肢肌力(r=⁃0.152,P=0.511)、下肢肌力(r=0.285,P=0.211)均无关联性,表明病程越长、上下肢肌肉功能障碍越严重的肌萎缩侧索硬化症患者越易出现周期性腿动。
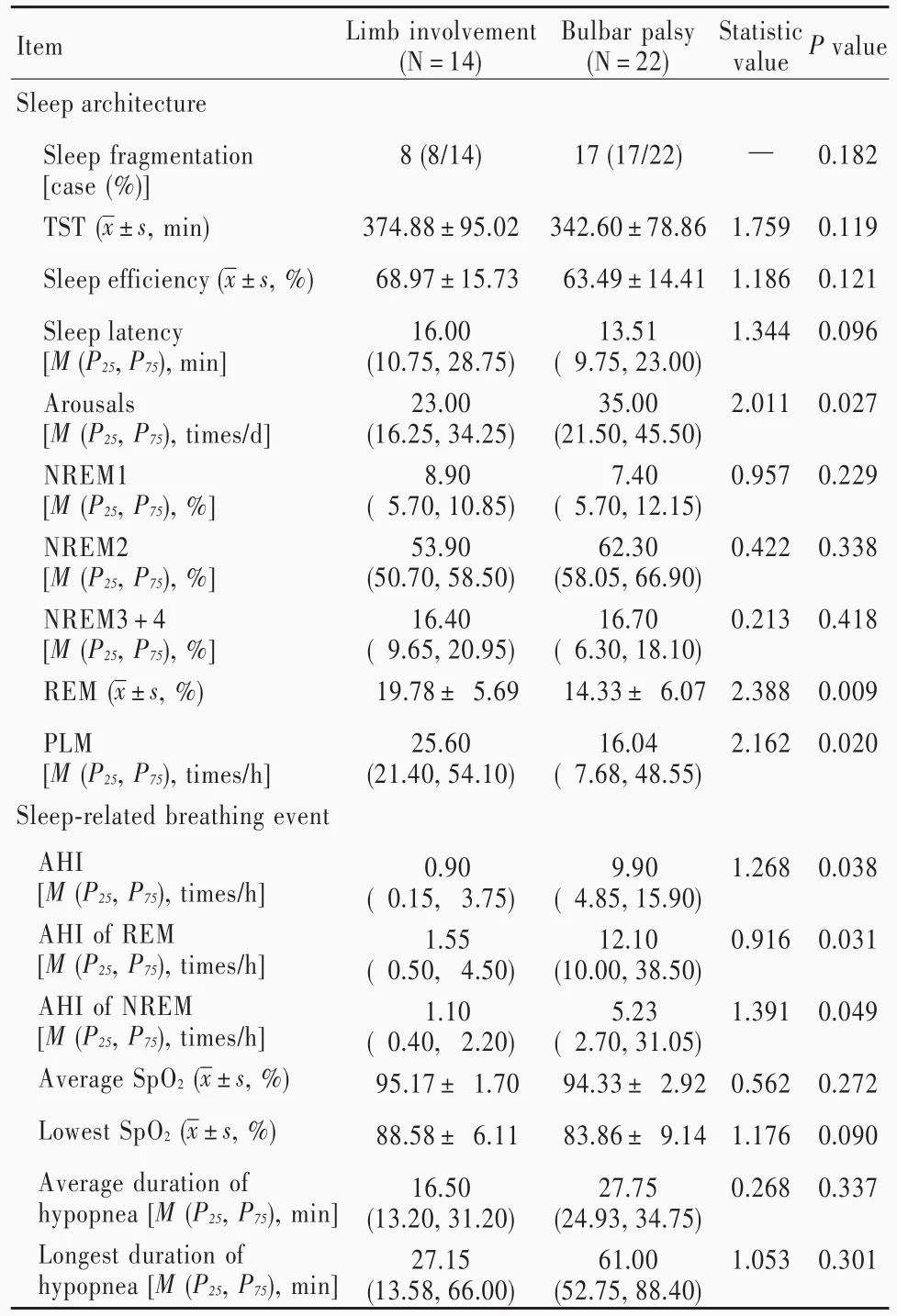
表3 延髓麻痹组与肢体受累组患者睡眠障碍和睡眠呼吸障碍的比较Table 3. Comparison of sleep dysfunction and SDB between bulbar palsy group and limb involvement group
讨 论
肌萎缩侧索硬化症是以进行性运动神经元缺失为特征的神经变性病,临床表现为进行性肌无力和肌萎缩,最终导致瘫痪[10]。其病因和发病机制尚不明确,目前认为影响预后的两项最重要因素是发病年龄和首发部位(延髓或脊髓)[1,10],发病年龄较大、首发部位位于延髓的患者,预后越差。
神经变性病可以出现多种形式的睡眠障碍,如失眠、嗜睡、昼夜节律紊乱、异态睡眠、睡眠呼吸障碍等[13]。肌萎缩侧索硬化症患者发生退行性变的运动神经元主要分布于大脑运动皮质锥体细胞、低位脑干、脊髓锥体束和脊髓前角细胞等,尚未累及睡眠调节中枢(丘脑、下丘脑和脑桥神经核团等),故睡眠结构紊乱主要受外源性因素的间接影响,如咳嗽、口咽分泌物过多、睡眠呼吸事件、不宁腿综合征、夜尿症、肌肉僵硬或疼痛、翻身困难、焦虑或抑郁情绪等[1,14]。
肌萎缩侧索硬化症直接死因多为呼吸功能衰竭,以夜间低通气为主要表现的睡眠呼吸障碍常发生于疾病早期阶段,虽然患者自觉症状不严重,但呼吸功能下降速度与呼吸功能衰竭程度相关[15]。本研究肌萎缩侧索硬化症患者普遍存在睡眠障碍,包括入睡困难、睡眠维持困难或早醒、夜间呼吸不畅或呼吸困难、夜尿症、不宁腿综合征、夜间肌肉疼痛或痉挛等。既往多项研究显示,肌萎缩侧索硬化症患者普遍出现总睡眠时间减少、睡眠效率降低、睡眠潜伏期延长、觉醒次数增多、非快速眼动睡眠期1和2期比例增加、快速眼动睡眠期比例减少[12,16]。本研究结果显示,肌萎缩侧索硬化症患者睡眠障碍主要表现为片段化睡眠,且延髓麻痹组较肢体受累组严重,同时,延髓麻痹组觉醒次数多于、快速眼动睡眠期比例低于、周期性腿动次数少于肢体受累组,提示累及延髓的肌萎缩侧索硬化症患者较累及肢体的患者睡眠紊乱更严重。
肌萎缩侧索硬化症患者呼气肌和吸气肌无力是预测生存期的重要因素[13]。因此对患者早期呼吸功能评价即显得尤为重要。用力肺活量(FVC)普遍作为评价呼吸功能的指标[17⁃18],但该项指标对呼吸功能的恶化并不敏感,而且有延髓症状或明确面肌无力的患者不能准确完成测定,故用力肺活量与呼吸功能衰竭和生存期无关联性[15,18]。因此,在临床工作中需要一种能够准确评价肌萎缩侧索硬化症患者呼吸功能的检测方法。疾病早期呼吸肌无力症状轻微,易忽视。但在睡眠中夜间仰卧位肺活量较日间站立位明显降低,与清醒期相比,睡眠期每分静息通气量(VE)下降13%~15%,快速眼动睡眠期下降更明显[8],而且睡眠中上呼吸道肌张力下降,导致解剖结构改变,上呼吸道管径变小、阻力增加,特别是快速眼动睡眠期呼吸肌张力进一步降低,膈肌是唯一主动呼吸肌[7,19]。上述因素均可以导致睡眠中低通气事件的发生,尤其是快速眼动睡眠期[20]。因此,日间无呼吸肌无力的患者,可能在睡眠中发生睡眠呼吸障碍[21]。肌萎缩侧索硬化症患者采用多导睡眠图监测睡眠障碍和睡眠呼吸障碍的发生,更能反映肌萎缩侧索硬化症早期呼吸功能障碍严重程度。
肌萎缩侧索硬化症患者睡眠呼吸障碍主要表现为夜间脉搏血氧饱和度下降伴长时间低通气事件,以快速眼动睡眠期为主,睡眠呼吸暂停少见[22],其中累及延髓的患者更易发生睡眠呼吸障碍[6]。在本研究中,63.64%(14/22)的延髓麻痹患者于快速眼动睡眠期发生低通气事件,13例呼吸不畅患者中仅3例因夜间出现呼吸困难而就诊,余10例症状轻微。因此,肌萎缩侧索硬化症患者夜间易出现睡眠呼吸障碍,其中以病程较长、延髓功能障碍和神经功能缺损严重的患者显著,且多发生于快速眼动睡眠期。延髓麻痹患者较多的夜间低通气事件可能是导致频繁觉醒的原因之一,由于在快速眼动睡眠期反复出现低通气事件,导致患者因供氧不足而憋醒,快速眼动睡眠期缩短。部分肌萎缩侧索硬化症患者即使睡眠呼吸暂停低通气指数正常,在快速眼动睡眠期即已存在明显的睡眠呼吸障碍。
关于肌萎缩侧索硬化症患者睡眠呼吸障碍的研究甚少,既往文献报道,有56%~68%的肌萎缩侧索硬化症患者出现低通气事件,而中枢性睡眠呼吸暂停(CSA)仅出现于 6%患者[6,23]。与之相似,本研究中枢性睡眠呼吸暂停十分少见。究其原因,可能与呼吸肌无力(包括膈肌和辅助呼吸肌),不足以产生足够的呼吸道内负压以闭合上呼吸道。虽然食管测压技术有助于证实我们的假设,但易增加患者不适感,间接导致频繁觉醒和增加误吸风险等,故未在临床常规应用。
综上所述,累及延髓和呼吸功能的肌萎缩侧索硬化症患者更易出现睡眠紊乱,主要表现为睡眠片段化,睡眠呼吸障碍和周期性腿动等可以解释部分患者的睡眠片段化,但影响睡眠的因素众多。此外,即使是重度延髓功能障碍患者,发生阻塞性睡眠呼吸暂停(OSA)的可能性亦较小。与其他神经肌肉病和限制性肺功能障碍的睡眠呼吸事件相似,夜间低通气也可以导致脉搏血氧饱和度下降,且以快速眼动睡眠期显著。多导睡眠图监测对评价肌萎缩侧索硬化症患者睡眠障碍和睡眠呼吸障碍十分有价值。对于此类患者应尽早行无创性正压通气治疗以延缓呼吸功能衰竭的发生,从而提高患者生活质量、延长生存期。
[1]Vucic S,Rothstein JD,Kiernan MC.Advances in treating amyotrophic lateral sclerosis:insights from pathophysiological studies.Trends Neurosci,2014,37:433⁃442.
[2]Benditt JO,BoitanoLJ.Pulmonary issues in patientswith chronic neuromuscular disease.Am J Respir Crit Care Med,2013,187:1046⁃1055.
[3]Al⁃Chalabi A,Hardiman O.The epidemiology of ALS:a conspiracy of genes,environment and time.Nat Rev Neurol,2013,9:617⁃628.
[4]Liu Y.Diagnostic value of electromyography in amyotrophic lateral sclerosis.Zhongguo Yi Xue Gong Cheng,2015,23:75⁃76.[刘源.肌电图对肌萎缩侧索硬化症的诊断价值分析.中国医学工程,2015,23:75⁃76.]
[5]Yang Q,Fan DS.Progress in clinical diagnosis of amyotrophic lateral sclerosis.Zhongguo Xian Dai Shen Jing Ji Bing Za Zhi,2012,12:245⁃251[.杨琼,樊东升.肌萎缩侧索硬化症临床诊断进展.中国现代神经疾病杂志,2012,12:245⁃251.]
[6]Santos C,Braghiroli A,Mazzini L,Pratesi R,Oliveira LV,Mora G.Sleep⁃related breathing disorders in amyotrophic lateral sclerosis.Monaldi Arch Chest Dis,2003,59:160⁃165.
[7]Gaig C, Iranzo A. Sleep⁃disordered breathing in neurodegenerative diseases.Curr Neurol Neurosci Rep,2012,12:205⁃217.
[8]Primhak R, Kingshott R. Sleep physiology and sleep⁃disordered breathing:the essentials.Arch Dis Child,2012,97:54⁃58.
[9]Agosta F,Al⁃Chalabi A,Filippi M,Hardiman O,Kaji R,Meininger V,Nakano I,Shaw P,Shefner J,van den Berg LH,LudolphA;WFN ResearchGrouponALS/MND.TheEl Escorial criteria:strengths and weaknesses.Amyotroph Lateral Scler Frontotemporal Degener,2015,16:1⁃7.
[10]Dong Y,Dong Q,Chen Y,Jiang YP.Relationship between clinical characters and onset subtypes of amyotrophic lateral sclerosis.Zhongguo Lin Chuang Shen Jing Ke Xue,2011,19:616⁃620[.董漪,董强,陈嬿,蒋雨平.肌萎缩侧索硬化症的临床特点与起病部位的关系研究.中国临床神经科学,2011,19:616⁃620.]
[11]Voustianiouk A,Seidel G,Panchal J,Sivak M,Czaplinski A,Yen A,Appel SH,Lange DJ.ALSFRS and appel ALS scores:discordance with disease progression.Muscle Nerve,2008,37:668⁃672.
[12]Iber C,Ancoli⁃Israel S,Chesson A,Quan SF.The AASM manual for the scoring of sleep and associated events.Westchester:American Academy of Sleep Medicine,2007:134⁃137.
[13]AtalaiaA,DeCarvalhoM,EvangelistaT,PintoA.Sleep characteristics of amyotrophic lateral sclerosis in patients with preserved diaphragmatic function.Amyotroph LateralScler,2007,8:101⁃105.
[14]Carratù P,Cassano A,Gadaleta F,Tedone M,Dongiovanni S,Fanfulla F,Resta O.Association between low sniff nasal⁃inspiratory pressure(SNIP)and sleep disordered breathing in amyotrophic lateral sclerosis:preliminary results.Amyotroph Lateral Scler,2011,12:458⁃463.
[15]Tsara V,Serasli E,Steiropoulos P,Tsorova A,Antoniadou M,Zisi P.Respiratory function in amyotrophic lateral sclerosis patients:the role of sleep studies.Hippokratia,2010,14:33⁃36.
[16]Arnulf I,Similowski T,Salachas F,Garma L,Mehiri S,AttaliV,Behin⁃Bellhesen V,Meininger V,Derenne J.Sleep disorders and diaphragmatic function in patients with amyotrophic lateral sclerosis.Am J Respir Crit Care Med,2000,161:849⁃856.
[17]Czaplinski A,Yen AA,Appel SH.Forced vital capacity(FVC)as an indicator of survival and disease progression in an ALS clinic population.J Neurol Neurosurg Psychiatry,2006,77:390⁃392.
[18]Gelinas DF.Pulmonary function screening.Semin Neurol,2003,23:89⁃96.
[19]Gonzalez⁃Bermejo J,Morélot⁃Panzini C,Salachas F,Redolfi S,Straus C,Becquemin MH,Arnulf I,Pradat PF,Bruneteau G,IgnagniAR,Diop M,OndersR,NelsonT,MenegauxF,Meininger V,Similowski T.Diaphragm pacing improves sleep in patients with amyotrophic lateral sclerosis. Amyotroph Lateral Scler,2012,13:44⁃54.
[20]Fraigne JJ,Orem JM.Phasic motoractivity ofrespiratory and non⁃respiratory muscles in REM sleep.Sleep,2011,34:425⁃434.
[21]Lyall RA,Donaldson N,Polkey MI,Leigh PN,Moxham J.Respiratory muscle strength and ventilatory failure in amyotrophic lateral sclerosis.Brain,2001,124:2000⁃2013.
[22]Thomas A,Bonanni L,Onofrj M.Symptomatic REM sleep behaviour disorder.Neurol Sci,2007,28:S21⁃36.
[23]Pinto S,Pinto A,Atalaia A,Peralta R,de Carvalho M.Respiratory apraxia in amyotrophic lateral sclerosis.Amyotroph Lateral Scler,2007,8:180⁃184.
Characteristics of sleep dysfunction and sleep⁃disordered breathing in amyotrophic lateral sclerosis patients
WANG Fang,HUANG Zhao⁃yang,DING Yan,LI Ning,WANG Yu⁃ping,ZHAN Shu⁃qin
DepartmentofNeurology,XuanwuHospital,CapitalMedicalUniversity;BeijingKeyLaboratoryof Neuromodulation,Beijing 100053,China
Corresponding author:ZHAN Shu⁃qin(Email:shqzhan@hotmail.com)
ObjectiveTo study the characteristics of sleep architecture and sleep ⁃disordered breathing (SDB)in patientswith amyotrophic lateralsclerosis(ALS)using polysomnography (PSG).MethodsA total of 36 patients with ALS were recruited in this study.According to symptoms of medulla oblongata,the patients were divided into limb involvement group(N=14)and bulbar palsy group(N=22).Detailed record of the patients was made including general information and chief complaints of sleep dysfunction and SDB,which covered sleep initiation and maintenance disorders,arousals,difficulty in breathing and snoring,nocturnal polyuria,restless legs syndrome(RLS)and muscle soreness. Appel Amyotrophic Lateral Sclerosis(AALS)Scores were used to assess bulbar function,breathing function,myodynamia and limbs function.PSG was performed to monitor EEG,EOG,EMG,ECG,position,snore,gas flow of mouth and nose,chest breathing,pulse oxygen saturation(SpO2)and sleep⁃related parameters including total sleep time(TST),sleep efficiency(SE),sleep latency(SL),awakening times,percentage of different non⁃rapid eye movement(NREM)and rapial eye movement(REM),and apnea hypopnea index(AHI). Pearson correlation analysis evaluated the relationship between AHI of REM,periodic limb movements(PLM)and clinical information,AALS Scores.ResultsBulbar palsy group had higher scores in AALS Scores(P=0.007),bulbar function(P=0.000)and breathing function(P=0.000),and lower score in upper limb myodynamia(P=0.016)than limb involvement group.Both 2 groups showed disturbed sleep architecture in the performance of sleep fragmentation.Bulbar palsy group had more awakening times(P=0.027),lower percentage of REM sleep(P=0.009)and less PLM(P=0.020)than limb involvement group.The main respiratory event of 2 groups was hypopnea.Bulbar palsy group had higher AHI(P=0.038)and AHI of REM and NREM(P=0.031,0.049)than limb involvement group.Pearson correlation analysis showed that AHI of REM was positively correlated with duration(r=0.654,P=0.028),AALS total score(r=0.458,P=0.034),bulbar function score(r=0.572,P=0.030)and breathing function(r=0.756,P=0.002).PLM was also positively correlated with duration(r=0.574,P=0.030),AALS total score(r=0.321,P=0.042),upper limb function(r=0.656,P=0.028)and lower limb function(r=0.754,P=0.015).ConclusionsPatients with ALS have many types of sleep disorders including insomnia,SDB and periodic limb movements disorder(PLMD).PSG can monitor respiratory event thus providing clinical evidence for the non⁃invasive ventilation intervention.
Amyotrophic lateral sclerosis; Sleep disorders; Polysomnography
10.3969/j.issn.1672⁃6731.2017.10.007
100053北京,首都医科大学宣武医院神经内科 北京市神经调控重点实验室[王芳(现在华中科技大学同济医学院附属武汉市中心医院神经内科,邮政编码:430014)]
詹淑琴(Email:shqzhan@hotmail.com)
2017⁃08⁃21)

