特发性快速眼动睡眠期行为障碍纹状体微结构磁共振成像研究
张亚萌 王泓力 白莹莹 贺文颉 尤阳 张红菊 张杰文
·神经影像学·
特发性快速眼动睡眠期行为障碍纹状体微结构磁共振成像研究
张亚萌 王泓力 白莹莹 贺文颉 尤阳 张红菊 张杰文
目的 探讨帕金森病(PD)和特发性快速眼动睡眠期行为障碍(iRBD)患者纹状体结构和白质纤维束完整性。方法 联合应用基于体素的形态学分析和扩散张量成像对12例特发性快速眼动睡眠期行为障碍患者、12例帕金森病患者及10例性别、年龄和受教育程度相匹配的正常对照者进行头部MRI检查,观察纹状体结构(灰质体积)和白质纤维束完整性[部分各向异性(FA)值]变化。结果 与对照组相比,iRBD组左侧尾状核灰质体积缩小(P<0.005),以及左侧(P<0.005)和右侧(P<0.001)尾状核、右侧壳核(P<0.05)FA值降低;PD组仅右侧壳核FA值降低(P<0.05)。与PD组相比,iRBD组左侧尾状核灰质体积缩小(P<0.001),以及左侧(P<0.01)和右侧(P<0.005)尾状核FA值降低。结论 特发性快速眼动睡眠期行为障碍患者存在纹状体灰质体积缩小和白质纤维束完整性损害,其白质纤维束完整性损害与帕金森病具有一致性,为特发性快速眼动睡眠期行为障碍是帕金森病的临床前期提供解剖学依据。
REM睡眠行为障碍; 帕金森病; 纹状体; 磁共振成像
特发性快速眼动睡眠期行为障碍(iRBD)表现为快速眼动睡眠期(REM)骨骼肌生理性张力失迟缓伴梦境演绎行为。特发性快速眼动睡眠期行为障碍可能是神经变性病的临床前期,进展为α⁃突触核蛋白(α⁃Syn)病,如帕金森病(PD)、路易体痴呆(DLB)和多系统萎缩(MSA)[1],其中,该病与帕金森病的临床伴发率为15%~46%,多导睡眠图(PSG)监测其伴发率为46%~58%[2];且有文献报道,特发性快速眼动睡眠期行为障碍存在于帕金森病Braak分期中[3]。帕金森病和特发性快速眼动睡眠期行为障碍缺乏特征性常规MRI表现,而多模态MRI为神经变性病的研究提供技术手段。帕金森病主要病理改变位于纹状体,本研究采用基于体素的形态学分析(VBM)和扩散张量成像(DTI)对特发性快速眼动睡眠期行为障碍患者纹状体进行微结构研究,以探讨帕金森病与特发性快速眼动睡眠期行为障碍之间的联系。
对象与方法
一、研究对象
1.特发性快速眼动睡眠期行为障碍组(iRBD组) 选择2015年3月-2016年2月以夜间行为异常为主诉就诊于郑州大学人民医院睡眠障碍门诊的患者共12例,均为右利手,采用快速眼动睡眠期行为障碍问卷香港版(RBDQ⁃HK)筛查特发性快速眼动睡眠期行为障碍,并经视频多导睡眠图监测证实,同时符合2014年睡眠障碍国际分类第3版(ICSD⁃3)[4]诊断标准:(1)睡眠中反复出现的发声和(或)复杂异常行为。(2)经音频和视频多导睡眠图监测证实异常行为发生于快速眼动睡眠期,或者基于病史,异常行为是对梦境的演绎,推测其发生于快速眼动睡眠期。(3)多导睡眠图监测到快速眼动睡眠期骨骼肌失弛缓。(4)异常行为不能用其他睡眠障碍、精神病、药物滥用等原因解释。排除其他中枢或周围神经系统疾病,如缺血性卒中、癫等;精神病、抑郁和(或)焦虑;文盲;失聪;严重心、肺、肝、肾功能障碍;植入假牙或牙齿金属填充物、心脏起搏器、神经刺激器、金属动脉夹等MRI检查禁忌症。男性10例,女性2例;年龄43~87岁,平均(63.08±10.33)岁;受教育程度 5~15年,平均(10.28±3.29)年;病程 1~15年,中位病程 3.50(2.00,5.75)年;统一帕金森病评价量表第三部分(UPDRSⅢ)评分 0~60分,中位评分 0.00(0.00,7.25)分;Hoehn⁃Yahr分级 0~2级,中位分级 0.00(0.00,0.75)级。
2.原发性帕金森病组(PD组) 共选择2015年3月-2016年4月在我院门诊或住院治疗的帕金森病患者12例,均为右利手,符合英国帕金森病协会(UKPDS)脑库帕金森病临床诊断标准、排除帕金森综合征和帕金森叠加综合征,经RBDQ⁃HK问卷和视频多导睡眠图监测证实不伴快速眼动睡眠期行为障碍;排除标准同iRBD组。男性9例,女性3例;年龄42~76岁,平均为(56.33±9.65)岁;受教育程度4~15年,平均为(8.58±2.97)年;病程1~11年,中位病程 3.00(1.25,7.00)年;UPDRSⅢ评分为16 ~56分,中位评分 30.50(18.75,33.00)分;Hoehn⁃Yahr分级1~3级,中位分级1.96(1.50,2.50)级。
3.正常对照组(对照组) 选择来自社区的同期在我院进行体格检查的健康志愿者共10例,均为右利手,排除标准同iRBD组。男性8例,女性2例;年龄45~78岁,平均(61.62±9.98)岁;受教育程度8~13年,平均(10.89±2.03)年。
3组受试者性别、年龄和受教育程度差异无统计学意义(均P>0.05);而iRBD组患者UPDRSⅢ评分(P=0.001)和Hoehn⁃Yahr分级(P=0.003)均低于PD组(表1)。本研究经郑州大学人民医院道德伦理委员会审核批准,所有受试者或其家属均知情同意并签署知情同意书。
二、研究方法
1.头部MRI检查 采用美国GE公司生产的Discovery MR750 3.0T超导型MRI扫描仪,梯度场强50mT/m,8通道头部线圈,扫描序列包括T1⁃三维快速扰相梯度回波序列(3D⁃FSPGR)和DTI序列。(1)T1⁃3D⁃FSPGR:重复时间(TR)8.20 ms、回波时间距[M(P25,P75)]表示,采用 Kruskal⁃Wallis秩和检验(H检验)。以P≤0.05为差异具有统计学意义。
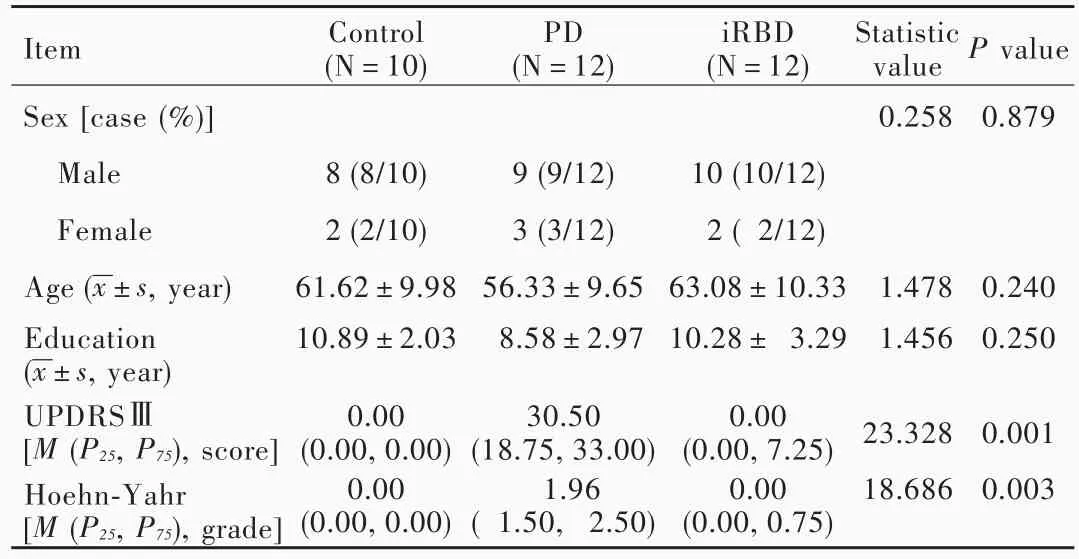
表1 3组受试者一般资料的比较Table 1. Comparison of general data among 3 groups
结 果
一、灰质体积的比较
iRBD组患者左侧尾状核灰质体积较对照组和PD组缩小且差异有统计学意义(P<0.005或0.001),而PD组与对照组左侧尾状核灰质体积差异无统计学意义(P>0.05;表2,图1)。
二、白质纤维束完整性的比较
与对照组相比,PD组患者仅右侧壳核FA值降低(P<0.05),而左侧和右侧尾状核FA值未见明显降低(P>0.05);iRBD组患者左侧(P<0.005)和右侧(P<0.001)尾状核、右侧壳核(P<0.05)FA值均降低。与PD组相比,iRBD组患者左侧(P<0.01)和右侧(P<0.005)尾状核FA值降低,而右侧壳核FA值未见明显降低(P>0.05;表3,图2~4)。
讨 论
帕金森病发病率较高,除典型静止性震颤、肌强直等运动症状外,还可以引起情绪障碍、睡眠障碍、认知功能障碍和自主神经功能障碍等非运动症状(NMS),严重影响生活质量。出现运动症状时,黑质纹状体细胞变性程度已达70%以上[5]。根据Braak分期,特发性快速眼动睡眠期行为障碍被认为是帕金森病较为特异的临床前期[3]。本研究采用MRI对特发性快速眼动睡眠期行为障碍患者、帕金森病患者和正常对照者纹状体微结构进行研究,以探讨帕金森病与特发性快速眼动睡眠期行为障碍之间的病理生理学联系。
多模态MRI已应用于帕金森病和特发性快速眼动睡眠期行为障碍的研究,其中,基于体素的形态学分析通过测量灰质和白质体积和密度,定量评价脑组织结构变化;DTI序列用于评价白质纤维束完整性,其核心参数FA值可以量化白质纤维束,是值得关注的指标[6]。本研究结果显示,与对照组相比,iRBD组和PD组患者右侧壳核FA值均降低,提示白质纤维束完整性损害;而iRBD组与PD组无明显差异。既往认为,帕金森病患者早期即可出现黑质⁃纹状体通路白质纤维束损害[7⁃8]。Zhan 等[9]的研(TE)3.20 ms、翻转时间(TI)450 ms,扫描视野(FOV)24 cm×24 cm,矩阵256×256,激励次数(NEX)1次,扫描层厚1 mm、层间距0 mm,扫描时间287 s、层数156层,范围覆盖颅底至颅顶全部脑组织。(2)DTI序列:重复时间8000 ms、回波时间3.20 ms,扫描视野25.60 cm×25.60 cm,矩阵128×128,层厚2.50 mm、层间距0 mm,扫描时间520 s、层数63层,扫描范围覆盖颅底至颅顶全部脑组织。
2.数据处理 (1)基于体素的形态学分析:采用SPM8统计参数图软件(www.fil.ion.ucl.ac.uk/spm/)中基于体素的形态学分析对所获得的原始灰质和白质图像进行组织分割和标准化,并以1 mm×1 mm×1 mm大小体素将图像归一至加拿大蒙特利尔神经病学研究所(MNI)标准空间,再进行8 mm半高全宽(FWHM)的高斯平滑处理。(2)DTI序列:采用美国约翰霍普金斯大学大脑解剖磁共振成像实验室和影像科学中心研发的DTI成像软件DTI Studio对所获得的数据进行头动和涡流校正,计算部分各向异性(FA)值,再采用SPM8统计参数图软件进行空间标准化和6 mm半高全宽的高斯平滑处理。处理后的灰质和白质图像以及FA图像采用SPM统计参数图软件中两独立样本的t检验进行统计分析。
3.统计分析方法 采用SPSS 19.0统计软件进行数据处理与分析。计数资料以相对数构成比(%)或率(%)表示,行χ2检验。呈正态分布的计量资料以均数±标准差(x±s)表示,采用单因素方差分析;呈非正态分布的计量资料以中位数和四分位数间究显示,帕金森病患者中央前回、黑质、壳核、纹状体后部、额叶和辅助运动区(SMA)FA值均降低,与本研究结果相符。Unger等[10]对12例特发性快速眼动睡眠期行为障碍患者进行MRI研究,发现黑质FA值降低,提示黑质投射纤维束完整性损害,可能发生神经退行性变。本研究结果显示,与对照组相比,iRBD组患者左侧和右侧尾状核、右侧壳核FA值均降低,提示特发性快速眼动睡眠期行为障碍有进展为帕金森病的可能。由于以帕金森综合征为主要表现的多系统萎缩(MSA⁃P)患者常表现为壳核体积缩小[11],故不能排除特发性快速眼动睡眠期行为障碍进展为MSA⁃P型的可能,尚待结合帕金森病脑组织代谢模式和血流灌注综合判断[12]。Reetz等[13]对23例帕金森病患者进行基于体素的形态学分析,结果显示,右侧壳核和左侧尾状核体积明显缩小,其萎缩部位与本研究白质损害部位相符。上述研究结果的不同考虑可能与本研究样本量较小有关。本研究结果显示,与对照组相比,iRBD组患者左侧尾状核灰质体积缩小,而PD组与对照组无明显差异。Menke等[14]研究显示,早期帕金森病患者右侧苍白球和壳核体积缩小,但并未发现尾状核和黑质体积变化。聂坤[15]对46例帕金森病患者进行MRI研究,发现尾状核和壳核体积均缩小。目前关于帕金森病患者尾状核体积改变尚无统一结论。本研究结果显示,与PD组相比,iRBD组左侧和右侧尾状核体积均缩小,推测可能与应用抗帕金森病药有关,如左旋多巴等。Eggers等[16]发现,左旋多巴可以使帕金森病患者纹状体区(包括壳核和苍白球等)葡萄糖代谢降低。亦有研究显示,除壳核外,尾状核也可以出现葡萄糖代谢降低[17⁃18]。Cerasa 等[19]发现,左旋多巴可以使帕金森病患者前额叶灰质体积增加。但目前尚无左旋多巴导致尾状核体积变化的证据。Ellmore等[20]研究显示,快速眼动睡眠期行为障碍患者双侧尾状核和壳核体积均缩小,但仍大于早期帕金森病患者,认为可能与早期帕金森病患者灰质体积代偿性增大有关,与本研究结果相符。而iRBD组患者左侧尾状核灰质体积较PD组缩小的机制尚待进一步研究。

表2 3组受试者左侧尾状核灰质体积的比较Table 2. Comparison of gray matter volume of left caudate nucleus among 3 groups

图1 3组受试者左侧尾状核灰质体积的两独立样本的t检验:与对照组和PD组相比,iRBD组左侧尾状核灰质体积缩小(蓝色区域所示);而PD组与对照组左侧尾状核灰质体积无明显差异Figure 1 Two⁃independent⁃sample t test of gray matter volume of left caudate nucleus among 3 groups:compared with control and PD group,gray matter volume of left caudate nucleus of iRBD group was significantly reduced(blue areas indicate);there was no significant difference between PD and control group in gray matter volume of left caudate nucleus.
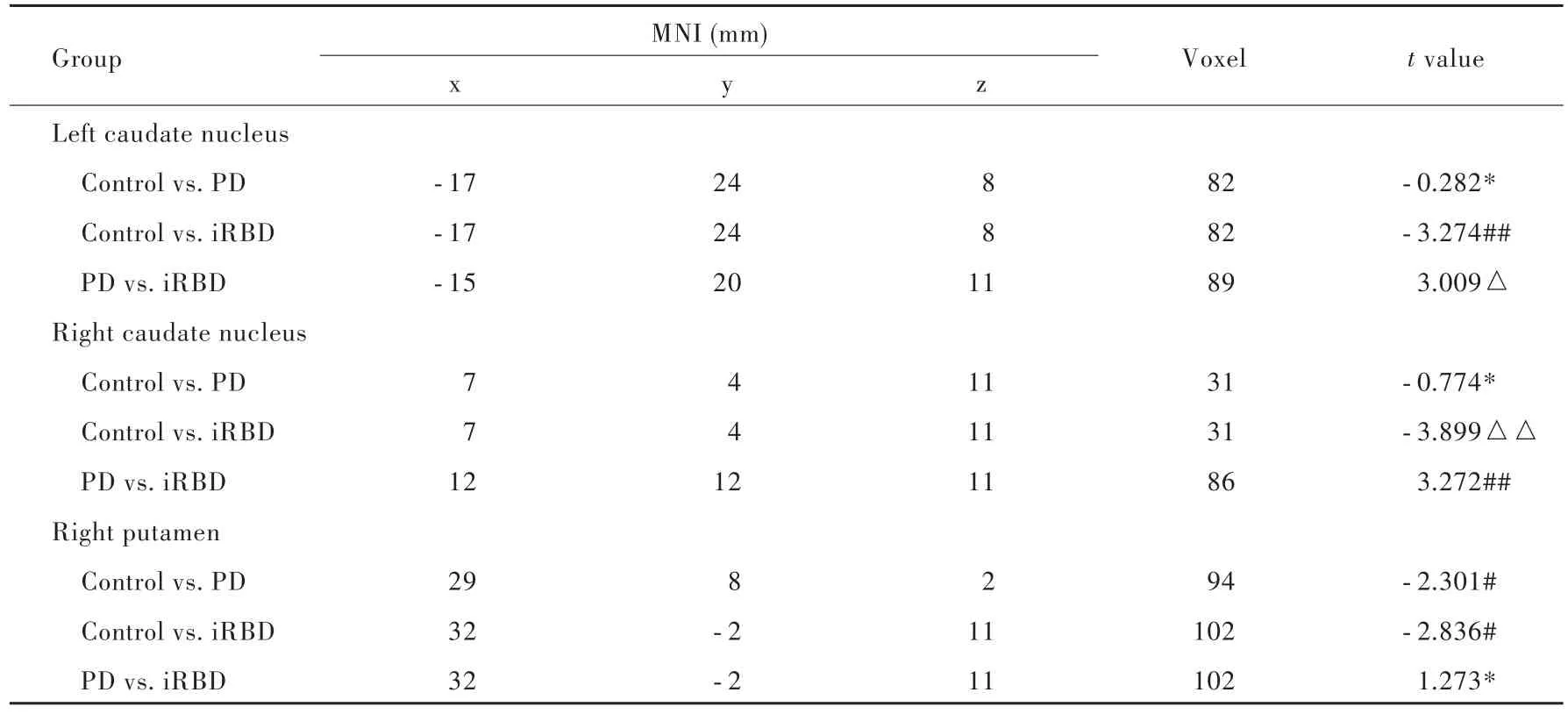
表3 3组受试者左侧和右侧尾状核及右侧壳核FA值的比较Table 3. Comparison of FA values of left and right caudate nucleus and right putamen among 3 groups

图2 3组受试者左侧尾状核FA值的两独立样本的t检验:与对照组和PD组相比,iRBD组左侧尾状核FA值降低(蓝色区域所示);而PD组与对照组左侧尾状核FA值无明显差异Figure 2 Two⁃independent⁃sample t test of FA values of left caudate nucleus among 3 groups:compared with control group and PD group,FA value of left caudate nucleus of iRBD group was significantly reduced(blue areas indicate);there was no significant difference between PD group and control group in FA values of left caudate nucleus.
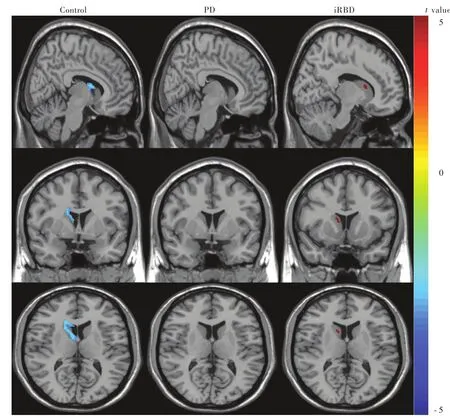
图3 3组受试者右侧尾状核FA值的两独立样本的t检验:与对照组和PD组相比,iRBD组右侧尾状核FA值降低(蓝色区域所示);而PD组与对照组右侧尾状核FA值无明显差异Figure 3 Two⁃independent⁃sample t test of FA values of right caudate nucleus among 3 groups:compared with control group and PD group,FA value of right caudate nucleus of iRBD group was significantly reduced(blue areas indicate);there was no significant difference between PD group and control group in FA values of right caudate nucleus.

图4 3组受试者右侧壳核FA值的两独立样本的t检验:与对照组相比,PD组和iRBD组右侧壳核FA值均降低(蓝色区域所示);而iRBD组与PD组右侧壳核FA值无明显差异Figure 4 Two⁃independent⁃sample t test of FA values of right putamen among 3 groups:compared with control group,FA values of right putamen of PD group and iRBD group were significantly reduced(blue areas indicate);there was no significant difference between iRBD group and PD group in FA values of right putamen.
在本研究中,iRBD组患者UPDRSⅢ评分低于PD组,且影像学异常更显著,提示由特发性快速眼动睡眠期行为障碍进展的帕金森病患者较不合并特发性快速眼动睡眠期行为障碍的帕金森病患者可能存在更严重的脑组织损害,与既往研究结果相一致[21⁃22]。
帕金森病早期主要病理改变是多巴胺能神经元变性缺失,这些神经元自中脑黑质致密部投射至前脑纹状体。特发性快速眼动睡眠期行为障碍患者可以出现广泛纹状体体积和白质纤维束异常改变,且与帕金森病病程相同,强烈提示其发生神经退行性变,尤其是进展为帕金森病的可能。目前仅一项研究联合应用基于体素的形态学分析和DTI序列,共纳入34例特发性快速眼动睡眠期行为障碍患者,均未见纹状体结构和白质纤维束损害[23],与本研究结果不一致。尚待大样本临床试验和长期随访研究以得出更有力的证据,为帕金森病早期干预提供依据。
[1]Oertel WH,Depboylu C,Krenzer M,Vadasz D,Ries V,Sixel⁃Döring F,MayerG.REM sleep behaviordisorderasa prodromalstage ofα ⁃synucleinopathies:symptoms,epidemiology, pathophysiology, diagnosis and therapy.Nervenarzt,2014,85:19⁃25.
[2]Zhang LY,Liu WY,Kang WY,Yang Q,Wang XY,Ding JQ,Chen SD,Liu J.Association of rapid eye movement sleep behavior disorder with sleep⁃disordered breathing in Parkinson's disease.Sleep Med,2016,20:110⁃115.
[3]Boeve BF.Idiopathic REM sleep behaviour disorder in the development of Parkinson's disease.Lancet Neruol,2013,12:469⁃482.
[4]American Academy of Sleep Medicine. International classification of sleep disorders.3rd ed.Darien,IL:American Academy of Sleep Medicine,2014:24⁃25.
[5]Marino S,Ciurleo R,Di Lorenzo G,Barresi M,De Salvo S,Giacoppo S,Bramanti A,Lanzafame P,Bramanti P.Magnetic resonance imaging markers for early diagnosis of Parkinson's disease.Neural Regen Res,2012,7:611⁃619.
[6]Surdhar I,Gee M,Bouchard T,Coupland N,Camicioli R.Intact limbic⁃prefrontal connections and reduced amygdala volumes in Parkinson's disease with mild depressive symptoms.Parkinsonism Relat Disord,2012,222:808⁃813.
[7]Tan WQ,Yeoh CS,Rumpel H,Nadkarni N,Lye WK,Tan EK,Chan LL.Deterministic tractography of the nigrostriatal⁃nigropallidal pathway in Parkinson's disease.Sci Rep,2015,5:17283.
[8]LenfeldtN,Eriksson J, Åström B,Forsgren L,Mo SJ.Fractionalanisotropy and mean diffusion as measures of dopaminergic function in Parkinson's disease: challenging results.J Parkinsons Dis,2017,7:129⁃142.
[9]Zhan W,Kang GA,Glass GA,Zhang Y,Shirley C,Millin R,Possin KL,Nezamzadeh M,Weiner MW,Marks WJ Jr,Schuff N.Regional alterations of brain microstructure in Parkinson's disease using diffusion tensor imaging.Mov Disord,2012,27:90⁃97.
[10]Unger MM,Belke M,Menzler K,Heverhagen JT,Keil B,Stiasny⁃Kolster K,Rosenow F,Diederich NJ,Mayer G,Möller JC,Oertel WH,Knake S.Diffusion tensor imaging in idiopathic REM sleep behavior disorder reveals microstructural changes in the brainstem,substantia nigra,olfactory region,and other brain regions.Sleep,2010,33:767⁃773.
[11]Sako W,Murakami N,Izumi Y,Kaji R.The difference in putamen volume between MSA and PD:evidence from a meta⁃analysis.Parkinsonism Relat Disord,2014,20:873⁃877.
[12]Poston KL,Tang CC,Eckert T,Dhawan V,Frucht S,Vonsattel JP,Fahn S,Eidelberg D.Network correlates of disease severity in multiple system atrophy.Neurology,2012,78:1237⁃1244.
[13]Reetz K,Gaser C,Klein C,Hagenah J,Büchel C,Gottschalk S,Pramstaller PP,Siebner HR,Binkofski F.Structural findings in the basalganglia in genetically determined and idiopathic Parkinson's disease.Mov Disord,2009,24:99⁃103.
[14]Menke RA,Szewczyk⁃Krolikowski K,Jbabdi S,Jenkinson M,Talbot K,Mackay CE,Hu M.Comprehensive morphometry of subcortical grey matter structures in early⁃stage Parkinson's disease.Hum Brain Mapp,2014,35:1681⁃1690.
[15]Nie K.Changes of structural brain and white matter fiber in Parkinson's disease patients with mild cognitive impairment:combined evaluation by VBM and DTI magnetic resonance imaging analysis.Guangzhou:Southern MedicalUniversity,2013[.聂坤.联合应用VBM和DTI磁共振图像处理技术对帕金森病轻度认知障碍患者脑结构及白质纤维改变的研究.广州:南方医科大学,2013.]
[16]Eggers C,Schwartz F,Pedrosa DJ,Kracht L,Timmermann L.Parkinson'sdisease subtypesshow a specific link between dopaminergic and glucose metabolism in the striatum.PLoS One,2014,9:E96629.
[17]Hilker R,Voges J,Thiel A,Ghaemi M,Herholz K,Sturm V,Heiss WD.Deep brain stimulation of the subthalamic nucleus versus levodopa challenge in Parkinson's disease:measuring the on⁃and off⁃conditions with FDG ⁃PET.J Neural Transm(Vienna),2002,109:1257⁃1264.
[18]Berding G,Odin P,Brooks DJ,Nikkhah G,Matthies C,Peschel T,Shing M,Kolbe H,van Den Hoff J,Fricke H,Dengler R,SamiiM,Knapp WH.Resting regionalcerebralglucose metabolism in advanced Parkinson's disease studied in the off and on conditions with18F⁃FDG⁃PET.Mov Disord,2001,16:1014⁃1022.
[19]Cerasa A,Messina D,Pugliese P,Morelli M,Lanza P,Salsone M,Novellino F,Nicoletti G,Arabia G,Quattrone A.Increased prefrontal volume in PD with levodopa⁃induced dyskinesias:a voxel⁃based morphometry study.Mov Disord,2011,26:807⁃812.
[20]Ellmore TM,Hood AJ,Castriotta RJ,Stimming EF,Bick RJ,Schiess MC.Reduced volume of the putamen in REM sleep behavior disorder patients.Parkinsonism Relat Disord,2010,16:645⁃649.
[21]Romenets SR,Gagnon JF,Latreille V,Panniset M,Chouinard S,Montplaisir J,PostumaRB.Rapid eyemovement sleep behavior disorder and subtypes of Parkinson's disease.Mov Disord,2012,27:996⁃1003.
[22]Nihei Y,Takahashi K,Koto A,Mihara B,Morita Y,Isozumi K,Ohta K,Muramatsu K,Gotoh J,Yamaguchi K,Tomita Y,Sato H,Seki M,Iwasawa S,Suzuki N.REM sleep behavior disorder in Japanese patients with Parkinson's disease:a multicenter study using the REM sleep behavior disorder screening questionnaire.J Neurol,2012,259:1606⁃1612.
[23]Scherfler C,Frauscher B,Schocke M,Iranzo A,Gschliesser V,Seppi K,Santamaria J,Tolosa E,Högl B,Poewe W;SINBAR(Sleep Innsbruck Barcelona)Group.White and gray matter abnormalities in idiopathic rapid eye movement sleep behavior disorder: a diffusion⁃tensor imaging and voxel⁃based morphometry study.Ann Neurol,2011,69:400⁃407.
Study on microstructure of corpus striatum in patients with idiopathic rapid eye movement sleep behavior disorder using magnetic resonance imaging
ZHANG Ya⁃meng1,WANG Hong⁃li1,BAI Ying⁃ying1,HE Wen⁃jie2,YOU Yang3,ZHANG Hong⁃ju1,ZHANG Jie⁃wen11DepartmentofNeurology,3DepartmentofNuclearMedicine,Zhengzhou University People'sHospital,Zhengzhou 450003,He'nan,China
2Information System Engineering College,PLA Information Engineering University,Zhengzhou 450001,He'nan,China
Objective To investigate the structure of corpus striatum and the integrity of white matter fiber in patients with Parkinson's disease(PD)and idiopathic rapid eye movement sleep behavior disorder(iRBD).Methods Twelve patients with iRBD,12 patients with PD and 10 healthy subjects that were well matched in gender,age and education were enrolled in this study.Head MRI examination was performed to all subjects to observe the changes of corpus striatum structure(the gray matter volume)and the integrity of white matter fiber[fractional anisotropy(FA)]by combining voxel⁃based morphometry(VBM)and diffusion tensor imaging(DTI).Results Compared with healthy subjects,the gray matter volume of left caudate nucleus was significantly decreased(P<0.005),and FA values of left caudate nucleus(P<0.005),right caudate nucleus(P<0.001)and right putamen(P<0.05)were all significantly reduced in iRBD patients;FA value of right putamen was significantly decreased in PD patients(P<0.05).Compared with PD patients,the gray matter volume of left caudate nucleus of iRBD patients was significantly reduced(P<0.001),FA values of left caudate nucleus(P<0.01)and right caudate nucleus(P<0.005)of iRBD patients were significantly reduced.Conclusions There is atrophy of gray matter volume and extensive white matter fiber impairment in corpus striatum of patients with iRBD,and the white matter fiber impairment was similar to PD,which provides an anatomical evidence for iRBD being presymptom of PD.
REM sleep behavior disorder; Parkinson disease; Corpus striatum; Magnetic resonance imaging
s:ZHANG Jie⁃wen(Email:zhangjiewen9900@126.com);ZHANG Hong⁃ju(Email:hongjuz@sina.com)
This study was supported by Medical Science and Technology Key Plan Project of He'nan Province,China(No.201601022).
10.3969/j.issn.1672⁃6731.2017.05.008
河南省医学科技攻关计划项目(项目编号:201601022)
450003 郑州大学人民医院神经内科(张亚萌、王泓力、白莹莹、张红菊、张杰文),核医学科(尤阳);450001郑州,解放军信息工程大学信息系统工程学院(贺文颉)
张杰文(Email:zhangjiewen9900@126.com);张红菊(Email:hongjuz@sina.com)
2017⁃05⁃05)

