纤维素降解菌CMC-4的分离鉴定、诱变和酶学特性研究①
王 霞,华 琳,张海龙,朱安宁,曹 慧*
(1 环境保护部南京环境科学研究所,南京 210042;2 南京农业大学生命科学学院/农业部农业环境微生物重点实验室,南京 210095;3 中国科学院南京土壤研究所,南京 210008)
纤维素降解菌CMC-4的分离鉴定、诱变和酶学特性研究①
王 霞1,华 琳2,张海龙2,朱安宁3,曹 慧2*
(1 环境保护部南京环境科学研究所,南京 210042;2 南京农业大学生命科学学院/农业部农业环境微生物重点实验室,南京 210095;3 中国科学院南京土壤研究所,南京 210008)
从秸秆还田土壤中初筛获得一株高效纤维素降解菌CMC-4,根据菌株形态、理化性质及16S rDNA序列分析,初步鉴定为地衣芽孢杆菌(Bacillus licheniformis)。以此为出发菌株,经亚硝酸钠诱变获得一株稳定高产纤维素酶突变株CMC-4-3。对CMC-4和CMC-4-3的产酶条件和酶学性质进行比较分析,结果表明:CMC-4-3纤维素酶活力较CMC-4提高67.5%;其最适产酶条件是:37℃、pH 6.0、葡萄糖为碳源、蛋白胨为氮源、接种量2.0%、装液量60 ml/250 ml。该菌株所产纤维素酶的最适反应pH为6.0,且在4.0 ~ 7.0酶活力较稳定;最适反应温度为50 ℃,在20~80 ℃范围内均保持稳定;金属离子Fe2+、Mg2+、Co2+、K+对酶有激活作用,其余离子均有不同程度抑制作用,而Cu2+和Ca2+抑制作用最强,酶活力减弱近50%,是该酶的强效抑制因子。诱变前后菌株产酶条件和酶学性质等部分表型发生了变化,而突变菌株显示出了更宽泛的环境适应范围。据此,获得一株高效产纤维素酶、耐受范围广的具纤维素降解能力的地衣芽孢杆菌,而CMC-4-3和CMC-4的表型可作为深入探讨基因型变化的线索。
地衣芽孢杆菌;纤维素酶;诱变;酶学特性;产酶条件
纤维素是自然界中分布最广的由β-1,4-糖苷键以线性模式连接葡萄糖组成的一种复杂多糖,是植物细胞壁的主要成分,也是饲料、燃料及化学制品最丰富的有机资源[1-2]。每年光合作用固定的CO2产量约1011t,而其中近乎一半是由纤维素所构成[3]。尽管纤维素资源可作为再生能源发挥巨大潜能,但其尚未得以充分、合理利用,同时其焚烧还造成了环境污染。纤维素酶是可水解纤维素内β-1,4-糖苷键并释放葡萄糖单位的一类酶,包括外切葡聚糖苷酶(EC.3.2.1.91)、内切葡聚糖苷酶(EC.3.2.1.4)、β-葡萄糖苷酶(EC.3.2.1.21)[4]。纤维素酶类在纺织、造纸、清洁剂生产、环保制剂及动物饲料制造等领域得到广泛应用,据统计纤维素酶贡献了全球约8% 的工业酶需求[5],在美国其年均市场价值估计达4亿美元[6],且2004—2014年间纤维素酶的使用率增加了近100%[7]。目前纤维酶主要产自木霉属(Trichoderma)和曲霉属(Aspergillus)等真菌类微生物[8],这是因为真菌能够分泌胞外纤维素分解酶,比源自细菌的酶类更容易被提取和纯化[9],但来源于真菌的纤维素酶耐热性能较差[10]。纤维素加工过程通常是在较高的温度环境下进行,因而降低了酶活性,严重制约了其应用和经济性[11]。细菌产生的纤维素酶多为胞内酶,虽不易提纯,却具有生长速率高、产酶功能多、热耐受性能好等特点[8,12-13]。此外,细菌纤维素酶具有更有效的催化效率,且受到反馈调节作用相对较小,同时细菌纤维素酶为组成型表达,而自然界中真菌纤维素酶却为诱导性表达[14]。因此,筛选产纤维素酶细菌一直受到各国科研和企业界的广泛关注。在发酵工业中,细菌是重要的种子微生物,尤其是芽孢杆菌属细菌易于通过遗传修饰以获得期望酶活力并减少副产物产量,在工农业生产中具有很大应用潜力[15]。研究发现该属细菌可产生大量胞外水解酶,不易形成包涵体,有利于基因工程表达[13,16]。地衣芽孢杆菌(Bacillus licheniformis)是一种革兰阳性嗜热细菌,可以产生孢子抵抗恶劣环境。本研究从秸秆还田土壤中分离获得一株可降解纤维素的地衣芽孢杆菌,并进行亚硝酸钠诱变,对诱变前后菌株形态、生理生化特征、16S rDNA序列、产酶条件及酶学特性展开初步研究,以期为地衣芽孢杆菌产纤维素酶研究及其在工农业上的应用奠定基础。
1 材料与方法
1.1 土壤样本
土壤采自中国科学院封丘农业生态实验站内的保护性耕作长期试验地。
1.2 土壤纤维素降解菌富集液制备
在装有90 ml的无机盐培养基和无菌水中分别加入处理过的无淀粉滤纸和10 g新鲜土壤样品。28℃、180 r/min条件下培养5 ~ 7 d,观察滤纸崩解情况。取10 ml崩解的土壤悬液转接到90 ml无淀粉滤纸的无机盐培养基中继续培养,连续传代3次后,制备成10-3~ 10-5浓度梯度悬液。
1.3 菌株筛选
将稀释倍数为10-3、10-4、10-5的梯度悬液涂布于羧甲基纤维素CMC-Na平板上,30 ℃培养3 ~ 5 d,待长出菌落后点接在CMC-Na固体平板上,刚果红染色,选择四周有透明圈的菌株划线纯化。将纯化菌株点种到CMC-Na固体培养基上,28 ℃ 培养4 d,刚果红染色。根据水解圈直径 (H) 与菌落直径 (C)比值的大小初选。选出比值较大的5个菌株,取编号为CMC-1 ~ CMC-5。将CMC-1 ~ CMC-5 各自1 ml(1×109CFU) 种子液分别接种到100 ml液体产酶培养基中,30℃、180 r/min 条件下培养 1 d,采用 3,5 -二硝基水杨酸(DNS)法测定粗酶酶活[18],进行复选,获得目的菌株。
1.4 菌株鉴定
利用通用引物[19]扩增目的菌株16S rRNA基因,后送金斯瑞生物科技有限公司测序,返回序列于NCBI中比对。同时参照《常见细菌系统鉴定手册》和《Bergeys Manual of Determinative Baeteriology》[20]对目的菌株部分生理生化特性加以分析。
1.5 目的菌株诱变及产酶酶活验证
利用亚硝酸钠法诱变菌株[21],取对数生长期的目的菌株悬液(1×109CFU/ml)5 ml于无菌培养皿中,分别加0.1 mol/L和0.05 mol/L NaNO2溶液,各自反应5、10、15 min,同时设置对照。后加入2 ml 0.7 mol/L Na2HPO4终止诱变。诱变终止后菌液及对照菌液梯度稀释后取10-2、10-3及10-4倍稀释菌液200 μl涂布CMC-Na平板,30 ℃ 培养 3 d。利用刚果红染色和DNS法对诱变菌单克隆产酶酶活验证,筛选优良突变菌株。
1.6 遗传稳定性
将筛选出的产酶活性最大的优良突变株连续传代10次,对每代菌株产酶酶活用DNS法测定粗酶酶活,探究诱变菌株是否具有良好的遗传稳定性。
1.7 出发菌株与诱变菌株产酶条件的研究
1.7.1 最适产酶装液量 将1 ml出发菌株和诱变菌株种子液分别加入含40、60、80、100、120、140 ml CMC-Na培养基的三角瓶中,通气培养24 h后,测定粗酶酶活,确定最适产酶装液量。
1.7.2 最适产酶接种量 0.5%、1.0%、1.5%、2.0%、2.5%(v/v)不同接种量接入100 ml CMC-Na培养基中,通气培养24 h后,测定粗酶酶活,确定最适产酶接种量。
1.7.3 最适产酶碳源 将各种不同碳源(CMC-Na、乳糖、麦芽糖、淀粉、糊精、蔗糖、葡萄糖)按1% 加入培养基(酵母膏为氮源),以不加任何碳源为对照(CK组),测定粗酶酶活,确定最适产酶碳源。
1.7.4 最适产酶氮源 将各种不同氮源(酵母膏、蛋白胨、氯化铵、硫酸铵、尿素、硝酸钾)以1% 加入培养基(CMC-Na为碳源),以不加任何氮源为对照组(CK组),测定粗酶酶活,确定最适产酶氮源。
1.7.5 最适产酶温度 将培养好的种子液按1%的接种量接种至100 ml液体CMC-Na培养基,后置于不同温度、180 r/min通气培养24 h,温度梯度为20、25、30、37、42 ℃。测定粗酶酶活,确定最适产酶温度。
1.7.6 最适产酶pH 培养好的种子液按1% 接种量接种至100 ml CMC-Na培养基中,不同pH条件37 ℃、180 r/min摇床培养24 h,pH设置为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0。测定粗酶酶活,确定最适产酶pH。
1.8 酶学特性的研究
1.8.1 最适反应pH 用pH分别为 3.0、4.0、5.0、6.0、6.4、6.8、7.0、7.4、8.0、9.0和 10.0 的缓冲液配置质量浓度为2% 的羧甲基纤维素(CMC)底物溶液,将培养24 h后的菌液4 ℃、5 000 r/min离心取上清液作为纤维素酶粗酶液,在不同 pH 条件下测定酶活力。
1.8.2 pH稳定性测定 将上述酶液分别用 pH 3.0、4.0、5.0、6.0、6.4、6.8、7.0、7.4、8.0、9.0和10.0的缓冲液2倍稀释后置于4 ℃ 24 h,后在最适pH下测定残余酶活力。
1.8.3 最适反应温度测定 取上述酶液经最适pH缓冲液适当稀释后,和2% CMC-Na底物混合,在20、30、40、50、60、70和80 ℃温度测定其酶活力。
1.8.4 热稳定性测定 将上述酶液分别置于30、40、50、60、70和80 ℃水浴锅中水浴1 h,按照上述酶反应最适条件测定残余酶活力。
1.8.5 金属离子对酶活的影响 将终浓度为1 mmol/L的金属离子Cu2+、Fe3+、Fe2+、Ca2+、Ni+、Zn2+、Mg2+、Mn2+、Co2+、Cr3+、K+、Ba2+添加至酶活力测定体系中,以不添加任何金属离子组做对照(CK),测定不同浓度各金属离子对酶活力的影响。酶活力测定在酶反应最适pH和最适温度下进行,反应时间为20 min;酶活力定义为上述反应条件下,1 ml发酵液1 min催化底物生成1μmol葡萄糖的酶量为一个酶活力单位“U”。
2 结果与分析
2.1 菌株筛选及鉴定
经刚果红染色初筛、分离纯化获得5株透明圈H/C值较大的菌株。测定5株分离菌株的粗酶酶活,分别为39.31、42.82、34.63、95.89、44.46 U/ml,其中CMC-4酶活力最大,以此作为出发菌株。菌株CMC-4的16S rRNA基因序列经NCBI比对表明其与地衣芽孢杆菌属(Bacillus licheniformis)16S rDNA序列一致性高达99%。系统发育树结果显示CMC-4与Bacillus licheniformis ATCC 14508、Bacillus licheniformis Pb-WC11006、Bacillus licheniformis Pb-WC 09005聚在同一分支上。镜检结果发现该菌为革兰阳性杆菌、产芽孢,其菌落圆形较小,边缘锯齿状,表面非黏稠状。生理生化实验显示该菌为氧化酶阴性,过氧化氢酶、V-P试验阳性,结合其他生理生化特征与地衣芽孢杆菌基本生理生化特征[22]比较,初步鉴定CMC-4为地衣芽孢杆菌。
2.2 诱变菌株酶活力及遗传稳定性
以CMC-4为出发菌株,NaNO2诱变获得48个突变株,刚果红染色筛选获得3个水解圈H/C值较CMC-4大的突变株。DNS法测定粗酶酶活,结果表明3株突变菌粗酶酶活均比出发菌株高,其中CMC-4-3酶活力最大为160.29 U/ml,选为目的突变菌株。经过菌株的传代培养,每隔2代测定其纤维素酶活力,分析菌株CMC-4-3的遗传稳定性,经方差分析,P=0.831(P>0.05),表明各代的产酶能力无显著性差异,突变菌株CMC-4-3具有良好的遗传稳定性。
2.3 出发菌株和诱变菌株的产酶条件
2.3.1 温度和初始pH对产酶的影响 不同温度条件对菌株产酶活力影响结果(图1A)表明在37 ~ 40 ℃培养温度对CMC-4和CMC-4-3产酶有利,且两者最适产酶温度均为37 ℃,诱变前后最适温度未发生变化。初始pH对产酶影响结果显示(图1B),CMC-4在初始pH 7.0产酶最佳,而CMC-4-3的最适产酶初始pH为6.0,诱变前后最适产酶pH发生变化。当初始pH高于最适pH时两者粗酶酶活均随pH的升高而减弱,且在弱碱性环境中粗酶酶活均较酸性环境中偏高。
2.3.2 不同碳源、氮源对产酶的影响 不同碳源、氮源培养时结果(图1C、图1D)表明,CMC-4和CMC-4-3对碳源利用广泛,当碳源分别为葡萄糖和麦芽糖时它们的产酶较碳源为CMC-Na高。其中CMC-4最佳碳源为麦芽糖,CMC-4-3最佳碳源为葡萄糖,诱变前后最适碳源发生了改变;而对于氮源,CMC-4和CMC-4-3的最佳氮源均为蛋白胨,当氮源为尿素时产酶均最低,诱变前后最佳氮源未发生变化。
2.3.3 接种量和装液量对产酶的影响 接种量影响产酶酶活试验结果(图1E)表明当接种量为2.0%时CMC-4和CMC-4-3产酶最佳,其次是1.5%。装液量的不同是调节培养基溶氧量的主要手段之一,CMC-4和CMC-4-3产酶最佳装液量均为60 ml/ 250 ml(图1F),且在其他不同装液量水平诱变前后产酶酶活变化较小,诱变发生前后菌株产酶最佳接种量和装液量均未发生变化。
2.4 菌株产纤维素酶酶学特性
2.4.1 酶反应的最适pH及酶活力pH稳定性 由图2A可见,CMC-4和CMC-4-3表达的纤维素酶活力均在 pH 3.0 ~ 6.0 呈上升趋势,在6.0时达最高峰,然后酶活逐渐下降。突变前后菌株分泌的纤维素酶其合适酶促反应 pH 为 4.0 ~ 7.0,最适反应 pH 为6.0。而pH对酶活力稳定性的影响结果(图2B)显示这两株菌所产的纤维素酶对酸碱的适应范围均较广,总体上偏酸环境更有利于酶活力保持。在pH 4 ~ 7时残留酶活力较高,超过60% 以上,而在pH<4.0或>7.4时酶活力则下降较快。
2.4.2 酶反应的最适温度及酶活力热稳定性 温度对酶活力影响的结果(图3A)表明CMC-4和CMC-4-3表达的纤维素酶酶活力在20 ~ 50 ℃呈逐渐上升趋势,50 ℃ 时达到最高峰,后呈下降趋势。这些结果表明酶反应的最适温度为50 ℃,且诱变前后未发生变化,但60 ~ 80 ℃ 间,CMC-4-3产生酶的活力变化轻微,而来源CMC-4的酶其活力下降明显。温度对酶稳定性的结果显示诱变前后菌株来源的酶在30 ~ 70 ℃ 范围活力较稳定,均维持在60%以上,且诱变后菌株产生的酶活力温度范围更广,耐低温性(20 ℃,59.1% vs 37%)和耐热性(80 ℃,64.3% vs 50.9%)相对较好。
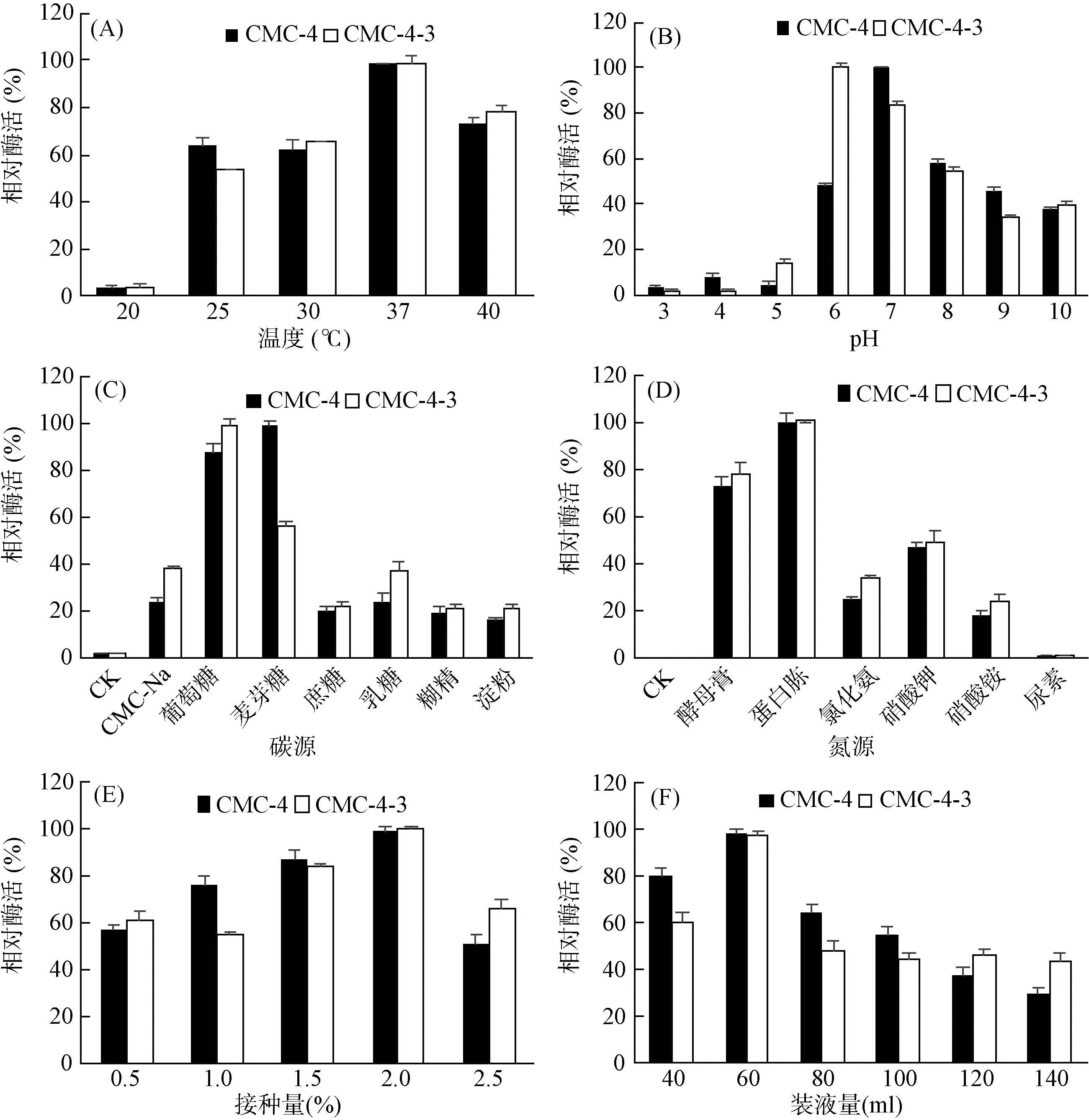
图1 不同温度(A)、初始pH(B)、碳源(C)、氮源(D)、接种量(E)和装液量(F)对CMC-4和CMC-4-3产酶的影响Fig. 1 The effects of the temperature (A), initial pH (B), carbon sources (C), nitrogen sources (D), inoculation quantity (E), medium volume (F)on the production of cellulase in CMC-4 and CMC-4-3
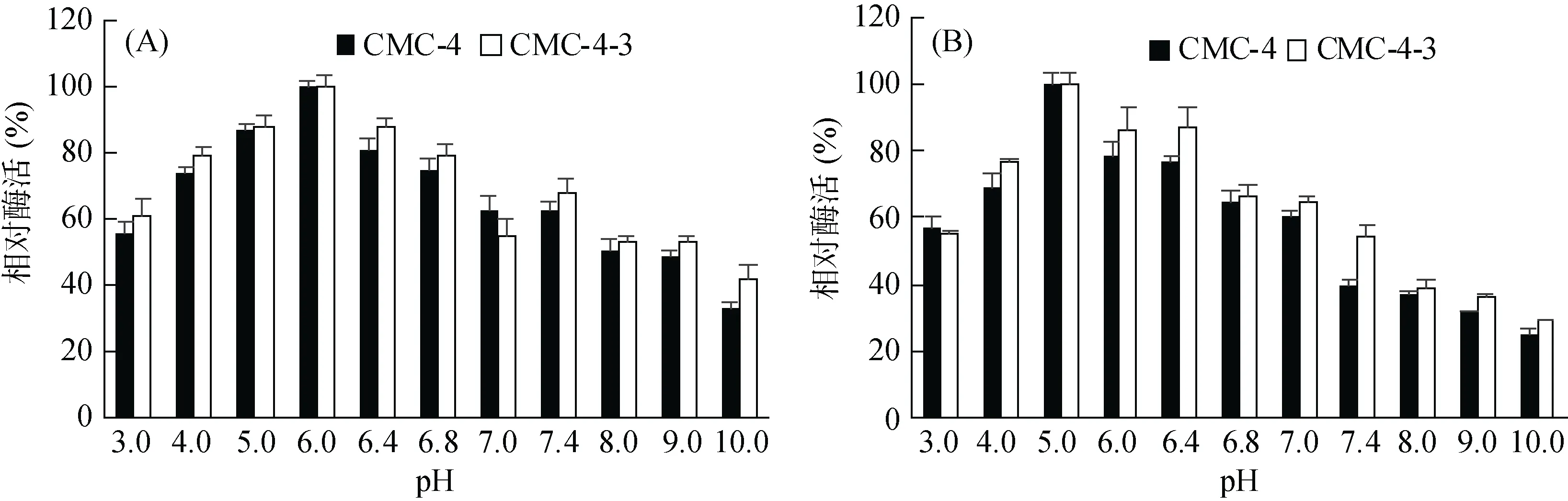
图2 pH对CMC-4和CMC-4-3所产酶酶活力(A)和酶活稳定性(B)的影响Fig. 2 The effects of pH on activity (A) and stability (B) of cellulase produced by CMC-4 and CMC-4-3
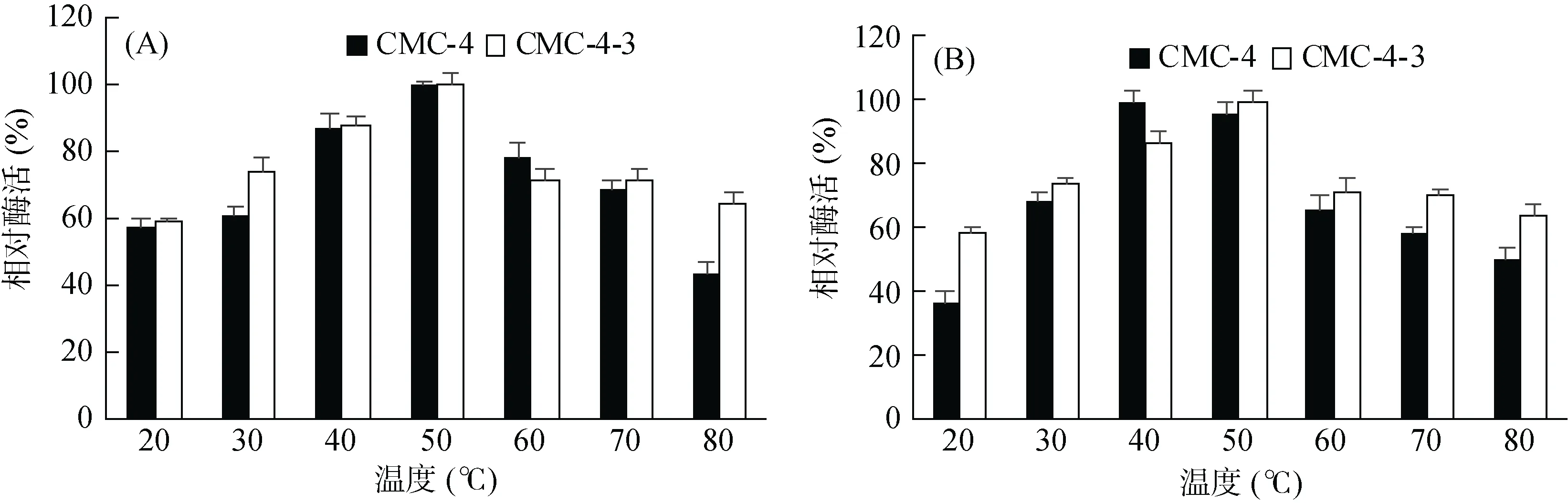
图3 温度对CMC-4和CMC-4-3所产酶酶活力(A)和酶活稳定性(B)的影响Fig. 3 The effects of temperature on activity (A) and stablity (B) of cellulase produced by CMC-4 and CMC-4-3
2.4.3 金属离子对酶活力的影响 表1为不同金属离子对CMC-4和CMC-4-3来源纤维素酶活力影响的结果,可以发现Fe2+、Mg2+、Co2+、K+对纤维素酶有激活作用;其中Fe2+和K+分别对 CMC-4和CMC-4-3的酶激活作用最强。其余离子均有不同程度抑制作用,其中Cu2+和Ca2+抑制作用最强,酶活力减弱超过50%,是该酶的强效抑制因子。
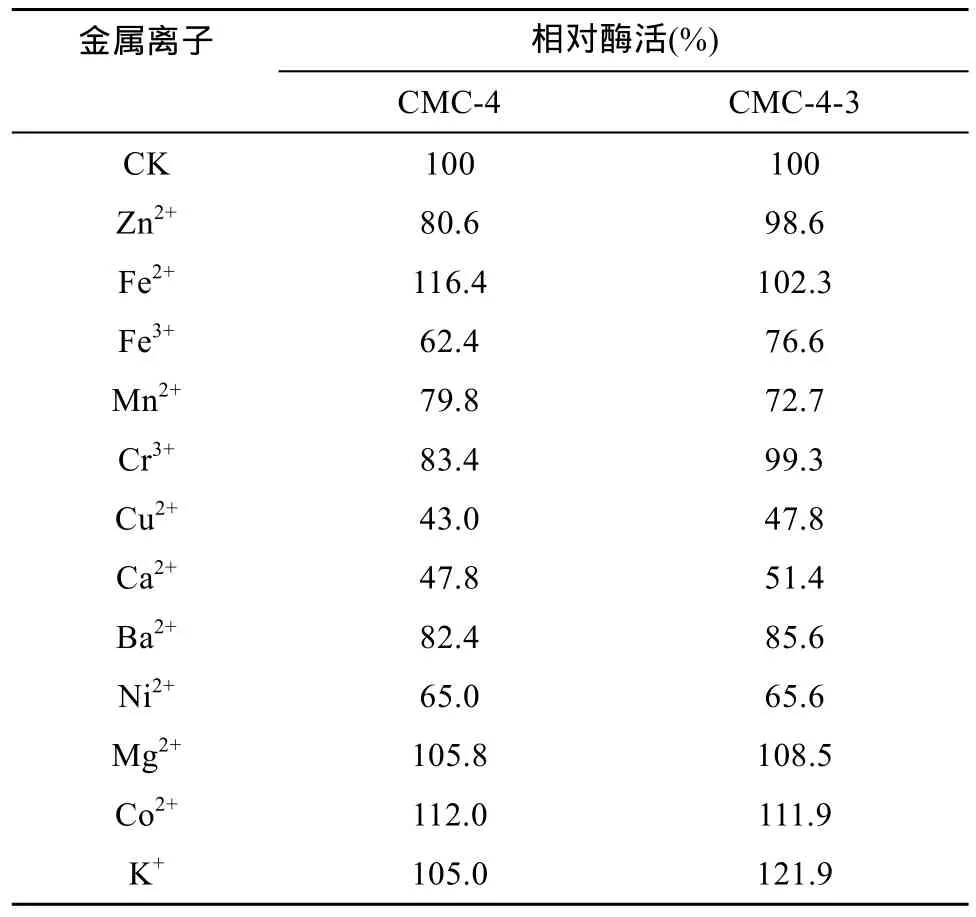
表1 不同金属离子对酶活力的影响Table 1 The effect of different mege sstal ions on activity of cellulase produced by CMC-4 and CMC-4-3
3 讨论
由于纤维素酶的巨大作用潜力,筛选产纤维素酶微生物成为工农业研究的重点。目前工业上纤维素酶主要来源于真菌[23]。细菌也有纤维素酶产生能力,一般细菌产纤维素酶水平低,但由于其生长速度快、发酵周期短以及纤维素酶具有耐碱耐热等优点而备受关注。芽孢杆菌具有适应性强、生长pH和温度范围广、能分解多种底物且产酶活性高等特点[17,24],作为纤维素产生菌株受到广泛重视。本研究筛选及诱变获得的菌株也具有上述特性。在产纤维素细菌研究工作中关于地衣芽胞杆菌纤维素降解的研究在国内外报道均较少涉及,国内刘永生等[22]首次分离获得一株具有纤维素降解能力的地衣芽孢杆菌GXN151,但该研究是从分子克隆角度筛选编码纤维素酶的基因,并未对菌株产酶活性、产酶条件、酶学性质展开研究。本研究从诱变、菌株产酶方面综合分析,为其应用创造了基本条件。
温度、培养基初始pH、碳源、氮源、装液量、接种量是微生物产酶重要因素。本研究发现对于诱变前后菌株,最适产酶温度均为37 ℃,温度过高或过低会使得菌株生长缓慢或抑制生长影响产酶。而对于最适产酶初始pH,诱变前后发生了变化,CMC-4为7.0,CMC-4-3为6.0,这可能是因为诱变使得纤维素酶等功能蛋白发生突变,进而有利于蛋白折叠的pH范围也发生相应变化;菌株CMC-4和CMC-4-3产酶最适氮源均为蛋白胨,而氮源为尿素时产酶处于最低水平,这与前人研究相符[25]。而最适产酶碳源对于诱导前后菌株则发生了变化,即由麦芽糖转变为葡萄糖,这可能是因为诱变后菌株麦芽糖水解酶活力下降造成的。
目前纤维素酶产生菌的筛选除了寻找高活力产酶菌外,就是找寻具有特殊活性的产酶菌株,如中性碱性纤维素酶、低温或高温纤维素酶等[26]。多数研究中纤维素酶作用底物的最适温度在45 ~ 65 ℃ 范围[27-28]。本研究中出发菌株和诱变菌株纤维素酶最适pH均为50℃,在20 ~ 80 ℃ 范围活力维持在60% 以上。但高温时诱变菌株所产酶的活力变化轻微,而原始菌株酶的活力下降显著。诱变后使得酶活力温度范围更广,耐低温性和耐热性能力均有所提升。pH对大部分纤维素酶的活性影响较大,一般认为纤维素酶最适反应pH在4.0 ~ 5.5[29],本研究中两菌株最适反应pH均为6.0,在pH 6.0 ~ 7.4范围内,相对酶活均在60%以上,且诱变后菌株维持相对酶活能力更强。研究人员在筛选特殊活性产酶菌株方面做了大量工作,如Kaur等[30]筛选到一株嗜热菌Melanocarpus sp.可产生较高活力的耐热、中性纤维素酶,有可能成为一个产纤维素酶的优良菌株。有研究还分离到适宜在碱性条件下生长的高效纤维素降解菌,在pH 7 ~ 11的范围内能够产生纤维素酶[31]。本研究获得的CMC-4和突变菌株CMC-4-3是兼具可产生较高活力、相对耐热耐碱特点纤维素酶的菌株,可以进一步提高纤维素酶的利用范围,为工业生产提供了产纤维素酶的优良菌株。
除了温度和pH,影响纤维素酶降解效率的因素还包括抑制剂及激活剂。纤维素酶酶促反应过程产生纤维二糖和葡萄糖会形成反馈抑制,而添加金属离子则是一种普遍使用的提高酶活力发挥激活剂的新方法。但来源不同的纤维素酶因组分差异,金属离子对其促进作用有所不同。本研究中Fe2+、Mg2+、Co2+、K+对纤维素酶有激活作用,这些也是纤维素酶的常见激活性离子。而其余金属离子均有不同程度抑制作用,其中Cu2+和Ca2+可强效抑制酶活性,Cu2+发挥抑制效应与先前研究一致[32-34];Ca2+一般对纤维素酶激活或者影响作用较小[35-36];丁轲等[37]发现Ca2+对芽孢杆菌纤维素酶活性有所抑制,但抑制效应微小,而本研究中筛选的地衣芽孢杆菌Ca2+对其纤维素酶活力具有强效抑制作用。可能Ca2+对芽孢杆菌来源的纤维素酶均具有一定抑制作用,但抑制效应如此强烈,在工、农业生产利用中应引起关注。
大量的筛选发现从自然界直接获得高效降解、适应性强的微生物几率较小,人工诱变则成为了获得理想菌株的改造方法。化学诱变育种具有突变率较高、可定位到碱基水平、染色体畸变比例低及遗传稳定等特点[17],其中亚硝酸(盐)是最早发现的类诱变剂,它在提高产能以及改善微生物有用性能方面具有明显的作用。本研究采用亚硝酸钠诱变法获得了一株高效产酶、耐pH和温度范围广且遗传稳定的纤维素降解地衣芽孢杆菌CMC-4-3突变株,成功实现了人工改造。
4 结论
本研究从秸秆还田土壤中筛选到一株产酶活性较高的地衣芽孢杆菌CMC-4,成功对其诱变获得产酶能力较出发菌株提高67.5%,且可稳定遗传的突变菌株CMC-4-3。进一步对CMC-4和CMC-4-3产酶条件和酶学性质加以研究,确立了各自最适产酶条件和环境条件对其所产纤维素酶的影响。研究结果对于丰富纤维素酶产生菌株资源,以及该纤维素酶的深入研究具有参考价值。
[1] Štursová M, Žifčáková L, Leigh M B, et al. Cellulose utilization in forest litter and soil: Identification of bacterial and fungal decomposers[J]. FEMS Microbiology Ecology,2012, 80(3): 735-746
[2] Heck J X, Hertz P F, Ayub M A Z. Cellulase and xylanase production by isolated Amazon Bacillus strains using soybean industrial residue based solid-state cultivation[J].Brazilian Journal of Microbiology, 2002, 33: 213-218
[3] Eriksson K, Blanchette R A, Ander P. Microbial and enzymatic degradation of wood and wood components[M].Berlin: Springer-Verlag, 1990
[4] Beguin P, Aubert J P. The biological degradation of cellulose[J]. FEMS microbiology reviews, 1994, 13: 25-58
[5] Bon E P S, Ferrara M A. Bioethanol production via enzymatic hydrolysis of cellulosic biomass // The role of agricultural biotechnologies for production of bioenergy in developing countries[C]. FAO. 2007, Available via http://www. fao. org/biotech/seminaroct 2007. htm. Cited, 12
[6] Zhang Y H P, Himmel M E, Mielenz J R. Outlook of cellulase improvement: Screening and selection strategies[J]. Biotechnology advances, 2006, 24: 452-481
[7] Costa R B, Silva M V A, Freitas F C, et al. Mercado e perspectivas de uso de enzimas industriais e especiais no brasil//Bon E P S, Ferrara M A, Corvo M L, et al. Enzimas em biotecnologia, produc¸aõ, aplicac, ões e mercados[M].1st ed. Interciência, Rio de Janeiro, 2008: 463-488
[8] Bhat M K. Cellulases and related enzymes in biotechnology[J]. Biotechnology Advances, 2000, 18: 355-383
[9] Sangrila S, Tushar K M. Cellulase production by bacteria:A review[J]. British Microbiology Research Journal, 2013,3: 235-258
[10] Aphichart K, Amorn P, Polkit S. A novel thermostable endoglucanase from the wood-decaying fungus Daldinia eschscholzii (Ehrenb. Fr.) Rehm[J]. Enzyme and Microbial Technology, 2008, 42: 404-413
[11] Sá-Pereira P, Mesquita A, Duarte J C. Rapid production of thermostable cellulase free xylanase by a strain of Bacillus subtilis and its properties[J]. Enzyme and Microbial Technology, 2002, 30: 924-933
[12] Ghani M, Ansari A, Aman A. Isolation and characterization of different strains of Bacillus licheniformis for the production of commercially significant enzymes[J]. Pakistan Journal of Pharmaceutical Sciences, 2013, 26: 691-697
[13] Priest F G. Extracellular enzyme synthesis in the genus Bacillus[J]. Bacteriological reviews, 1977, 41: 711-753
[14] Suto M, Tomita F. Induction and catabolite repression mechanisms of cellulase in fungi[J]. Journal of Bioscience and Bioengineering, 2001, 92(4): 305-311
[15] 颜霞, 柳晓东, 杨俊杰. 高温纤维素酶产生菌的筛选鉴定及其酶学性质研究[J]. 太阳能学报, 2011, 32(6):787-791
[16] 祝小, 王振华, 潘康成, 等. 产纤维素酶芽孢杆菌筛选及发酵条件的初步研究[J]. 现代农业科技, 2006, 11:122-124
[17] 吕熹, 王刚, 李俊, 等. 紫外、亚硝酸钠诱变筛选高产耐有机溶剂脂肪酶菌株[J]. 吉林农业大学学报,2010, 32(4):394-397
[18] 赵斌, 何绍江. 微生物实验[M]. 1版. 北京: 科学出版社,2002
[19] 顾方媛, 陈朝银, 石家骥, 等. 纤维素酶的研究进展与发展趋势[J]. 微生物学杂志, 2008, 28(1): 83-87
[20] Buchanan R E, Gibbons N E. Bergey’s manual of determinative baeteriology (8th ed.)[M]. Baltimore: The Williams &Wilkins Company, 1984
[21] Zhang S, Yin Q Y, Li Y H, et al. Molecular and biochemical characterization of Ba-EGA, a cellulase secreted by Bacillus sp. AC-2 1 from Ampullaria crosseans[J]. Applied Microbiology and Biotechnology, 2007, 75(6): 1327-1334
[22] 刘永生, 冯家勋, 段承杰, 等. 能降解天然纤维素的地衣芽孢杆菌 GXN151 的分离鉴定及其一个纤维素酶基因 (cel5A) 的克隆和测序分析[J]. 广西农业生物科学,2003, 22(2): 133-138
[23] 黄乾明, 谢君, 张寒飞, 等. 漆酶高产菌株的诱变选育及其产酶条件[J]. 菌物学报, 2006, 25(2): 263-272
[24] Zhang Y H P, Himmel M E, Mielenz J R. Outlook for cellulase inprovement screening and selection strategies[J].Biotechnology Advances, 2006, 24(5): 452-481
[25] 周建, 罗学刚, 苏林. 纤维素酶法水解的研究现状及展望[J]. 化工科技, 2006, 14(2): 51-56
[26] 罗贵民. 酶工程[M]. 北京: 化学工业出版社, 2003
[27] 余兴莲, 王丽, 徐伟民. 纤维素酶降解纤维素机理的研究进展[J]. 宁波大学学报(理工版), 2007, 20(1): 78-82
[28] Kaur J, Chadha B S, Saini H S. Regulation of cellulase production in two themophilic fungi Melanocarpus sp.MTCC 3922 and Scytalidium them ophilum MTCC 4520[J].Enzyme and Microbial Technology, 2006, 38: 931-936
[29] 郭大城, 席宇, 朱大恒. 一株碱性纤维素降解菌的分离与分子鉴定科技信息[J]. 科技信息: 学术研究, 2008,(26): 99-100
[30] Kaur J, Chadha B S, Kumar B A, et al. Purification and Chrarterization of B-glucosidase from Melanocarpus sp.MTCC 3922[J]. Electronic Juernal of Biotechnology, 2007,10(2): 260-270
[31] 李德莹, 龚大春, 田毅红, 等. 金属离子对纤维素酶活力影响的研究[J]. 酿酒科技, 2009(6): 40-42, 46
[32] Zhang C, Li D, Yu H, et al. Purification and characterrization of piceid-b-D-glucosidase from Aspergillus oryzae[J]. Process Biochemistry, 2006, 7: 83-88
[33] 赵玉蓉, 金宏, 陈清华, 等. 金属离子对纤维素酶及木聚糖酶活性影响的研究[J]. 饲料博览, 2005(1): 1-3
[34] 张智研, 张伟伟. 金属离子对纤维素酶水解玉米秸秆的影响[J]. 中国新技术新产品, 2010(8): 3-4
[35] 安刚, 陶毅明, 龙敏南, 等. 金属离子对白蚁纤维素酶活力的影响[J]. 厦门大学学报(自然科学版), 2008,47(S2): 107-109
[36] 丁轲, 余祖华, 恒子钤, 等. 产纤维素酶芽孢杆菌的诱变和酶学性质研究[J]. 饲料研究, 2012(9): 38-41
[37] 韩丽丽, 刘敏. 诱变方法在微生物育种中的应用[J]. 酿酒, 2008, 3(35): 16-18
Isolation, Identification, Mutagenesis of Cellulose-degrading Bacterium CMC-4 and Its Enzymatic Properties
WANG Xia1, HUA Lin2, ZHANG Hailong2, ZHU Anning3, CAO Hui2*
(1 Nanjing Intitute of Environmental Sciences, MEP, Nanjing 210042, China; 2 College of Economics and Management,Nanjing Agricultural University, Nanjing 210095, China; 3 Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008, China)
A strain with highly efficient to degrade cellulose was screened from straw returning soil, termed CMC-4. This strain was identified as Bacillus licheniformis by 16S rRNA gene sequencing, physiological and biochemical properties. Using sodium nitrite as mutagene, a mutant strain CMC-4-3 with stable high-cellulase producing was obtained. The enzymatic properties and enzyme producing conditions of CMC-4 and CMC-4-3 were analyzed. The results showed that cellulase activity of CMC-4-3 was two times as that of CMC-4. And the optimal conditions for enzyme producing of CMC-4-3 were as follows:medium Volume 60 ml/250 ml, inoculation size 2.0%, source of carbon glucose, nitrogen source peptone, the optimum temperature 37 ℃, optimum pH 6.0. The optimal pH and temperature of reaction for the cellulase were 6.0 and 50 ℃, and the enzyme activity was stable at the ranges of pH from 4.0 to 7.0 and temperature from 20 ℃ to 80 ℃. Fe2+, Mg2+, Co2+and K+could activate this cellulase, while other metal ions had some inhibiting effects on enzyme activity. Among inhibitory ions, the inhibition levels of Cu2+and Ca2+were strongest, with a 50% decrease in enzyme activity, thus proved to be the strongest inhibitors for this cellulase. Compared with wild strain CMC-4, the enzymatic properties and enzyme producing conditions for the mutant strain CMC4-3 changed partly, and showed more wide range of environment adaption. Thus a strain of Bacillus licheniformis with stable high-cellulase producing and wide adaption range was obtained. Moreover, the phenotypes of CMC-4 and CMC-4-3 could be the clue for studying genotype changes and the underlying molecular mechanism of mutation breeding.
Bacillus licheniformis; Cellulase; Mutagenesis; Enzymatic properties; Enzyme producing conditions
S154.39
A
10.13758/j.cnki.tr.2017.05.010
国家重点基础研究发展计划项目(2011CB100504)和江苏省环境监测科研基金项目(0713)资助。
王霞(1978—),女,山东泰安人,博士,主要从事生态学研究。E-mail:wangx@ofdc.org.cn

