脱氧雪腐镰刀菌烯醇的物理和化学脱毒方法研究进展
常敬华,栾雨婷,周安群,何志明
(辽宁工程技术大学理学院,辽宁 阜新 123000)
脱氧雪腐镰刀菌烯醇的物理和化学脱毒方法研究进展
常敬华,栾雨婷,周安群,何志明
(辽宁工程技术大学理学院,辽宁 阜新 123000)
脱氧雪腐镰刀菌烯醇(DON)主要污染小麦、玉米、大麦和燕麦等谷类作物,并可带入至面包、面条、麦片、饼干、啤酒和饲料中,是一种世界性粮食及其制品污染物。DON毒素具有较强的化学稳定性,在食物链中可持续对人和动物造成危害。DON毒素的脱毒方法主要包括物理、化学及生物脱毒。详细论述了加热、吸附、辐照等物理方法及碱性试剂、氧化试剂、还原试剂等化学试剂对DON毒素的影响,为降低DON毒素的潜在危害提供参考。
脱氧雪腐镰刀菌烯醇;谷类作物;脱毒
脱氧雪腐镰刀菌烯醇(DON)主要由禾谷镰刀菌产生,属B族单端孢霉烯族毒素,是世界流行性的谷物污染物。DON毒素主要污染小麦、玉米、大麦、燕麦等谷类作物,以及由这些原料加工成的小麦粉、面包、面条、麦片、啤酒和饲料等制品。由于受气候因素和种植、贮藏方式的影响,我国主要粮食易受DON毒素的污染,尤其是南方高温高湿地区,梅雨季节更有利于镰刀菌生长及产毒。
DON毒素具有多种毒性作用,分子中C12/C13上的环氧基团是DON毒素最主要的毒性基团,另外,三个自由羟基与DON毒性也有关,比较重要的是C3羟基(见图1)[1]。作物被DON毒素污染不仅造成产量降低、品质下降,并由于其具有较强的物理化学稳定性,加工中不易被破坏,严重影响人和动物的健康。在赤霉病的高发地区,严重时可造成人和动物的死亡。因此,污染谷物DON毒素的脱毒技术成为国内外科研工作者的研究热点。详细综述了国内外DON毒素的物理、化学脱毒方法,为饲料和食品的合理加工提供参考。
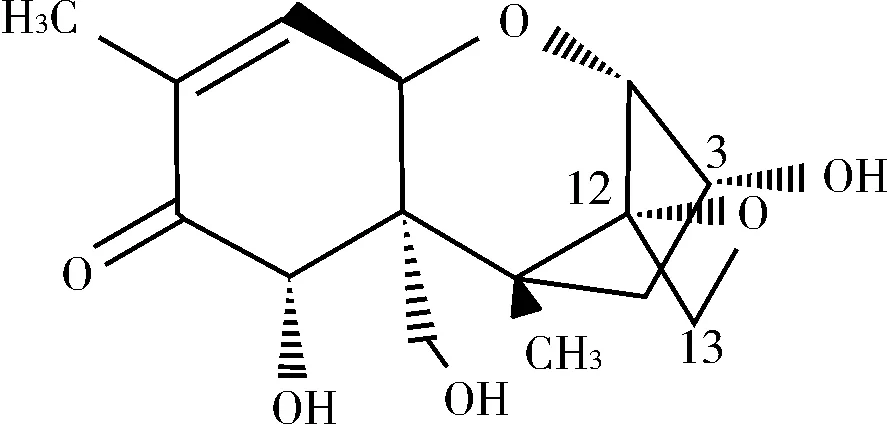
图1 脱氧雪腐镰刀菌烯醇(DON)的分子结构
1 脱氧雪腐镰刀菌烯醇的物理脱毒技术研究进展
1.1热处理
加热处理是降解DON毒素常用的物理方法,但在不同的酸碱性条件下,DON的热稳定程度及降解产物不同。Wolf在不同pH值(4、7、10)对DON标准品的热稳定性进行了研究,认为DON毒素在100℃或120℃弱酸性和中性条件加热1 h相对稳定,在碱性条件pH10.0时,120℃、30 min或者170℃、15 min条件下,DON毒素完全被破坏,加热时碱性环境促进了DON毒素的降解[2]。Bretz通过在碱性条件下加热DON和3-ADON,除获得已知的降解产物外,还获得了4种新产物[3]。Mishra将DON在不同温度下加热1 h,结果发现加热至100℃时稳定,125℃时DON轻度降解(约16%),温度提高到150~250℃,DON的降解率为83%~100%;将DON分别在pH值为1~12的水溶液中37℃孵育1 h后发现,pH6时降解率为11%,pH值为3、2和1时,DON浓度分别下降了30%,60%和66%,利用ESI-MS对酸性条件下的降解产物进行分析,其m/z为279,利用UV光谱与DOM-1标准品比对证实其λmax均为208,经判断为DOM-1,即脱环氧DON[4],而DON在低温条件37℃时,碱性pH(8~12)时较稳定。以上研究可以看出,热和碱性环境的协同作用增加了DON毒素的降解效果。
DON毒素在热加工食品中的变化已进行广泛的研究,由于食品中的DON毒素存在形式和所处环境相对复杂,不同的加工方式DON毒素的降解效果不同。用不同温度、处理时间、流速的过热蒸汽处理DON污染过的小麦发现,110℃和135℃未发生DON毒素含量降低,185℃的蒸汽处理6 min使DON浓度降低52%,其中热降解是DON破坏的主要因素[5]。面包等焙烤食品不仅需要加热,同时不同微生物发酵对DON毒素及衍生物产生的作用不同,从而影响焙烤后DON毒素含量变化;不含微生物发酵的饼干等焙烤食品其处理相对简单,但也需考虑食品成分、添加剂及焙烤条件的影响;黄碱面条等食品由于碳酸钠的加入在加热过程促进了DON毒素的降解。因此,不同食品加工过程DON毒素含量的变化除加热外可能由多种原因共同作用,研究食品加热过程对DON毒素的降解机制及降解产物,寻找合理的热加工方式有助于DON毒素的有效降解,从而提高产品的安全性[6-7]。
1.2吸附
利用吸附剂对真菌毒素进行吸附,可减少肠道对毒素的吸收,防止其进入血液及靶器官,降低真菌毒素对人体的毒害作用。合适的吸附剂选择需充分了解吸附剂及毒素的性质,包括吸附剂的物理结构如:总的吸收量、分布状况、孔径大小和表面性质等;对于真菌毒素,需要了解真菌毒素的极性、可溶性、分子大小、形状以及电离情况、电荷分布、电离常数等[8]。用于真菌毒素的吸附剂主要有活性炭、硅酸铝、水合铝硅酸钠钙(HSCAS)、黏土、膨润土、斜发沸石、合成树脂及酵母细胞壁衍生产物等。
用于真菌毒素吸附的材料由于来源不同、组成存在差异导致其物理性质不同,因而对DON毒素的吸附效果不尽相同。Avantaggiato建立的猪胃肠道实验室模型研究了活性炭和硅酸铝盐(Q/FIS)对真菌毒素的吸附作用,添加质量分数2%Q/FIS使黄曲霉毒素B1(AFB1)吸收率降低88%,玉米赤霉烯酮(ZON)降低44%,伏马菌素(FB)和赭曲霉毒素(OT)降低29%,而对DON效果不显著[9]。Sabater通过体外消化模型筛选对ZON和DON具有吸附作用的吸附剂,除所采用的阳性对照活性炭对DON具有较高的吸附率外,其它所采用的矿物黏土,腐殖质和酵母细胞壁衍生物对DON毒素均无效[10]。而用不同黏土矿物配制的专利产品真菌毒素吸附剂对DON具有吸附作用[11]。Hassan通过小鼠饲喂试验,在DON污染的饲料中添加活性炭显著减轻了不良反应[12]。Devreese对猪进行口服管饲的方式,添加0.1 g/kg BW活性炭吸附DON毒素并在猪体内进行吸附动力学试验,在猪的血浆中并未检测到DON毒素[13]。邓波利用提纯蒙脱土和碳化蒙脱土制成DON吸附剂添加至DON含量为2 500 μg/kg的霉变玉米中,能够改善DON对断奶仔猪生长性能的不利影响,并缓解DON对断奶仔猪所产生的肠道损伤[14]。从以上研究中发现,筛选合适的材料或对原始材料进行改性或与其它材料复合从而改变材料性质可能对提高DON毒素的吸附效果具有重要作用。
由于无机吸附剂的局限性,如某些活性炭虽然对DON具有一定吸附作用,但同时对饲料营养的吸附使其在实际生产中受到限制。最近十年,有机吸附材料的研究越来越受到重视,希望能找到有效的、专一的有机材料,或与无机材料进行复合,制造新型吸附剂。在猪的饲料中添加酵母细胞壁产品,具有减少DON和ZON对猪生长和健康的影响的能力[15]。Niderkorn等研究认为链球菌和肠球菌,能分别结合33% DON,49% ZON,24% FB1和62% FB2[16]。乳酸菌可结合DON和FB1、FB2,但菌株间差异较大,DON毒素去除率最高的为55%,FB1为82%,FB2为100%[17]。Cavret通过Caco-2细胞模型分析了6种吸附剂的作用,结果发现,活性炭、酵母甘露聚糖、海藻β-多糖、真菌β-多糖及豆科植物可降低DON对增生性肠细胞的毒性和分化的肠细胞对DON吸收的程度,但消胆胺无效[18]。Kong模拟猪的消化系统利用体外实验考察了10种吸附剂对DON和AFB1毒素的吸附效果,5种膨润土、2种纤维素、酵母细胞壁、活性炭及矿物、微生物与植物的复合产品对DON相应吸附率分别为3.24%、11.6%、22.9%、14.4%和4.3%,而对AFB1的吸附效果92.5%、-13.5%、92.7%、100.2%和96.6%,大多数吸附剂对AFB1的吸附更有效[19]。李荣佳以水合铝硅酸钠钙(HSCAS)、葡甘露聚糖(GM)制备复合吸附剂HG,通过体外及蛋雏鸡体内试验分析HG对AFB1及DON毒素的吸附效果,体外试验HG对AFB1吸附率(90.24%)优于DON(28.08%),体内试验发现,单纯添加HG对蛋鸡机体几乎无损害并具备与体外试验同样的吸附效果[20]。但Zhao研究结果为,壳聚糖复合物对DON无吸附作用[21]。Giuseppina研究发现葡萄皮渣对多种真菌毒素AFB1、ZEA、OTA、FB1均有吸附作用,但对DON毒素无效[22]。Souza分析了复合吸附剂(活性炭、酵母细胞壁)在体外对DON毒素的吸附效果并提供了DON毒素吸附预测模型[23]。Shang等评估了酵母细胞壁(YCW)吸附剂在预防真菌毒素对肉鸡毒性中的功效,研究认为,加入YCW可以防止真菌毒素对肉鸡的一些不良影响,但并未单独说明对DON毒素的吸附及效果[24]。从现有研究结果来看,利用吸附达到对DON毒素的脱毒并未取得显著突破,充分了解DON毒素的物理化学性质,寻找安全、吸附效果好的材料及人工合成新型、安全的复合料将成为吸附脱毒的研究重点。
1.3辐照脱毒
利用60Co、137Cs产生的γ射线或电子加速器产生的电子束以及紫外线辐照已经广泛用于谷物单端孢霉烯族毒素的去毒研究。利用60Co-γ射线辐照不同存在条件下的DON和3-ADON,结果表明:在溶液中,DON和3-ADON对60Co-γ射线均很敏感,1 kGy和5 kGy时降解开始,辐照剂量为50 kGy时,二者均被完全破坏;而玉米籽粒中的毒素在辐照剂量达50 kGy仍含有80%~90%,干燥状态下毒素对辐照不敏感[25]。利用γ射线对自然污染镰刀菌毒素的小麦、小麦粉和面包中DON毒素去除作用的研究中发现,γ射线对自然污染毒素的面包中DON的去除效果最好[26]。李萌萌研究认为,60Co-γ射线剂量为10 kGy、辐照0.5 μg/ml DON溶液时降解率达90%以上[27]。冯敏等用9 kGy剂量辐照水溶液、乙酸乙酯溶液中DON标准品及散装大米中DON,结果发现,在乙酸乙酯溶液中,800 μg/ml的DON的降解率为27.5%,水溶液中的降解率为73.1%,散装大米中DON含量为112.5 μg/kg时,9 kGy辐照降解率为90%[28]。李萌萌等用10 kGy辐照赤霉病小麦,籽粒中DON的降解率超过20%,赤霉病麦粒经浸泡后再辐照降解率可达55.76%[29]。另外,4组DON毒素含量不同的大麦在0、2、4、6、8和10 kGy条件下进行处理,发芽后测定DON毒素的变化,结果表明,6~10 kGy处理的大麦制备的成品麦芽中DON毒素降低60%~100%,辐照抑制了大麦发芽过程中镰刀菌的生长及产毒[30]。用电子束辐照小麦、DDGS及中间产物含可溶物的湿酒糟、酒糟可溶物及酒糟,发现中间产物在55.8 kGy剂量下DON毒素去除率为47.5%~75.5%,小麦DON含量降低了17.6%,而对DDGS中的DON去除效果不佳[31]。张昆采用高能射线电子束辐照处理DON溶液,辐照剂量增大,降解率增大[32]。从以上研究结果可以看出,辐照时的含水量对DON毒素的降解具有重要影响,且其辐照降解产物结构、性质及毒性有待进一步研究。
Park利用自制的微波诱导氩等离子体系统,经过5 s处理后可完全去除AFB1、DON和NIV,进一步利用老鼠巨噬细胞RAW264.7证明其毒性显著降低[33]。DON毒素在0.1 mW/cm2,254 nm的紫外线照射下随时间延长而减少,1 h后基本全部降解;24 mW/cm2紫外线增强了DON毒素的降解效果,照射剂量越大降解效果越好[34]。Murata用强度1.5 mW/cm2、254 nm紫外光辐照DON毒素浓度为60 μg/g的玉米青贮饲料,并连续搅拌30 min后,DON水平显著降低(13 μg/g),且其中所含维生素E及β-胡萝卜素含量没有变化[35]。余以刚以紫外照射强度1.2 mW/cm2,水分12.00%的条件下处理DON污染小麦粉60 min,4种不同DON含量的小麦粉降解率均达30%以上,且紫外线处理的DON毒素对LO2细胞的毒性降低[36]。通过充分研究紫外线照射条件下DON毒素的降解产物结构、性质及毒性,从而利用紫外线降解粮食及饲料中的DON毒素可能具有广泛的应用前景。
2 脱氧雪腐镰刀菌烯醇的化学脱毒技术研究进展
2.1碱法脱毒
研究认为,DON毒素在碱性条件下,DON的分子结构发生变化,分子毒性基团被破坏使毒性降低或者消失,例如,DON和NIV在碱性环境中会转化为不同的产物,包括打开12,13-环氧基团或C15经由反醛醇重排形成醛基或形成内酯结构。DON毒素的降解程度与pH值、温度及反应时间相关。在室温下利用氨熏发霉玉米1 h和18 h后,DON的浓度降低9%和85%。DON在NaOH溶液中加热已分离出的降解产物有9种,即isoDON、norDON A、norDON B、norDON C、DON内酯、9-羟甲基DON内酯、norDON D、norDON E、norDON F,利用人的无限增殖化肾脏上皮腺细胞进行细胞毒性试验,结果表明,DON有效浓度约1.1 μmol/L,而norDON A、B和C在100 μmol下没有发挥任何显著作用,表明环氧基团的破坏显著降低了DON的毒性[2]。同样,用Na2CO3和NaHCO3等碱性试剂处理DON毒素,随着温度及反应pH升高,对DON毒素分子结构的破坏作用越强。食品加工中,一定浓度的Na2CO3和适当的加热增强了DON毒素的去除效果[37]。在含有18.4 μg/g DON的大麦样品中加入1 mol/L的Na2CO3,添加量为20 ml/100 g,80℃孵育1 d后DON降至4.7 μg/g,8 d后DON毒素几乎被完全降解,而无添加Na2CO3的样品,DON在1 d后下降至14.7 μg/g,8 d后降至4.9 μg/g[38]。DON和NIV与N-α-乙酰-L-赖氨酸甲酯加热会迅速降解,可能与ε-氨基基团的碱性催化有关。因以赖氨酸为基础,ε-氨基基团常常参与氢键结合,并作为广义碱起催化作用。这个功能基团常发生甲基化作用,可以解释DON的反应产物中C15常会失去乙酰基团[2]。因此,在食品及饲料的加工过程中,合理利用热和碱的协同效应可对DON毒素进行有效去除。
2.2氧化作用

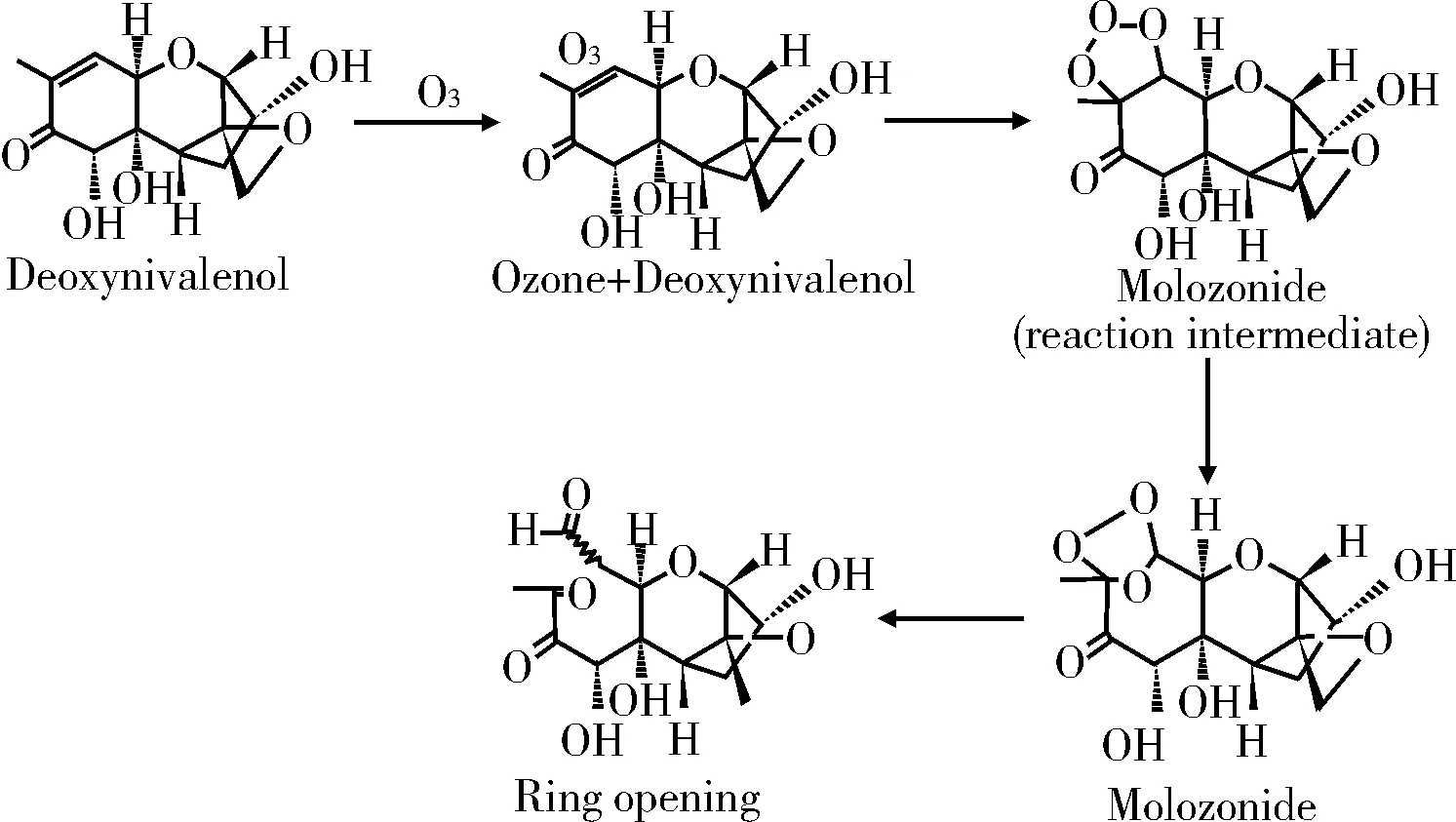
图2 DON在臭氧条件下的变化
2.3还原作用
还原剂也可改变单端孢霉烯族毒素的分子结构和生物活性。例如:抗坏血酸、半胱氨酸、谷胱甘肽以及含硫试剂等。其中,去毒效果较好的化合物主要是含硫试剂,主要包括亚硫酸氢钠、亚硫酸钠、硫代硫酸钠、焦亚硫酸钠等,因其具有较强的还原性能将DON转化成DON-磺酸盐,并已被证明对猪的毒性降低有作用[50-51]。利用含硫试剂与DON反应后鉴别得到三类磺酸盐产物及产生的条件,结果见图3[52],另有研究认为,DON与Na2S2O5(SBS)结合的位点有两个,见图4[51]。
用NaHSO3处理的小麦生产的小麦粉,DON的保留率只有5%。以100℃,输入水分为22%的饱和蒸汽连续搅拌15 min,1%的Na2S2O5能使小麦中DON含量由7.6 mg/kg降至0.28 mg/kg,降解产物为DON-磺酸盐,并在碱性条件可重新水解为DON。用Na2S2O5处理过的小麦与未处理过的发霉小麦进行小猪饲喂试验,结果发现,用Na2S2O5处理过的小麦显著优于未处理的发霉小麦,在试验小猪的血浆中没有发现DON,说明DON-磺酸盐具有一定的稳定性,在胃的强酸环境及在中性和弱碱性的小肠中稳定存在而没有水解,接近于无毒[52]。用Na2S2O5、甲胺及氢氧化钙处理受DON及ZEN污染的玉米并饲喂雌性仔猪,并对仔猪的各项指标进行检测,27 d之后,通过血浆毒素的检测证明,Na2S2O5、甲胺及氢氧化钙对发霉玉米具有有效的脱毒作用,用处理后的玉米饲喂的仔猪的健康状态未受到影响。造粒时添加Na2S2O5可提高污染猪饲料的利用率,Na2S2O5具有较好的脱毒效果及并未对保育猪产生显著的影响[53-54]。通过体外MTT实验,分析了DON、DOM-1、DON-磺酸盐、SBS对外周血单个核细胞(PBMC)和猪肠道上皮细胞IPEC-1和IPEC-J2的毒性,DON的IC50分别为1.2±0.1,1.3±0.5和3.0±0.8 mmol/L,而DONS、SBS和DOM-1浓度分别为17、8和23 mmol/L,均未对上述细胞产生显著影响[51]。Dänicke在不同水分下,调查Na2S2O5和丙酸(PA)对贮藏中的发霉小麦DON的动态变化及腐败现象,结果发现,Na2S2O5(5 g/kg)单独或与PA(10 g/kg)联合使用,阻止了霉菌的生长,DON毒素含量降至原含量的1.2%~4.3%[55]。Paulick测试了用Na2SO3和PA进行对DON脱毒的效果研究,DON浓度随着补充的Na2SO3的量的增加而减少,高水分30%有利于DON减少,在低含水量下,玉米粒中的DON降低比玉米粉更显著[56]。Frobose研究认为,1.0%的Na2S2O5使污染的小麦DON降低了92%,添加了Na2S2O5的饲料降低了DON对猪的毒性作用,但在生理条件下DON-磺酸盐可能重新降解为DON[57]。由于磺酸盐类化合物在食品中应用具有较大的安全隐患,其在食品中脱毒受到限制,但从现有研究来看,一定浓度的磺酸盐含量用于饲料脱毒并未发现对动物的生理生化造成显著影响,因此,经过严格的检验与分析,在饲料中的应用可能具有较好的前景。
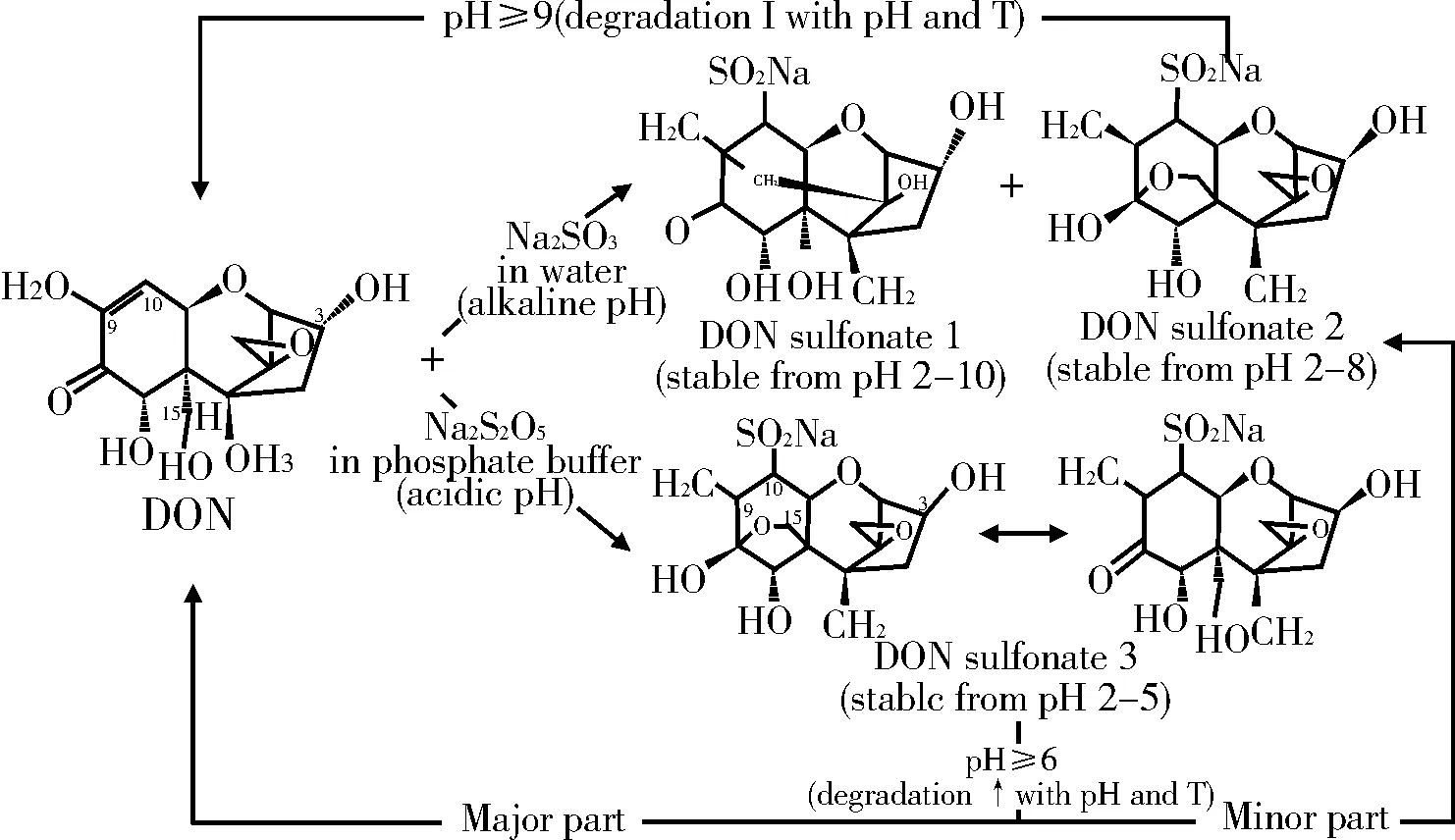
图3 DON与含硫试剂的反应产物及产生条件
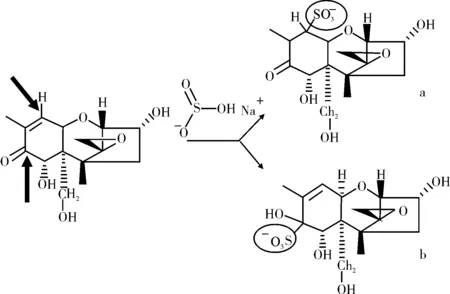
图4 DON与Na2S2O5的反应产物结构
相对安全的还原试剂主要有抗坏血酸、L-半胱氨酸和谷胱甘肽等,L-半胱氨酸作为添加剂使用的可显著降低面包中DON的含量(38%~46%),并检测到产物isoDON[58]。谷胱甘肽是生物体最强的还原剂,研究发现,谷胱甘肽与DON共孵育时可降低DON含量,并分析了3种降解产物的可能结构,见图5[59],但其在生产中应用及安全性有待验证。

图5DON与谷胱甘肽结合物的可能结构
注:质谱测定结合物分子量为603.65(C25H37N3O12S)
3 展望
自然污染的谷物中除存在DON毒素外,其衍生物也广泛存在,在物理、化学反应过程中可能出现相互转化的现象,且DON毒素的物理、化学脱毒技术大多伴随着分子结构的变化,应对其反应产物的分子结构、毒性进行详细分析。尤其是化学脱毒技术,除保证较好的脱毒效果外,还应考虑化学试剂本身带来的安全性问题,研发高效、安全的物理、化学脱毒技术在谷物脱毒过程具有重要意义。
[1] KARLOVSKY P. Biological detoxification of the mycotoxin deoxynivalenol and its use in genetically engineered crops and feed additives[J]. Applied Microbiology and Biotechnology, 2011, 91(3): 491-504.
[2] WOLF C E, BULLERMAN L B. Heat and pH alter the concentration of deoxynivalenol in an aqueous environment[J]. Journal of Food Protection, 1998, 61(3):365-367.
[3] BRETZ M, BEYER M, CRAMER B, et al. Thermal degradation of theFusariummycotoxin deoxynivalenol [J]. Journal of Agricultural and Food Chemistry, 2006, 54(17): 6 445-6 451.
[4] MISHRA S, DIXIT S, DWIVEDI P D, et al. Influence of temperature and pH on the degradation of deoxynivalenol (DON) in aqueous medium: comparative cytotoxicity of DON and degraded product[J]. Food Additive and Contaminants Part A Chemistry Analysis Control Exposure Risk Assess, 2014, 31(1): 121-131.
[5] CENKOWSKI S, PRONYK C, ZMIDZINSKA D, et al. Decontamination of food products with superheated steam[J]. Journal of Food Engineering, 2007, 83(1): 68-75.
[6] VIDAL A, SANCHIS V, RAMOS A J, et al. Thermal stability and kinetics of degradation of deoxynivalenol, deoxynivalenol conjugates andOchratoxinA during baking of wheat bakery products[J]. Food Chemistry, 2015, 178:276-286.
[7] WU Q, KUCA K, HUMPF H U, et al. Fate of deoxynivalenol and deoxynivalenol-3-glucoside during cereal-based thermal food processing: a review study[J]. Mycotoxin Res, 2017,33(1):79-91.
[8] JARD G, LIBOZ T, MATHIEU F, et al. Review of mycotoxin reduction in food and feed: from prevention in the field to detoxification by adsorption or transformation[J]. Food Additives and Contaminants Part A Chemistry Analysis Control Exposure amp; Risk Assessment, 2011, 28(11): 1 590-1 609.
[9] AVANTAGGIATO G, HAVENAAR R, VISCONTI A. Assessment of the multi-mycotoxin-binding efficacy of a carbon/aluminosilicate-based product in an in vitro gastrointestinal model[J]. Journal of Agricultural amp; Food Chemistry, 2007, 55(12):4 810-4 819.
[10] SABATER-VILAR M, MALEKINEJAD H, SELMAN M H, et al. In vitro assessment of adsorbents aiming to prevent deoxynivalenol and zearalenone mycotoxicoses[J]. Mycopathologia, 2007, 163(2): 81-90.
[11] QIANG Z, TRUONG M, MEYNEN K, et al. Efficacy of a mycotoxin binder against dietary fumonisin, deoxynivalenol, and zearalenone in rats[J]. Journal of Agricultural and Food Chemistry, 2011, 59(13): 7 527-7 533.
[12] HASSAN M M S. Efficacy of some adsorbent materials against deoxynivalenol toxicity in laboratory animals[EB/OL].[2017-03-18].http://agris.fao.org/agris-search/search.do?recordID=EG2012000658.
[13] DEVREESE M. Efficacy of active carbon towards the absorption of deoxynivalenol in pigs[J]. Toxins, 2014, 6(10):2 998-3 004.
[14] 邓 波, 万 晶, 徐子伟,等. 脱氧雪腐镰刀菌烯醇吸附剂对断奶仔猪生长性能、血清生化指标及肠道形态的影响[J]. 动物营养学报, 2014, 26(5):1 294-1 301.
[15] WEAVER A C, SEE M T, KIM S W. Protective effect of two yeast based feed additives on pigs chronically exposed to deoxynivalenol and zearalenone[J]. Toxins, 2014, 6(12):3 336-3 353.
[16] NIDERKORN V, MORGAVI D P, PUJOS E, et al. Screening of fermentative bacteria for their ability to bind and biotransform deoxynivalenol, zearalenone and fumonisins in an in vitro simulated corn silage model[J]. Food Additives amp; Contaminants, 2007, 24(4):406-415.
[17] NIDERKORN V, MORGAVI D P, BOUDRA H. Binding of Fusarium mycotoxins by fermentative bacteria in vitro[J]. Journal of Applied Microbiology, 2006, 101(4):849-856.
[18] CAVRET S, LAURENT N, VIDEMANN B, et al. Assessment of deoxynivalenol (DON) adsorbents and characterisation of their efficacy using complementary in vitro tests[J]. Food Additive and Contaminants Part A Chemistry Analysis Control Exposure Risk Assess, 2010, 27(1): 43-53.
[19] KONG C, SHIN S Y, KIM B G. Evaluation of mycotoxin sequestering agents for aflatoxin and deoxynivalenol: an in vitro approach[J]. Springerplus, 2014, 3(1):346-346.
[20] 李荣佳,李治忠,周 闯,等.新型复合吸附剂HG对黄曲霉毒素B1和呕吐毒素的吸附脱毒研究[J].南京农业大学学报,2015,38(1):113-119.
[21] ZHAO Z, LIU N, YANG L, et al. Cross-linked chitosan polymers as generic adsorbents for simultaneous adsorption of multiple mycotoxins[J]. Food Control, 2015, 57:362-369.
[22] GIUSEPPINA A, DONATO G, ANNA D, et al. Assessment of multi-mycotoxin adsorption efficacy of grape pomace[J]. J Agric Food Chem, 2014, 62(2):497-507.
[23] SOUZA A F D, BORSATO D, LOFRANO A D, et al. In vitro removal of deoxynivalenol by a mixture of organic and inorganic adsorbents[J]. World Mycotoxin Journal, 2015, 8:113-119.
[24] SHANG Q H, YANG Z B, YANG W R, et al. Toxicity of mycotoxins from contaminated corn with or without yeast cell wall adsorbent on broiler chickens[J]. Asian Australasian Journal of Animal Sciences, 2016, 29(5):674-680.
[25] ONEILL K, PATTERSON A P D M F. The stability of deoxynivalenol and 3-acetyl deoxynivalenol to gamma irradiation[J]. Food Addit Contam, 1993, 10(2):209-215.
[26] AZIZ N, ATTIA E S, FARAG S. Effect of gamma-irradiation on the natural occurrence ofFusariummycotoxins in wheat, flour and bread[J]. Food/Nahrung, 1997, 41(1): 34-37.
[27] 李萌萌,卞 科,关二旗,等. 辐射降解脱氧雪腐镰刀菌烯醇(DON)的研究[J]. 食品研究与开发, 2013(1):1-4.
[28] 冯 敏, 王 玲, 朱佳廷,等. 辐照降解溶液及粮谷中的脱氧雪腐镰刀菌烯醇[J]. 核农学报, 2016(9):1 738-1 743.
[29] 李萌萌, 关二旗, 卞 科.60Co-γ辐照对赤霉病小麦中DON的降解效果[J]. 中国粮油学报, 2015(10):1-5.
[30] KOTTAPALLI B, WOLF-HALL C E, SCHWARZ P. Effect of electron-beam irradiation on the safety and quality ofFusarium-infected malting barley[J]. International Journal of Food Microbiology, 2006, 110(3): 224-231.
[31] STEPANIK T, KOST D, NOWICKI T,et al. Effects of electron beam irradiation on deoxynivalenol levels in distillers dried grain and solubles and in production intermediates[J]. Food Additives and Contaminants, 2007, 24(9):1 001-1 006.
[32] 张 昆,卞 科, 关二旗,等.电子束辐照降解脱氧雪腐镰刀菌烯醇的研究[J].粮食与饲料工业, 2014(2):13-16.
[33] PARK B J, TAKATORI K, SUGITA-KONISHI Y, et al. Degradation of mycotoxins using microwave-induced argon plasma at atmospheric pressure[J]. Surface and Coatings Technology, 2007, 201(9): 5 733-5 737.
[34] MURATA H, MITSUMATSU M, SHIMADA N. Reduction of feed-contaminating mycotoxins by ultraviolet irradiation: an in vitro study[J]. Food Additives and Contaminants Part A Chemistry Analysis Control Exposure amp; Risk Assessment, 2008, 25(9): 1 107-1 110.
[35] MURATA H, YAMAGUCHI D, NAGAI A, et al. Reduction of deoxynivalenol contaminating corn silage by shortterm ultraviolet irradiation: a pilot study[J]. The Japanese Society of Veterinary Science, 2011, 73(8): 1 059-1 060.
[36] 余以刚, 马涵若, 侯 芮,等. 臭氧和紫外降解小麦粉中的DON及对小麦粉品质的影响[J]. 现代食品科技, 2016(9):196-202.
[37] 常敬华, 赵月菊, 邢福国,等. 挂面加工中脱氧雪腐镰刀菌烯醇的变化规律[J]. 中国食品学报, 2015, 15(8):178-184.
[38] ABRAMSON D, HOUSE J D, NYACHOTI C M. Reduction of deoxynivalenol in barley by treatment with aqueous sodium carbonate and heat[J]. Mycopathologia, 2005, 160(4): 297-301.
[39] TIWARI B K, BRENNAN C S, CURRAN T, et al. Application of ozone in grain processing[J]. Journal of Cereal Science, 2010, 51(3): 248-255.
[40] YOUNG J C, ZHU H, ZHOU T. Degradation of trichothecene mycotoxins by aqueous ozone[J]. Food and Chemical Toxicology, 2006, 44(3): 417-424.
[41] LI M M, GUAN E Q, BIAN K. Effect of ozone treatment on deoxynivalenol and quality evaluation of ozonised wheat[J]. Food Additives amp; Contaminants Part A Chemistry Analysis Control Exposure amp; Risk Assessment, 2014, 32(4):1-10.
[42] DODD J G, VEGI A, Vashisht A, et al. Effect of ozone treatment on the safety and quality of malting barley[J]. Journal of Food Protection, 2011, 74(12):2 134-2 141.
[43] MYLONA K. Fusarium species in grains: dry matter losses, mycotoxin contamination and control strategies using ozone and chemical compounds[D].Cranfield, Bedfordshire:Cranfield University, 2012.
[44] SAVI G D, PIACENTINI K C, BITTENCOURT K O, et al. Ozone treatment efficiency onFusariumgraminearum and deoxynivalenol degradation and its effects on whole wheat grains (TriticumaestivumL.) quality and germination[J]. Journal of Stored Products Research, 2014, 59:245-253.
[45] SUN C, JI J, WU S, et al. Saturated aqueous ozone degradation of deoxynivalenol and its application in contaminated grains[J]. Food Control, 2016, 69:185-190.
[46] WANG L, SHAO H, LUO X, et al. Effect of ozone treatment on deoxynivalenol and wheat quality[J]. Plos One, 2016, 11(1):e0147613.
[47] WANG L, LUO Y, LUO X, et al. Effect of deoxynivalenol detoxification by ozone treatment in wheat grains[J]. Food Control, 2016, 66:137-144.
[48] WANG L, WANG Y, SHAO H, et al. In vivo toxicity assessment of deoxynivalenol-contaminated wheat after ozone degradation[J]. Food Additives amp; Contaminants Part A Chemistry Analysis Control Exposure amp; Risk Assessment, 2016,34(1):103-112.
[49] OCONNELL T W. Apparatus and method for treating stored crops infected with toxins:US2013/0071287 A1[P]. 2013-03-21.
[50] MARLEEN P, JANINE W, SUSANNE K, et al. Studies on the bioavailability of deoxynivalenol (DON) and DON sulfonate (DONS) 1, 2, and 3 in pigs fed with sodium sulfite-treated DON-contaminated maize[J]. Toxins, 2015, 7(11):4 622-4 644.
[51] DANICKE S, KERSTEN S, VALENTA H, et al. Inactivation of deoxynivalenol-contaminated cereal grains with sodium metabisulfite: a review of procedures and toxicological aspects[J]. Mycotoxin Research, 2012, 28(4): 199-218.
[52] SCHWARTZ H E, HAMETNER C, SLAVIK V, et al. Characterization of three deoxynivalenol sulfonates formed by reaction of deoxynivalenol with sulfur reagents[J]. Journal of Agricultural and Food Chemistry, 2013, 61(37): 8 941-8 948.
[53] REMPE I, BREZINA U, KERSTEN S, et al. Effects of aFusariumtoxin-contaminated maize treated with sodium metabisulphite, methylamine and calcium hydroxide in diets for female piglets[J]. Archives of Animal Nutrition, 2013, 67(4): 314-329.
[54] REMPE I, KERSTEN S, VALENTA H, et al. Hydrothermal treatment of naturally contaminated maize in the presence of sodium metabisulfite, methylamine and calcium hydroxide; effects on the concentration of zearalenone and deoxynivalenol[J]. Mycotoxin Research, 2013, 29(3):169-175.
[55] DANICKE S, PAHLOW G, GOYARTS T, et al. Effects of increasing concentrations of sodium metabisulphite (Na2S2O5, SBS) on deoxynivalenol (DON) concentration and microbial spoilage of triticale kernels preserved without and with propionic acid at various moisture contents[J]. Mycotoxin Research, 2009, 25(4):215-223.
[56] PAULICK M, REMPE I, KERSTEN S, et al. Effects of increasing concentrations of sodium sulfite on deoxynivalenol and deoxynivalenol sulfonate concentrations of maize kernels and maize meal preserved at various moisture content[J]. Toxins, 2015, 7(3):791-811.
[57] FROBOSE H L, STEPHENSON E W, TOKACH M D, et al. Effects of potential detoxifying agents on growth performance and deoxynivalenol (DON) urinary balance characteristics of nursery pigs fed DON-contaminated wheat[J]. Journal of Animal Science,2017, 1(7):1-16.
[58] BOYACIOGLU D, HELTIARACHCHY N S, DAPPOLONIA B L. Additives affect deoxynivalenol (vomi toxin) flour during bread baking[J]. Journal of Food Science, 1993, 58(2): 416-418.
[59] GARDINER S A, BODDU J, BERTHILLER F, et al. Transcriptome analysis of the barley-deoxynivalenol interaction: evidence for a role of glutathione in deoxynivalenol detoxification[J]. Molecular Plant-Microbe Interactions, 2010, 23(7): 962-976.
(责任编辑:赵琳琳)
Progressofdeoxynivalenoldetoxificationbyphysicalandchemicalmethods
CHANG Jing-hua,LUAN Yu-ting,ZHOU An-qun,HE Zhi-ming
(College of Science,LiaoningTechnical University,Fuxin 123000, China)
Deoxynivalenol (DON), a kind of trichothecene mycotoxin, is a frequent worldwide contaminant of cereal crops including wheat, corn, oat, et al. And bread, noodles, oatmeal, biscuit, beer and feeds can also be contaminated by DON. DON has strong chemical stability, sustainable cause harm to people and animals in the food chain. Physical, chemical and biological methods are popular to reduce DON. We discussed the influence of physical methods, such as heating, adsorption, irradiation and chemical methods such as alkaline reagents, oxidizing reagents, reducing reagent on DON,to provide reference for potential hazard reduction of DON.
deoxynivalenol;cereal crops;detoxification
2017-03-18;
2017-11-07
科技部基础性工作专项重点项目(2013FY113400);辽宁省教育厅基金(L2015207);辽宁工程技术大学生产技术问题创新研究基金(20160040T)。
常敬华(1975-),女,讲师,博士,研究方向为粮食真菌及毒素控制。
10.7633/j.issn.1003-6202.2017.11.006
Q936;TS201.6;S379.7
A
1003-6202(2017)11-0021-07

