构巢曲霉锰过氧化物酶转化子菌株对6种染料的脱色1)
张健 池玉杰 于存
(东北林业大学,哈尔滨,150040)
构巢曲霉锰过氧化物酶转化子菌株对6种染料的脱色1)
张健 池玉杰 于存
(东北林业大学,哈尔滨,150040)
为了获得构巢曲霉(Aspergillusnidulans)锰过氧化物酶转化子菌株TN02A7-Lg-mnp2对不同染料的脱色效果。用分光光度法对酶活性检测的丙二酸钠缓冲溶液的pH进行了优化筛选,用单因素和正交试验对产酶条件进行了优化;检测了优化后的酶液对达旦黄、孔雀石绿、中性红、刚果红、曲利本蓝和结晶紫的脱色效果。菌株酶液对偶氮类的达旦黄、三苯基甲烷类的孔雀绿和杂环类的中性红都有显著的脱色效果,在1 h时脱色率分别为达94.41%、91.43%和90.00%,在16 h时脱色率分别为98.36%、100%和96.47%。酶液对双偶氮的刚果红和曲利本蓝也有不错的脱色效果,在16 h的脱色率分别为96.76%和89.39%。对三苯基甲烷类的结晶紫的脱色效果相对较弱,在16 h的脱色率为67.31%。最终结果表明,菌株TN02A7-Lg-mnp2的酶液对多种染料都有很强的脱色能力,在染料废水处理方面具有极强的应用前景。
构巢曲霉;锰过氧化物酶;转化子;染料脱色
染料废水是主要的水体污染源和有害工业废水之一,主要来源于染料及其中间体生产和纺织印染行业,由各种产品和中间体结晶的母液、生产过程中流失的物料及冲刷地面的污水等组成。根据化学结构的特征基团合成染料可分为偶氮、蒽醌、靛旋、酞菁、硫化、硝基和亚硝基、甲川、三芳基甲烷、杂环、二苯乙烯等类别。自1856年第一个合成染料“苯胺紫”问世以来,染料制备工业迅速发展,合成染料广泛应用于纺织业、造纸业、食品、医药、化妆品、摄影、橡胶、涂料、油墨和制革等行业[1]。据统计合成染料在生产和使用过程中,约12%以废水形式释放到环境中[2-4],其内含多种有毒物质,有色度高、成分复杂、化学需氧量高、化学性质稳定、可生化性差、生物毒性大等特点,对人体和其他生物具有致畸、致癌、致突变等作用[5],对生物的健康与生态环境造成了极大的威胁和严重危害。目前,世界上对染料废水的处理方法主要有物理化学法、物理吸附法、化学法、生化法和生物法等[6]。其中生物法是利用微生物菌体的吸附作用和酶的降解作用从而净化废水中污染物的方法。生物法由于处理费用低、环境友好、无二次污染、操作简单等优点,受到了广泛地关注,其中真菌对染料的脱色研究最为广泛[7-8]。白腐真菌分泌的锰过氧化物酶(MnPs)对于木质素结构相似的染料等有机污染物具有降解能力,白腐菌的mnp2基因已转入到了构巢曲霉尿嘧啶尿苷营养缺陷菌株TN02A7中,获得了转化子菌株TN02A7-Lg-mnp2。本研究在此基础上先对该菌株的产酶条件进行了优化筛选,然后用优化后的酶液对达旦黄、孔雀石绿、中性红、刚果红、曲利本蓝和结晶紫6种染料进行了脱色研究,目的是搞清构巢曲霉转化子菌株TN02A7-Lg-mnp2的酶液对多种染料的脱色能力与该菌株在染料工业废水脱色中的潜能。
1 材料与方法
1.1 菌种来源、培养基与菌种复壮
白腐菌mnp2基因的构巢曲霉转化子菌株TN02A7-Lg-mnp2,由东北林业大学森林保护学科森林病虫病理实验室提供,于冰箱内4 ℃的MMPGRT固体平板培养基上保存。取出后,在室温下静置24 h,先接种在新鲜的MMPGRT平板培养基上,于37 ℃下培养,对菌株进行第1次复壮,然后再接种在MMPGRT平板培养基上进行第2次复壮,此时一般3~4 d即可长满平板,菌种活力最强,为后续试验菌株。
MMPGRT培养基:20×Salts(NaNO3120.0 g,KCl 10.4 g,KH2PO430.4 g,MgSO4·7H2O 10.4 g,蒸馏水定容至1 000 mL)50.0 mL,微量元素(ZnSO4·7H2O 22.0 g,H3BO311.0 g,MnCl2·4H2O 5.0 g,FeSO4·7H2O 5.0 g,CoCl2·5H2O 1.6 g,CuSO4·5H2O 1.6 g,(NH4)6MO7O24·4H2O 1.1 g,EDTA 50.0 g,蒸馏水定容至1 000 mL)1.0 mL,100%甘油10.0 mL,吡哆醇0.5 mg,核黄素2.5 mg,苏氨酸11.9 g,固体培养基需加入20.0 g·L-1琼脂粉,调pH至6.5[9]。
1.2 初始培养与MnP活性检测
在三角瓶(100 mL)中加入50 mL的MMPGRT培养液,产酶底物为青杨木屑2.0 g,pH=6.5,高压灭菌20 min,将2个φ=10 mm菌块接入,在37 ℃、220 r·min-1下摇床培养,分别在0、24、48、72、96、120、144、168 h时提取培养液即酶液500 μL,6 000 r·min-1离心5 min,取上清液测酶活性。测定体系1 mL,其中丙二酸钠缓冲液(50 mmol·L-1,pH=4.5)840 μL,MnSO4(10 mmol·L-1)50 μL,2,6-DMP(10 mmol·L-1)50 μL,酶液样品50 μL,H2O2(10 mmol·L-1)10 μL,以1 000 μL去离子水作为对照,以470 nm处1 min内吸光度OD值的变化作为MnP活性值[10-11]。上述条件下,每分钟催化1 μmol 2,6-DMP所需的酶量为一个酶活单位(U·L-1)。酶活计算公式,MnP活力=[106×V1×ΔA×N]/[V2×ε470×Δt]。式中:V1为反应总体积;V2为酶液的体积;N为酶液稀释倍数;ε为摩尔消光系数,ε470=49 600 mol·L-1·cm-1;Δt为反应时间;ΔA为反应时间内吸光度的变化增量值。
1.3MnP活性检测中丙二酸钠缓冲液最适pH的筛选
在初始条件下对转化子菌株进行培养,72 h后提取酶液。在酶活测定中,称取一定量的丙二酸溶于去离子水中,然后用NaOH溶液来调节pH,配制一系列不同pH的50 mmol·L-1丙二酸钠缓冲液,使其pH值分别为2.0、2.5、3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0、8.5、9.0、9.5、10.0、10.5、11.0、11.5、12.0。用这些缓冲液替代原来pH=4.5的缓冲液后测定酶活力,以pH为横坐标,以相对酶活力为纵坐标作图(以酶活最高者为100%)。每组做3次重复。从中筛选出酶活性最高的缓冲液pH。
1.4 TN02A7-Lg-mnp2产MnP培养条件的优化
1.4.1 最适产酶温度的单因素试验
为了确定产酶的最适培养温度,在适于菌株生长和产酶的温度范围内选取27、32、37、42 ℃这4个温度梯度在220 r·min-1下摇床培养,分别在0、24、48、72、96、120、144、168 h时各提取500 μL培养液检测酶活,对培养温度进一步筛选验证,明确菌株产酶量最高的培养温度。
1.4.2 正交试验
MnP活性受多种培养条件的影响,如进行多个单项单因素筛选工作量大且耗时长,所以选用正交试验进行多因素的筛选。选取对产酶影响较大并易于控制的主要培养参数作为试验因素,进行了4个培养因素[12-15]在3个水平下酶活性的检测与筛选(表1)。每组试验3个重复,在培养后的72 h检测酶活值。

表1 菌株TN02A7-Lg-mnp2产MnP培养因素正交试验设计
1.4.3 优化培养验证试验
以所有优化后的条件培养TN02A7-Lg-mnp2,以1.2中的初始条件培养作对照,3个重复,验证优化产酶条件的结果。
1.5TN02A7-Lg-mnp2胞外酶液对6种染料的脱色试验
将6种染料(偶氮类的达旦黄、刚果红和曲利本蓝,杂环类的中性红,三苯基甲烷类的孔雀绿和结晶紫)分别配制成质量浓度为50 mg·L-1的溶液,用紫外分光光度计在300~800 nm内扫描,得到吸收峰光谱图,从中查找到最大吸收峰处的吸光值及对应的波长值,以去离子水为对照。将TN02A7-Lg-mnp2按照1.4中得到的优化条件进行培养,提取72 h的培养液过滤掉菌丝得到胞外酶液,分设成6个试验组和1个对照组,向试验组的小管中先分别加入6种染料再加入酶液,使染料质量浓度均为50 mg·L-1,对照组不加任何染料只有酶液,每组3个重复,静止,在5 min、1 h、4 h、8 h、12 h、16 h、20 h时,或达到最大脱色率为止[13],在最大吸收峰处的波长值下测定各自染料的吸光值,取3组数据的平均值,以试验组的吸光值减去对照组的吸光值记为Ai值,以含50 mg·L-1不同染料水溶液的吸光值减去对照组的吸光值记为A0值,以下述公式计算脱色率,脱色率=((A0-Ai)/A0)×100%。绘制6种染料脱色率随时间的变化曲线[16]。
2 结果与分析
2.1 初始培养条件下MnP的活性
由图1可知,在初始培养条件下,转化子菌株TN02A7-Lg-mnp2产MnP的活性在24~72 h呈显著升高的趋势,72 h达到最高,为9.81 U·L-1,之后缓慢下降。
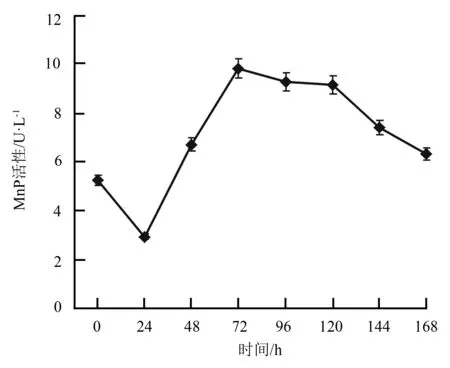
图1 初始培养条件下TN02A7-Lg-mnp2的MnP活性
2.2 MnP活性检测中丙二酸钠缓冲液的最适pH
在不同pH的丙二酸钠缓冲液下,菌株TN02A7-Lg-mnp2在初始条件培养72 h提取的相同酶液活性有显著差异(图2),其中pH=3.5时酶活最高,为12.31 U·L-1(相对酶活为100%),是最低酶活(pH=6.0)的30倍,是pH=4.5时酶活的8.3倍。因此,酶活性检测中丙二酸钠缓冲液的最适pH为3.5。pH=5.0~6.5酶活较低,而pH=7.0~12.0酶活略有回升。
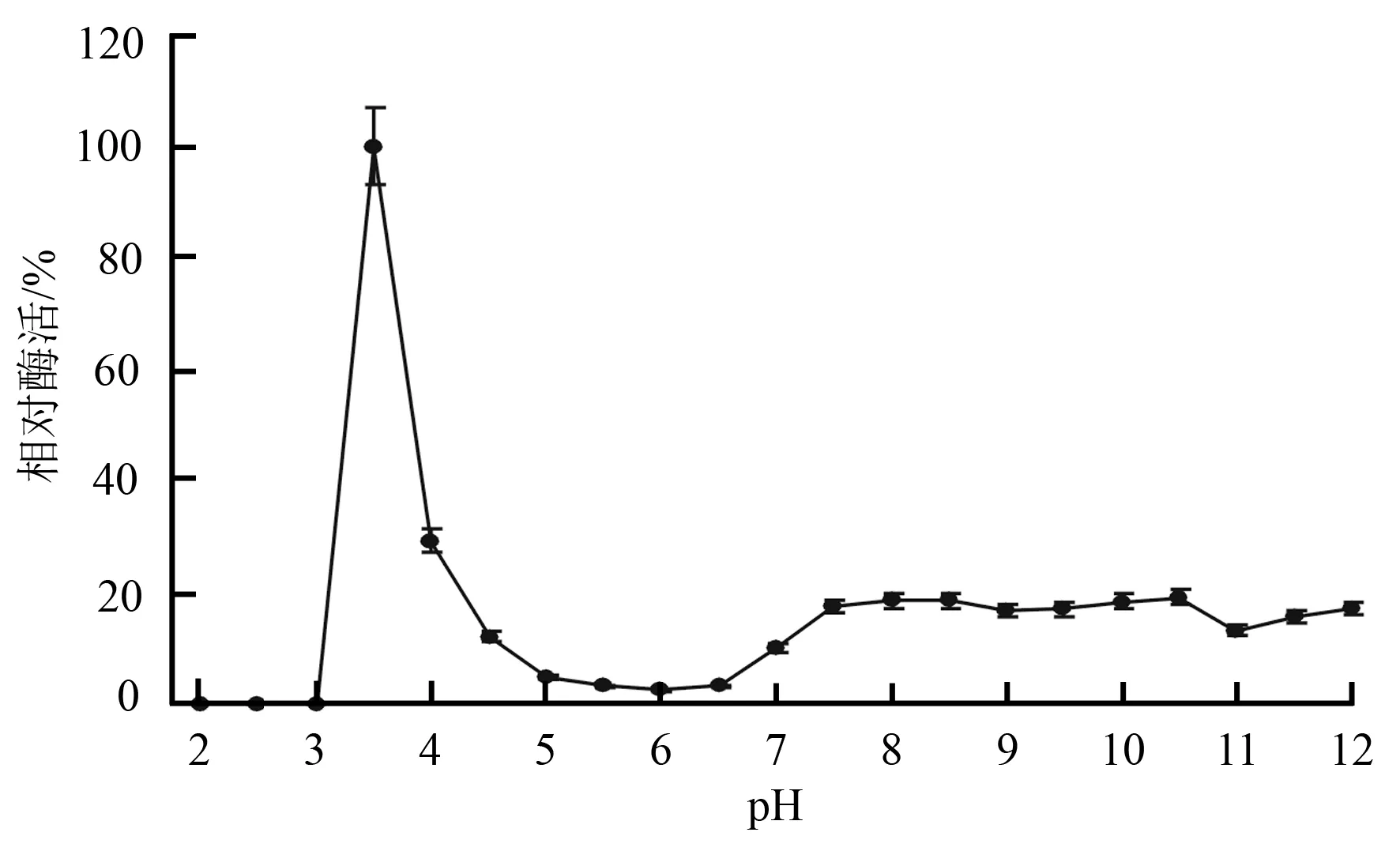
图2丙二酸钠缓冲液pH对TN02A7-Lg-mnp2 MnP活性的影响
2.3 TN02A7-Lg-mnp2产MnP的优化培养
2.3.1 最适产酶培养温度
TN02A7-Lg-mnp2在27、32、37、42 ℃培养条件下,培养液的MnP活性随时间的变化见图3。由图3可知,在4个温度梯度下产酶活性的规律相近,培养48~144 h都是在37 ℃下酶活最高;27、32、37 ℃酶活最高峰均出现在72 h,只有42 ℃酶活最高峰出现在96~120 h。温度筛选结果表明,37 ℃时的酶活性整体高于其他温度,所以37 ℃为TN02A7-Lg-mnp2产MnP的最适培养温度。

图3 TN02A7-Lg-mnp2在4种温度下的MnP活性
2.3.2 正交试验筛选结果
构巢曲霉转化子菌株72 h MnP活性的9组试验结果分别为63.51、62.10、60.69、62.10、86.09、83.27、53.63、43.75、69.15 U·L-1。由表2可知,最适培养条件是A2B3C3D1,即培养基的pH为6.5、Mn2+的浓度为267.0 μmol·L-1、摇床的转速为220 r·min-1、血红素质量浓度为0.05 g·L-1。极差分析表明,影响构巢曲霉转化子菌株产MnP活性的因素由强到弱依次为培养液的pH、血红素质量浓度、Mn2+的浓度和转速。

表2 构巢曲霉转化子菌株产MnP正交试验结果极差分析 U·L-1
2.3.3 优化培养验证试验结果
在优化的培养条件下,即在100 mL三角瓶中加入50 mL的MMPGRT培养液,加入2.0 g青杨木屑作为产酶底物,0.05 g·L-1血红素、267.0 μmol·L-1MnSO4、调节培养液pH到6.5、在220 r·min-1的摇床转速下于37 ℃进行72 h培养,此时检测MnP活性为91.80 U·L-1,是初始培养条件下MnP活性值(9.81 U·L-1)的9.36倍。
2.4 染料的脱色
利用紫外分光光度计在波长300~800 nm的区间内进行扫描,得到6种染料在最大吸收峰处的波长值分别为:达旦黄405 nm(Abs=1.212)、孔雀石绿605 nm(Abs=1.931)、中性红529 nm(Abs=1.928)、刚果红507 nm(Abs=2.199)、曲利本蓝579 nm(Abs=0.844)、结晶紫529 nm(Abs=1.560)。在菌株TN02A7-Lg-mnp2产MnP酶量最高的72 h时提取培养液,对6种染料进行脱色。6种染料溶液中加入酶液的染料脱色直观结果见图4,染料脱色率随时间变化结果见图5。从图4和图5可见,TN02A7-Lg-mnp2的培养液对前5种染料都有很大程度的脱色作用,尤其对偶氮类的达旦黄、三苯基甲烷类的孔雀石绿和杂环类的中性红脱色效果显著,在1 h时,脱色率分别为94.41%、91.43%和90.00%,在16 h时脱色率分别为98.36%、100%和96.47%。酶液对双偶氮的刚果红和曲利本蓝也有不错的脱色效果,在16 h的脱色率分别为96.76%和89.39%。在20 h,酶液对达旦黄、刚果红、中性红和曲利本蓝的脱色率分别为99.53%、99.43%、96.63%和95.19%,都在95%以上。酶液只对三苯基甲烷类的结晶紫脱色效果相对较弱,在8 h的脱色率为63.18%,在16 h的脱色率为67.31%,在20 h的脱色率为67.36%。

图4 TN02A7-Lg-mnp2的胞外酶液对6种染料脱色的直观效果
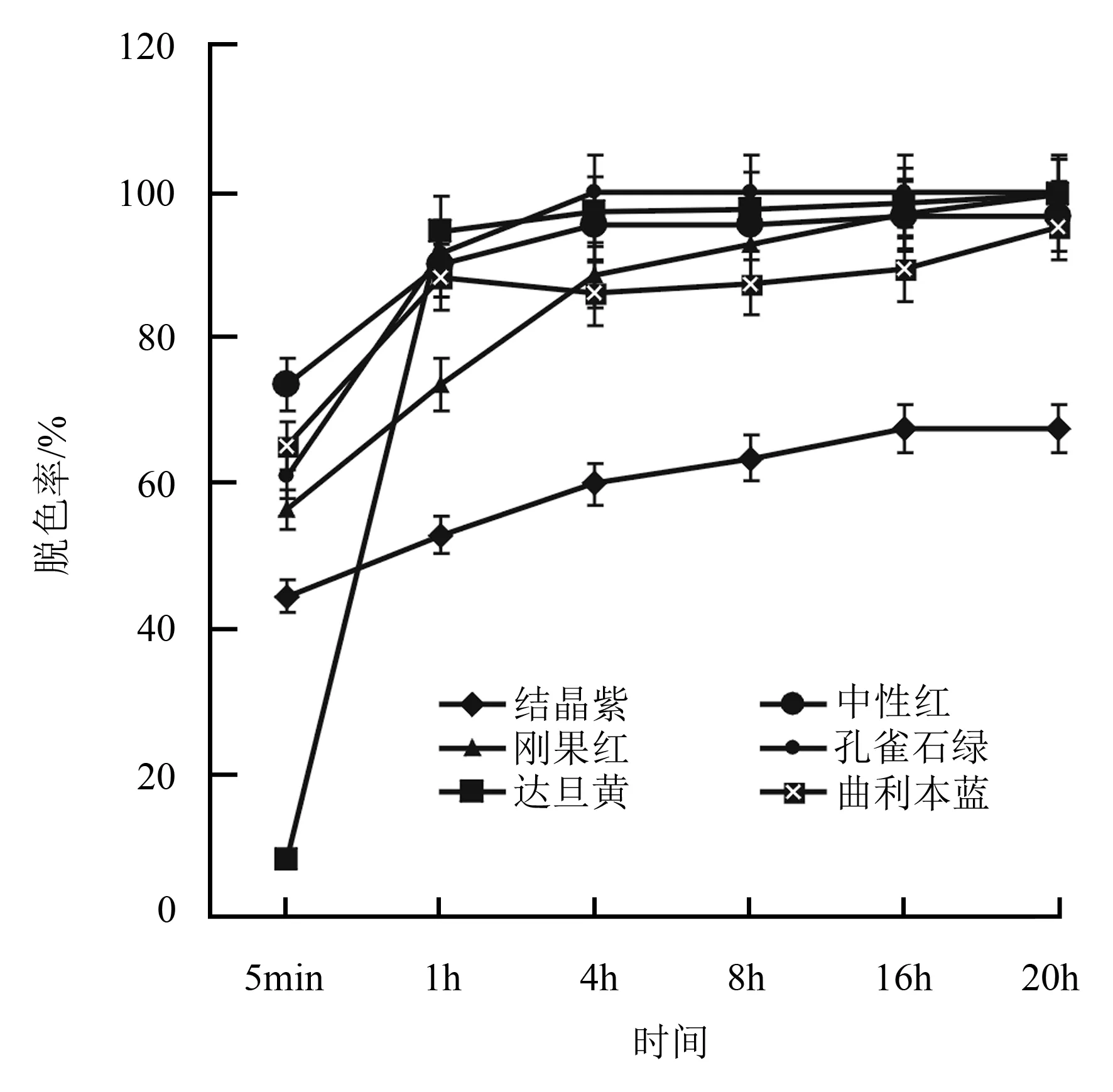
图5 TN02A7-Lg-mnp2的胞外酶液对6种染料的脱色效果
3 结论与讨论
本研究结果表明,优化的培养条件对已转入白腐菌L.gibbosamnp2基因的构巢曲霉转化子菌株TN02A7-Lg-mnp2 MnP的产酶量有显著的提高作用。TN02A7-Lg-mnp2的酶液对偶氮类的达旦黄、刚果红和曲利本蓝,三苯基甲烷类的孔雀石绿和杂环类的中性红等多种染料都有很强的脱色能力,因此,在工业染料废水的处理中具有极广的应用前景。
构巢曲霉菌丝生长的最适温度是37 ℃。最适产酶培养温度试验表明,TN02A7-Lg-mnp2产MnP的最适温度也是37 ℃,符合转化原理。TN02A7-Lg-mnp2酶活高峰比一般白腐菌出现的早,可缩短菌株培养时间而大大提高生产应用效率。
很多白腐菌及其产生的其他酶也具有脱色效果,不同的酶作用于不同染料脱色效果不尽相同。本研究是对构巢曲霉白腐菌mnp基因重组的菌株进行产MnP条件优化,用其含有MnP的培养液进行6种不同结构染料的脱色研究,排除了白腐菌所产生的其他酶对染料的脱色作用,目的是精确地研究MnP对染料的脱色作用。
[1] 许玫英,郭俊,岑英华,等.染料的生物降解研究[J].微生物学通报,2006,33(1):138-143.
[2] PALMIERI G, CENNAMO G, SANNIA G. Remazol brilliant blue R decolourisation by the fungusPleurotusostreatusand its oxidative enzymatic system[J]. Enzyme and Microbial Technology,2005,36(1):17-24.
[3] 章杰.我国染料工业发展新特点和面临的新形势[J].印染,2007,33(22):46-49.
[4] BALDRIAN P,NAJDR J. Production of ligninolytic enzymes by litter-decomposing fungi and their ability to decolorize synthetic dyes[J]. Enzyme and Microbial Technology,2006,39(5):1023-1029.
[5] 戴树桂,宋文华,李彤,等.偶氮染料结构与其生物降解性关系研究进展[J].环境科学进展,1996,4(6):2-10.
[6] 洪俊明,洪华生,熊小京,等.铁屑法处理活性染料废水的实验研究[J].环境污染与防治,2005,27(9):689-691.
[7] 王慧,郑小伟,王宾香,等.真菌对染料的脱色研究进展[J].应用与环境生物学报,2009,15(1):147-151.
[8] 胥维昌.染料行业废水处理现状和展望[J].染料工业,2002,39(6):35-39,10.
[9] 曹进玲.钙离子通道蛋白MidA在构巢曲霉中的功能特征研究[D].南京:南京师范大学,2011.
[10] 池玉杰,闫洪波.红平菇木质素降解酶系统漆酶、锰过氧化物酶及木质素过氧化物酶的检测[J].林业科学,45(12):154-158.
[11] 赵德英,茌亚青.酶活性检测技术[J].中国饲料,1996(14):38-40.
[12] 浦跃武,甄浩铭,冯书庭,等.白腐菌产锰过氧化物酶条件的研究[J].菌物系统,1998,17(3):251-255.
[13] 张玉龙.偏肿革裥菌MnP发酵条件的优化和纯化以及对染料脱色的研究[D].哈尔滨:东北林业大学,2012.
[14] NÜSKE J, SCHEIBNER K, DORNBERGER U, et al. Large scale production of manganese-peroxidase using agaric white-rot fungi[J]. Enzyme and Microbial Technology,2002(4):556-561.
[15] SCHEEL T, HÖFER M, LUDWIG S, et al. Differential expression of manganese peroxidase and laccase in white-rot fungi in the presence of manganese or aromatic compounds[J]. Applied Microbiology and Biotechnology,2000,54(5):686-691.
[16] 李国富.重组血红密孔菌漆酶的固定化及其染料脱色中的应用[D].哈尔滨:东北林业大学,2013.
DecolorationofSixDyesbyAspergillusnidulansManganesePeroxidaseTransformantTN02A7-Lg-mnp2//
Zhang Jian, Chi Yujie, Yu Cun
(Northeast Forestry University, Harbin 150040, P. R.China)//
Aspergillusnidulans; Manganese peroxidase; Transformant; Dye decolorization
1)黑龙江省自然科学基金面上项目(C2016006);东北林业大学博士研究生自主创新基金项目(2572015AA32)。
张健,女,1992年3月生,东北林业大学林学院,硕士研究生。E-mail:1475731922@qq.com。
池玉杰,东北林业大学林学院,教授。E-mail:chiyujienefu@126.com。
2017年3月7日。
责任编辑:程 红。
S718.81
Journal of Northeast Forestry University,2017,45(11):99-103.
In order to find out the dye decolorization effect ofAspergillusnidulansmanganese peroxidase tranformant stain TN02A7-Lg-mnp2 which produces manganese preoxidase (MnP), the pH value of sodium malonate buffer used for enzyme activity determination was screened by spectrophotometry. The optimal culture conditions to produce MnP were optimized by single factor and orthogonal test. The decolorizing capacity of optimized culture solutions to six kinds of dyes, thiazol yellow G, malachite green, neutral red, congo red, trypan blue and crystal violet were determined by the absorbance value. The optimized extracellular MnP solution had a significant decolorizing effect to azo dye thiazol yellow G, triphenylmethane malachite green, and heterocyclic neutral red, the decolorization rate at 1 h was 94.41%, 91.43% and 90.00%, respectively, and at 16 h was 98.36%, 100%, and 96.47%, respectively. The MnP solution also had a rather good decolorizing effect to double azo dyes Congo red and trypan blue, the decolorization rate at 16 h was 96.76% and 89.39%, respectively. But the MnP solution had a relatively weaker decolorizing effect to triphenylmethane crystal violet, the decolorization rate at 16 h was 67.31%. The enzyme solution of strain TN02A7-Lg-mnp2 had strongly decoloring ability to several kinds of dyes with strong application prospect for dye wastewater treatment.

